INTRODUCCIÓN
Los contaminantes emergentes (CE) en su mayoría son sustancias no reguladas detectadas en efluentes de plantas de tratamiento de aguas residuales y fuentes de abasto. Estos están sujetos a regulaciones por sus efectos potencialmente negativos a la salud humana y ecosistemas (Stuart et al., 2012). Por lo tanto, es necesario aplicar tratamientos avanzados a las aguas residuales. La ozonización y Procesos de Oxidación Avanzada (POAs) oxidan compuestos recalcitrantes presentes en aguas residuales convirtiéndolos en más oxigenados y biodegradables (von Gunten, 2018).
Los CE del grupo de los fármacos han suscitado preocupación, en los últimos años, en particular los antibióticos. Se ha detectado la toxicidad de antibióticos frente especies acuáticas. Su presencia en aguas y sedimentos ha incrementado la resistencia bacteriana, desfavorable para la salud humana (Gothwal, R. & Shashidhar, 2015; OMS, 2018).
En Cuba, se desarrolla la Industria Biofarmacéutica y sus empresas generan aguas residuales que requieren tratamiento adecuado, aspecto identificado en su Estrategia Ambiental. En este sentido, la Empresa Farmacéutica que produce antibióticos del grupo betalactámicos ejecuta un proceso inversionista en la planta de tratamiento de aguas residuales. Dentro de este grupo están la amoxicilina y la oxacilina con reconocida aplicación terapéutica (Kidak y Doğan, 2018).
Para la eliminación de antibióticos, en matrices acuosas, se reportan como eficientes la ozonización y los POAs (Giraldo et al., 2018; Norte et al., 2018). El ozono, en soluciones acuosas, reacciona con los compuestos directamente por la vía molecular (pH< 4) e indirectamente, dada su descomposición en radicales OH˙ (pH > 10), que es la vía de reacción en los POAs.
Se reporta la efectividad de la oxidación con ozono de varios antibióticos betalactámicos, aunque se debate la toxicidad de los productos intermedios y subproductos de reacción. Esto puede ser una limitante para su aplicación por lo que deben definirse las condiciones de operación. Andreozzi et al. (2005) alcanzaron a pH=5,5 más del 90% de degradación de la amoxicilina en cuatro min de ozonización, pero baja mineralización con tiempos prolongados, presencia de productos intermedios y subproductos e indicaron una evaluación toxicológica.
Kidak y Doğan (2018), bajo sus condiciones experimentales, obtuvieron un 32% de mineralización y compuestos intermedios con alta toxicidad. Sin embargo, con la aplicación de ultrasonido y ozonización a pH=10 lograron mineralizar un 45% y reducir la toxicidad. Bajo condiciones ácidas y 30 min no se degradó el antibiótico. Lefebvre et al. (2013) aplicaron el ozono para degradar amoxicilina antes de un biorreactor y detectaron la disminución de su eficiencia, dada la toxicidad de los subproductos generados. Marcelino et al. (2017) eliminaron el 99% del fármaco con la ozonización (pH= 5 a 12). Obtuvieron un óptimo a pH=9,6 con una remoción del carbono orgánico total (COT) del 46% y disminución del 62% de la toxicidad. Norte et al. (2018) reportaron resultados de la ozonización de antibióticos betalactámicos en disoluciones modelos. La amoxicilina a pH= 7 con 30 min de reacción se degradó hasta 95%, el COT y la toxicidad disminuyeron un 10% y un 60%. En el tratamiento con agua residual industrial, bajo las mismas condiciones, se animó el 90% del fármaco y un 99% a pH=12.
Por otra parte, Souza et al. (2017) aplicaron POAs que involucran la ozonización alcalina, la radiación (O3/UV), la catalítica homogénea (O3/Fe2+) y la fotocatalítica homogénea (O3/Fe2+/UV). Seleccionaron la ozonización a pH=10 como la mejor alternativa con degradación de la amoxicilina entre 5 y 10 min, y eliminación de la toxicidad. Por otra parte, Kidak y Doğan (2018) obtuvieron 32% de mineralización y alta toxicidad de los subproductos de la ozonización de la amoxicilina, y combinada con ultrasonido una mineralización del 45 % y reducción de la toxicidad.
Sin embargo, no se han identificado reportes de estudios de ozonización para la degradación de oxacilina. Se reportan la aplicación de otros tratamientos de oxidación y POAs con resultados favorables, pero que presentan dificultades en su implementación tecnológica. Giraldo et al. (2015a; 2015b; 2018) estudiaron la eliminación de la oxacilina en matrices acuosas y los subproductos con procesos de oxidación electroquímica, fotocatálisis/TiO2 y foto-Fenton. Ellos lograron la eliminación del antibiótico y la actividad antimicrobiana. El primer tratamiento no logró una mineralización después de 8 h, la demanda química de oxígeno se redujo y la biodegradabilidad se incrementó. En el segundo proceso se observó una alta mineralización a las 8 h. Los mejores resultados fueron a pH=6,0 con 2,0 g/L de TiO2/150W. También, Giraldo-Aguirre et al. (2018) evidenciaron la eficiencia del tratamiento de oxacilina con Foto-Fenton a pH neutro. Se alcanzó solo 5% de mineralización en 8 horas, pero la biodegradabilidad incrementó indicando subproductos más biodegradables, aunque resistentes. Por otra parte, Yabalak et al. (2017), en la degradación de oxacilina reportó alta eliminación de COT (76 %) a 100 0C, H2O2 y 45 min. La genotoxicidad y la actividad antimicrobiana fue reducida.
Con estas premisas los objetivos del trabajo son: establecer las condiciones de ozonización de soluciones modelo de amoxicilina y la oxacilina y el alcance de la oxidación, evaluar la degradación, actividad genotóxica y antimicrobiana de muestras ozonizadas, así como proponer una alternativa de tratamiento de las aguas residuales industriales.
MATERIALES Y MÉTODOS
Instalación experimental de laboratorio
Las ozonizaciones de las disoluciones de los antibióticos se llevaron a cabo en el Laboratorio de Tecnologías (CNIC). La operación fue semicontinua en una columna de burbujeo de 100 mL equipada con un difusor de vidrio poroso. La mezcla oxígeno-ozono se obtuvo con el empleo de un equipo generador de ozono (AQOZO, Cuba) que se alimentó con oxígeno. El ozono residual en el gas, que no reaccionó, fue destruido catalíticamente a la salida de la columna.
Se empleó un flujo de gas de 5 L/h y una concentración de ozono en el gas a la entrada de 70 y 100 mg/L. La concentración de ozono en el gas fue determinada a 256 nm en un espectrofotómetro UV-VIS (Pharmacia LKB, Reino Unido). Las muestras se tomaron a diferentes tiempos de tratamiento y en el frasco se burbujeó un flujo de nitrógeno por un min para detener la reacción.
Evaluación de la degradación de los antibióticos en las disoluciones ozonizadas
Para evaluar el tiempo de degradación de los antibióticos, sin la posible interferencia de subproductos generados, el muestreo se realizó a cortos intervalos de tiempo cortos durante 5 y 10 min de reacción a pH= 7 controlado (con empleo de solución tampón).
Evaluación de la degradación de los subproductos
Para evaluar la degradación de los subproductos generados en las disoluciones ozonizadas se realizaron dos diseños experimentales. Para la amoxicilina un 22 bajo una concentración de ozono en el gas de 70 mg/L para analizar el efecto en la degradación debido a los factores: tiempo de ozonización (30 y 60 min) y del pH (7 y 12). Para oxacilina un 23 y se analizó el efecto en la degradación por los factores: concentración de ozono en el gas (70 y 100 mg/L), tiempo de ozonización (15 y 30 min) y del pH (7 y 12).
Bajo las condiciones experimentales evaluadas no fue posible la identificación y determinación de la concentración de los subproductos. Por lo tanto, se procesó el valor del área total de los picos registrados en los cromatogramas, para cada condición experimental, y se consideró como la variable dependiente para la comprobación estadística del efecto de las variables independientes seleccionadas. En este sentido, el valor del área total de los picos se corresponde con el alcance de la degradación y eliminación de los subproductos de la ozonización.
Preparación de las disoluciones modelo de amoxicilina y oxacilina
En la preparación de las disoluciones modelo se empleó amoxicilina y oxacilina con un 99,99 % de pureza, proporcionada por la Empresa Farmacéutica, y agua ultrapura. Se partió de concentraciones iniciales de amoxicilina de 36,5 mg/L (1x10-4 mol/L) y de 148,2 mg/L (4x10-4 mol/L), y de oxacilina 30,0 mg/L (7,5 x 10-5 mol/L). Para el ajuste a pH= 7 y 12 se añadió hidróxido de sodio (2%). En los experimentos a pH=7 controlado se prepararon las disoluciones empleando una solución tampón de fosfato sódico dibásico (Na2HPO4) y dihidrógeno fosfato de potasio (KH2PO4).
Determinaciones para el seguimiento de la degradación de los antibióticos y subproductos
La determinación de las concentraciones de los antibióticos y el seguimiento de la presencia de subproductos se realizó por Cromatografía Líquida de Alta Resolución (CLAR) (Tabla 1). Se emplearon dos sistemas de CLAR-1 y CLAR-2 que están conformados en cada caso, entre otros elementos, por un detector UV K-2501 e interfase (Knauer, Alemania) y sus respectivos programas Claritychrom y Eurochrom 2000 (Knauer). El sistema CLAR-3, marca Shimadzu, está compuesto por un detector UV-Vis y una interfase CBM-20ª con el programa LCsolution (Shimadzu Corp).
Evaluación de otros indicadores de la degradación en las disoluciones ozonizadas
La presencia de una coloración en las disoluciones ozonizadas fue seguida con la determinación de la absorbancia a 450 nm (Abs450). Para valorar la extensión de la degradación se determinaron los valores de la demanda química de oxígeno (DQO) de las muestras tratadas y sin tratar según los Métodos Estándar (APHA, AWWA, WPCF, 2017). También se realizó la determinación de los valores de la absorbancia a 254 nm (Abs254). Estas determinaciones se realizaron con el empleo de un espectrofotómetro UV-VIS (CINTRA-101, Australia).
Procesamiento estadístico de la data experimental
Las determinaciones se hicieron por triplicado. Para el procesamiento estadístico de resultados se empleó el programa Microsoft® Excel 2016 y el programa estadístico Statgraphics Centurion XV.
Evaluación de la actividad antimicrobiana de muestras ozonizadas
Las muestras ozonizadas fueron evaluadas en el Laboratorio de Microbiología del CNIC. Se determinó la actividad antimicrobiana a través de la susceptibilidad de Staphylococcus aureus ATCC 25922 hacia las disoluciones tratadas, escogido porque presenta una respuesta adecuada a bajas concentraciones de antibióticos. Se utilizó el método de difusión en agar (Palominos et al., 2009). La actividad se evaluó mediante el halo de inhibición generado por la difusión del antibiótico en el agar no permitiendo el crecimiento del microorganismo. La disminución del halo indica una reducción de la actividad antimicrobiana.
Primeramente, se llenaron las placas Petri con el agar Mueller Hinton con unos 30 mL de medio de cultivo e incubadas a 37°C durante 24h para comprobar la efectividad de la esterilización y pureza del medio de cultivo. Se preparó el inóculo de 0,5 McFarland de un cultivo puro con 18 h de crecimiento utilizando el equipo DIRAMIC-10 (Cuba). Este inóculo se diluyó hasta una concentración de 5x105 UFC/ mL, utilizada para la siembra en placa. En las placas con agar una vez inoculadas se horadó un orificio de 3 mm de diámetro evitando llegar al fondo de la placa. En los orificios se inocularon 100 µL del inóculo y se incubaron a 37°C durante 24 h. Transcurrido este tiempo se midió el diámetro del halo de inhibición generado.
Evaluación de la actividad genotóxica de muestras ozonizadas
El estudio del potencial genotóxico de las muestras ozonizadas se realizó con el Ensayo de Reversión Bacteriana en Salmonella thyphimurium (Salmonella / Microsoma) o Prueba de Ames en el Laboratorio de Genética Toxicológica del Centro de Investigación y Desarrollo de Medicamentos (CIDEM) (Maron y Ames, 1983; Gatehouse et al., 1994; OECD, 1997; Mortelmans y Zeiger, 2000).
Se evaluaron muestras de disoluciones ozonizadas de ambos antibióticos bajo la concentración de ozono a la entrada de 70 mg/L a pH inicial ajustado y no controlado. Para la amoxicilina se aplicó pH: 7 y 12 (30 y 60 min), así como para la oxacilina pH: 7 (5, 15, 30 y 60 min). Las cepas TA98 y TA100 fueron donadas por la Universidad Autónoma de México, como control negativo se empleó agua destilada estéril y control positivo se utilizaron los mutágenos directos e indirectos (Tabla 2).
Tabla 2 Cepas de Salmonella typhimurium y controles positivos.

+S9: con mezcla S9 (con activación metabólica); -S9: sin mezcla S9 (sin activación metabólica).
La fracción postmicrosomal S9 (sistema exógeno de activación metabólica) se preparó a partir de hígado de ratas Wistar machos de 200 g de peso tratadas con fenobarbital y benzonaftoflavona (Sigma, EE.UU.). La fracción S9 es un componente de la mezcla S9, que se explica más adelante.
El ensayo de Ames se realizó dos veces y cada muestra ozonizada por triplicado para las dos cepas.
Se empleó el método de incorporación en placa. En cada placa de medio mínimo Vogel Bonner E (VBE) se vertieron 2 mL de agar suave a los que se le incorporó previamente 0,1 mL del cultivo bacteriano, 0,1 mL de la muestra ozonizada y según el caso 0,5 mL de la mezcla S9.
En el momento del ensayo se preparó la mezcla S9 con KCl 33 mM, MgCl2 2,8 mM, NADP 4 mM, Glucosa 6-fosfato 5 mM, un 4% de fracción S9 y tampón-fosfato de sodio 200 mM a pH 7,4. Las placas se incubaron a 37ºC durante 48 h y se contó el número de colonias revertantes por placa. Un resultado positivo se define como un aumento en el número de colonias revertantes que supere más de dos veces al obtenido en el control negativo (solvente), y muestre un incremento en el número de colonias revertantes en función de las muestras ozonizadas bajo los tratamientos.
Se aplicó el programa estadístico SALANAL versión 1.0 diseñado para el Ensayo de Ames. Permite calcular la significación estadística de las diferencias observadas entre las frecuencias promedios del control negativo y los tratamientos con ozono. Asimismo, valorar si los efectos observados mantienen una relación proporcional a los tratamientos.
RESULTADOS Y DISCUSION
Ozonización de amoxicilina a pH=7 controlado durante 10 min
El tiempo en que la amoxicilina se degradó completamente, según el límite de cuantificación del equipo (CLAR-2) a los cinco min se logró una eliminación del 99 % ± 1,4. La degradación de la amoxicilina en corto tiempo coincide con lo reportado por otros autores bajo diferentes condiciones experimentales. Andreozzi et al. (2005) obtuvieron a los cuatros min una degradación mayor del 90%, mientras Souza et al. (2017) lograron una completa degradación entre cinco y 10 min.
En la Figura 1 se muestran los cromatogramas correspondientes a los tres min de reacción. Los resultados indicaron la presencia de amoxicilina con un tiempo de retención de 4,22 min y el registro de dos subproductos o grupos de subproductos (grupo S-1 y S-2) con tiempos de retención de 2,23 y 3,15 min, respectivamente. Esto sugiere que son compuestos más polares que la amoxicilina bajo las condiciones de estudio.
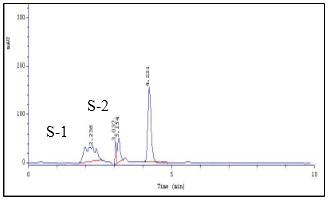
Fig. 1 Cromatograma de la ozonización de la disolución de amoxicilina (pH=7 controlado y 3 min de ozonización).
Se apreció un incremento de una coloración en la disolución junto a la formación del grupo S-2 desde el primero hasta el cuarto min, donde se registró un valor de Abs450= 0,062 ± 0,001 y un valor del área del pico del cromatograma de 6,51 ± 1,2. A partir de ese tiempo de tratamiento ambos valores comenzaron a disminuir de manera apreciable, obteniendo a los 10 min un valor de Abs450= 0 y del área del pico de 1,60 ± 0,28. Respecto al grupo S-1 el valor del área del pico del cromatograma incrementó hasta un máximo de 38,46 ± 0,75 a los cinco min y después decreció, registrándose a los 10 min un valor de 32,22 ± 0,60, por lo que se mantuvo persistente.
Evaluación de la degradación de subproductos en las disoluciones ozonizadas de amoxicilina
Ozonización a pH= 7 y 12 inicial ajustado y no controlado para 30 y 60 min
La presencia y degradación de subproductos generados fueron evaluadas bajo un diseño experimental 22. En Figura 2 a) se muestra el cromatograma inicial de la amoxicilina con un tiempo de retención de 2,20 min a pH=7. La Figura 3a) presenta el cromatograma inicial a pH=12 con dos picos representando a la amoxicilina, esto pudiera ser por la protonación del compuesto. En las Figuras 2b) y 2c) así como en las 3b) y 3c) no se observa la presencia del fármaco en los cromatogramas a los 30 y 60 min de reacción para ambos pH.
Los resultados indicaron el registro de un subproducto o grupo de subproductos (grupo S-1) con tiempos de retención de 0,83 y 0,90 min para pH= 7 y 12, respectivamente. Así como, la posible formación de compuestos más polares ya que son más solubles en la fase móvil (polar) y menos retenidos en la columna cromatográfica (apolar). Esto se puede inferir por los tiempos menores de retención obtenidos respecto a la amoxicilina. Los picos registrados se corresponden con subproductos de la ozonización dada su intensidad y como estos no son simétricos se sugiere la existencia de una mezcla de compuestos.
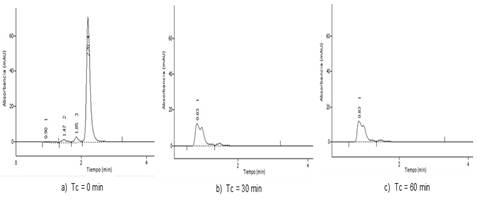
Fig. 2 Cromatogramas de ozonización de la disolución de amoxicilina (pH = 7 inicial ajustado y no controlado para 30 y 60 min de tiempo de ozonización). CLAR-1.
Fig. 3 Cromatogramas de ozonización de la disolución de amoxicilina (pH=12 inicial ajustado y no controlado para 30 y 60 min de tiempo de ozonización). CLAR-1.
La presencia de subproductos se corresponde con lo reportado por otros autores, y es la causa de la no mineralización completa del fármaco incluso aplicando diferentes POAs (Andreozzi et al., 2005; Lefbrve et al., 2013; Souza et al., 2017; Kidak y Doğan, 2018; Norte et al., 2018). Por otra parte, se han propuesto diferentes mecanismos o vías de formación de los productos intermedios y subproductos generados, que dependen del proceso de oxidación de la amoxicilina y las condiciones experimentales. Por ejemplo, (Andreozzi et al. 2005) sugieren que el ozono ataca principalmente el anillo fenólico y el átomo de azufre en los pasos iniciales de la oxidación, destruyendo la molécula del antibiótico. Kidak et al. (2017) resumen como posibles mecanismos de oxidación de este antibiótico: la hidroxilación (adición del OH al compuesto original), la apertura del anillo β-lactámico y la decarboxilación (pérdida del COOH) y reorganización del anillo tiazole. Además, se han identificado posibles subproductos según las vías de degradación: ácido 2-amino-2-(p-hidroxifenil) acético (Andreozzi et al., 2005), ácidos carboxílicos con valores bajos de masa molar y refractarios a la oxidación química (Lefbrve et al., 2013, Souza et al., 2017).
Análisis del Diseño Experimental
El efecto de las variables aplicadas (pH y tiempo de ozonización) en la degradación de grupo S-1 fue comprobado estadísticamente con el diseño experimental 22. Se obtuvo una diferencia significativa del efecto del incremento del pH en la eliminación de S-1, mientras que el tiempo y la interacción entre ambas variables resultaron no significativos. A partir de la simplificación de los términos no significativos del modelo más general se obtuvo el resultado siguiente:
Area grupo S-1 = 256,10 - 9,333*pH R2: 93,2 %
El coeficiente negativo del término lineal indica físicamente la disminución del área del grupo S-1 con respecto al aumento del pH, única variable significativa según el diseño experimental. Una vez formado el grupo S-1 se observó un efecto mayor en la reducción al incrementar el pH. Esto está dado por la formación de los radicales OH˙ que presentan un poder oxidante mayor que el ozono. Un incremento de la degradación de subproductos a pH básico ha sido reportado por otros autores (Andreozzi et al., 2005; Souza et al., 2017).
Ozonización de oxacilina a pH=7 controlado durante 5 min.
Se observó que a pH=7 controlado a los 0,5 min de reacción se obtiene un 97% de degradación del antibiótico, según el límite de cuantificación del equipo (CLAR-3). Este valor se alcanzó a los 2 min cuando se añade el captor de radicales OH˙ (t-butanol). La tendencia de una degradación más rápida en la condición sin t-butanol sugiere la formación de radicales OH˙. Esto favorece la oxidación por vía radicálica con una mayor velocidad de reacción y degradación.
Por otra parte, en la Figura 4 se aprecian los picos registrados, que indican la degradación de la oxacilina, así como la formación de subproductos durante los 5 min de reacción evaluados.
Evaluación de la degradación de subproductos en las disoluciones ozonizadas de oxacilina
Ozonización a pH= 7 y 12 inicial ajustado y no controlado para 30 y 60 min
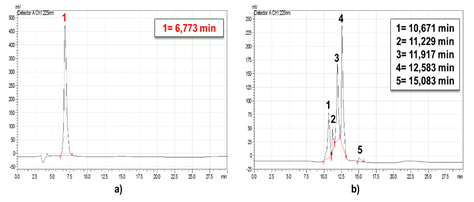
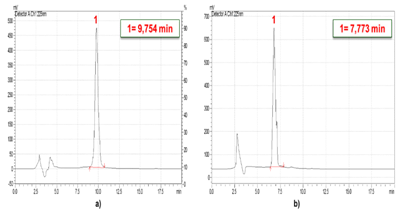
Para evaluar el efecto de la ozonización en la degradación de los subproductos generados se realizó un diseño experimental 23. En la Figura 5a) y b) aparecen los cromatogramas de la oxacilina a pH= 7 y 12 (inicial ajustado y no controlado) con tiempos de retención de 9,754 min y 7,773 min, respectivamente. Se observa el registro de un pico simétrico, que corresponde a un solo compuesto que no presenta interacción con la columna.
A partir del análisis de los cromatogramas presentados en las Figuras 6 y 7, como era esperado, no se detectó oxacilina para ambos pH a los 15 y 30 min de reacción. Se observó a pH=7 la presencia de tres compuestos o grupos de compuestos (picos registrados) los cuales no tienen una variación apreciable en su intensidad con el incremento del tiempo de ozonización.
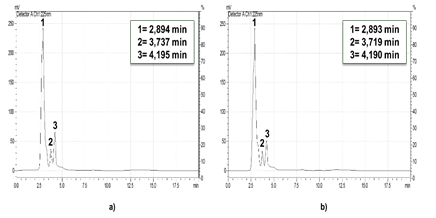
Fig. 6 Cromatogramas de ozonización de la disolución de oxacilina a pH 7 inicial ajustado y no controlado, 70 mg/L de concentración de ozono en el gas: a) 15 min, b) 30 min.
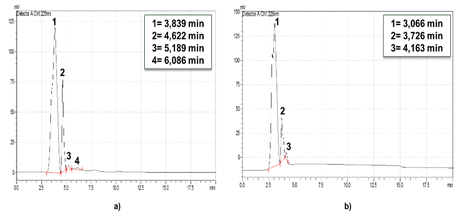
Fig. 7 Cromatogramas de ozonización de la disolución de oxacilina para pH 12 inicial ajustado y no contralado, 70 mg/L de concentración de ozono en el gas: a) 15 min, b) 30 min.
Por otra parte, se apreció a pH=12 la formación de cuatro compuestos o grupos donde el pico de menor intensidad registrado a los 15 min no es detectado a los 30 min (Figura 8 b). El área de los picos de menor tamaño se reduce con el incremento del tiempo de reacción, aunque no varía de forma apreciable la intensidad del pico de mayor tamaño. De manera general se observan varios picos, de los cromatogramas registrados, de menor tamaño y la formación de compuestos más polares ya que son más solubles en la fase móvil (polar) y menos retenidos en la columna cromatográfica (apolar). Esto se puede inferir por los tiempos menores de retención obtenidos respecto a la oxacilina. Por la intensidad de los picos registrados se evidencia que estos corresponden con subproductos de la ozonización, además al no ser simétricos sugiere la existencia una mezcla de compuestos.
Este comportamiento puede atribuirse a que el ozono ataca preferentemente a los sitios con dobles enlaces, así como a los anillos aromáticos. En el caso de la presencia de compuestos con menor tiempo de retención, puede estar asociado al ataque a los heteroátomos (N y S) y a los tres grupos de nitrógeno, provocando la fragmentación de la oxacilina y la obtención de varios picos en el cromatograma, los cuales pueden coexistir. Para una concentración de ozono a la entrada de 100 mg/L, para iguales intervalos de pH y tiempos de contrato, se observó un comportamiento similar al descrito para 70 mg/L.
Análisis del Diseño Experimental
La Figura 8 indica que, dentro del intervalo experimental, no se obtuvo una diferencia significativa del efecto de las variables seleccionadas en el valor del área total de los picos de los cromatogramas. Los subproductos en su degradación deben transformarse por la oxidación durante el proceso de ozonización en compuestos que no se degradan totalmente y persisten al tratamiento. Además, se infiere que bajo las condiciones experimentales aplicadas no se logra una alta mineralización después de la ozonización. Por lo que los subproductos que se generan y transforman durante el tratamiento tributan a que el valor del área total de los picos registrados no disminuya significativamente.
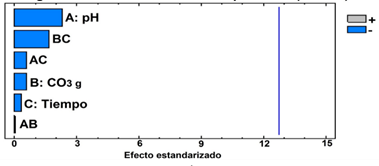
Fig. 8 Diagrama de Pareto. Evaluación del efecto en la reducción del área total de los subproductos debido a las variables pH (A): 7 y 12 ajustado y no controlado; Concentración de ozono en el gas (B): 70 y 100 mg/L; Tiempo de contacto (C): 15 y 30 min; Interacciones (AB) (BC) (AC.)
Este resultado se corresponde con lo reportado en varios estudios de tratamiento de la oxacilina con otros POAs. Giraldo-Aguirre et al. (2018) solo logran una mineralización del 5% a 480 min aplicando foto-Fenton a pH neutro, aunque lograron disminuir la actividad antimicrobiana e incrementar la biodegradabilidad de 0,08 a 0,98 de las matrices. Respecto a la oxidación electroquímica no hubo ninguna mineralización después de 8 h, pero la DQO se redujo un 70% y la biodegradabilidad incrementó de 0,03 a 0,84 (Giraldo et al., 2015a). Por otra parte, Norte et al. (2018) en la ozonización de antibióticos β-lactámicos, alcanza una reducción de los fármacos del 95%, pero solo una mineralización del 10 a 20% en disoluciones acuosas. Estos resultados reportados indican la presencia de subproductos del fármaco degradado después de los tratamientos aplicados dada la baja mineralización en general que se obtiene. Además, que se logran matrices con subproductos que son más biodegradables y la actividad antimicrobiana disminuye o se elimina.
Dada la presencia de subproductos de ozonización persistentes, y para tener un criterio general de la extensión de la degradación se evaluó en las disoluciones ozonizadas de ambos antibióticos la actividad genotóxica. Para la oxacilina además se evaluó la actividad antimicrobiana, los valores de la absorbancia UV a 254 nm y de DQO, así como el seguimiento del pH.
Evaluación de la actividad genotóxica de las muestras ozonizadas de disoluciones de amoxicilina y oxacilina.
Bajo las condiciones experimentales aplicadas no se alcanzó la degradación de los subproductos en su totalidad. Por lo tanto, la evaluación de la actividad genotóxica realizada es un complemento importante del estudio. Se emplearon las cepas TA98 y TA100, que detectan mutaciones por adiciones o deleciones de bases y mutaciones por sustitución de pares bases respectivamente.
Las Figuras 9, 10, 11, 12 indican los valores promedio del número de colonias revertantes por placa con la desviación estándar para las muestras ozonizadas y los controles. Los resultados obtenidos en este estudio evidenciaron que no hubo incrementos significativos de la frecuencia de revertantes para las cepas evaluadas (Figuras 9). No se obtuvieron diferencias estadísticamente significativas entre los valores promedios del número de colonias revertantes por placa de las muestras ozonizadas y el control negativo para ambos antibióticos. Tampoco, fue evidente una respuesta positiva dependiente de las muestras ozonizadas bajo diferentes valores de pH y los tiempos de contacto aplicados, que definen las dosis de ozono.
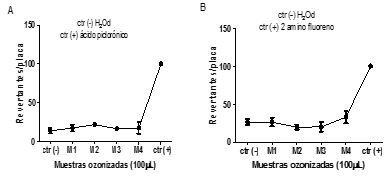
Fig. 9 Resultado de la exposición de las muestras ozonizadas de disoluciones de amoxicilina (M1-M4 100µL) frente a la cepa TA 98 A) con S9 y B) sin S9.

Fig. 10 Resultado de la exposición de las muestras ozonizadas de disoluciones de amoxicilina (M1-M4 100µL) frente a la cepa TA 100. A) con S9 y B) sin S9.
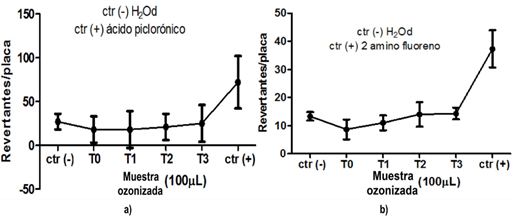
Fig. 11 Resultado de la exposición las muestras ozonizadas de oxacilina (T0-T3 100µL) frente a la cepa TA 98: a) con S9; b) sin S9.
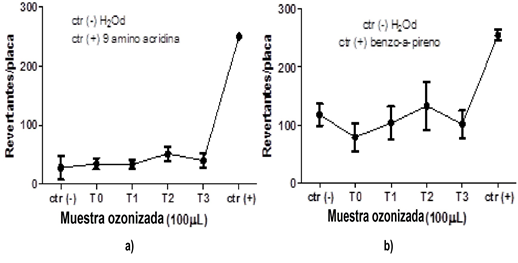
Fig. 12 Resultado de la exposición las muestras ozonizadas de oxacilina (T0-T3 100µL) frente a la cepa TA 100: a) con S9, b) sin S9.
Por lo que se considera que las muestras evaluadas no tienen actividad genética en las cepas estudiadas según las normativas internacionales, que establecen estos parámetros como definitorios para los ensayos de reversión bacteriana. Se puede concluir que las muestras ozonizadas de disoluciones de amoxicilina y oxacilina no son mutagénicas en las condiciones evaluadas. Este resultado es muy favorable para la propuesta de la ozonización como tratamiento, ya que en el presente trabajo se logró la degradación de los antibióticos en tiempos cortos, pero se mantuvo la presencia de subproductos.
Sin embargo, la alerta de toxicidad de subproductos de la ozonización de amoxicilina ha sido reportada por varios autores (Lefebrve et al., 2013; Kidak and Doğan, 2018). No obstante, Souza et al. (2017) han reportado toxicidad negativa o su disminución bajo determinados procesos incluyendo la ozonización. Norte et al. (2018) lograron una disminución del 86% de la toxicidad en muestras ozonizadas de aguas residuales industriales con presencia de antibióticos β-lactámicos, entre estos la amoxicilina. Yabalak et al. (2017) reportaron que las muestras de disoluciones de oxacilina tratadas por oxidación, con agua subcrítica usando H2O2, no mostraron ningún efecto genotóxico. Consecuentemente, los autores del presente trabajo recomiendan como estrategia realizar una evaluación de la actividad genotóxica, durante estudios previos, a las propuestas de tratamiento con ozono para aguas residuales industriales, así como a las aguas tratadas antes de su disposición final.
Evaluación de la actividad antimicrobiana de las muestras ozonizadas de oxacilina
La Tabla 3 se indican los resultados de las muestras de las disoluciones sin tratar y tratadas aplicando una concentración de ozono en el gas de 70 mg L-1, a diferentes tiempos de ozonización, bajo los pH=7 y 12 inicial ajustado y no controlado. Se consideró el valor del diámetro del halo de inhibición generado.
Tabla 3 Actividad Antimicrobiana a través de la susceptibilidad de Staphylococcus aureus ATCC 25922 hacia las disoluciones de oxacilina tratadas.

Se observó la no formación de halo de inhibición alrededor de la zona cargada con disoluciones de muestras ozonizadas de oxacilina. Esto demuestra la eliminación de la actividad antimicrobiana bajo las condiciones experimentales evaluadas. Se evidenció que en las matrices tratadas no hay presencia del antibiótico y que los subproductos generados de la oxidación no presentan actividad antimicrobiana.
La eliminación de la actividad antimicrobiana puede estar relacionada con las transformaciones estructurales de la oxacilina y los subproductos durante el proceso de ozonización. Por lo tanto, los resultados sugieren que el tratamiento propuesto transforma la oxacilina en productos que tienen modificaciones en el anillo β-lactámico, responsable de esta actividad (Giraldo et al., 2015b). Esto indica que la ozonización, bajo las condiciones aplicadas, eliminó eficientemente la actividad farmacéutica de la oxacilina, y de aquellos subproductos de reacción que pudieran tenerla. En consecuencia, se elimina el riesgo asociado a la proliferación de bacterias resistentes debido a la entrada segura en ambientes acuáticos de matrices acuosas sin efectos antimicrobianos.
Evaluación de la absorbancia UV a 254 nm y la DQO
En la Tabla 4 se observa que para ambas concentraciones de ozono en el gas existe una disminución del valor de Abs254 en las muestras de disoluciones de oxacilina ozonizadas durante 30 min. Esto sugiere una disminución de la presencia de anillos aromáticos y compuestos insaturados durante el proceso de oxidación aplicando ozono (Norte et al., 2018; Chávez et al., 2019), lo cual se favorece a valores de pH=12 donde se alcanzan mayores porcentajes de reducción de este indicador.
Se alcanzó un 60,4% y un 80,5% de reducción de la DQO para el pH=7 y 12, respectivamente, en las muestras de disoluciones de oxacilina ozonizadas durante 30 min. Estos resultados indican la degradación y trasformación del antibiótico y los subproductos generados en compuestos más oxidados y biodegradables, así como una degradación de compuestos orgánicos (Tabla 5).
Seguimiento del pH durante la ozonización
Los subproductos de la ozonización presentan mayores estados de oxidación en función de la dosis de ozono aplicada, comúnmente pueden ser oxidados hasta la obtención de ácidos carboxílicos. En la Tabla 6 se presenta la variación del pH durante la ozonización de disoluciones de oxacilina durante diferentes tiempos de contacto, concentración de ozono de 70 mg L-1 a pH=7 y 12 inicial ajustado y no controlado.
En las disoluciones a pH=7 inicial el valor disminuyó hasta 4,45 a los 30 min de ozonización. Este comportamiento puede estar asociado a la formación de ácidos debido a la reacción de oxidación de la oxacilina, es decir, la formación de grupos carboxílicos en productos de transformación del fármaco. Estos resultados corroboran, como se ha planteado, que el sistema es capaz de transformar el antibiótico en compuestos orgánicos más oxidados, y que son recalcitrantes a la acción de la ozonización bajo las condiciones experimentales aplicadas. Este resultado se reporta por Giraldo-Aguirre et al. (2018) en el tratamiento de oxidación de oxacilina, bajo un POA aplicando foto-Fenton cerca del pH neutro.
Por otra parte, la disolución con pH inicial básico (pH=12) muestra un decrecimiento leve en su valor. La adición del hidróxido de sodio para ajustar la disolución al parecer provoca un efecto buffer en la disolución, lo que posibilita que el pH se mantenga relativamente estable ante las transformaciones ocurridas en la matriz acuosa.
Propuesta de la alternativa de tratamiento con ozono para las aguas residuales
La ozonización es una tecnología establecida que proporciona flexibilidad para adaptarse a los cambios en la composición del agua residual. Los principales desafíos son garantizar la aplicación de una adecuada dosis de ozono y un buen sistema de contacto que permitan altos niveles de transferencia gas-líquido. Además, es necesario desarrollar estrategias sólidas de monitoreo y control, sobre todo en el tratamiento de aguas residuales industriales por la potencial formación y eliminación de subproductos de transformación tóxicos.
Como se ha podido constatar la ozonización de disoluciones modelos de amoxicilina y oxacilina indicó que en los primeros 10 min de reacción se logra una eliminación total del fármaco. Respecto al grupo de subproductos generados y persistentes, en la mezcla de reacción, se demostró la no mutagenicidad y la eliminación de la actividad como antibiótico. Se propone emplear 30 min para el tratamiento de las aguas residuales industriales. Este tiempo resulta tres veces superior al tiempo en que se puede lograr la degradación total de cada antibiótico, por lo que debe garantizar que el efluente no contenga concentraciones de los mismos.
También, se propone ozonizar al pH de las aguas residuales de la Empresa Farmacéutica con valores entre 7 y 8. Esto garantizará un menor costo de operación al no emplear reactivos químicos y sistemas de dosificación. En cuanto a la concentración de ozono en el gas se propone mantener 70 mg/L. No obstante, las condiciones de ozonización deben ser ajustadas en la práctica durante la implementación.
Como aspecto importante se tiene en cuenta el aumento de la demanda de ozono al tratar aguas residuales reales, que poseen otros compuestos procedentes del proceso productivo. En este sentido, se recomienda que estas aguas sean debidamente segregadas para una mejor caracterización y control del tratamiento propuesto.
Se propone para el tratamiento de las aguas residuales industriales diseñar y emplear, como reactor, una columna de burbujeo, muy utilizada para sistemas gas-líquido. Logra valores eficientes de transferencia de masa, flexibilidad en los tiempos de contacto, bajo costo de mantenimiento y operación. Se propone un sistema de ozonización compacto y automatizado como muestra la Figura 13 y un estimado del costo de los elementos fundamentales (Tabla 7). Este sistema se insertará en la actual planta de tratamiento de aguas residuales de la Empresa Farmacéutica, que se encuentra bajo un proceso inversionista para su mejora.
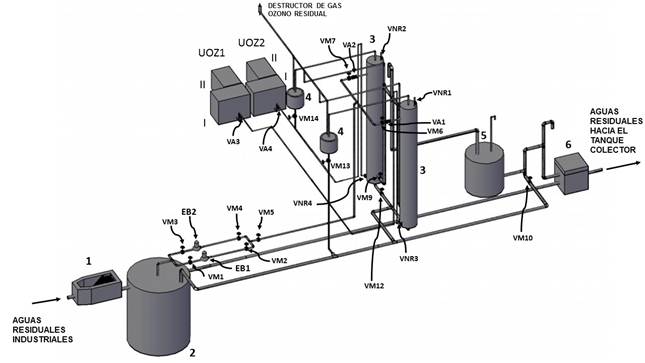
Leyenda:1-Tamiz, 2-Tanque de balance inicial, 3-Columnas de ozonización, 4-Trampas de espuma, 5-Tanque de balance final, 6- Registro, EB: Bombas centrífugas, UOZ1 y UOZ2: Unidades de ozonización. (I-Ozonizador con concentrador de oxígeno), II-Enfriador), VM: Válvula manual, VA: Válvula automática, VNR: Válvula de no retorno
CONCLUSIONES
Se alcanzaron altos porcentajes de degradación de amoxicilina y oxacilina en tiempos cortos. Varios subproductos de reacción resultaron resistentes al tratamiento con ozono. Las muestras ozonizadas no presentaron actividad antimicrobiana ni genotoxicidad, y los valores de DQO y AbsUV254 disminuyeron. Esto indicó que los subproductos se degradaron parcialmente y se transformaron en compuestos más, biodegradables e inocuos. Se propone para el tratamiento de las aguas residuales industriales una concentración de ozono en el gas de 70 mg/L, pH = 7-8 y 30 min de ozonización.