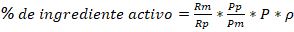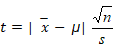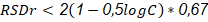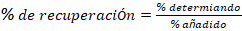INTRODUCCIÓN
El Fipronilo es un insecticida de amplio espectro que pertenece a la familia de los fenilpirazoles. Fue descubierto y desarrollado por Rhône-Poulenc Agro entre 1985 y 1987 y puesto en el mercado en 1993 (Colliot y col., 1992). Este compuesto inhibe los canales de cloruro de los receptores de GABA A de los insectos a concentraciones mucho más bajas que las de los receptores de GABA A de los vertebrados. Por tanto, su acción insecticida se debe al potente efecto depresor del sistema nervioso central de los insectos (Islam y Lynch, 2012).
Debido a su efectividad en gran número de plagas, es utilizado a menudo como componente activo de antipulgas para mascotas y antiplagas domésticas, así como para la fumigación de cultivos de maíz, campos de golf, etc. Su uso extensivo debe ser objeto de atención, mediante observaciones en efectos secundarios nocivos en humanos o ecosistemas (Cabrera, 2005).
El Fipronilo se puede encontrar en el mercado en formulaciones tales como polvo, spray, geles, cebos, entre otras, utilizándose diferentes técnicas para su determinación de acuerdo a la formulación.
En Cuba el Ministerio de la Agricultura importa un cebo de Fipronilo de la Compañía Bayer (Plan de Importación de Plaguicidas para el Año (Ajustado), 2017) por lo que el desarrollo de una formulación de este tipo para la producción nacional pudiera contribuir a la sustitución de importaciones. En este sentido es importante contar con una técnica de determinación propia para garantizar el control de la calidad de las formulaciones desarrolladas.
Teniendo en cuenta lo anterior, este trabajo tiene como objetivo desarrollar y verificar una nueva técnica de análisis por HPLC para la identificación y cuantificación de Fipronilo en cebo, el cual se utiliza para el control de hormigas forrajeras.
MATERIALES Y MÉTODOS
2.1. Equipos
Cromatógrafo líquido YL9100 con detector de UV/Vis YL9120, bomba cuaternaria YL9110, columna Teknokroma C18; 5 µm de 0,4 × 25 mm. Balanza técnica RADWAG AS310/X (precisión 0,001). Agitador magnético LTE Scientific.
2.2. Sustancias y reactivos
Patrón de Fipronilo al 99%, metanol marca Panreac, acetonitrilo marca Quimefa, agua bidestilada, todos para uso en HPLC. Para la preparación de la matriz de la muestra se utilizó harina de maíz, miel de purga y agua.
Las principales propiedades y características del Fipronilo se presentan en la Tabla 1 (British Crop Protection Council, 2003).
Tabla 1 Principales propiedades y características del Fipronilo
| Nombre común | Fipronilo (BSI, pa E-ISO) |
| Nombre IUPAC | (±)-5-amino-1-(2,6-dicloro- a, a, a-trifluoro- |
| Peso Molecular | 437,2 g/mol |
| Fórmula molecular | C12H4Cl2F6N4OS |
| Estado de agregación y color a temperatura ambiente | Sólido blanco |
| Temperatura de fusión | 200-201 ºC |
| Presión de vapor | 3,7x10-4 mPa (25 ºC) |
| Densidad | 1,477-1,626 (20 °C) |
| Solubilidad en agua | 1,9 (pH 5), 2,4 (pH 9), 1,9 (agua destilada) (todos expresados en mg/L, a 20 °C). |
| Solubilidad en otros solventes | acetona 545,9, diclorometano 22,3, n-hexano 0,028, tolueno 3,0 (expresados en g/L, a 20 °C). |
| Estabilidad | Estable en agua a pH 5 y 7; ligeramente hidrolizado a pH 9. Estable al calor. Se degrada ligeramente por exposición a la luz solar. En solución acuosa sufre fotólisis rápidamente. |
2.2.1. Soluciones
Patrón de Fipronilo
Se pesaron exactamente 0,0253 g de estándar de Fipronilo en un volumétrico de 25 mL y se enrasó con metanol.
Muestra
Se pesó aproximadamente 1g del cebo de Fipronilo, se extrajo con 5 mL de metanol durante 15 minutos. Posteriormente se filtró con filtros de 0,45 µm y de la solución resultante se tomó 0,1 mL que se adicionaron a un volumétrico de 10 mL y se enrasó con metanol.
Se inyectaron 20 µL de la solución patrón y seguidamente la misma cantidad de la muestra por triplicado.
Matriz (contiene todos los componentes del cebo de Fipronilo, excepto el ingrediente activo)
Se tamizó la harina de maíz (soporte) hasta un tamaño de partícula menor de 0,5 mm. Se adicionó la miel de purga y agua. Se mezcló manualmente hasta lograr homogeneidad y se dejó secar a temperatura ambiente. Finalmente, la matriz se envasó en un recipiente de cristal ámbar cerrado.
2.3. Técnica cromatográfica
En la Tabla 2 se resumen las condiciones cromatográficas de la nueva técnica bajo las cuales se realizó la verificación.
2.4. Cálculos
El porcentaje de ingrediente activo en la formulación se determinó empleando la ecuación (1):
Donde: Rm - Valor de la altura del pico de la muestra (mV).
Rp - Valor de la altura del pico del patrón (mV).
Pp - ingrediente activo en la disolución patrón (mg).
Pm - peso de la muestra (mg)
P - pureza del patrón
(- densidad de la muestra (g/L)
2.5. Análisis estadístico
Se determinó la linealidad, precisión, exactitud y especificidad de la técnica basándose en la guía de validación de técnicas analíticas para formulados agroquímicos del Consejo Colaborativo Internacional de Análisis de Plaguicidas (CIPAC por sus siglas en inglés) (Guidelines for CIA, 1986). La curva de calibración y los resultados de regresión lineal, así como los parámetros estadísticos: media, desviación estándar (SD) y desviación estándar relativa (RSD), fueron determinados por el programa de computación Microsoft Excel 2010.
Prueba F:
F se calcula mediante la siguiente fórmula (ecuación (2))
Donde: RSD: Desviación estándar relativa de la repetibilidad.
RSD's: Desviación estándar relativa de la exactitud.
Prueba t
Primeramente, se calcula t mediante la siguiente fórmula (ecuación (3)):
Donde: (: valor real, x: Media, n: número de muestra, s: desviación estándar (SD)
RESULTADOS Y DISCUSIÓN
3.1 Linealidad
La linealidad de un procedimiento analítico es su capacidad para obtener resultados de análisis que son directamente proporcionales a la concentración (cantidad) de un analito en un rango definido ((Guidelines for CIA, 1986).
Para estudiar la linealidad se prepararon cinco pesadas del patrón de Fipronilo abarcando el 20 % tanto por encima como por debajo de la cantidad recomendada por la técnica que se valida (0,025 g) y se determinó el intercepto, la pendiente, la desviación estándar (SD) y el coeficiente de correlación (r), (British Crop Protection Council, 2003). Los resultados obtenidos se muestran en la Tabla3 3 y Tabla 4.
Se puede apreciar en la Tabla 3 que el resultado obtenido para el coeficiente de correlación (0,9997) es mayor que 0,990, valor mínimo requerido para que la linealidad sea aceptable, por lo que se puede decir que la técnica analítica es lineal en el rango de concentración estudiado.
Tabla 3 Resultados de la linealidad del método
| Coeficiente de correlación | 0,9997 |
| Valor del Intercepto | -4,5 |
| Valor de la pendiente | 602,9 |
| Desviación estándar(SD) | 96,9 |
3.2. Precisión
La precisión es una medida de que tan cerca están los resultados entre sí y usualmente se expresa por medio del valor de la desviación estándar, que describe la dispersión, o sea, que describe la magnitud de los errores aleatorios (Gustavo, 1999). Puede ser expresada como repetibilidad y reproducibilidad ((Guidelines for CIA, 1986).
Para la precisión se prepararon cinco réplicas de la muestra y se determinó el por ciento de ingrediente activo. Posteriormente se determinó la media, la desviación estándar y se comparó con la obtenida en la ecuación de Horwitz la cual es (ecuación (4)):
donde C = concentración del analito (% p/p) en la muestra como una fracción decimal (Miller, y Miller, 1988); (Miller, 2000).
En la Tabla 5 se pueden observar los resultados obtenidos.
Tabla 5 Resultados de la precisión del método
| 1 | 0,0753 |
| 2 | 0,0592 |
| 3 | 0,0612 |
| 4 | 0,0627 |
| 5 | 0,0686 |
| X | 0,065 |
| SD | 0,006 |
| RSD | 0,1007 |
| RSDr | 4,040 |
La ecuación de Horwitz es el resultado de estudios de intercomparación realizados por el CIPAC en laboratorios internacionales acreditados donde se controla la calidad de plaguicidas. A partir de estos estudios se llegó a la conclusión de que la precisión para técnicas analíticas donde se determinen ingredientes activos de formulados de plaguicidas con concentraciones entre 100 y 0,25 %, será aceptable si la desviación estándar relativa (RSD) obtenida es inferior al valor determinado por la mencionada ecuación ((Guidelines for CIA, 1986). En este caso, se puede afirmar que el método es preciso pues como se observa en la Tabla 5, RSD (0,1007) < RSDr (4,040).
3.3. Exactitud
La exactitud de un procedimiento analítico expresa la capacidad del método analítico para obtener resultados lo más próximos posibles al valor verdadero. A diferencia de la precisión, que refleja el error aleatorio, la exactitud refleja el error sistemático o la tendencia a él (Gustavo, 1999).
La exactitud de un procedimiento debe ser determinado por el examen de un número de muestras a la cual se le añade una cantidad de analito conocida.
Para esta prueba se preparó una disolución patrón de Fipronilo de concentración 1 mg/mL y se le añadió 1 mL a cada muestra, lo cual equivale a un 0,1 % p/v. En la Tabla 6 se muestran los resultados obtenidos.
Tabla 6 Resultados obtenidos en la determinación de Fipronilo para la exactitud
| Blanco | 0,0547 |
| 1 | 0,1506 |
| 2 | 0,1595 |
| 3 | 0,1595 |
| 4 | 0,1596 |
| 5 | 0,1598 |
| Promedio | 0,1578 |
| X | 0,1578 |
| SD | 0,0065 |
| CV | 4,0948 |
| RSD's | 0,0409 |
Prueba F:
El valor obtenido mediante la ecuación 2 se compara con el tabulado a P = 0,05
F = 6,05457853 F0,05 = 6,39
Como el valor de F calculado es menor que el tabulado se puede afirmar que no hay diferencias significativas entre las desviaciones estándar relativas.
Prueba t
El valor obtenido mediante la ecuación 3 se compara con el tabulado a P = 0,05.
t = 0,657573843 t0,05 = 2,132
Se puede observar que el valor calculado es menor que el tabulado por lo que no hay errores sistemáticos en la técnica.
% de recuperación
El % de recuperación se calcula mediante la ecuación 5.
% recuperación = 101,8 %
El resultado obtenido es satisfactorio ya que se encuentra en el rango de por ciento exigido. Concluido el procedimiento propuesto para el análisis de los resultados se puede afirmar que la técnica es exacta.
3.4 Especificidad
La especificidad es la habilidad para calcular inequívocamente un analito en presencia de otros componentes que se espera que esté presente.
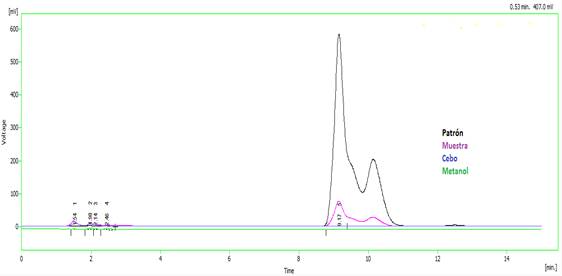
Para realizar el estudio de la especificidad del método se analizaron los cromatogramas del solvente, los ingredientes de los excipientes (placebo) utilizados en la formulación del Fipronilo, así como el cromatograma del estándar del principio activo. Se realizaron tres inyecciones del solvente y del placebo, tres inyecciones del patrón de Fipronilo así como tres inyecciones de la muestra a analizar. Primero se analizó el solvente con el objetivo de observar que no hubiera interferencia con el pico cromatográfico de interés, seguidamente se analizó el cromatograma correspondiente al placebo con el propósito de demostrar que no existen interferencias debida a los excipientes, posteriormente se analizó el cromatograma del estándar de Fipronilo, así como el de la muestra. Tal como se observa en la Fig. 1, no existe ninguna interferencia.
CONCLUSIONES
La nueva técnica implementada para la determinación de Fipronilo, formulado como cebo, por HPLC, arrojó buenos resultados.
La nueva técnica analítica cumple con los requisitos exigidos, linealidad, precisión, exactitud y especificidad; permitiendo garantizar el control de la calidad de las formulaciones desarrolladas.