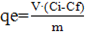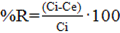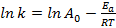Introducción
El problema de la contaminación de las aguas es sin duda, uno de los aspectos más preocupantes de la degradación de los medios naturales por parte de la civilización contemporánea, siendo considerado como un problema universal.1
El desarrollo industrial ha causado serios problemas de contaminación que tiene efectos negativos tanto en el medioambiente, como en la sociedad. Los contaminantes son descargados muchas veces a concentraciones por encima de los valores permisibles por legislaciones nacionales e internacionales, siendo los recursos hídricos, los de mayor riesgo por su alta velocidad de propagación.2
Las plantas de procesamiento de minerales, chapado de metales, las industrias eléctrica, electrónica y química son las que mayores descargas de metales pesados tóxicos y metaloides generan. Al estar presentes en altas concentraciones, pueden causar, además de los efectos tóxicos específicos de cada uno, otros cambios físicos, químicos y biológicos dentro de los cuerpos de agua; tales como, turbidez, viscosidad, aumento de la demanda de oxígeno, cambios en el pH, entre otros. Estos compuestos, aun en bajas concentraciones, provocan afectaciones en los organismos vivos, ya que son bioacumulables y no biodegradables. Se reporta que tienen un impacto negativo sobre la vida acuática y humana, debido a que causan problemas respiratorios, debilitamiento del sistema inmune, daño en los riñones e hígado, hipertensión, alteración del material genético, cáncer, alteraciones neurológicas e incluso la muerte.3
En los últimos años se ha incrementado el control de la contaminación causada por la presencia de metales pesados en el agua, en especial, iones metálicos como el Pb (II). Este es un metal pesado muy utilizado por su resistencia a la corrosión, ductilidad, maleabilidad y facilidad para formar aleaciones, por lo que lo hace altamente disponible en el ambiente, especialmente en cuerpos de agua, y por su alta toxicidad para el ser humano y diversos microorganismos, su remoción adquiere un especial interés.4 La Norma cubana (NC 27:1999) 5) establece como límite máximo permisible de Pb (II) en aguas 1 mg/L.
Se han utilizado diversas tecnologías para la remoción de este metal en aguas residuales, entre las que destacan: la precipitación química, la filtración por membrana, el intercambio iónico y la adsorción sobre carbón activado. No obstante, estos métodos tienen limitaciones, debido a los altos costos de operación para el caso de la adsorción con carbón activado, siendo en muchos casos ineficientes cuando la concentración de los metales es muy baja. Además, involucran el uso de reactivos químicos, generando grandes cantidades de residuos contaminantes.6
Recientemente, se ha extendido la utilización de nuevas tecnologías sostenibles para la remoción de metales en general, por medio del uso de residuos agrícolas como biosorbentes de bajo costo, eficientes y reutilizables. En este sentido, la biosorción constituye una alternativa promisoria para el tratamiento de aguas contaminadas por metales pesados.7
Por otra parte, estudios realizados por diversos investigadores 8 han demostrado que la biomasa lignocelulósica es una excelente opción para el tratamiento de aguas, debido a la presencia de numerosos grupos funcionales que facilitan la bioadsorción de los iones metálicos. Entre los materiales ampliamente utilizados con excelentes resultados para la remoción de metales pesados se encuentran: tallo de palma con Cr (VI) 9; cáscara de tapioca con Ni (II) 10; fibras de yute con Cu (II) 11, entre otros.
Sin embargo, el meollo proveniente del desmedulado del bagazo de la caña de azúcar no ha sido reportado como posible biosorbente. La industria azucarera cubana desmedula el bagazo antes de su empleo para la producción de pulpa química y otros derivados. Se recomienda eliminarlo porque produce afectaciones tecnológicas durante los procesos productivos en los que se involucra como materia prima.12 El meollo es un residuo que se genera en Cuba en miles de toneladas anuales y hasta el momento no se le ha encontrado una adecuada disposición final. En el año 2016 comenzaron las investigaciones en el Instituto de Investigaciones de los Derivados de la Caña de Azúcar (ICIDCA) para la posible reutilización de este residuo y se demostró su efectividad para la remoción de azul de metileno.13
En este trabajo, se estudia el proceso de adsorción de Pb (II) sobre el meollo de caña de azúcar para evaluar su posible uso en la remoción de este catión en aguas contaminadas y ampliar así las posibles aplicaciones de este residuo vegetal.
Materiales y métodos
Preparación del material
Se utilizó el meollo obtenido durante el desmedulado en suspensión del bagazo de la caña de azúcar proveniente del Complejo Agroindustrial “Manuel Fajardo” en Quivicán, provincia de Mayabeque, durante la zafra 2014-2015.
El tratamiento general consistió en lavado, filtración, secado, molienda, envase en bolsa de polietileno de doble capa y almacenamiento en estante de laboratorio a temperatura entre 25 y 30 °C.
El material fue secado al aire libre y se molió en un molino de púas marca Olivetti, empleándose la fracción de partículas con tamaño inferior a 0,5 mm para la caracterización y evaluación de las propiedades de biosorción.
Caracterización del biosorbente
Al meollo que se utilizó en esta investigación se le realizó una caracterización físico-química completa, reportada en trabajos anteriores.13
Espectroscopia Infrarroja con Transformada de Fourier
Se utilizó un equipo de FTIR marca Bruker, modelo Vector 32 para la determinación y ratificación de la aparición de los grupos funcionales esperados en el meollo. El material no tuvo previa preparación y el espectro se registró en el rango de 4000-600 cm-1.
Microscopia Electrónica de Barrido
Se empleó un microscopio electrónico de barrido marca Hitachi modelo S-530. La caracterización morfológica se efectuó fijando en soportes de aluminio puro las muestras del meollo natural y cargado con una solución de 50 mg/L de plomo (II) que se preparó a partir de PbNO3 (p.a., Sigma Aldrich) disuelto en agua desionizada (Grado III pH 7,0±0,5 y conductividad <3μS). Se les aplicó una fina capa de carbón, posteriormente de oro, a vacío, para proporcionar conductividad y rigidez a las muestras. Las imágenes se obtuvieron a una magnificación de 500x y 2000x.
Estudios de adsorción
Los ensayos de adsorción fueron realizados en modo “batch”. Para ello, se colocó una masa determinada de meollo en contacto con 50 ml de soluciones de Pb (II) en frascos erlenmeyers de 250 mL, que se situaron en una Zaranda Incubadora GFL 3033 con control de temperatura y velocidad de agitación en cada caso. Posteriormente, se determinó la concentración de plomo en solución mediante Espectrometría de Absorción Atómica con Llama (EAALL), en un equipo marca Shimadzu, modelo AA-6800. Las condiciones instrumentales de determinación se presentan en la tabla 1:
Tabla 1 Condiciones experimentales de la determinación mediante EAALL
| Tipo de llama | λ (nm) | h (cm) | pbe (nm) | i (mA) | Veloc. de aspiración (mL/min) |
|---|---|---|---|---|---|
| Aire -C2H2 esteq. | 283,3 | 10,0 | 1,0 | 7,0 | 5,0 |
Para el cálculo de la capacidad de adsorción del meollo se utilizó la ecuación 1 11:
donde
qe: capacidad de adsorción (mg/g), V: volumen de la solución en contacto con el adsorbente,
Ci: concentración inicial de la solución de Pb (II) (mg/L),
Cf: concentración final de la solución de Pb (II) (mg/L),
m: masa seca de adsorbente.
El porcentaje de remoción de Pb (II) de la solución se calculó a partir de la ecuación 2:
donde
%R: porciento de Pb (II) adsorbido sobre el adsorbente, Ce: concentración en el equilibrio de la solución de Pb (II) (mg/L), Ci: concentración inicial de Pb (II) en solución (mg/L)
Para la evaluación estadística de los datos experimentales se empleó el software OriginLab Versión 8.0 y Statgraphics. La significancia estadística de las variables fue evaluada por el análisis de varianza ANOVA, tomando como criterio de carencia de ajuste (p-valor), el coeficiente de determinación R2 y la suma de cuadrados del error (SSE).13,14
Efecto del pH
Para estudiar la influencia del pH se utilizó una solución de Pb (II) de 50 mg/L, a la cual se le ajustó el pH en el intervalo de 3-6 con la ayuda de un Potenciómetro marca Hanna Instruments (Mettler Toledo AG 8603) con electrodo de vidrio y calomel, y utilizando soluciones de NaOH (0,1 mol/L) (p.a., Titolchimica, Italia) y HNO3 (0,1 mol/L) (p.a., Riedel de Haen, Alemania). Se mantuvieron constantes la temperatura (30 °C), agitación (150 rpm) y el tiempo estimado para que el sistema alcance el equilibrio (180 min).
Influencia de la dosis de adsorbente
Durante este estudio se evaluó el efecto de la dosis de meollo sobre la remoción del Pb (II). La concentración del meollo se varió entre 0,5-5 g/L. Los demás factores se mantuvieron constantes: pH=5, temperatura 30 ℃, velocidad de agitación 150 rpm, tiempo hasta alcanzar el equilibrio (180 min) y concentración de Pb (II) 50 mg/L.
Cinética de adsorción
Para estudiar la cinética de adsorción de Pb (II) sobre meollo, se diseñaron experimentos en los cuales el pH se ajustó a 5, la dosis de adsorbente a 3 g/L y la velocidad de agitación a 150 rpm en todos los casos. En la tabla 2 se resumen las condiciones de trabajo seleccionadas para cada estudio cinético:
Efecto de la concentración inicial de Pb (II)
Las isotermas de adsorción fueron obtenidas a partir de datos experimentales en el equilibrio. Se añadió una concentración de meollo de 3 g/L en los erlenmeyers que contenían soluciones de plomo con concentraciones: 10, 30, 50, 70, 90, 110, 130 y 150 mg/L. Los recipientes se mantuvieron en agitación a 150 rpm, pH = 5, temperatura de 30 °C y tiempo de contacto 45 min
Influencia de la temperatura sobre el proceso de adsorción
La temperatura se ajustó a 30, 40 y 50 ℃, variando la concentración inicial de plomo entre 10-150 mg/L, y manteniendo constantes: pH=5, dosis de adsorbente 3 g/L, velocidad de agitación 150 rpm, tiempo de contacto 45 min.
Regeneración del bioadsorbente
Para evaluar la posible reutilización del adsorbente se realizaron ensayos de desorción. Después de fijado el Pb (II) en las condiciones experimentales establecidas previamente se filtró el adsorbente y se realizaron las pruebas de desorción utilizando concentraciones de HNO3 de 0,05; 0,1; 0,2 y 0,3 mol/L (p.a., Riedel de Haen, Alemania). Este experimento se realizó en las mismas condiciones experimentales ya descritas en la adsorción.
Resultados y discusión
Caracterización del meollo
Desde el punto de vista químico, la composición del meollo y el bagazo es similar, con la diferencia que el primero está constituido morfológicamente por tejido parenquimatoso.13
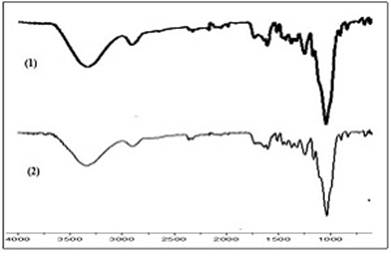
Con el objetivo de verificar la no existencia de cambios en la composición del meollo previamente caracterizado se obtuvo el espectro IR.
Espectro FTIR del meollo natural
En la figura 1 se muestra el espectro FTIR del meollo, donde se evidencia, la naturaleza compleja de este material. Los principales componentes del meollo son: celulosa, hemicelulosa y lignina; y las bandas que se aprecian en el espectro IR pueden ser asignadas a los grupos funcionales de estos polímeros que lo constituyen.
En la figura se destaca la banda ancha en 3337 cm-1, reconocida por las vibraciones de los grupos OH; 2904 cm-1 asociada a las vibraciones de los grupos C-H y 1732 cm-1 atribuida a las vibraciones de estiramiento C=O de los grupos carboxílicos.15 Las bandas 1603, 1508 y 1423 cm-1 corresponden a vibraciones de las estructuras aromáticas relacionadas a la lignina. En 1375 y 1319 cm-1 se encuentran dos picos relacionados a las vibraciones de enlace de los grupos CH3; 1244 cm-1 asignada para la vibración de la extensión C-O-R de éster o carboxilo; 1034 cm-1 para la vibración de enlace C-O del esqueleto celulósico.16 Todas las bandas mencionadas son características de materiales lignocelulósicos y la presencia de estos grupos funcionales sirven como sitios de adsorción de iones metálicos y otros componentes.17
Los espectros obtenidos en los años 2015 (1) y 2019 (2) indican que el meollo no ha experimentado transformaciones durante su almacenamiento.
Microscopia electrónica de barrido
La figura 2 muestra las micrografías SEM obtenidas del meollo natural y cargado con Pb (II) para diferentes magnificaciones:
Se observa la estructura fibrosa característica de los materiales lignocelulósicos y las cavidades de diferentes tamaños que conllevan a la formación de un sistema de poros interconectados donde pudieran insertarse los iones Pb (II).18 Además, la rugosidad del material y la presencia de deformaciones superficiales sugiere la disponibilidad de sitios para que ocurra la adsorción. Las imágenes posteriores al proceso de sorción indican una disminución de las cavidades, las cuales podrían estar ocupadas por los iones Pb (II) adsorbidos.19
Estudios de adsorción
Influencia del pH en la adsorción de Pb (II) sobre el meollo
En la figura 3 se representa la capacidad de adsorción (qe) del meollo y el porcentaje de remoción (%R) de Pb (II) de la solución, para un intervalo de pH de 3-6.
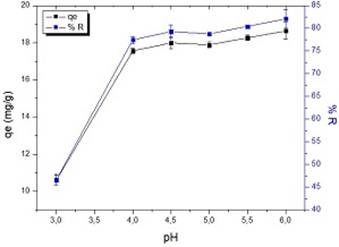
Fig. 3 Variación de la capacidad de adsorción del meollo y el %R de Pb (II) con el pH. (Conc. Pb (II) = 50 mg/L, dosis de meollo = 2 g/L, tiempo de contacto = 180 min, T = 30 ℃)
Se escogió este rango de pH debido a que como se observa en la figura, en medios muy ácidos disminuye de forma importante el porcentaje de plomo retenido, lo cual pudiera ser el resultado de la presencia de mayor cantidad de iones H3O+, que pueden competir con los iones de Pb (II) por los sitios de adsorción del meollo y a su vez, limitan la aproximación de los cationes del metal como consecuencia de las fuerzas de repulsión, debido a que la superficie se encuentra cargada positivamente.20
A medida que el pH se incrementa, más grupos funcionales carboxílicos están disociados y se convierten en posibles sitios activos para la interacción con los iones Pb (II), incrementándose la fuerza de atracción entre el metal y la superficie del biosorbente.21
Varios autores han obtenido resultados similares en el estudio de la biosorción de plomo con diferentes materiales. Lavado 21, indica que el porcentaje de adsorción de plomo con marlo de maíz aumenta en el intervalo de pH de 2 a 5, mostrándose un máximo de adsorción en el rango de 5-6. Otros autores encontraron que la mayor eficiencia en la biosorción de Pb ocurre a pH 5 en residuos de cáscara de maní 17 y bagazo de la caña de azúcar.3
Adicionalmente, en el caso particular del meollo, el pH del punto de carga cero (pHpcc) es 6,94 reportado por Dopico 13 y por eso debe esperarse que a pH superiores la capacidad de adsorción aumente, pues aumentan los sitios con carga negativa debido a la disociación de los grupos carboxílicos principalmente. Sin embargo, se selecciona un pH=5, ya que no es conveniente aumentar el pH a valores superiores por la formación de especies poco solubles de Pb.3
Efecto de la dosis de meollo sobre la adsorción de Pb (II)
En la figura 4 se muestran los resultados obtenidos en este estudio:
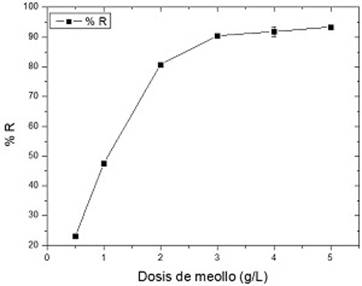
Fig. 4 Influencia de la dosis de meollo en la retención de Pb (II). (Conc, Pb (II) = 50 mg/L, pH = 5; tiempo de contacto = 180 min, T = 30 ℃)
En la figura se evidencia un aumento en el porcentaje de retención de Pb (II), la remoción fue desde 23,1 % a 90,4 %, cuando la dosis de adsorbente aumenta, en el intervalo de 0,5-3 g/L, por encima de este valor no se obtienen cambios significativos.
Este incremento de la adsorción se debe al aumento de la superficie de contacto del adsorbente y la mayor cantidad de sitios activos. Al aumentar la dosis de adsorbente por encima de 3 g/L, se crea un exceso de sitios disponibles que comienzan a competir entre sí, lo cual sumado a la reducción del gradiente de concentración de Pb (II) en solución, provocan que la remoción permanezca prácticamente invariable.15
Además, Dar 22 discute la formación de una monocapa de adsorbato sobre la superficie del sólido y que la etapa limitante podría ser la difusión de los iones hacia el interior de las partículas del biosorbente. Por lo tanto, un aumento en la cantidad de adsorbente utilizado no mostrará cambios significativos en el proceso de adsorción. Otros investigadores encontraron comportamientos semejantes al obtenido para meollo al estudiar la retención de Pb (II) sobre carbón activado modificado con EDTA y HNO3.23 Por tanto, para los estudios posteriores se seleccionó una dosis de meollo de 3 g/L.
Efecto del tiempo de contacto en la adsorción de Pb (II)
Como paso previo al estudio cinético, se procedió a evaluar el tiempo de contacto necesario para alcanzar el equilibrio. Los resultados se muestran en la figura 5:
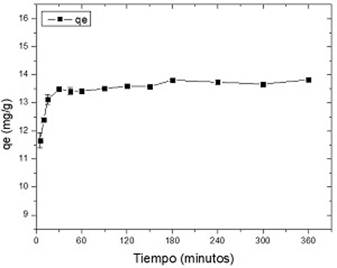
Fig. 5 Influencia del tiempo de contacto en la capacidad de sorción de Pb (II) en meollo. (Conc. Pb = 50 mg/L, pH = 5, dosis de meollo = 3 g/L, T= 30º C).
Se observa como la retención de plomo se produce de forma muy rápida, llegándose a 82 % de remoción a los 15 min y alcanzándose el equilibrio a partir de los 30 min de tiempo de contacto. Para tiempos superiores a 30 min no existen variaciones apreciables. El tiempo de contacto escogido para estudios posteriores fue de 45 min.
El hecho de que la adsorción de Pb (II) es rápida al inicio se debe a que el material adsorbente tiene numerosos sitios activos disponibles, los cuales van disminuyendo en la medida en que son ocupados hasta establecerse un equilibrio entre la fase sólida y líquida. En estas condiciones, el proceso se hace lento, probablemente, porque comienza a ser controlado por la difusión de los iones al interior de las cavidades del meollo.24
Estos resultados son semejantes a los obtenidos por otros investigadores: Mopoung 25, indica que la máxima retención de plomo con residuos de piña tratado con NaOH se produce a los 30 min de tiempo de contacto, mientras que Kun y col. 26) afirman que el proceso de biosorción de plomo con residuos de cáscara de maní es muy rápido en los primeros 30 min, alcanzándose el equilibrio a los 100 min de operación.
Estudio de la cinética de adsorción
En las tablas 3 y 4 se recogen los valores de los parámetros cinéticos calculados para los modelos de pseudo primer orden, pseudo segundo orden y difusión intraparticular.
Tabla 3 Constantes calculadas a partir del modelo cinético de pseudo primer y segundo orden
| SSE | R2 | p-valor | k | Qe (mg/g) | |
| Pseudo 1er orden | 2,335 2 | 0,619 7 | 0,000 0 | 0,005 2 (min-1) | 0,96 |
| Pseudo 2do orden | 0,055 2 | 0,999 9 | 0,085 0 | 0,055 5 (g/mg·min) | 13,81 |
El modelo de pseudo primer orden no se ajusta al proceso de adsorción que tiene lugar, por los bajos valores del coeficiente de determinación y el p-valor obtenido. En cambio, los datos experimentales se ajustan bien al modelo de pseudo segundo orden con un nivel de confianza del 95 % según los valores calculados de p-valor, R2 y SSE. Además, la capacidad de adsorción en el equilibrio, calculada por el modelo, es similar a la obtenida experimentalmente (13,6±0,2 mg/g). Estos resultados indican que la capacidad de adsorción es proporcional al número de centros activos en la superficie del adsorbente. Estos resultados concuerdan con los obtenidos para la biosorción de plomo en carbón xantado.14
Tabla 4 Constantes calculadas a partir del modelo cinético de difusión intraparticular
| Etapa | Kdf (mg/g·min1/2) | Bdf | p-valor | R2 | SSE |
|---|---|---|---|---|---|
| Primera | 0,887 2 | 9,64 | 0,548 9 | 0,989 1 | 0,005 8 |
| Segunda | 0,028 6 | 13,26 | 0,043 1 | 0,733 4 | 0,047 5 |
Kdf: Constante de velocidad de difusión intraparticular
Bdf: Intercepto del modelo cinético de difusión intraparticular
Los resultados de la aplicación del modelo de difusión intraparticular revelan que el proceso de adsorción ocurre en 2 etapas: una primera etapa rápida que tiene lugar en los primeros minutos de contacto, donde se produce una adsorción instantánea entre el adsorbato y la superficie externa, y una segunda etapa más lenta donde se alcanza el equilibrio.11
Los valores de las constantes de velocidad obtenidas en ambas etapas y el hecho de que las líneas del modelo de difusión no interceptan el origen de coordenadas, es un indicativo de que el proceso de adsorción no está controlado por la difusión intraparticular.27
Influencia de la concentración inicial de Pb (II) sobre la velocidad del proceso de sorción
En la figura 6 se representan los valores de la capacidad de adsorción en función del tiempo:
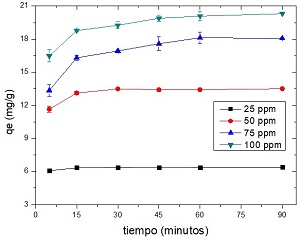
Fig. 6 Efecto de la concentración inicial de Pb (II) en la cinética del proceso de biosoción (pH = 5, dosis de meollo = 3 g/L, temperatura = 30 ℃)
Para el procesamiento cinético de los datos experimentales se utilizó el modelo de pseudo segundo orden, por ser el de mejor ajuste. En la tabla 5 se muestran los resultados obtenidos:
Tabla 5 Constantes calculadas a partir del modelo cinético de pseudo segundo orden
| Conc. Pb2+ (mg/L) | 25 | 50 | 75 | 100 |
|---|---|---|---|---|
| SSE | 0,003 3 | 0,055 2 | 0,003 7 | 0,001 1 |
| R2 | 0,999 9 | 0,999 9 | 0,999 7 | 0,999 9 |
| p-valor | 0,139 6 | 0,085 0 | 0,561 3 | 0,339 5 |
| K2 (g/mg·min) | 0,507 0 | 0,055 5 | 0,019 6 | 0,009 1 |
| Qe (mg/g) | 6,42 | 13,81 | 18,90 | 20,63 |
La capacidad máxima de retención de Pb (II) por el biosorbente, aumenta de 6,42 a 20,63 mg/g a medida que se eleva la concentración inicial del metal en solución, lo que puede ser atribuido al incremento del gradiente de concentración del adsorbato.28 Sin embargo, la constante cinética del proceso disminuye a medida que aumenta la concentración de plomo de 25 a 100 mg/L. Esto indica que la etapa inicial de la sorción ocurre de forma rápida y una vez alcanzado el equilibrio, el proceso se hace más lento, posiblemente por la saturación de los centros activos de la superficie, pues estaría limitado por la difusión de los iones Pb (II) de la superficie al interior del sorbente. Estos resultados son similares a los obtenidos para la remoción de Pb (II) utilizando hueso de aceituna, alpeorujo y poda de olivo.29
Influencia de la temperatura en la cinética de la sorción de Pb (II) sobre meollo
En la figura 7 se muestran los resultados obtenidos. Así mismo, en la tabla 6, se recogen los valores calculados del ajuste de los datos experimentales al modelo de pseudo segundo orden.
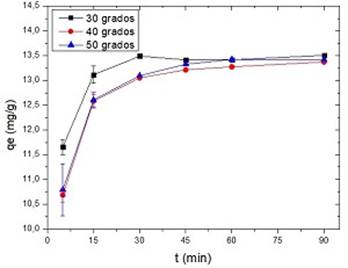
Fig. 7 Efecto de la temperatura en la cinética del proceso de biosorción (Conc. Pb (II) = 50 mg/L, pH = 5, dosis de adsorbente = 3 g/L, tiempo de contacto = 45 min)
Tabla 6 Constantes calculadas a partir del modelo cinético de pseudo segundo orden
| Temperatura (℃) | 30 | 40 | 50 |
|---|---|---|---|
| SSE | 0,055 2 | 0,000 2 | 0,000 9 |
| R2 | 0,999 9 | 0,999 9 | 0,999 9 |
| p-valor | 0,085 0 | 0,833 0 | 0,627 9 |
| K2 (g/mg·min) | 0,055 5 | 0,060 1 | 0,061 3 |
| Qe (mg/g) | 13,81 | 13,55 | 13,64 |
Tanto la capacidad de adsorción de Pb (II) en meollo, como los valores de las constantes de velocidad de pseudo segundo orden no muestran cambios significativos en el rango de temperatura estudiado. Resultados similares fueron obtenidos utilizando tuza de maíz en la retención de rojo 40.30
Para conocer la energía de activación del proceso de adsorción a las diferentes temperaturas se aplicó la ecuación de Arrhenius linealizada (ecuación 3):
donde
A0 es la constante de Arrhenius,
Ea es la energía de activación (kJ/mol),
R es la constante universal de los gases, 8,314·10-3 kJ/mol·K y T es la temperatura (K).
La magnitud de Ea da una idea si el proceso es predominantemente físico (<40 kJ/mol) o químico (40-800 kJ/mol).31 La energía de activación determinada es de 4,07 kJ/mol, lo cual sugiere que en las fuerzas implicadas en la unión del ion con la superficie del sólido predominan las interacciones de tipo físico. Estos resultados son semejantes a los encontrados por Han y col.32) que obtienen un valor de Ea = 2,10 kJ/mol para la biosorción de plomo con arena recubierta de óxido de manganeso.
Efecto de la concentración inicial de Pb (II) sobre el proceso de adsorción
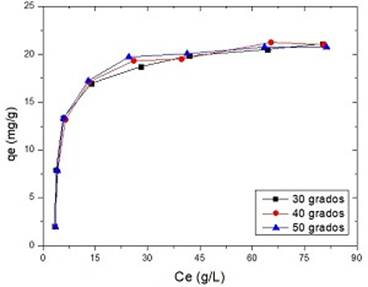
En la figura 8 se muestran los resultados obtenidos:
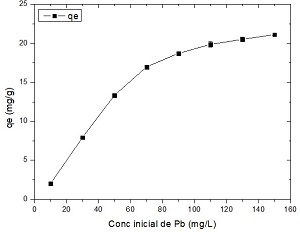
Fig. 8 Influencia de la concentración inicial de Pb (II) sobre la adsorción (pH=5, dosis de adsorbente=3 g/L, tiempo de contacto=45 min, temperatura=30 ℃)
Los resultados muestran que la capacidad de adsorción se incrementa de 2,01 a 21,14 mg/g al aumentar la concentración inicial de Pb (II) en el intervalo de 10-150 mg/L, debido a que aumenta el gradiente de concentración del metal en solución, lo cual provoca que disminuya la resistencia a la difusión de Pb (II) desde la fase líquida hasta la superficie del sólido. Además, la capacidad de adsorción se eleva hasta un valor límite, donde se satura la superficie del meollo.33 Resultados similares fueron encontrados para la adsorción de metales sobre distintas biomasas.15,21
Estudio en el equilibrio. Isotermas de adsorción
Los datos e información obtenida a partir de los experimentos de equilibrio se muestran en las isotermas de adsorción (ver figura 9):
En el gráfico se evidencia que no existe diferencias significativas entre las isotermas al variar la temperatura en el intervalo estudiado, lo cual está en concordancia con lo obtenido anteriormente al analizar su efecto en la cinética del proceso. Este mismo resultado ha sido obtenido en la biosorción de Cu (II), Zn (II) y Ni (II) con corcho.34
Según Limousin 35, las curvas son de tipo L, lo cual indica que la relación entre la concentración del adsorbato que permanece en solución y el adsorbido sobre la superficie del sólido decrece cuando aumenta la concentración inicial de Pb (II). De esta manera, se obtiene una curva cóncava que sugiere una posible saturación del meollo.
La primera porción de la isoterma provee información acerca de la disponibilidad de los sitios de adsorción en la superficie del meollo, seguido de la formación de una monocapa. Se han encontrado resultados similares para la adsorción de Pb (II) a temperatura de 25-30 ℃ con cáscara de yuca como biosorbente (11,5 mg/g).36
Para la modelación del proceso de adsorción de Pb (II) se emplearon los modelos de las isotermas de Langmuir, Freundlich, Tempkin y Dubinin-Radushkevich.37) Se muestra solo el modelo de Langmuir, por ser el de mejor ajuste. Las constantes y parámetros estadísticos obtenidos se resumen en la tabla 7:
Tabla 7 Constantes y parámetros estadísticos obtenidos según Langmuir
| Langmuir | 30 | 40 | 50 |
|---|---|---|---|
| Q max (mg/g) | 22,39 | 22,72 | 22,19 |
| KL (L/g) | 0,19 | 0,18 | 0,22 |
| RL (mínima conc) | 0,34 | 0,36 | 0,32 |
| RL (máxima conc) | 0,03 | 0,04 | 0,03 |
| SSE | 0,011 1 | 0,023 9 | 0,026 4 |
| p-valor | 0,112 2 | 0,144 6 | 0,578 9 |
| R2 | 0,998 7 | 0,997 2 | 0,997 1 |
KL: Constante de Langmuir
RL: Factor de separación obtenido del modelo de Langmuir
Como se observa, este modelo se ajusta bien a los resultados experimentales, obteniéndose un p-valor por encima de 0,05 y un coeficiente de determinación cercano a la unidad para todos los casos.
Los valores de Q máx (22,39 mg/g; 22,72 mg/g; 22,19 mg/g) se encuentran en correspondencia con los alcanzados experimentalmente (21,14 mg/g; 21,03 mg/g; 20,77 mg/g). Por lo tanto, se pudiera inferir que la adsorción se establece esencialmente mediante la formación de una monocapa.38
Los valores de RL calculados para las 3 temperaturas, se encuentran en el rango de 0 a 1, lo que apunta a que el proceso es favorable. Resultados análogos han sido descritos por Promthet y col. 9 en la adsorción de metales.
La comparación de los resultados de la capacidad de sorción del meollo para Pb (II) con la obtenida con otros biosorbentes se muestra en la tabla 8:
Estudio de desorción del Pb (II)
Los estudios de desorción ayudan a determinar la naturaleza del proceso de adsorción y la recuperación del ion metálico desde el biosorbente sin dañar la estructura del material. Además, la regeneración del biosorbente es importante desde el punto de vista económico. En este estudio se escogió HNO3, pues en la literatura se recomienda su uso en este tipo de materiales.15 En la figura 10 se muestran los resultados obtenidos:
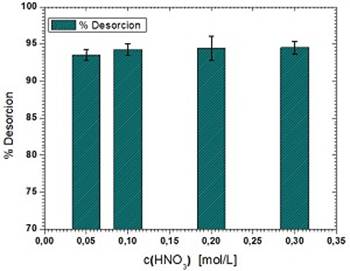
Fig. 10 Desorción de Pb (II) (Conc. Pb (II) = 50 mg/L, pH = 5, dosis de adsorbente = 3 g/L, tiempo de contacto = 45 minutos, temperatura = 30 ℃)
Se puede observar en la figura 10 que no hay cambios significativos en el porciento de desorción al aumentar la concentración de HNO3 de 0,05 mol/L a 0,3 mol/L. La máxima desorción de plomo que se obtiene es de 93,5 %, la cual está en correspondencia con la reportada para marlo de maíz utilizando HNO3.15
El alto porcentaje de desorción obtenido es un indicativo de que el proceso de sorción se debe llevar a cabo principalmente por procesos físicos con los grupos funcionales presentes en la superficie del adsorbente, según ha sido reportado en estudios con otros biosorbentes.44
Conclusiones
La caracterización morfológica y físico química el meollo del bagazo de la caña de azúcar permitió establecer que este material presenta propiedades que favorecen la adsorción de cationes metálicos, utilizándose por vez primera para estos fines. Las condiciones óptimas para la adsorción de Pb (II) fueron: pH = 5, dosis de absorbente = 3 g/L, tiempo de contacto = 45 min, T = 30 ℃. En estas condiciones se alcanzó una capacidad de sorción (qe) de 22,39 mg/g, que está en correspondencia con la obtenida para este catión con otros biosorbentes. La desorción del Pb (II) puede realizarse con una efectividad de un 93,5 % utilizando soluciones de HNO3 0,05 mol/L, lo cual abre la posibilidad de poder reutilizar el meollo en varios ciclos de adsorción.