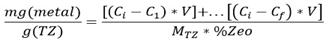Introducción
La contaminación de las fuentes hídricas, plantea actualmente un problema global, debido al incremento intensivo de la actividad tecnológica, 1,2 que provoca que una gran cantidad de agua residual de procesos industriales se descargue a ríos y demás sistemas hídricos.
Estas aguas residuales suelen tener una gran variedad de contaminantes, muchos en forma de iones catiónicos y aniónicos. Los metales pesados son de los contaminantes que más afectan al medio ambiente y están considerados como uno de los grupos más peligrosos debido a su no biodegradabilidad y alta toxicidad a bajas concentraciones. 3
La Empresa “Comandante Pedro Sotto Alba” (ECPSA) ubicada en el municipio Moa de la provincia Holguín procesa minerales lateríticos mediante la tecnología de lixiviación ácida a alta presión (HPLA) para obtener sulfuros de níquel y cobalto.
El WL por sus siglas en inglés (waste liquor) es un residual líquido que genera esta planta durante el proceso metalúrgico. Es de coloración azulosa y olor desagradable por su contenido de H2S. Posee una temperatura de 90-95oC, contiene partículas en suspensión de sulfuros de Ni y Co, gran acidez y varios metales disueltos.
Este residual se descarga al río Cabaña con una concentración de metales, acidez y temperatura que superan las normas ambientales de vertimiento, 4 dando lugar a la pérdida de elementos metálicos que pudieran ser recuperados. 5
Disímiles han sido las investigaciones enfocadas a dar solución al problema de contaminación generado por este efluente, 4,6,7) sin embrago las variantes propuestas, no han sido puestas en práctica por diferentes motivos, entre los que sobre sale que incrementan los costos de producción. 8
En este sentido muchos investigadores han estudiado diversos aspectos de la eliminación de metales pesados mediante el empleo de zeolitas, teniendo en cuenta su viabilidad técnica para estos fines debido su bajo costo. 1,9
Erdem et al. 10 estudiaron el comportamiento de la adsorción de la zeolita clinoptilolita frente a diferentes iones. Se constató que la adsorción depende de la densidad de carga y del diámetro del ion hidratado. El orden de selectividad de la zeolita con relación a los iones analizados fue: Co+2 > Cu+2 > Zn+2 > Mn+2.
Cabrera et al.11) investigaron las características de adsorción de zeolita cubana compuesta por clinoptilolita y mordenita, frente a efluentes metalúrgicos. Se demostró que la zeolita tiene un alto potencial para la retención de metales pesados con un orden de selectividad: Cu+2 > Ni+2 > Zn+2 y que la habilidad de retención es muy dependiente del pH y en menor extensión de la relación metal/zeolita.
En este contexto el empleo de tobas zeolitizadas pudiera ser relevante en el tratamiento del WL, si se tiene en cuenta su estructura porosa, su capacidad inherente de intercambio iónico y material adsorbente, la forma y el tamaño de sus poros, así como su disponibilidad, ya que Cuba cuenta con las características geológicas favorables para el desarrollo de yacimientos de este tipo. (12
Sin embargo, el mayor número de los trabajos reportados en cuanto a la posibilidad de empleo de las tobas zeolitizadas en la industria del níquel, corresponden a la lixiviación carbonato amoniacal, siendo insignificantes los trabajos realizados en la lixiviación ácida. 13
Rodríguez 14 comprobó la efectividad de la zeolita natural clinoptilolita (CLI) cálcica del yacimiento Tasajeras (Cuba) para remover y recuperar por intercambio iónico, Ni, Co y NH4 de residuales líquidos de carácter carbonato-amoniacal de la Industria Cubana del Níquel.
Posterior a esta investigación Rodríguez et al.15 estudiaron a escala de laboratorio la remoción de metales pesados, presentes en los mismos residuales líquidos, combinando procesos de precipitación de sulfuros con intercambio iónico a 25oC usando CLI del yacimiento Caimanes (Moa-Cuba) modificada a forma amónica. Demostraron que la zeolita tuvo mayor selectividad por el Cu2+, Co2+ y Mn2+, que por el Ni2+ y Fe3+; y que con excepción del Cu, el intercambio de estos cationes metálicos es de carácter reversible.
Sin embargo, más tarde estos autores, 16 con estos residuales carbonato-amoniacales y zeolita del mismo yacimiento, a nivel piloto y temperaturas de 85oC demostraron un incremento significativo en la remoción de Ni por intercambio iónico.
También 13 evaluaron el comportamiento de la zeolita del yacimiento de Farallones frente al residual de la planta de Neutralización de la Fábrica Pedro Sotto Alba conocido como licor crudo y a disoluciones de sulfato de níquel (II) y sulfato de cobalto (II). De los resultados se desprendió que la zeolita adsorbió Ni y Co. La presencia de estos metales en la zeolita se demostró por análisis semicuantitativo, debido a un incremento en la intensidad de las líneas espectrales del Ni y el Co con respecto a la zeolita inicial.
De ahí, que el objetivo de este trabajo es evaluar el comportamiento de las tobas zeolitizadas del yacimiento San Andrés en el tratamiento del licor residual ácido WL de la Empresa Cmdt. Pedro Sotto Alba.
Materiales y métodos
Para el experimento se emplearon tobas zeolitizadas (TZ) del yacimiento San Andrés, las muestras fueron obtenidas de la Planta de Procesamiento de Zeolitas de la UEB Geominera Holguín en sacos de polipropileno de 25 kg.
Se realizó el análisis granulométrico, seleccionando la fracción (-1,4+0,85) mm, dado que la efectividad de las TZ como intercambiador iónico frente a licores ácidos aumenta al disminuir la clase de tamaño. 13 Por lo que para aprovechar el mayor % en peso de la muestra obtenida, las fracciones de mayor tamaño fueron trituradas en un molino de disco ubicado en el Centro de Investigaciones del Níquel (CEDINIQ), donde además se realizaron los análisis químicos y mineralógicos.
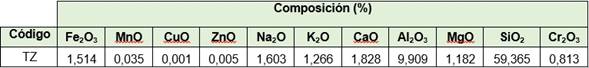
La composición química en óxido de las TZ se muestra en la tabla 1, determinada a partir del método de Espectrometría de Absorción Atómica (EAA).
En la figura 1 se muestra el difractograma obtenido por Difracción de Rayos X (DRX), que evidencia que la TZ natural refleja un predominio de la fase zeolítica, con una composición mineralógica del tipo clinoptilolita-heulandita, más mordenita.
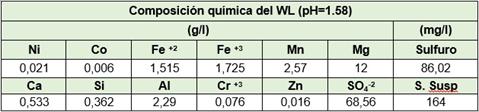
El WL empleado en el experimento fue recolectado de la línea de descarga del tanque de licor de desperdicio (194-TK-1) de la Planta de Precipitación de Sulfuros de la ECPSA.
El pH y la composición química del mismo previo a su vertimiento se muestran en la tabla 2, la cual se determinó por EAA para los elementos Ni, Co, Cu, Mn, Mg y Zn. El método de análisis empleado para la determinación del Fe y el Cr fue el método colorimétrico y se empleó el método gravimétrico para la determinación de los sulfatos y los sólidos suspendidos.
Para el ensayo de intercambio iónico se diseñó una columna de acrílico de 10 cm de diámetro, una altura total de 61 cm y una altura del lecho de 52 cm, provista con una válvula de bola en la descarga y como soporte del relleno una malla de acero inoxidable de abertura 20 Mesh para impedir el arrastre de material zeolítico.
El experimento de intercambio iónico se realizó en batch. La metodología experimental consistió en adicionar 2 L de WL a una temperatura entre 55-60oC, a la columna cargada con 3,44 kg de TZ y dejar en contacto durante 30 min, descargar todo el licor y repetir el proceso hasta las 3 h de contacto, para evaluar el comportamiento de la capacidad de la TZ en la adsorción de los iones metálicos presentes en el WL en los distintos tiempos, así como el por ciento de remoción.
Al finalizar el experimento se procedió a determinar la capacidad de adsorción de la toba zeolitizada por ion metálico en solución, para conocer la cantidad de cada metal que fue capaz de adsorber. Esto se determinó mediante la siguiente ecuación:
Donde:
mg (metal)/g (TZ): son los miligramos de metal adsorbidos por gramos de TZ utilizada en la remoción.
Ci: concentración inicial de la solución cabeza (mg/L).
C1: es la concentración final del licor de salida de la 1ra muestra tomada (mg/l).
V: volumen de solución pasado por la columna (L).
Cf: concentración final del licor de salida de la última muestra tomada (mg/l).
MTZ: masa de tobas zeolitizadas empleada en la remoción (g).
%Zeo: porciento de zeolitización del yacimiento San Andrés.
El porcentaje de remoción se calculó según la ecuación:
Resultados y discusión
En la figura 2 se muestran los resultados obtenidos de la concentración de equilibrio de los diferentes metales analizados presentes en el licor residual WL durante el proceso de adsorción con las TZ puestas en contacto durante 3 h a una temperatura de 50-60oC.
El gráfico muestra un incremento en la composición del Ni2+ en la solución eluída como señal de que la TZ cedió iones de este metal, a pesar, de que en los análisis químicos hechos en esta investigación por EAA no fueron detectadas concentraciones de Ni en la muestra inicial. Sin embargo Chaves-Martín12) reporta mediante las pruebas a elementos minoritarios por ICP-AES que existe un contenido de 6,79 mg/L de níquel en las TZ del yacimiento San Andrés, y que el metal se incrementa ligeramente en la solución como resultado de la liberación de Ni2+ por parte de la TZ. Este catión es sustituido como catión compensante de la carga negativa de la estructura zeolítica por protones hidratados, dado que el pH de las disoluciones es entre 1 y 2, por lo que este caso este comportamiento pudiera estar explicado por el mismo fenómeno.
Para el Co2+ se observa que en la primera hora disminuye su contenido en 1 mg/L y luego aumentó a su valor inicial manteniéndose constante durante el resto del ensayo, como evidencia de la saturación de la TZ. En ambos casos el intercambio resultó bajo, dado que los contenidos de Ni2+ y Co2+ en el WL son muy bajos.
Es apreciable que en el caso del Mn2+ y el Mg2+ ocurre una disminución en su contenido en el licor eluído, lo que evidencia que son adsorbidos por la TZ. Se aprecia un comportamiento similar en ambos metales, donde la mayor remoción ocurre durante los primeros 30 min del experimento y luego sus contenidos en el licor efluente se incrementan gradualmente hasta alcanzar los valores iniciales.
Por otra parte la remoción del Fe3+ es menor en comparación con los metales ya analizados. Se observa que incrementa su concentración a valores superiores que en el licor cabeza a partir de los 150 min de contacto del licor con las TZ, este comportamiento indica que a partir de este momento la TZ comienza a ceder iones de este metal que forman parte también de su composición. Sin embargo los mejores resultados en la remoción se obtuvieron para el Fe2+, donde al finalizar el experimento aún no se observa la saturación de la TZ.
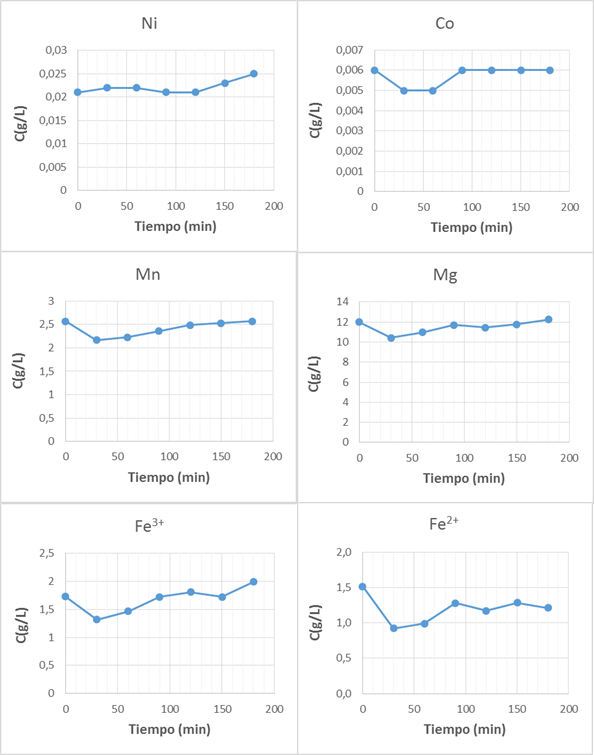
Fig. 2 Concentración de los iones metálicos presentes en el WL a diferentes tiempos de contacto con las TZ.
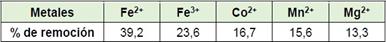
Para todos los casos los mayores por cientos de remoción se obtuvieron durante los primeros 30 min lo que se muestra en la tabla 3.
Según los resultados obtenidos en cuanto a los por cientos de remoción por metal analizado presente en el WL al finalizar el experimento, se encontró que la TZ mostró selectividad en el siguiente orden: Fe2+ ˃ Mn2+ ˃ Co2+ ˃ Mg2+ ˃ Fe3+, como se muestran en la tabla 4. La disminución de la capacidad de adsorción del Fe3+ en el tiempo es atribuible a la desorción que puede acontecer por fenómenos de mayor selectividad por unos u otros iones en solución presentes en el líquido. (5
Los resultados de la capacidad de adsorción por ion metálico que presentó la TZ al finalizar las 3 horas de contacto se muestran en la tabla 5.
En el caso del Mg2+ aunque no presentó el mayor el por ciento de remoción, muestra la mayor capacidad de adsorción, como consecuencia de una mayor concentración de estos iones metálicos en el licor WL.
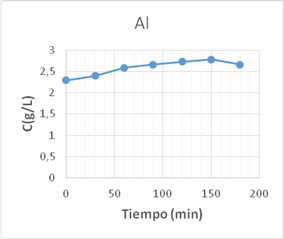
En la figura 3 se observa un aumento del contenido de Al3+ con respecto a la concentración inicial, lo que demuestra su paso desde la toba hacia el licor. Este comportamiento está dado por el ambiente ácido en el que se desarrolló el experimento que hizo que la TZ se dealuminizará, lo que provoca una disminución en su capacidad de intercambiar iones, ya que se reducen las cargas negativas que deben ser compensadas por los iones intercambiables de la TZ, lo que explica que no se hayan obtenidos mejores resultados en la prueba de intercambio iónico. 17
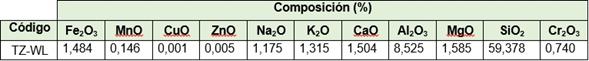
Al realizar el análisis químico a la muestra de tobas zeolitizadas tratadas con WL (TZ-WL) se observa que se produce una disminución en el contenido del Al2O3 de 1,4 %, con respecto a la TZ natural, como se aprecia en la tabla 6, lo que corrobora su paso desde la estructura zeolítica al licor.
Así mismo se observa que para el Na2O y el CaO existió también una disminución, esto comprueba que el proceso de intercambio estuvo dado por los iones Al3+, Na+ y Ca2+ de la toba zeolitizada que intercambiaron con los iones metálicos presentes en el WL. A diferencia para el MnO y el MgO, se incrementaron sus por cientos en la composición de la toba zeolitizada, debido a que el Mn2+ y el Mg2+ quedaron retenidos en sus poros.
Análisis del comportamiento del pH
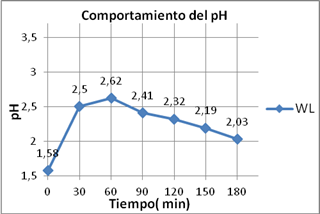
Al analizar la figura 4 se observa que existe un incremento del pH en el WL durante su contacto con la TZ, que es más intenso en la primera hora, llegando a incrementarse su valor de 1,58 hasta 2,62. Esto puede ser explicado porque disminuye la concentración de los iones hidronios (H+) del licor. A medida que transcurre el tiempo, estos iones se van incorporando al material zeolítico. Las causas que provocan este cambio están dadas por el intercambio con iones presentes en la TZ, como por ejemplo el Na+ debido a sus propiedades similares, entre las que sobre sale que tienen igual carga. Logrando establecer una correlación directa de la dependencia temporal del consumo de H+ por el material zeolítico, con la dependencia temporal de la liberación de Na+.
Eliminar parte de la acidez con el empleo de TZ en el tratamiento del residual líquido WL, logrando solo con ello elevar el pH hasta valores superiores a 2 como se evidencia en este caso, constituye un variante favorable en relación con los indicadores ambientales, debido a que, a este pH se logra alcanzar niveles mínimos de ácido sulfhídrico, y disminuir además la concentración de ácido libre.
Se observó al final del experimento que el tratamiento del residual WL con las TZ tuvo efecto en el color y en el olor, donde se obtuvo como resultado un licor clarificado con respecto al alimentado, y libre del olor desagradable que produce el H2S. Esto demuestra que las TZ actúan como filtro con carácter desodorizante, lo que comprueba su efectividad en la disminución de la contaminación ambiental, al ser estos, dos de los parámetros que más impactan al medio ambiente. Además se observó un cambio en la coloración de las tobas correspondiente al tope del filtro que se tornaron más oscuras, lo que evidencia que es ahí donde quedan retenidos la mayor parte de los contaminantes.
En cuanto a la composición mineralógica las muestras de TZ-WL muestran difractogramas idénticos a las muestras de TZ naturales, en los cuales se obtienen los mismos reflejos difractométricos con intensidades iguales, por lo que el tratamiento con el WL no modificó su composición fásica.
Conclusiones
Se evidenció la capacidad de las tobas zeolitizadas de adsorber metales pesados por intercambio iónico en contacto con el WL en batch, donde la selectividad estuvo en el orden: Fe2 + ˃Mn2 + ˃Co2 + ˃ Mg2 + ˃Fe3 +.
Los análisis demostraron que las tobas zeolitizadas sufren una dealuminación, con una pérdida de Al2O3 de 1,4 %, debido a la acidez del WL.
Se comprobó la propiedad de las tobas zeolitizadas de actuar como filtro en la reducción del color y el olor desagradable del residual tratado, además de su carácter neutralizante que permitió elevar el pH del WL de 1,58 a 2,62.