INTRODUCCIÓN
La concientización sobre los problemas medioambientales ha conducido a la implementación de estrategias ecológicas en la concepción de los procesos industriales (Angural et al., 2020). Las tecnologías que conciben el uso de enzimas garantizan estos preceptos, ya que permiten la utilización eficiente de las materias primas con la generación mínima de residuos y la disminución en el uso de compuestos químicos contaminantes (Danilova y Sharipova, 2020).
La demanda de las enzimas y su aplicación en varias industrias crece continuamente. En el 2021 el mercado mundial de las enzimas representó ganancias de 6,4 mil millones de dólares. Se prevé que este valor aumentará a 8,7 mil millones para el 2026, con una tasa de crecimiento anual compuesta del 3,6% (Benatti y Polizeli, 2023). Las celulasas y las hemicelulasas (mananasas y xilanasas) son las enzimas más empleadas a nivel industrial, específicamente, el sector de la alimentación demanda notablemente su uso, donde representan más del 30% del mercado (Cann et al., 2020).
Las celulasas, mananasas y xilanasas son hidrolasas que degradan los enlaces glicosídicos presentes entre los carbohidratos de conforman sus respectivos polímeros. Pertenecen a la familia glicosil hidrolasas según el sitio de las enzimas activas en carbohidratos (Carbohydrate- Active Enzymes Database CAZy: http://www.cazy.org/) (Gonzalez-Gonzalez y Miranda-Lopez, 2022). También suelen ser reconocidas como enzimas fibrolíticas o carbohidrasas (Gusakov et al., 2011; Mousa et al., 2022).
Las enzimas celulolíticas y hemicelulolíticas se obtienen esencialmente a partir de microorganismos y una de las principales fuentes utilizadas por las empresas biotecnológicas son las cepas de Bacillus (Su et al., 2020). Las bacterias de este género son bacilos Gram positivos formadores de endosporas que no sintetizan endotoxinas, razón por la cual muchas especies se consideran como seguras. Estos microorganismos tienen un sistema de secreción enzimática eficiente, lo cual les permiten degradar una variedad de sustratos, posibilitándoles la supervivencia en diversos ambientes. Esto los convierte en excelentes productores de enzimas de valor industrial. Es importante destacar además que estas bacterias crecen rápido y los tiempos de fermentación, por lo tanto, se hacen más cortos en comparación con otros microorganismos productores de hidrolasas (Blibech et al., 2019). Aproximadamente, el 50% del total de enzimas del mercado se producen a partir de Bacillus (Sulistiyani et al., 2021).
Sin embargo, la producción de estos catalizadores, depende de las condiciones ambientales donde se desarrollen estos microorganismos; por lo que es importante mencionar que todos los Bacillus no sintetizan siempre el mismo tipo de enzimas. Para ello es necesario realizar una selección adecuada de los microorganismos en función del sustrato. A partir de lo planteado anteriormente, esta investigación se propone seleccionar cepas de Bacillus productoras de celulasas, β-mananasas y xilanasas para su utilización en la alimentación animal.
MATERIALES Y MÉTODOS
Cultivo bacteriano y preinóculo
El estudio se realizó con diez cepas pertenecientes al género Bacillus, las cuales se aislaron en el Laboratorio de Microbiología de la Facultad de Ciencias Agropecuarias de la Universidad de Matanzas. A partir de las muestras conservadas a -30 °C en caldo nutriente y glicerol al 20%, se inocularon los matraces que contenían 50 mL de caldo nutriente y se incubaron a 37 °C en zaranda orbital a 110 rpm durante 16 h hasta que la densidad óptica a 600 nm fue de 0,8 - 1.
Medio de cultivo
El ensayo se realizó sobre placas Petri que contenían medio mínimo (MM) compuesto por NaCl (0,1%), KH2PO4 (0,3%), K2HPO4 (0,6%), MgSO4 (0,12%), peptona (0,5%), extracto de levadura (0,3%), agar (1,5%). Para evaluar cada enzima las placas se suplementaron con carboximetilcelulosa (1%), goma de algarrobo (0,5 %) o xilano de haya (1%). El pH del medio se ajustó a 7,5 con KOH (1 mol·L-1) y se esterilizó a 121°C durante 15 min. Los reactivos químicos se adquirieron de la firma Sigma-Aldrich.
Determinación in vitro de la producción enzimática de xilanasas, mananasas y celulasas
Las cepas se inocularon con un asa de siembra estéril sobre la superficie del medio de cultivo y las placas se incubaron durante 24 h a 37 °C. El revelado de la síntesis de las celulasas y hemicelulasas por las bacterias se realizó al añadir la disolución de rojo congo al 0,5% a cada placa y se dejó a temperatura ambiente durante cinco minutos; posteriormente se realizaron tres lavados con NaCl 1 mol·L-1. El índice de potencia (IP) se calculó mediante la relación existente entre el diámetro de la zona de hidrólisis y el diámetro de la colonia medidos en milímetros. Según el IP los microorganismos evaluados se clasificaron en excelente (IP > 5,0), bueno (2,0 > IP < 5,0) y pobre (IP < 2,0) (Latorre et al., 2016). Se empleó un pie de rey Vernier (marca Suertek cap. Sensibilidad de ± 0,02 mm) para realizar las mediciones de los diámetros y se utilizó un diseño completamente aleatorizado con cuatro réplicas para cada enzima.
Análisis estadístico
El análisis de los datos se realizó con el software estadístico Statgraphics Plus 5.0. Se llevó a cabo el análisis de varianza simple para determinar la presencia de diferencias estadísticamente significativas entre las cepas con respecto a los sustratos evaluados. Para el contraste de las medias se realizó la prueba de Student-Newman-Keuls. La significación se estableció para p < 0,05. Los datos se muestran como la media ± la desviación estándar.
RESULTADOS
Se estudiaron diez cepas de Bacillus para evaluar la capacidad de producir enzimas hidrolíticas de interés biotecnológico e industrial. Los resultados mostraron que el 100% de las bacterias evaluadas mostraron la capacidad de producir endocelulasas, β-mananasas y xilanasas. A partir del análisis de los resultados, las cepas E-44 y C-31 se clasifican como buenas productoras de las tres enzimas estudiadas. De igual forma, la cepa 45 BP se considera buena productora de β-mananasas. El resto de las bacterias estudiadas en la presente investigación mostró resultados inferiores en la actividad enzimática relativa de las enzimas evaluadas, los cuales se clasifican como pobres. La Tabla 1 muestra el perfil de la actividad enzimática de las cepas investigadas.
Tabla 1 Valores de los índices de potencia de las cepas de Bacillus sp. evaluadas para la producción de xilanansas, β-mananasas y celulasas
| Celulasas | β -Mananasas | Xilanasas | |
| 5 BP 1 | 1,31 ± 0,05de | 1,48 ± 0,08de | 1,44 ± 0,14de |
| 23 BP4 | 1,74 ± 0,05c | 1,51 ± 0,20de | 1,63 ± 0,17cd |
| 45 BP5 | 1,49 ± 0,06cd | 2,03 ± 0,09c* | 1,90 ± 0,07c |
| 48 BP6 | 1,48 ± 0,09cd | 1,66 ± 0,04de | 1,68 ± 0,09cd |
| 54 BP7 | 1,16 ± 0,11e | 1,63 ± 0,10de | 1,41 ± 0,11de |
| 55 BP8 | 1,69 ± 0,21c | 1,57 ± 0,16de | 1,68 ± 0,12cd |
| E-44 9 | 3,01 ± 0,18ª* | 3,82 ± 0,31ª* | 4,22 ± 0,23ª* |
| C-31 10 | 2,41 ± 0,22b* | 2,55 ± 0,25b* | 2,55 ± 0,25b* |
| 12 BCm11 | 1,13 ± 0,07e | 1,34 ± 0,11e | 1,60 ± 0,15cd |
| 6 BCm12 | 1,12 ± 0,14e | 1,76 ± 0,14d | 1,22 ± 0,14e |
Los datos representan la media ± desviación estándar de cuatro réplicas. Letras diferentes en una columna indican diferencias estadísticamente significativas según la prueba de Student-Newmn-Keuls para p< 0,05. Las cepas marcadas con (*) se consideran buenas productoras de la enzima.
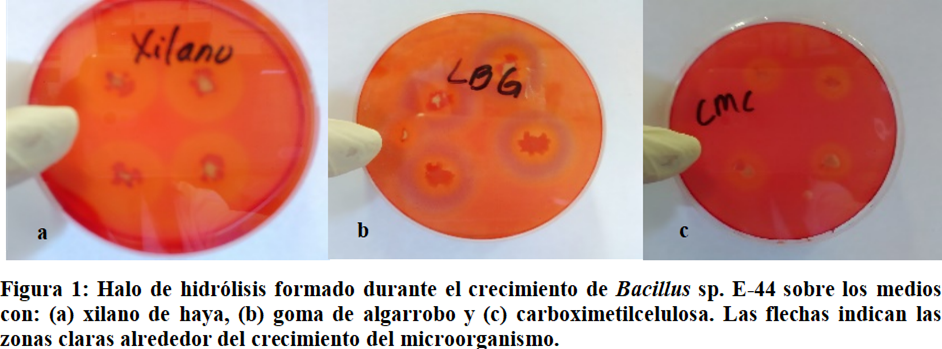
El índice de potencia calculado de las enzimas producidas por Bacillus sp. E-44 es superior al de las otras cepas estudiadas. El análisis de varianzas que comparó este factor, encontró diferencias estadísticamente significativas para cada uno de ellos en función de las cepas estudiadas; de manera que permite afirmar que esta cepa es la que mostró la mayor actividad de las tres enzimas frente a los sustratos evaluados y por lo tanto se selecciona como la mejor. En el revelado del ensayo para la determinación de la producción de enzimas por Bacillus sp. E-44 (
Figura 1 ) se pueden observar zonas claras alrededor del crecimiento del microorganismo en las placas que contienen xilano, goma de algarrobo y CMC como sustrato, lo cual indica que la bacteria expresó enzimas que despolimerizan el sustrato presente en el medio de cultivo.
DISCUSIÓN
La bioprospección de microorganismos con capacidad para producir enzimas de interés biotecnológico e industrial es un tema de actividad científica constante. Para conseguir que esta búsqueda sea eficaz se requieren metodologías de trabajo que sean rápidas, sensibles, replicables y económicas. La técnica cualitativa más empleada es la propuesta por Teather y Wood (1982), la cual se basa en el crecimiento de los microorganismos sobre un medio mínimo de sales que contiene el sustrato de la enzima que se desea evaluar y la presencia de un colorante reportero de la despolimerización (Moreno y Vélez, 2011).
En este estudio se utilizaron el xilano de haya, la goma de algarrobo y la carboximetilcelulosa como única fuente de carbono en el medio selectivo empleado, el cual se combinó con el rojo congo. Este colorante interactúa con los polímeros correspondientes en el medio, y al excretarse las enzimas se producen disacáridos, monosacáridos y ácidos orgánicos como producto de la degradación. La formación de un halo transparente alrededor de la colonia es resultado de la disminución del pH (Li et al., 2020).
Como previamente se mencionó, la capacidad que tienen varias especies de microorganismos de degradar sustratos complejos se debe a la producción de enzimas extracelulares y depende en gran medida de la fuente de carbono que se emplea (Rodrigues et al., 2020). Las celulasas, xilanasas y β-mananasas son enzimas inducibles en condiciones naturales por los productos de su propia acción. Algunos autores plantean que las mismas se expresan constitutivamente a bajos niveles, de manera que permiten la producción de fragmentos de bajo peso molecular que actúan como sus propios inductores. La regulación de estas enzimas está estrictamente controlada por los mecanismos de activación y de represión catabólica; solamente se secretarán en presencia de su sustrato específico y la disponibilidad de azúcares fácilmente asimilables reprimirá su producción (Behera et al., 2017; Chauhan y Gupta, 2016).
El índice de potencia (IP) es un indicador que se utiliza por varios autores para evaluar la expresión de enzimas microbianas como celulasas (Li et al., 2020), xilanasas (Latorre et al., 2015) y mananasas (Riaz et al., 2019). La actividad enzimática relativa es un indicador equivalente al índice de potencia según Latorre et al. (2015). Estos autores utilizaron la misma escala para la selección de cepas de Bacillus spp. que sintetizan celulasas y xilanasas. Los resultados obtenidos permitieron su clasificación como excelentes y buenas productoras de estas enzimas.
También, este indicador se utilizó para seleccionar la cepa de Bacillus velezensis que excretó la mayor cantidad de celulasas en un estudio realizado donde se evaluaron diez cepas (Li et al., 2020). Los resultados estuvieron en correspondencia con los obtenidos en esta investigación; incluso, estos fueron superiores. El índice de potencia para la producción de celulasas de Bacillus sp. E-44 fue superior al obtenido por Ma et al. (2020). De igual manera la cepa seleccionada en la presente investigación mostró índices de potencia superiores a Bacillus subtilis US 191 para la producción de mananasas, la cual mostró un índice de potencia de 1,60. (Blibech et al., 2019). Sin embargo, los valores registrados en este estudios fueron inferiores a los obtenidos por Zhang et al. (2018) para la producción de xilanasas en la cepa de Bacillus velezensis ZY-1-1. No obstante, estos datos concuerdan con los autores anteriores en el sentido de que la actividad de las xilanasas fue superior a la de las celulasas; lo que a decir de los mismos se debe a los mecanismos de regulación de los genes que codifican las enzimas lignocelulósicas, los cuales deben ser más investigados.
Las especies del género Bacillus se caracterizan por sintetizar enzimas extracelulares diversas, sin embargo, no siempre todas tienen la capacidad de expresarlas con igual magnitud. Esto sugiere que esta es una característica específica de la cepa en la que no influye la especie y depende en gran medida del origen del microorganismo (Latorre et al., 2016). Por otra parte, se informa en la literatura que la fase de crecimiento, la temperatura y el pH afectan directamente la producción final de enzimas extracelulares. Por tal motivo se optimizan diferentes condiciones de cultivo para la secreción de estas biomoléculas, lo que confirma que la expresión de estos catalizadores está estrictamente asociada con la adaptación al crecimiento (Liu et al., 2023).
La bacteria que mostró los mejores resultados en la síntesis de celulasas y hemicelulasas está identificada como Bacillus subtilis subespecie subtilis y se aisló a partir de jugo de tomate en descomposición (Milián et al., 2014). Esta cepa resultó tener características potenciales para utilizarse como aditivo con efecto probiótico en animales de interés zootécnico (Milián et al., 2017). Lo resultados aquí obtenidos aumentan las posibilidades de utilizar a Bacillus subtilis E-44; esta vez en la producción de enzimas que mejoren la calidad de los alimentos ricos en fibra, lo cual incrementa el efecto probiótico de la misma (Luise et al., 2022). Las celulasas, mananasas y xilanasas son hidrolasas que comúnmente se emplean en la producción animal (Sathitkowitchai et al., 2022).
Además de los posibles beneficios para la nutrición de animales de interés zootécnico de las enzimas producidas a partir de esta cepa, su uso podría extenderse a la obtención de las mismas para aplicarse en otros renglones de la alimentación que demanden su empleo. Esto incrementaría las posibilidades de su uso industrial, por ejemplo: para mejorar la calidad de los jugos de frutas y vegetales, aumentar los rendimientos en el proceso de producción de café instantáneo, suavizar la masa del pan e incrementar su volumen y reducir el deterioro de los alimentos (Behera et al., 2017; Chauhan y Gupta, 2016; Kaur et al., 2021; Marimuthu et al., 2019).
Por otra parte, la hidrólisis completa de los carbohidratos complejos presentes en la biomasa lignocelulósica, requiere de mezclas con múltiples actividades enzimáticas. Con este propósito, el uso de cocteles enzimáticos es más apropiado que las enzimas purificadas, ya que disminuye los costos y los procesos son más eficientes. Desde el punto de vista de la alimentación animal, los cocteles enzimáticos tienen efectos positivos en la mejora del valor nutricional de los alimentos al afectar los porcentajes de fibra detergente neutra (FDN) y fibra detergente ácida (FDA) e incrementar los de nutrientes digestibles totales (Weschenfelder et al., 2023). Una de las estrategias más acertadas para la producción de cocteles enzimáticos es el empleo de microorganismos que posean la capacidad de secretar dos o más enzimas celulolíticas y hemicelulolíticas (Angural et al., 2020). En este sentido, sería conveniente evaluar las potencialidades de B. subtilis E-44 en la producción de cocteles enzimáticos frente a sustratos lignocelulósicos complejos. Por otra parte, deben realizarse otros estudios relacionados con la cuantificación de las actividades enzimáticas y la determinación de la estabilidad de las enzimas a diferentes pH y temperaturas, ya que los resultados que aquí se muestran constituyen un estudio preliminar y el primer paso para seleccionar una cepa con potencialidades para producir enzimas de interés biotecnológico e industrial.
CONCLUSIONES
La evaluación de la capacidad para producir celulasas y hemicelulasas permitió seleccionar a dos cepas como buenas productoras. Sin embargo, Bacillus subtilis E-44 mostró la mayor actividad en la secreción de celulasas, β-mananasas y xilanasas. Esto incrementa las potencialidades de su uso en la alimentación animal y las perspectivas de su empleo en el sector de la alimentación.