INTRODUCCIÓN
El creciente aumento de la población mundial ha conllevado a un incremento sostenido de la demanda de alimentos. Estadísticas recientes indican que alrededor de un tercio del alimento producido para el consumo humano es desperdiciado a nivel mundial lo que representa más de 1,3 billones de toneladas de desechos por año.
La acuicultura es una de las actividades económicas de mayor crecimiento, que aporta cerca del 50 % de la oferta mundial de pescado, sin embargo, el procesamiento de las producciones pesqueras tales como peces, crustáceos y camarones genera enormes cantidades de residuos sólidos no comestibles como cabezas, colas y caparazones. Se estima que cada año se producen entre 6 y 8 toneladas de desecho de cáscaras de langosta, camarón y cangrejo de forma global, cifra que alcanzó en el 2022 los 122,6 millones de toneladas, representando un valor total de 281 500 millones de dólares (Cheng et al., 2023). De este valor los moluscos representaron el 13 %, mientras que los crustáceos representaron el 9 % (Kiehbadroudinezhad et al., 2023) lo que constituye un serio problema medioambiental.
El aprovechamiento sostenible de estos residuos constituye una alternativa promisoria para impulsar el rendimiento económico de las industrias pesqueras convencionales y reducir su impacto ambiental. En los últimos años han surgido diversas propuestas sostenibles de gestión y valorización de esta biomasa marina, siendo la biorrefinería una de las más prometedoras.
La biorrefinería como modelo productivo y de negocio no es un concepto nuevo, este hace parte de la literatura científica desde 2001 y se han brindado distintas definiciones del término ampliando su panorama y alcance. Sin embargo no es hasta 2017 que surge el término de biorrefinería marina (Vicente et al., 2022) con grandes expectativas para obtener productos de alto valor agregado a partir del empleo de desechos de la industria acuícola.
Los residuos biológicos de pescado contienen varias moléculas potencialmente valiosas, como aceites, mezclas de aminoácidos y péptidos bioactivos, colágeno, quitina, gelatina, aceites y pigmentos. En consecuencia, en los últimos años se han reportado numerosos estudios y tecnologías para la obtención de numerosos productos de alto valor agregado como biocombustibles a partir del aceite de pescado (García-Moreno et al., 2014), omega 3 y ácido hialurónico (García‐Santiago et al., 2021).
En el estudio realizado por Antelo et al. (2015), desarrollaron un modelo matemático para la optimización de redes de procesamiento de biomasa a partir de peces de descarte, en base a objetivos ambientales y económicos. La biomasa se dividió y analizó en tres grupos: peces, crustáceos y especies cartilaginosas. Los principales resultados mostraron que las rutas de procesado más óptimas corresponden a la obtención de productos de alto valor añadido (biopéptidos, enzimas, y sulfato de condroitina), no solo por sus altos precios de venta, sino también por el menor impacto ambiental asociado a sus procesos productivos en comparación con el resto de productos que se pueden obtener en la red de valorización (Antelo et al., 2015).
Existen varias tecnologías de producción de biogás en plantas piloto en el mundo a partir de desechos de pescado. Realizan una propuesta de diagrama de flujo del proceso de producción de biogás a partir de la fermentación anaerobia de desechos de pescado. Este es utilizado para la producción de energía térmica o eléctrica mediante su uso en calderas o motores de cogeneración, y el residuo restante es utilizado normalmente como enmienda orgánica en aplicaciones agronómicas, pudiendo ser espesado y compostado posteriormente para su uso como abono sólido.
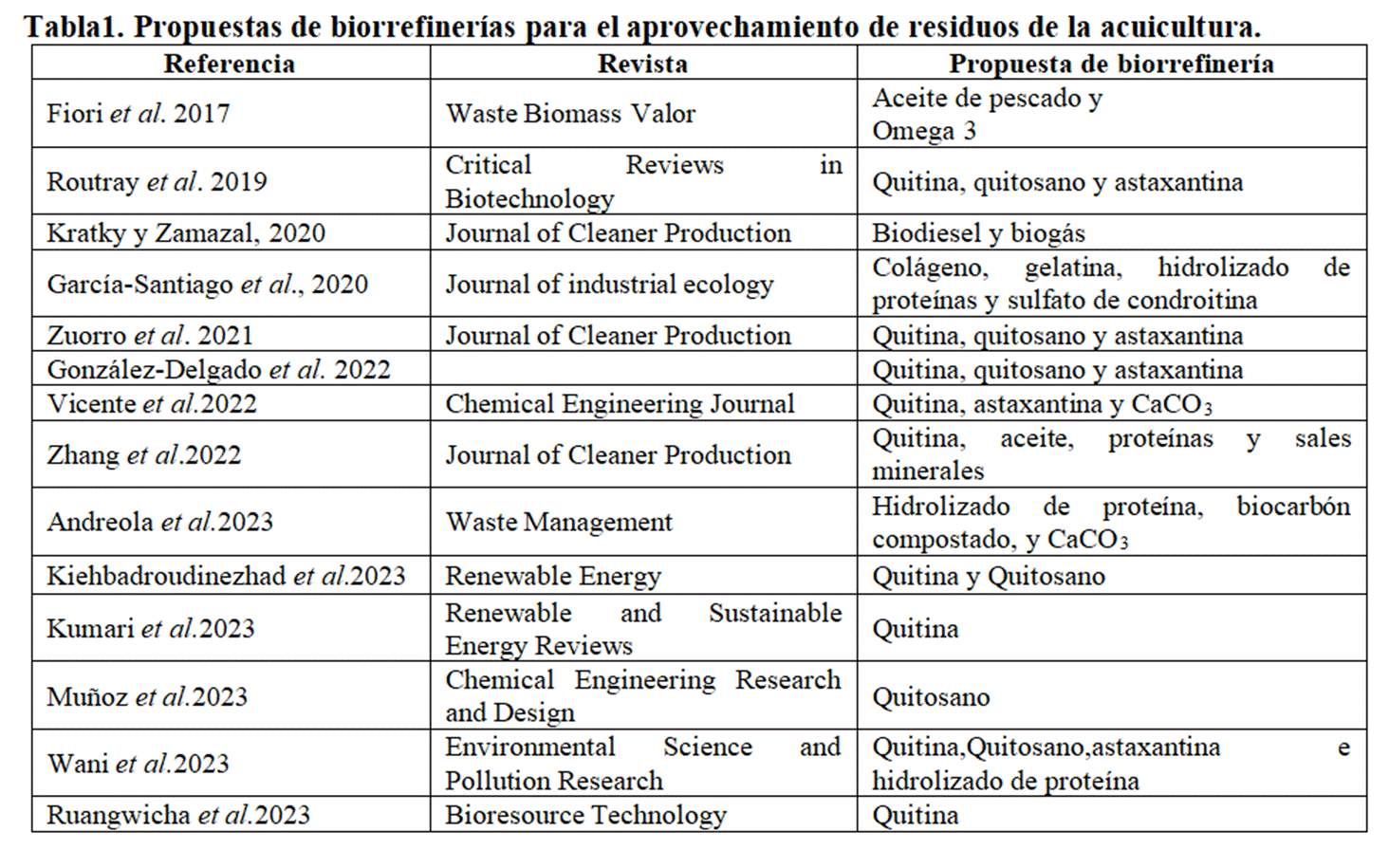
Las conchas de los crustáceos están compuestas principalmente por un 20-30 % de proteínas,30-40 % de carbonato de calcio (CaCO3), 20-30 % de quitina y una cantidad mínima de astaxantina. La quitina es un polisacárido marino presente en paredes celulares, exoesqueleto de insectos y conchas de crustáceos, que presenta aplicaciones en medicina, farmacia, alimentación y biotecnología. Varios autores proponen la recuperación de estos compuestos a partir de biorrefinerías (Antelo et al., 2015; Kiehbadroudinezhad et al., 2023; Kumari et al., 2023; Routray et al., 2019; Ruangwicha et al., 2024).
Zuorro et al. (2021) estiman en su trabajo qué tan rentable es desarrollar una biorrefinería de camarón a escala piloto en Colombia, siguiendo las oportunidades de negocio previstas derivadas de los crecimientos del mercado. La biorrefinería recupera componentes valiosos derivados de las cáscaras de los camarones, como la quitina, el quitosano y la astaxantina, al tiempo que produce carne como parte del procesamiento convencional (Zuorro et al., 2021).De igual forma Vicente et al. (2022) reportan una propuesta de biorrefinería sostenible para la recuperación de quitina, proteínas, carbonato de calcio y astaxantina a partir de desechos de camarón. Mientras que Muñoz et al. (2023) realizan una propuesta de biorrefinería a partir de caparazones de langosta para la obtención de quitosano.
En el contexto cubano al aprovechar los residuos de la industria pesquera como ingredientes para otros productos, se conservan recursos naturales y se reduce la cantidad de desechos generados, promoviendo la sostenibilidad ambiental y la economía circular. Además, esto permite generar oportunidades económicas y emprender el desarrollo de la industria pesquera y alimentaria en el país, contribuyendo a la diversificación económica y a la reducción de la dependencia de las importaciones. No obstante, el desarrollo de una tecnología eficiente y escalable que permita el recobrado de cada uno de los componentes presentes en estos residuos es aún un reto.
El objetivo de este trabajo es realizar una revisión bibliográfica de los productos derivados que pueden ser obtenidos de los desperdicios de la industria pesquera, con un enfoque de biorrefinería.
DESARROLLO
La generación incontrolada de residuos se está convirtiendo en un importante problema medioambiental, lo que implica la necesidad de crear nuevos sistemas de producción que aprovechen estos desechos como componentes esenciales para la creación de otros productos. Desde el punto de vista multicriterio podrían estar basados en la protección del medio ambiente, la rentabilidad económica y la aceptación social (Arias et al., 2023). En este sentido se contempla el papel de los sistemas de biorrefinerías como actor clave en el desarrollo sostenible, ya que se considera la tecnología más eficiente que puede usarse para crear oportunidades económicas y contribuir al avance de una bioeconomía, sintetizando diversos productos industrialmente competitivos (Sekoai et al., 2023).
El concepto biorrefinería no es reciente; con frecuencia, y en diversos ámbitos, como la agricultura, la industria alimenticia y la obtención de las materias primas, muchos artículos son convertidos en una variada serie de productos, cada uno con una aplicación final diferente. Este es análogo al concepto convencional de la refinería de petróleo, es decir, una instalación donde, mediante diversos procesos de transformación de la materia prima (biomasa), se genera bioenergía (calor, electricidad, biocombustibles) y un amplio espectro de bioproductos (materiales, productos químicos, alimentos y piensos). Pero para conseguir esta extensa gama de productos se requiere la integración de diferentes procesos y tecnologías en una misma instalación.
La biorrefinación se define como aplicaciones continuas de una estrategia ambiental preventiva integrada y aplicada a productos, procesos y servicios para reducir los riesgos para los seres humanos y el medio ambiente (Venugopal, 2022). En la actualidad existe una demanda por desarrollar biorrefinerías sostenibles que permitan la generación de una amplia gama de productos, reduciendo al mismo tiempo el consumo de recursos no renovables.
Tomando en cuenta el tipo de biomasa como materia prima y el producto final deseado, las biorrefinerías utilizan diferentes procesos y tecnologías para transformar la biomasa en fuentes energéticas comerciales; procesos que incluyen: fermentación, gasificación y transesterificación; en tal sentido, métodos nuevos y más eficientes son constantemente investigados y desarrollados (Gómez Millán, 2015). Las biorrefinerías sincronizan una variedad de procesos de conversión y diferentes instalaciones, de acuerdo con el rango de procesos biológicos, químicos y termoquímicos que se utilizan. La optimización y alta eficiencia de los procesos son la clave para que el sistema sea económicamente viable y sustentable. Se estima que la adopción significativa de procesos productivos circulares a nivel global generaría un ahorro significativo de materiales. Además, la transición hacia modelos circulares prevendría la generación de millones de toneladas métricas de desechos sólidos al año.
Existen un elevado número de opciones de biorrefinación para los subproductos de la acuicultura para la obtención de productos de alto valor agregado. La primera opción es siempre la prevención para minimizar la generación de subproductos. La segunda opción es mantener el subproducto en la cadena alimentaria mediante la comercialización de las fracciones de bajo valor, la producción de ingredientes alimentarios o la obtención de biomoléculas de alto valor que pueden ser de uso en la industria nutraceútica, cosmética o farmacéutica, y la tercera, es la alimentación animal. En algunos casos, otras soluciones de menor valor como la producción de energía, el compostaje o la incineración pueden ser tenidos en cuenta como opciones de valorización. Por último, se encuentra el envío de los subproductos a vertedero, solución que no puede considerarse como valorización.
Especialmente en el ámbito de la acuicultura del camarón se ha evidenciado que existen subproductos que pueden ser aprovechados para obtener derivados de alto valor comercial. (Moreno-Sader et al., 2021).
En función de la demanda del consumo, las industrias de cultivo y procesamiento de camarón generan grandes cantidades de desechos de marisco, que deben valorizarse para dar valor agregado a los productos para prevenir la contaminación ambiental (Mathew et al., 2020). El camarón tiene una baja gravedad específica de la carne y la cáscara, y la cabeza, el caparazón y la cola representan alrededor del 50 % de su masa total. Estos desechos contienen aproximadamente un 40 % en peso de biopolímeros, concretamente quitina y proteínas, cubiertos por carbonato de calcio/magnesio y astaxantina, además de residuos de carne y lípidos (Rahman & Maniruzzaman, 2023). Estudios sugieren que el peso seco del camarón comprende 18 % de quitina, 43 % de proteína, 29 % de ceniza y 10 % de grasa (Mao et al., 2017).
Todos estos componentes de los desechos de camarón han sido ampliamente estudiados, en especial la quitina, el quitosano y la astaxantina (Cabanillas-Bojórquez et al., 2020); en este contexto proponen un sistema de biorrefinería (Tabla 1) basado en cuatro secciones: (1) procesamiento de camarones, (2) recuperación de quitina, (3) producción de quitosano y (4) recuperación de astaxantina.
Productos derivados
El pescado y sus partes tienen una amplia gama de aplicaciones, siendo la lista de posibles productos (aceite, péptidos bioactivos, el colágeno, sulfato de condroitina, enzimas, gelatina, los ácidos grasos omega-3 y el ácido hialurónico) tan diversa como los sectores industriales que se beneficiarían de las alternativas de valorización.
En los últimos años se han dirigido importantes esfuerzos a investigar e implementar tecnologías para mejorar la producción de los llamados hidrolizados de proteínas de pescado mediante la conversión de desechos de pescado en péptidos que contienen entre 2 y 20 aminoácidos. Este tema ha sido examinado en diferentes artículos de revisión destacando la relevancia de estos en la química de los alimentos, particularmente como ingredientes funcionales de suplementos dietéticos, debido a sus potentes actividades biológicas como antihipertensivo, antioxidante, antimicrobiano, inmunomodulador y anticancerígeno (Maschmeyer et al., 2020).
En la literatura se reportan diversos estudios acerca de la producción de biocombustibles a partir de aceite de pescado (García-Moreno et al., 2014). Este aceite consiste en una mezcla de lípidos que contienen diferentes ácidos grasos, entre ellos dos importantes ácidos grasos poliinsaturados, como el eicosapentaenoico y el docosahexaenoico (DHA), y se puede extraer de la muestra entera o del hígado. Las recientes mejoras en los procesos de desodorización y estabilización han extendido la incorporación de aceite de pescado en productos alimenticios y bebidas para el consumo humano (García‐Santiago et al., 2021).
Los descartes y vísceras son buenas fuentes de harina de pescado, este es un polvo rico en proteínas y en ácidos grasos poliinsaturados. Es de color marrón, pero puede variar en función de las especies de peces, el tamaño de las partículas, el contenido en grasa y la humedad. Se utiliza principalmente en la alimentación animal, especialmente en la acuicultura con más del 60 % del consumo, el sector porcino el 25 % y las aves de corral el 8 %. Tanto la harina como el aceite de pescado se pueden obtener de cualquier tipo de desecho o subproducto de pescado, incluyendo el marisco. La composición y calidad de los productos depende de la especie y el grado de frescura de la materia prima, por lo que, si se produce un deterioro del pescado crudo, se obtiene una calidad y precio de venta del producto final inferiores (Kiehbadroudinezhad et al., 2023).
Los péptidos, aparte de su propio valor nutricional, pueden presentar diferentes actividades biológicas, y tienen usos potenciales en el desarrollo de nuevos productos tanto en la industria alimentaria como en la industria farmacéutica, cosmética y nutraceútica. En el campo de la alimentación, los péptidos bioactivos con propiedades inmunoestimulantes, antioxidantes y antimicrobianas pueden tener interés en la prevención de enfermedades gastrointestinales.
La piel o el cartílago de pescado de algunas especies podrían ser excelentes materias primas para productos como gelatina o sulfato de condroitina con aplicaciones en los sectores alimentario, cosmético y farmacéutico (Maschmeyer et al., 2020). Las gelatinas: derivadas de la hidrólisis parcial del colágeno que produce péptidos de pequeño tamaño con un amplio rango de pesos moleculares, y se utilizan comúnmente como agente gelificante en alimentos, fármacos, fotografía o cosméticos. Así mismo, se encuentra en productos como gominolas, en postres, helados, salsas y yogures (García‐Santiago et al., 2021).
Además, los órganos internos de los peces son una rica fuente de enzimas, por ejemplo, pepsina, tripsina, quimotripsina, elastasa o colagenasa. En general, estas enzimas presentan alta actividad a baja concentración y baja temperatura Se han utilizado en biotecnología, aplicaciones clínicas y en procesos de diagnóstico (Venugopal, 2021).
En la búsqueda de productos renovables que satisfagan las nuevas demandas de diversos mercados y que sea al mismo tiempo sostenible desde el punto de vista económico y ambiental, la obtención de quitina, quitosano y astaxantina se destacan como una alternativa prometedora, al ser compuestos valiosos de alto valor agregado.
Cada año se pierde una cantidad significativa de materia orgánica proveniente de los desechos de camarón, alrededor de 5,57 millones de toneladas (Su et al., 2023); estos son reconocidos como una fuente de compuestos biológicos empleados para diversas aplicaciones (Meramo-Hurtado et al., 2020). De manera general, los desechos se componen principalmente de 20 a 30 % de quitina, 30 a 40 % de carbonato de calcio (con un precio de mercado de entre 60 y 66 dólares o 14 000 dólares por tonelada vendida como partículas gruesas o ultrafinas, respectivamente), 20 a 30 % de proteínas (aminoácidos esenciales como valina, isoleucina, treonina, serina, tirosina, histidina y triptófano, alcanzando un valor de mercado de hasta 100 millones de dólares) y una pequeña cantidad de astaxantina (pigmento de tipo carotenoide con un valor de mercado de hasta un billón de dólares) por tanto, existe un alto valor comercial para estos compuestos naturales (Kiehbadroudinezhad et al., 2023; Vicente et al., 2024). A continuación, se abordan las principales características y propiedades de estos compuestos, así como algunas de sus aplicaciones.
Quitina
La quitina (C8H13O5) es el segundo biopolímero más abundante en la Tierra, después de la celulosa (Yihun, 2022). Fue aislada por primera vez de hongos en 1811 por Braconnot, quien descubrió un polisacárido que contenía un porcentaje sustancial de nitrógeno (Muzzarelli et al., 2012). Es una molécula de color blanco, duro, no elástico y nitrogenado (Al-Rooqi et al., 2022), que debido a su alto grado de acetilación es hidrófoba y, por lo tanto, insoluble en agua y en la mayoría de los disolventes orgánicos (Sieber et al., 2018). Se encuentra principalmente en caparazones de crustáceos, insectos, especies de hongos, moluscos, escamas de peces, algas coralinas, polizoos, esponjas de agua dulce y coral negro (Mohan et al., 2021).
La quitina con un valor de mercado de 42 290 millones de dólares en 2020, que se prevé alcance los 69 300 millones de dólares en 2028, mientras crece a una tasa compuesta anual del 5,07 % de 2021 a 2028. Este biopolímero tiene aplicaciones potenciales en medicina, alimentos y bebidas, cosmética, agricultura y atención sanitaria, debido a su baja toxicidad, alta biocompatibilidad, biodegradabilidad, bioactividad, propiedades antibacterianas y cicatrizantes. Es el componente estructural fundamental de los caparazones de los crustáceos, con propiedades biológicas como biodegradabilidad, baja inmunogenicidad, no toxicidad y acción antimicrobiana (Ngasotter et al., 2023). La quitina es además el precursor del quitosano mediante desacetilación.
Al ser el uno de los polímeros naturales con mayor contenido de nitrógeno y provenir de fuentes renovables de biomasa, la quitina, ha despertado un gran interés como una fuente natural prometedora para la producción de materiales funcionales. Esto se debe a sus propiedades únicas como no toxicidad, características biomédicas como biodegradabilidad, biocompatibilidad, bioactividad y renovabilidad, además de propiedades antifúngicas, antivirales y antimicrobianas (Al Shaqsi et al., 2020; Rodrigues-De Souza & Giudici, 2021; Ngasotter et al., 2023); su amplia disponibilidad y su atractivo desde el punto de vista ambiental atraen un gran interés para una amplia gama de aplicaciones, tales como:
Aplicación como material de embalaje biológico
La quitina, por sus prometedores compuestos bioactivos y propiedades funcionales es uno de los compuestos que desempeña un papel importante en las aplicaciones de envasado de alimentos (Bose et al., 2021), los recubrimientos a base de quitina ayudan a preservar el color, disminuir la pérdida de peso, mejorar la actividad antimicrobiana y prolongar la vida útil de las frutas y alimentos en general (Sun et al., 2021).
Aplicaciones biomédicas
Se ha estudiado una actividad biomédica notable, como la mejora del sistema inmunológico, la actividad antimicrobiana, hipolipidémica, hemostática y cicatrizante (Oyekunle & Omoleye, 2019), también es un material muy atractivo para el tratamiento de heridas y quemaduras (Sieber et al., 2018).
Aplicaciones agrícolas
La mejora del suelo con quitina, alivia los síntomas de las enfermedades por nemátodos al producir amoníaco, fomentar el crecimiento de bacterias antagonistas y mejorar la tolerancia de los cultivos durante la remediación del suelo (Fan et al., 2023). Favorece el crecimiento de plantas (Sieber et al., 2018), por ejemplo algunos análisis indicaron que el tratamiento con quitina podría inducir eficazmente una fuerte resistencia contra el moho gris causada por B. cinerea en el fruto del tomate (Sun et al., 2018).
La obtención de quitina se puede realizar mediante métodos químicos, biológicos y enzimáticos. Sin importar el tipo de método elegido, los procesos a realizar consisten en extraer los componentes presentes en la materia que no sean quitina, como son la desmineralización y la desproteinización, seguida en ocasiones de decoloración, cuyo orden dependerá del origen de la materia prima, o de la intención de recuperación de subproductos. Por otra parte, los métodos químicos son altamente contaminantes, los métodos biológicos mantienen estrictos controles en variables de proceso, en tanto que los métodos enzimáticos no tienen o son mínimos estos problemas permitiendo así aprovechar estos subproductos, aunque en principio pueden ser más costosos por el alto valor de las enzimas en el mercado (Concepción, 2019).
Según los métodos convencionales de extracción de quitina son procesos químicos y biológicos, estos implican un proceso de dos pasos básicos: (1) la proteína se elimina mediante desproteinización y (2) los minerales se eliminan mediante desmineralización, aunque un paso más nuevo agregado en la industria es la decoloración de la quitina para eliminar los pigmentos (Al Shaqsi et al., 2020). En este sentido, el método químico es el método más apropiado utilizado comercialmente debido a su pureza, rendimiento y rentabilidad.
Para Sieber et al., 2018 la desproteinización se realiza mediante tratamientos alcalinos utilizando altas cantidades de NaOH y temperaturas elevadas, mientras que la desmineralización se realiza mediante tratamientos ácido utilizando HCl, HNO3, H2SO4, CH3COOH y HCOOH, siendo HCl el agente preferido; a su vez considera que la ruta de extracción química con enfoques biológicos, al utilizar enzimas y microorganismos en lugar de productos químicos agresivos, tiene la ventaja de ser más ecológico, seguro, tecnológicamente flexible y económicamente viable.
Por otra parte, también plantean que la quitina se puede extraer de los desechos del caparazón de estos crustáceos mediante un método de extracción química que utiliza un tratamiento ácido para disolver el CaCO3 (desmineralización) seguido de una solución alcalina para disolver las proteínas (desproteinización) o un método de extracción biológica que utiliza enzimas proteolíticas para descomponer las proteínas o un proceso de fermentación microbiana.
Proponen que antes de poder acondicionar los desechos recolectados, se deben lavar con agua para eliminar el exceso de masa, luego deben secarse y congelarse para mantener una composición química y contenido de humedad constante, posteriormente se continua con la molienda y escurrido, eliminación de proteínas, desmineralización y decoloración.
En la actualidad varios países de la región de Latinoamérica, poseen empresas productoras de quitina, así como también producen derivados de este material, por lo que tendría la capacidad de generar hasta un 12 % del material quitinoso que se produce a nivel mundial con alrededor de unas 170 000 toneladas/año de desechos sólidos, lo que serviría para producir alrededor de unas 25 000 toneladas/año de quitina (Quiroz et al., 2021).
Cuba, a pesar de ser reconocida por la Sociedad Iberoamericana de Quitina como pionero en el estudio de estos valiosos polisacáridos, no cuenta con una planta de obtención de estos biopolímeros, solo con estudios, experimentos aislados y trabajos de laboratorios para la obtención de quitina y quitosano a partir de la langosta común. Desde finales de la década de los años 90 del pasado siglo y hasta el 2003 un laboratorio farmacéutico cubano llamado Mario Muñoz procesó residuos de langosta para la obtención de quitina con un rendimiento de 16%, pero desde esa fecha no existen en el país evidencias de producción de quitina (Concepción, 2019).
Quitosano
El quitosano es un aminopolisacárido natural derivado de la quitina. Este lo producen naturalmente algunos hongos Mucoraceae, aunque se prepara comercialmente mediante la quitina des-N-acetilada del polisacárido natural (Ta et al., 2021). Presenta propiedades como una excelente biodegradabilidad, biocompatibilidad y bioactividad (Rodrigues-De Souza & Giudici, 2021), además de no ser tóxico tiene buenas propiedades quelantes, y de adsorción en comparación con diferentes materiales plásticos sintéticos (Gómez-Ríos et al., 2017). Además es un biomaterial intrigante con actividad antibacteriana y baja inmunogenicidad, así como higroscopicidad y propiedades humectantesd (Wang & Zhuang, 2022).
Estudios recientes prevén que el mercado mundial de quitosano alcance los 2893 millones de dólares estadounidenses para 2027 (Bose et al., 2021).El mercado actual del quitosano está dominado por la industria farmacéutica, que representa el 23 % de su uso, seguida de cerca por la industria alimentaria con un 22 %, la industria cosmética con un 18 % y la de tratamiento de agua con un 17 % (Muñoz et al., 2023). Algunas de las principales aplicaciones son:
Actividad antimicrobiana
El quitosano y sus derivados presentan actividad antimicrobiana contra bacterias y hongos. Existen diferentes hipótesis, las cuales están relacionadas con su naturaleza catiónica, lo que le permite reaccionar con moléculas y superficies cargadas negativamente como las paredes microbianas. También actúa como agente quelante soluble y se comporta como un activador de los mecanismos de defensa de varias plantas (Bauer et al., 2022).
Aplicaciones agrícolas
Debido a sus propiedades bactericida, fungicida, bacteriostáticas, e inhibición enzimática el quitosano se está utilizando en el campo agrícola. Se emplea en la fabricación de películas y recubrimientos alimentarios para prolongar la vida útil pos cosecha y lograr así incrementar el tiempo de almacenamiento. en áreas requeridas como la eliminación, la entrega controlada y la detección de pesticidas (Kandasamy et al., 2023). Esto costituye una alternativa más sostenible y menos dañina para el medio ambiente y también induce una respuesta inmune en las plantas y ayuda a controlar el estrés biótico y abiótico (Ingle et al., 2022). Este compuesto además aumenta la resistencia de los cultivos a los nemátodos (Fan et al., 2023), como por ejemplo aumenta la tolerancia del Pinus Pinaster al nemátodo de la madera del pino (Bursaphelenchus xylophilus) (Nunes Da Silva et al., 2021).
Aplicaciones médicas
En el área biomédica tiene interesantes usos como por ejemplo en tratamiento de quemaduras, como cubierta de fármacos para su liberación controlada (Yang et al., 2023) y en el secuestramiento de grasas para el control de la obesidad. También es un potenciador del aparato inmunológico (Bauer et al., 2022). Por su naturaleza bioabsorbible, policatiónica y su gran potencial en la regeneración de tejidos se aplica ampliamente en los campos farmacéuticos, incluyendo sistemas de administración de medicamentos, bioimagen, implantes y lentes de contactos (Kedir et al., 2022; Spriano et al., 2023). Se ha demostrado que promueve tanto la diferenciación de células madre en osteoblastos formadores de huesos como el crecimiento de colonias óseas en estudios in vitro, por sus propiedades osteogénicas (Örlygsson et al., 2022).
Aplicaciones industriales
En el área industrial tiene importantes aplicaciones como por ejemplo su uso como clarificante de vinos, efluentes contaminados por la actividad minera, y también para fijar colorantes en la industria textil (Bauer et al., 2022).
Purificación de agua
El quitosano en el tratamiento de las aguas es muy amplio ya que elimina materiales contaminantes como colorantes, metales pesados y compuestos orgánicos, se usa como adsorbente, coagulante-floculante y bactericida (Burillo-Montufar et al., 2019; Thakur & Voicu, 2016). Otra ventaja viene dada por la hidrofilia del quitosano, que aseguran mayores flujos de agua con la mejor eficiencia para el proceso de separación (Thakur & Voicu, 2016); además los hidrogeles de quitosano han ganado especial atención en este campo debido a sus excelentes propiedades como alta capacidad de adsorción, rápida cinética y reutilización (Mohammadzadeh Pakdel & Peighambardoust, 2018).
Aplicaciones en el sector alimentario
En el sector alimentario, este biopolímero es uno de los más adecuados, tanto en su forma nativa como químicamente modificada, ofrece una aplicación distintiva que incluye, clarificación y desacidificación de jugos, preservación del deterioro microbiano, mejora de la calidad de los alimentos y aditivos alimentarios (Cheba, 2020).
La obtención del quitosano a partir de fuentes biológicas como los desechos de cáscaras de camarón debe explorarse considerando criterios de sostenibilidad. Meramo-Hurtado et al., (2020) propone como vía las siguientes etapas de procesamiento: desproteinización, desmineralización, despigmentación y desacetilación alcalina.
Otra ruta efectiva para la obtención de quitosano es la propuesta, donde somete los desechos de cáscara de camarón a una serie de procesos estándar de desmineralización, desproteinización y desacetilación; mientras que González-Delgado et al., (2022) propone un proceso más detallado donde la quitina se transforma en quitosano por la eliminación de los grupos acetilo en un proceso de desacetilación a altas temperaturas y gran concentración de hidróxido de sodio, seguido de una etapa de neutralización con HCl, lavado para ajustar su pH y secado.
Actualmente, el mercado global del quitosano es dominado por Japón, quien representó un 37 % del mercado internacional del quitosano en 2018, pero dado el crecimiento del mercado países como China, India y Estados Unidos se han visto fuertemente atraídos por esta industria (A. D. González-Delgado et al., 2022), ya que tiene un tamaño de mercado prometedor. Se espera que entre 2021 y 2026 crezca de 6 a 12,41 billones de dólares, con una tasa de crecimiento anual compuesta del 19,2% (Muñoz et al., 2023).
Astaxantina
La astaxantina, de masa molar de 596,84 g/mol, consta en su estructura molecular de dos anillos terminales unidos por una cadena de polieno y contiene dos centros asimétricos ubicados en las posiciones 3 y 3' del anillo de β-ionona con un grupo hidroxilo (-OH) en cada extremo de la molécula (Jafari et al., 2021).
Es un cetocarotenoide colorido y soluble en lípidos que se encuentra en numerosos microorganismos, y animales (Haque et al., 2023). Se produce naturalmente en microalgas como Haematococcus pluvialis y Chlorella zofingiensis, ciertas levaduras como Xanthophyllomyces dendrorhous y la flor de la planta Adonis aestivalis (Cheong et al., 2020). Se encuentra ampliamente distribuido en animales acuáticos como camarones, salmón, trucha y langosta (Da Silva et al., 2018). En el camarón, es el principal pigmento y representa entre el 65 % y el 98 % del total de carotenoides (Gao et al., 2020), se obtiene a través de su dieta o por oxidación celular de betacaroteno y se deposita en las cáscaras, músculos, órganos y huevos donde aparece más comúnmente como complejos de carotenoproteína, carotenolipoproteínas y quitinocarotenoides (Cheong et al., 2020).
Debido a la presencia de grupos funcionales hidroxilo (-OH) y cetona, que se encuentran en cada una de las dos estructuras de anillo, la astaxantina tiene una alta capacidad de unirse a los radicales libres y, por tanto, tiene una fuerte actividad antioxidante. Posee numerosas actividades biológicas beneficiosas incluyendo efectos anticancerígenos y antienvejecimiento, además de prevenir enfermedades relacionadas con la edad y promover respuestas inmunes, están relacionadas con esta propiedad (Myint et al., 2022). Este compuesto muestra fuertes propiedades y funciones fisiológicas como antitumorales, antiinflamatorias, antidiabéticas y reparadoras del ADN (Cheong et al., 2020; Da Silva et al., 2018; L. Zhang, Li, & Gao, 2023).
La astaxantina es uno de los carotenoides liposolubles más importantes que tiene aplicaciones en las industrias farmacéutica, cosmética y alimentaria y como fuente de pigmentación en piensos para acuicultura, este pigmento también se considera en estudios y aplicaciones médicas y biomédicas debido a su función biológica como precursor de la vitamina A y sus altos efectos antioxidantes (Da Silva et al., 2018).
Aplicaciones médicas
Induce valiosos efectos fisiológicos en los seres humanos, incluida la inhibición de la peroxidación lipídica, prevención de enfermedades cardiovasculares, efectos inmunomoduladores y neuroprotección (Wulandari et al., 2023). Protege al sistema nervioso de la piel contra la radiación ultravioleta y constituye un refuerzo al sistema inmune (Jafari et al., 2021); se demostró su efecto anticoagulante en pacientes diabéticos tipos 2 (Chan et al., 2018); refuerzo inmunológico e inmunomodulador durante el tratamiento de COVID-19 (Talukdar et al., 2020) y mejora significativa en diversas enfermedades oculares como la retinopatía diabética, la degeneración macular relacionada con la edad, el glaucoma y las cataratas (Giannaccare et al., 2020).
Aplicaciones en la acuicultura
Estudios recientes han considerado los productos alimenticios que contienen astaxantina como alimentos funcionales (El-Bialy & Abd El-Khalek, 2020), la suplementación con astaxantina en las dietas de los peces ha mejorado el rendimiento reproductivo en términos de fecundidad, calidad de los huevos y tasa de supervivencia de las larvas en condiciones de cautiverio (Haque et al., 2023), por ejemplo, aumentó la supervivencia de las larvas del salmón del Atlántico (Salmo salar), la respuesta inmune de la platija japonesa (Paralichthys olivaceus) (Haque et al., 2021) y el enrojecimiento de los ovarios de las hembras adultas de Eriocheir sinensis, principal parte comestible (Zhang, Zhang, et al., 2023).
Aplicaciones en la cosmética
La aplicación tópica de astaxantina para fines cutáneos tiene varios beneficios, incluidos efectos antioxidantes y antienvejecimiento, protección contra la irradiación UV, antiarrugas, hidratación y cicatrización de heridas, por lo que constituye una forma prometedora de desarrollar nuevos cosméticos (Lima et al., 2021).
Debido a la creciente demanda de astaxantina es esencial desarrollar técnicas efectivas y eficientes para producirla (A. D. González-Delgado et al., 2022). Más del 90 % de la astaxantina en el mercado mundial se produce químicamente, lo que es costoso debido a los complicados pasos de síntesis y puede suponer un impacto ambiental (Zhang, Li, et al., 2023), por lo que recientemente se han desarrollado tecnologías ecológicas que incluyen la fermentación mediante bacterias probióticas, recuperando no solo la astaxantina sino también enriqueciendo el contenido de proteínas y quitina en los desechos fermentados y, la extracción con aceites comestibles (El-Bialy & Abd El-Khalek, 2020).
Para Gao et al., (2020) las técnicas de extracción convencionales para recuperar astaxantina de los desechos de camarón generalmente se basan en la extracción sólido-líquido utilizando aceites comestibles como aceite de girasol, aceite de salvado de arroz y aceite de palma o compuestos orgánicos volátiles como acetona, hexano, metanol y etanol (Gao et al., 2020).
Realidad en Cuba
La biorrefinería a partir de desechos de la industria pesquera, es un enfoque innovador que busca aprovechar al máximo todos sus componentes, incluidos los subproductos y desechos generados, esta estrategia está muy relacionada con los principios de economía circular y promueve la sostenibilidad de la industria.
La aplicación de este concepto puede tener un impacto significativo en la realidad de Cuba, tanto en términos económicos como ambientales, ya que la bioconversión de desechos no solo es una forma efectiva y ecológica de gestión, sino que también esos productos son valiosos desde una perspectiva de mercado. Este procesamiento también puede incluir su conversión en harina o pienso de camarón para animales, particularmente para acuicultura, y ofrecer varias ventajas como, un alto valor proteico para el crecimiento y desarrollo saludable de los animales o incluso potenciar la mejora del color en especies como peces y crustáceos, debido a la presencia de pigmentos como la astaxantina.
Promover esta industria puede contribuir al aprovechamiento integral de los recursos, reduciendo el desperdicio de materiales valiosos y maximizando la utilización de los mismos. La propuesta constituye además un impulso para el desarrollo de la industria pesquera en Cuba, ya que esto puede incentivar la modernización y mejora de las técnicas de pesca, así como el crecimiento de la flota pesquera; ayudaría a promover la diversificación económica al crear nuevas oportunidades de negocio en sectores emergentes; generar empleos en diferentes etapas de la cadena de valor y contribuir al desarrollo económico local. Otro aspecto no menos importante sería reducir la dependencia de las importaciones, ya que Cuba importa una gran cantidad de productos químicos y combustibles y la biorrefinería a partir de desechos marinos puede producir bioproductos que los sustituyan, reduciendo la dependencia del país en el mercado internacional y promoviendo la autosuficiencia, también permitiría exportarlos y generar divisas; contribuir a la reducción de la contaminación ambiental e impacto negativo en los ecosistemas marinos y terrestres, evitando que estos desechos sean arrojados al mar o en vertederos; y, fomentar la colaboración entre instituciones académicas y empresas, promoviendo la innovación y el avance científico en el país.
El desarrollo de esta propuesta es aún un reto no solo para Cuba si no para los investigadores a nivel mundial ya que el diseño de un complejo productivo integrado bajo el concepto de biorrefinería, requiere de la solución de un problema de optimización de la síntesis de procesos integrados no lineales, lo cual conlleva a la elaboración de modelos matemáticos representativos de cada planta involucrada. No obstante, en la literatura se mencionan algunos estudios con un acercamiento similar. Antelo et al., 2015) proponen un enfoque de cribado -optimizado adaptado a las particularidades de la biomasa marina de descarte en flotas pesqueras en España. Mientras que González-Delgado et al, (2022) realizan una propuesta de simulación de una biorrefinería a partir de desechos de camarón para la obtención de quitina, quitosano y astaxantina (Á. D. González-Delgado et al., 2022). Sin embargo, no se encontró en la literatura estudios que aborden la modelación matemática de biorrefinerías marinas e integre las herramientas de simulación y optimización.
CONCLUSIONES
La biorrefinería a partir de desechos de la industria acuícola es un enfoque sostenible que tiene el potencial de generar beneficios económicos, al tiempo que reduce el desperdicio y la contaminación ambiental. Productos derivados como la quitina, el quitosano, la astaxantina, las proteínas de pescado, el aceite, y el carbonanto de calcio tienen aplicaciones en diversas industrias, como la alimentaria, farmacéutica, cosmética y de bioplásticos, lo que ayuda a reducir la dependencia de un solo mercado, amplía las oportunidades comerciales y aumenta la resiliencia económica de las empresas acuícolas. En Cuba, la adopción de un sistema de biorrefinería marina, tiene un impacto positivo en la economía del país, al proporcionar una fuente adicional de productos derivados, que pueden ser utilizados tanto a nivel nacional como para la exportación.