INTRODUCCIÓN
La roya naranja (Puccinia kuehnii (W. Krüger) E. J. Butler de la caña de azúcar (Saccharum spp.), hasta el año 2000 estuvo restringida al sudeste de Asia y el Pacífico en 19 países. 1 Durante el 2007 se confirmó su presencia por primera vez en Florida (Estados Unidos), 2 desde entonces se dispersó a otros países de Centroamérica, el Caribe y América de Sur. Es una enfermedad emergente y en correspondencia con el peligro potencial que representa desde el año 2008, Cuba estableció la vigilancia fitosanitaria sobre la dispersión e incidencia de esta, en las áreas cañeras del país.
Las investigaciones persiguieron como objetivos fundamentales: detectar la presencia de P. kuehnii; evaluar la severidad de la enfermedad; caracterizar los síntomas y respuesta de cultivares al patógeno; determinar época más favorable del año para su desarrollo; actualizar la distribución y estado de la enfermedad en el país.
MÉTODOS
Identificación en Cuba de la roya naranja causada por Puccinia kuehnii (W. Kruger) E. J. Butler
Se realizaron inspecciones fitosanitarias a las plantaciones de caña de azúcar (Saccharum spp.) en diferentes áreas del país y se colectaron hojas con síntomas de roya. Las muestras se analizaron en el Laboratorio central de cuarentena de plantas por microscopía óptica. Se extrajo el ADN de hojas con los síntomas uredinias descritas siguiendo el protocolo descrito por Lin et al.3 En el PCR en tiempo real se empleó la técnica SYBR green con cebadores sintetizados de secuencias exactas de ITS1, 5.8S y ITS2 de la subunidad de la región ADNr informada en las accesiones de GenBank EU164549 y EU176009 según Comstock et al.2
Presencia de la roya naranja [Puccinia kuehnii (W. Kruger) E. J. Butler] en áreas experimentales de caña de azúcar (sacharum spp.) de la región central de Cuba
De octubre de 2008 hasta agosto del 2009, en las áreas experimentales de la ETICA Centro-Villa Clara se evaluaron un total de 562 cultivares comerciales, progenitores y cultivares en estudio en un área de 20 ha. En áreas de experimentos se seleccionaron 10 plantas al azar, en áreas para semilla 3 estaciones de muestreo en la diagonal del campo y en cada una se evaluaron 10 plantas al azar. Se registró la presencia o ausencia de síntomas de roya naranja y el área foliar afectada. Las hojas con síntomas de la enfermedad fueron enviadas al Laboratorio provincial de sanidad vegetal y al Laboratorio central de cuarentena vegetal para su diagnóstico según protocolo descrito por Comstock et al.2 y Lin et al.3
Determinación de la severidad de la roya naranja en cultivares de caña de azúcar infectados en la provincia de Villa Clara
En las áreas experimentales de la ETICA Centro-Villa Clara se condujo un experimento desde junio de 2013 hasta julio de 2014. Se evaluaron 25 cultivares comerciales, entre ellos a B7274, C89-147 y C95-414 como controles susceptibles, y 11 progenitores infectados desde 2009 de forma natural por P. kuehnii. Se incluyeron como controles a Q124 y CP72-2086, susceptibles en Australia y Centroamérica, respectivamente, según Magarey et al. 4 y Ovalle et al. (5 Se determinó el área foliar afectada (AFA %), área bajo la curva de progreso de la enfermedad (ABCPE) y tasa del progreso de la enfermedad (r).
Caracterización de los síntomas de la roya naranja [Puccinia kuehnii (W. Kruger) E. J. Butler] en 4 cultivares de caña de azúcar en Cuba
Se evaluaron 10 tallos infectados de los cultivares B52107, CSG398-92, C01-227 y Clon218-2011. De cada tallo se separaron las hojas con síntomas de la enfermedad, desde la +1 (primera hoja con cuello visible desde la cima del tallo hacia abajo) a la +8. Cada hoja fue seccionada en 3 partes iguales y cada una de estas se identificó como tercio 1, 2 y 3, a partir de la inserción de la hoja con la vaina hasta el ápice, respectivamente.
Con una cámara fotográfica se capturó la imagen de los 3 tercios de 236 hojas infectadas sobre un papel milimetrado. Mediante el procesador de imágenes ImageJ® 1.43u 6 se determinó el AFA % en cada tercio, posteriormente se midió el largo, ancho y área ocupada por 554 pústulas de P. kuehnii, se tomó como referencia 5 mm (área conocida) sobre papel milimetrado.
Las diferencias de largo, ancho y área de las pústulas en los cultivares infectados por P. kuehnii se determinaron mediante la comparación de las medianas y prueba de Kruskal y Wallis. El procesamiento estadístico se realizó a través de paquete STATGRAPHICS CENTURION XV sobre Windows.
Caracterización de la respuesta de cultivares de caña de azúcar a la inoculación artificial con Puccinia kuehnii (W. Krüger) E. J. Butler en casa de cultivo
Se emplearon plantas de Q124 y CP72-2082 (controles susceptibles), CP52-43, SP70-1284, C323-68, C1051-73, C86-12, C86-56, C90-469, C95-414 (comerciales) y C01-227 (en estudio), B4263 y los mutantes de este IBP8518, IBP8830, IBP8719 y IBP8917 resistentes a Puccinia melanocephala sydow & p. sydow según Oloriz et al. 7
Se prepararon 320 bolsas plásticas con una mezcla de compost y zeolita como sustrato en una proporción 80:20. Se plantaron 20 yemas de cada cultivar (1 por bolsa). El manejo agronómico de las plantas se realizó según Jorge et al. 8 bajo condiciones de casa de cultivo en el Instituto de Biotecnología de las plantas (IBP) de la Universidad Central Marta Abreu de las Villas. A los 60 días posteriores a la plantación se seleccionaron 10 plantas por cultivar para su inoculación con P. kuehnii.
El inóculo se obtuvo de hojas infectadas del cultivar C01-227, procedentes de la ETICA Centro-Villa Clara. Se realizó diagnóstico por microscopía óptica con el empleo de un microscopio óptico (Olympus) y análisis molecular por reacción en cadena de la polimerasa (RCP) con los cebadores PkPmF (AAGAGTGCACTTAATTGTGGCTC) y PkPm-R (TCCCACCTGATTTGAGGTCT), 9 para P. melanocephala y P. kuehnii. El ADN se extrajo de tejido foliar acorde con el protocolo de extracción in situ propuesto por Xin et al. 10
En la hoja enrollada se aplicaron 250 µl de una suspensión acuosa (4-5 x 105 uredosporas ml-1) con una micropipeta. El riego de agua por microaspersión se aplicó a las 2 horas posteriores a la inoculación y posteriormente 10 min 2 veces al día, en condiciones de luz solar y temperatura media de 20 °C a 25 °C. Se inocularon 10 plantas por cultivar. El experimento se repitió 3 veces. Después de la inoculación se determinó periodo de incubación y periodo de latencia según Martins 11 y Pérez. 12 Para caracterizar la resistencia se utilizó la escala de 5 grados propuesta por Sood et al. 13
Se tomaron imágenes de las hojas + 1 y + 2, con una cámara digital (Cannon) y se procesaron en el programa imageJ 1.43 u, para cuantificar el número de pústulas por cm2, medir su largo y ancho (mm) y calcular el área ocupada por la pústula.
El procesamiento estadístico se realizó mediante el programa STATGRAPHICS Plus 4.1, pruebas de Kruskall-Wallis y Mann-Whitney. Los cultivares infectados se agruparon de acuerdo a las dimensiones de las pústulas, se realizó un análisis de clasificación automática, se utilizó el método de la Mediana y la distancia Euclidiana.
Estado de la roya naranja de la caña de azúcar en Cuba
Se determinó la ruta de aparición y dispersión de la roya naranja en Cuba a partir de la primera detección y propagación de la enfermedad en el país. Se recopiló toda la información de las encuestas supervisadas por el INISAV y las realizadas por el servicio fitosanitario del INICA desde el año 2009 hasta el 2017. Las evaluaciones se realizaron en las áreas de riesgo mediante muestreos a bancos de germoplasma, jardines de variedades, áreas experimentales y bancos de semilla. En estos casos, se evaluó toda la población de plantas correspondiente a cada genotipo. Además, se realizaron encuestas en plantaciones comerciales, pruebas de validación comercial y áreas de semilla comercial, donde se evaluaron en la diagonal del campo 10 tallos al azar.
Para evaluar la severidad de los síntomas, de acuerdo al área foliar afectada (AFA) de la tercera hoja con cuello visible, se empleó la escala de 5 grados de Alfonso et al. 14) La confirmación del diagnóstico visual de la enfermedad se realizó por microscopía óptica en los laboratorios provinciales de sanidad vegetal y los laboratorios de las estaciones experimentales del INICA.
RESULTADOS
Identificación en Cuba de la roya naranja causada por Puccinia kuehnii (W. Kruger) E. J. Butler
En noviembre de 2008, en áreas experimentales de la Estación territorial de investigaciones de la Caña de azúcar Centro Villa Clara (ETICA Centro Villa Clara), se detectaron síntomas de la enfermedad roya naranja en hojas de los cultivares CSG86-504, CSG24-92, CSG204-92 and CC87-409 15 (figura 1A). Se observaron estructuras morfológicas similares a las descritas por Virtudazo et al. 16 y Comstock et al. (2 para P. kuehnii: lesiones de las uredinias (pústulas) de 3 mm a 4 mm de longitud de color pardo claro, ocasionalmente amarillo-naranja a pardo-canela (figura 1B); uredinias hipófilas elípticas a fusiforme y con distribución menos uniforme que en P. melanocephala; urediniosporas mayormente ovoides a piriformes y también helicoidales de 27,5-55,0 (41,9) x 17,5-37,5 (26,0) μm, equinuladas y distribución uniforme de espinas 15 (figura 1 C).
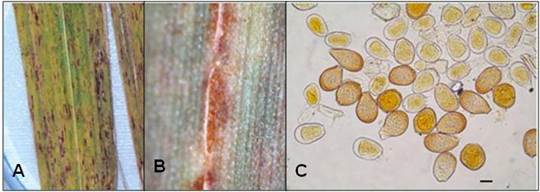
Fig. 1 A) Lesiones de roya naranja en hojas de caña de azúcar. B) Uredinia de Puccinia kuehnii. C) Urediniosporas jóvenes y maduras de Puccinia kuehnii (Bar = 10 μm).
La pared de las urediniosporas exhibió un color pardo claro con un espesor de 1 μm a 2,5 μm y un pronunciado engrosamiento apical de 3 μm a 7 μm, con 4 a 5 poros ecuatoriales. En el estereoscopio no se visualizaron paráfisis, telia y teliosporas. Estos resultados permitieron realizar el 1er informe en Cuba de esta enfermedad y su agente causal. 15
Presencia de la roya naranja [Puccinia kuehnii (W. Kruger) E. J. Butler] en áreas experimentales de caña de azúcar (Sacharum spp.) de la región central de Cuba
Se confirmó la presencia de la roya naranja en 58 cultivares de caña de azúcar, entre ellos 6 comerciales y 27 progenitores empleados en campañas de hibridación, otros 5 empleados como patrones de resistencia a la roya parda P. melanocephala (Ja60-5, Ja64-11, PR980) y al carbón Sporisorium scitamineum (M. Piepenbr, M. Stoll & Oberw.) (B42231 y Co213), además a B63118 susceptible a carbón y a roya parda. Se informó por primera vez la infección por P. kuehnii en los cultivares C1051-73 y C86-12, por el área que ocupan estos son de importancia en la producción comercial en Cuba, ello constituye una alerta de la posible vulnerabilidad a esta enfermedad. 17
En los cultivares infectados por P. kuehnii se determinó que el 62,5 % son resistentes a P. melanocephala y la infección simultánea por P. kuehnii y P. melanocephala,17 observaciones que coinciden con las de Ovalle et al. 18 (2008) en Guatemala y que deben tenerse en cuenta en el diagnóstico y en la evaluación de la severidad de la enfermedad. 17
Determinación de la severidad de la roya naranja en cultivares de caña de azúcar infectados en la provincia de Villa Clara
Se determinó que B52107, CSR81-86 y CSG398-92, presentan mayor infección y severidad por P. kuehnii que los cultivares comerciales infectados y que los controles susceptibles CP72-2086 y Q124. 19 Este resultado sirve de base para establecer protocolos y procedimientos necesarios para pruebas de resistencia de cultivares de caña de azúcar a la roya naranja. En los cultivares de importancia comercial C82-12 y C94-414 también se detectó la enfermedad, en ellos el área foliar afectada (AFA %) puede llegar a un 15 %. En los cultivares B7274 y C90-317, con menor área agrícola en explotación comercial, la severidad media no sobrepasó el 10 % de AFA %. 19
Se determinó que el inicio de la infección por P. kuehnii se produce a partir de los 5 meses de edad en noviembre y que la mayor severidad de la enfermedad se manifiesta a los 7 meses y 8 meses posteriores a la plantación, de enero a febrero. La infección continúa y decrece hasta los 13 meses. Se concluyó que, al igual que en Costa Rica 20 y Colombia, 21 la hoja + 3 puede ser utilizada en Cuba en la evaluación y aplicación de una escala de grados de severidad para la evaluación de la resistencia a P. kuehnii.19
Caracterización de los síntomas de la roya naranja (Puccinia kuehnii (W. Kruger) E. J. Butler) en cuatro cultivares de caña de azúcar en Cuba
Se determinó que el AFA % por P. kuehnii se incrementa de forma lineal con la edad de las hojas, superando la media a partir de las hojas +5 y +6, respectivamente. 22 En las hojas desde la +3 a la +7 se encontraron valores intermedios (entre 7,50 % y 12,82 %). 22 El AFA fue significativamente mayor en el tercio superior de las hojas y menor en la parte basal, 22 otros autores como Magarey et al.4) (2005), describen mayor cantidad de lesiones en la mitad basal.
Se observó que el largo de las pústulas de P. kuehnii varía entre 0,75 mm y 5,42 mm y el ancho de 0,24 mm a 0,99 mm con un área de 0,30 mm2 a 4,68 mm2. Los valores más frecuentes de largo y ancho de estas lesiones fueron 1,67 mm y 0,42 mm, respectivamente, que ocupan 0,60 mm2. Se concluyó además que el tamaño de las pústulas presenta variaciones significativas entre los cultivares infectados, aspectos que deben tenerse en cuenta durante la evaluación de los síntomas de la roya naranja. 22 Estas diferencias pueden ser atribuidas a diferentes niveles de susceptibilidad del hospedante. 23
Caracterización de la respuesta de cultivares de caña de azúcar a la inoculación artificial con Puccinia kuehnii (W. Krüger) E. J. Butler en casa de cultivo
Se investigó por primera vez en Cuba la respuesta de cultivares de caña de azúcar ante P. kuehnii mediante inoculación artificial. El cultivar no comercial C01-227 se seleccionó como control susceptible a la enfermedad, este junto a los comerciales C86-12 y CP52-43, mostraron mayor producción de pústulas de P. kuehnii que Q124 y CP72-2086 24) (tabla 1).
Tabla 1 Número de pústulas de P. kuehnii en los diferentes cultivares de caña de azúcar y el grado de resistencia determinado en condiciones de casa de cultivo
| Cultivar | Pústulas/cm2 | Grado | ||
|---|---|---|---|---|
| Media | Rango medio | |||
| CP72-2086 | 19,9 | 199,85 bc | 4 | S |
| Q124 | 9,7 | 170,05 cd | 4 | S |
| CP52-43 | 24,3 | 220,30 ab | 4 | S |
| SP70-1284 | 22,1 | 197,90 cd | 4 | S |
| C323-68 | 8,4 | 164,75 cd | 4 | S |
| C1051-73 | 10,6 | 162,12 d | 4 | S |
| C86-12 | 24,8 | 249,55 a | 4 | S |
| C86-56 | 0 | 79,00 e | 2 | MR |
| C90-469 | 0 | 79,00 e | 2 | MR |
| C95-414 | 18,2 | 206,05 bc | 4 | S |
| C01-227 | 32,4 | 248,00 a | 4 | S |
| B4263 | 13,3 | 168,45 cd | 4 | S |
| IBP8518 | 0 | 79,00 e | 1 | R |
| IBP8717 | 0 | 79,00 e | 2 | MR |
| IBP8719 | 21,8 | 205,37 bc | 4 | S |
| IBP8830 | 0 | 79,00 e | 1 | R |
Nota: Dentro de columnas, valores seguidos por diferentes letras indican diferencias significativas según la prueba Kruskall-Wallis/ Mann-Whitney para p<0,05
Se realizó el análisis molecular de P. kuehnii por reacción en cadena de la polimerasa (RCP) con cebadores específicos y la secuenciación de las muestras del patógeno aisladas del cultivar C01-227 (fuente de inóculo). Las secuencias de P. kuehnii obtenidas se colocaron en el Gen Bank (Accesión MF948614). 25 La primera prueba de resistencia a la roya naranja en Cuba permitió corroborar la susceptibilidad de CP72-2086 y Q124, clasificar además como: susceptibles los cultivares comerciales CP52-43, C323-68, C1051-73, C86-12, C95-414 y SP70-1284; moderadamente resistentes C86-56 y C90-469. 24
B4342, patrón de susceptibilidad a P. melanocephala, se clasificó además como susceptible a P. kuehnii.24 Se evaluaron además 4 mutantes de B4362 resistentes a P. melanocephala, 2 de ellos se clasificaron resistentes también a P. kuehnii (IBP8518 y IBP8830), ello puede ser de interés para programas de mejora genética para la resistencia. 24 Se elaboró un protocolo para seleccionar cultivares de caña de azúcar resistentes a la roya naranja mediante inoculación artificial en casa de cultivo. 26
Estado de la roya naranja de la caña de azúcar en Cuba
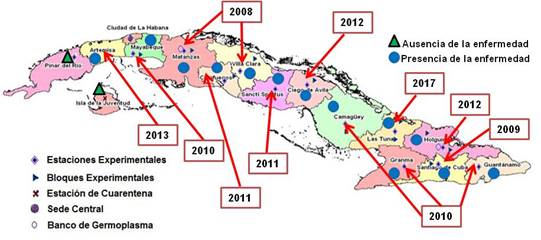
A partir de la detección de la roya naranja a finales de 2008 en las provincias Villa Clara y Matanzas, esta enfermedad continuó su dispersión hasta ser diagnosticada en todas las provincias en el 2017 (figura 2). En el 2016 se apreció una tendencia al incremento de las áreas con la enfermedad. 27
Las estaciones experimentales poseen el mayor número de clones y cultivares comerciales o progenitores infectados. Se detectó la infección simultánea de P. kuehnii y P. melanocephala en 4 cultivares comerciales (B80250, C1051-73, C90-317 y C95-414). En plantas provenientes del cultivo in vitro de los cultivares C95-414 y C89-176 los síntomas se clasificaron como intensos (grado 4). 27
Un total de 23 cultivares comerciales son frecuentemente infectados. Los resultados de la vigilancia fitosanitaria indican que algunos de los principales cultivares comerciales en Cuba son susceptibles y confirman el peligro potencial de esta enfermedad en Cuba 27 (tabla 2).
Tabla 2 Relación de cultivares que con mayor frecuencia se han infectado por roya naranja (P. kuehnii) y su resistencia a roya parda (P. melanocephala) en Cuba
| B7274 | C85-102 | C90-317 | Co997 | |
|---|---|---|---|---|
| C88-356 | C90-469 | |||
| C120-78 | C86-156 | C88-380 | C93-540 | CP72-2086** |
| C137-81 | C86-456 | C89-176 | My5514 | |
| C86-351 | C90-105 | Co-213** |
* Cultivares que con mayor frecuencia se han infectado por roya naranja en Cuba.
** no comerciales
Progreso de la enfermedad roya naranja en diferentes ciclos de plantación de la caña de azúcar.
Se realizaron los primeros estudios en Cuba para determinar el progreso de la enfermedad en diferentes ciclos de plantación de la caña de azúcar. Los resultados mostraron que la roya naranja es más severa en las plantaciones que se realizan desde abril a septiembre (figura 3).
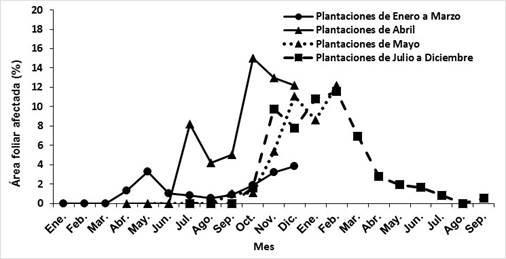
Fig. 3 Progreso de la roya naranja de la caña de azúcar (P. kuehnii) en diferentes meses de plantación del cultivar C01-227 en los años 2016, 2017 y 2018 en la región central de Cuba.
El rango de temperatura media y mínima del aire de 20 oC a 24 oC y 14 oC a 18 oC, respectivamente y máximas inferiores a 30 oC, acompañadas de la humedad relativa superior al 80 % favorecen la infección y severidad de la enfermedad. 28
Durante los meses de abril a octubre las temperaturas superan el rango de valores que favorecen el progreso de la enfermedad, su incidencia y severidad, ello coincide además con mayores valores de precipitación que superan los 150 mm. 28
Conclusiones
Se informa en el año 2008 la presencia en Cuba de P. kuehnii. En los cultivares infectados por P. kuehnii en ocasiones se detectó la infección simultánea junto a P. melanocephala. Cultivares resistentes a P. melanocephala pueden ser susceptibles a P. kuehnii. Los controles susceptibles CP72-2086 y Q124 de referencia no muestran alta susceptibilidad en las condiciones de Cuba, en su lugar se proponen otros cultivares para pruebas de resistencia (B52107, CSR81-86, CSG398-92 y C01-227). Se obtuvo una metodología para la evaluación de la resistencia mediante inoculación de P. kuehnii. La enfermedad roya naranja de la caña de azúcar se encuentra distribuida en todas las provincias del país y constituye un peligro potencial. En Cuba asciende a más de 23 el número de cultivares comerciales infectados por roya naranja, esta se muestra más severa en las plantaciones que se realizan desde abril a septiembre.