Introducción
El tallo es un órgano de relevancia para las plantas, permite el transporte y administración de agua, sales y nutrientes, siendo fundamental para el crecimiento, sostén y sobrevivencia de los individuos (Biondi y Rossi, 2015). En el caso específico de las especies leñosas, el tallo tiende a formar los tejidos xilema y floema que cumplen la función de almacenamiento y transporte de agua y nutrientes en el árbol (Sevanto et al., 2008). El xilema es el tejido inactivo del tronco, se encuentra más cercano a la médula del árbol y su función principal es de almacenamiento (Ayala-Usma et al., 2019); comercialmente, al xilema se le conoce como madera y se implementa como un material constructivo en edificaciones inmobiliarias, muebles, leña, entre otros usos (Campelo et al., 2018).
La madera puede variar sus propiedades físicas y mecánicas acorde a su procedencia (características del sitio donde creció el árbol) (Paz Pérez-Olvera y Dávalos-Sotelo, 2008) y genéticas (Biondi y Rossi, 2015); sin embargo, hay aspectos que se mantienen homogéneos dentro de cada especie arbórea que son sus propiedades anatómicas, aspectos como la distribución y forma de vasos, parénquima, fibras, entre otros, tienden a seguir los mismos patrones en las especies indiferentemente al sitio, condiciones de crecimiento y genética (Beyer et al., 2014), aspecto que ha permitido utilizar a la madera como instrumento de identificación de especies y ha generado la creación de colecciones de madera como mecanismo de consulta y comparación de muestras, comúnmente denominadas xilotecas (Machado et al., 2019).
Una de las limitaciones que presentan las xilotecas es su poca accesibilidad por medios digitales como colecciones virtuales (Havinga et al., 2020), aspecto que limita su consulta por parte del público y su implementación en investigaciones debido a la restricción en la cantidad de muestras (Malik et al., 2019). Además, otra limitación en la consulta de xilotecas es definir el tamaño mínimo de la muestra necesaria para poder hacer comparaciones anatómicas (Carlsson y Isaksson, 2018); muchas veces las especies arbóreas a comparar están vivas o son muestra de edificaciones históricas, lo que limita la extracción de muestra tradicionales sin generar daños significativos a la planta u edificación de origen.
De tal manera, se hace necesario empezar a desarrollar pruebas para definir la muestra mínima dimensional que permite hacer análisis anatómicos. Dantas y Cunha (2020) menciona que tradicionalmente se han empleado muestras cúbicas de 10 mm de cara, las cuales se implementan con microscopio a aumentos de 40 y 100 X para análisis anatómicos; por su parte, Sánchez-Costa et al., (2015) destacan el uso de muestras de cúbicas de 20 mm de cara para análisis macroscópico a 10X y microscópico a 100X; Arzac et al., (2018) mencionan que se pueden hacer muestras de distinto tamaño dependiendo del error del tamaño de la muestra, conforme la muestra sea menor el error de representación se incrementará, por lo que no recomienda uso de muestras cubicas menores a 4 mm de longitud. Micco et al., (2008), por su parte, menciona que el tamaño de la muestra dependerá del tipo y diámetro de vaso de la especie en estudio, conforme el vaso sea mayor, el tamaño de la muestra se incrementará debido a que será necesario una mayor área para representar la anatomía de la especie.
Brown (2013) menciona que definir dimensiones óptimas en digitalización de muestras permite no solo optimiza la muestra que se extrae del árbol o madera, generando el mínimo impacto al individuo, sino que también permite mejorar los procesos de entrenamiento y aprendizaje en sistemas de identificación automática de especies mediante algoritmos, debido a que generalmente la fotografía macroscópica tiende a ser seccionada en fotos más pequeñas para incrementar la cantidad de imágenes en el proceso de entrenamiento (Glabasnia y Hofmann, 2006); pero, si esta segmentación es muy alta se puede perder la representatividad de una especie y caer en errores de tener fotografías que cubran todo un vaso o ausente de vasos, lo cual inducirá a un mayor sesgo en la identificación de la especie (Ma y Huang, 2018).
Stepanova et al., (2013) menciona que, para la creación de colecciones virtuales de especies, se debe tener una muestra significativa de la especie, con imágenes correctas que permitan una identificación real y una selección de imágenes que sean representables o icónica de las especies. En el caso de anatomía macroscópica se hace necesario la determinación de una cantidad de imágenes que permitan dar representatividad mínima de las especies, la determinación de las dimensiones mínimas de la imagen y que permitan la representatividad y reproducibilidad de la especie; sin embargo, la disponibilidad de esos estudios ha sido reducida a nivel mundial.
En el caso de las regiones tropicales, el desarrollo de estudios anatómicos a especies arbóreas es muy limitado debido a la amplia diversidad y variabilidad de las especies, lo que hace necesario, primeramente, la generación de protocolos que sean afines a la región y que permitan un estudio adecuado de las especies (Brownson et al., 2020). Por lo anterior, presente estudio planteó como objetivo: determinar las dimensiones fotográficas mínimas para disponer de representatividad estadística para análisis macroscópicos anatómicos, definir la cantidad mínima de fotografías macroscópicas representables por especie y analizar la relación entre dimensiones fotográficas y características anatómicas.
Materiales y métodos
Especies y sitios de estudio
En el estudio se emplearon diez especies arbóreas procedentes de bosques de la Costa Pacífica de Costa Rica. Específicamente se recolectaron de cuatro localidades (Figura 1) que se ubicaron en la Estación Forestal Experimental Horizontes ubicada en Guanacaste (10°42'10'' N, 85°33'12'' O) a una altitud de 120 m, bosques en la región de Miramar, Puntarenas (10°01'29'' N, 84°14'04'' O) a una altitud de 270 m; en ambas regiones los bosques se caracterizaron por ser de tipo seco con régimen hídrico anual inferior a los 2 000 mm, con temperaturas que oscilaron de 27 a 34 °C y con una estación seca definida de diciembre a mayo. También se colectaron muestras en la Península de Osa, Puntarenas; específicamente en el bosque de los Mogos (8°45'00'' N, 83°22'59'' O) a una altitud de 40 m y San Juan (8°39'02'' N, 83°27'53'' O) a una altitud de 35 m, sitios que se caracterizaron por tener una época seca muy reducida (de enero a abril), con una precipitación anual de 4 000 a 4 300 mm y temperatura anual con variación de 27 a 33 °C con una humedad relativa anual de 70 a 90 %.
De cada especie se seleccionaron no menos de ocho individuos (Tabla 1), que presentaron un diámetro a 1,3 m sobre el suelo superior de 30 cm con una distancia entre árboles mayor a los 15 m (esto con el fin de aumentar la representatividad de la especie en el sitio).
Tabla 1 - Nombres científicos de las diez especies maderables en estudio
| Familia botánica | Especie | Cantidad de árboles colectados |
| Anacardiaceae |
|
12 |
| Bignoniaceae |
|
10 |
| Caryocaraceae |
|
12 |
| Fabaceae |
|
8 |
| Fabaceae |
|
12 |
| Fabaceae |
|
8 |
| Fabaceae |
|
8 |
| Malvaceae |
|
16 |
| Meliaceae |
|
15 |
| Vochysiaceae |
|
10 |
Proceso de colecta del material
Por cada individuo de estudio se obtuvo una muestra de madera de 75 mm de longitud y 25 mm de diámetro, conseguida mediante un muestreo no destructivo que consistió en el uso de una broca de tipo cortadora de tapones en espiral de implementada en un taladro de batería de 20 voltios. La perforación se realizó en cada árbol a una altura de 1,3 m sobre nivel del suelo se limpió un área de 4 cm2, la cual se liberó de la corteza y se colocó la broca para perforar el fuste, la perforación se realizó con una velocidad de 1 750 RPM; posterior a que se realizara la perforación con toda la broca, la pieza de madera se extrajo con una pinza y se introdujo en una bolsa con una disolución acuosa de alcohol al 15 %.
Procesamiento del material
Cada muestra cilíndrica se segmentó en cinco subcilindros de 13 mm de longitud, proceso en el cual las caras transversales se pulieron para dejarlas lo más lisas posibles; posteriormente, cada subcilindro se convirtió de manera manual en cubos de 12 mm de cara con superficies lo más lisas posibles y libres de defectos. Seguidamente, se secaron a una temperatura de 65 °C por 72 horas, esto con el fin de no tener contracciones drásticas de la madera a ser expuesta en poco tiempo a altas temperaturas. Posterior al secado, los cubos se rectificaron en vías de disponer de una cara transversal lo más limpia posible, libre de torceduras, defectos de secado o marcas del proceso de corte; el tamaño de cada cara fue de 10 mm.
Procedimiento de fotografiado
Las muestras se fotografiaron en su cara transversal en un estereoscopio electrónico marca Celestron, a una resolución de 5 MP y con un aumento de 20X. El material se colocó en una base banca y con una luminosidad estándar LED que dispone el estereoscopio integrado, utilizándose con una intensidad de 150 lux, con una temperatura de la luz de 4 500 K; cada muestra se fotografió cuatro veces, girando la muestra 90° en cada fotografía.
Análisis anatómicos considerados
Cada fotografía se procesó con el programa "Image J" y se estimó la densidad y diámetro promedio de los vasos, además de la relación de vasos-fibras para lo cual se implementó la metodología de Valverde y Arias (2018) para especies arbóreas latifoliadas del trópico.
Análisis estadístico
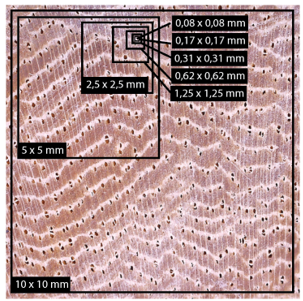
Primeramente, se realizó un análisis descriptivo de la anatomía de las muestras de madera en cara trasversal de las diez especies, analizando densidad de vasos y diámetro de vasos. Posteriormente, se determinó la cantidad óptima de fotografías por especie (implementado por referencia la imagen de 10 x 10 mm), para lo cual se realizó un análisis de Cochran de homogeneidad de valores; hasta que este análisis mostrara una variación superior al 0,05 mostraría que la cantidad de fotografías no sería significativa para el análisis. Seguidamente, se determinó la dimensión fotográfica óptima por especie, a partir de ambas variables anatómicas, para lo cual utilizó la cantidad mínima de fotografías y se seccionaron en imágenes de 10 x 10 mm, 5 x 5 mm, 2,5 x 2,5 mm, 1,25 x 1,25 mm, 0,62 x 0,62 mm, 0,31 x 0,31 mm, 0,17 x 0,17 mm y 0,08 x 0,08 mm (Figura 2). Las imágenes se implementaron para estimar la densidad y diámetro de vasos y con la prueba de Cochran de homogeneidad de valores se estimó el punto de variación.
Con respecto a la determinación de la repetibilidad se implementó el error de la prueba de Cochran de homogeneidad de valores; se utilizó la fórmula: (1- error) * 100 %. Con la reproducibilidad se aplicó la fórmula: √(s^2+v^2), donde s es la desviación estándar de la muestra analizada y V es el coeficiente de corrección de la prueba de Cochran realizada. Finalmente, se realizó con la cantidad y dimensiones óptimas de las imágenes un análisis de correlación de Pearson para identificar la correspondencia entre la dimensión fotográfica y el diámetro de vasos.
Todos los análisis se realizaron con un nivel de confianza 0,05 y se implementó el programa estadístico Origin Pro versión 2020.
Resultados y discusión
Caracterización anatómica inicial de las especies
En la Tabla 2, se presentan los datos de la caracterización macroscópica de las diez especies arbóreas en estudio. La densidad de vasos varió de 3,5 a 20,4 vasos mm-2, siendo la especie E. cyclocarpum la que presentó la menor densidad de vasos, mientras P. purpurea la de mayor densidad con 20,4 vasos mm-2. Con respecto al diámetro de los vasos, este varió de 119 a 252 µm, siendo la especie P. quinata la de menor diámetro de vasos, mientras la especie E. cyclocarpum mostró el mayor diámetro.
Los resultados mostrados concuerdan con los estudios desarrollados por De La Paz Pérez-Olvera y Dávalos-Sotelo (2008) para seis especies que determinó rangos de densidad y diámetro de vasos; solo cinco especies se encontraron en dicho estudio y presentaron valores con una similitud al 80 %, las variaciones obtenidas se pueden deber a variaciones climáticas, genéticas y de edad de los individuos analizados (Giachi et al., 2017), aspectos que según Kobayashi et al., (2019) pueden incidir en la diferenciación entre especies.
Tabla 2 - Caracterización macroscópica de ocho especies arbóreas forestales de Costa Rica
| Especie | Densidad de vasos (vasos mm-2) | Diámetro de vasos (µm) |
| 8,1 (3,4) | 211,3 (58,7) | |
| 12,4 (3,9) | 180,5 (44,8) | |
| 9,3 (3,8) | 176,2 (39,9) | |
| 6,6 (5,6) | 251,8 (49,7) | |
| 3,5 (2,1) | 246,7 (66,3) | |
| 20,4 (5,6) | 102,3 (38,9) | |
| 6,4 (3,7) | 187,8 (62,7) | |
| 3,4 (1,9) | 119,5 (59,2) | |
| 6,3 (2,8) | 242,9 (45,6) | |
| 3,9 (2,1) | 169,7 (56,6) |
Nota: valores entre paréntesis corresponden la desviación estándar
Determinación de la cantidad de imágenes mínima para representatividad por especie
En la determinación de la cantidad de imágenes mínimas por especie, en función de la variación de la densidad de vasos (Figura 3) , se observaron las siguientes características: conforme el número de imágenes aumentó, la variación en la estimación de vasos disminuyó; los altos valores de la variación de vasos en poca cantidad de imágenes se deben a que muchas imágenes solo cubrían secciones del vaso, lo que hacía que la heterogeneidad de imágenes fuera amplia. La variación de vasos en los muestreos con pocas imágenes incidió que en la mayoría de las especies se tendiera a sobreestimar el diámetro de vasos, variación que disminuyó según se incrementó la cantidad de imágenes.
En el estudio se determinaron tres agrupaciones en cuanto a la cantidad de fotografías. La primera agrupación la conformó C. costarricense, T. rosea, P. purpurea, S. saman y P. quinata, que mostraron la menor cantidad de imágenes necesarias para obtener una homogeneidad del error. La cantidad mínima varió de 19 a 23 imágenes (Figura 3b, 3c, 3f, 3g y 3h); posterior a dicha cantidad de imágenes no se dieron diferencias estadísticas con el aumento de la cantidad de fotografías. La segunda agrupación se conformó con las especies E. cyclocarpum, C. odorata y V. guatemalensis, que presentaron un número mínimo de significancia de imágenes de 25 a 30, posterior a la cual la variación se estabilizó. Finalmente, la especie S. mombin fue la que mostró la mayor cantidad de imágenes (35).
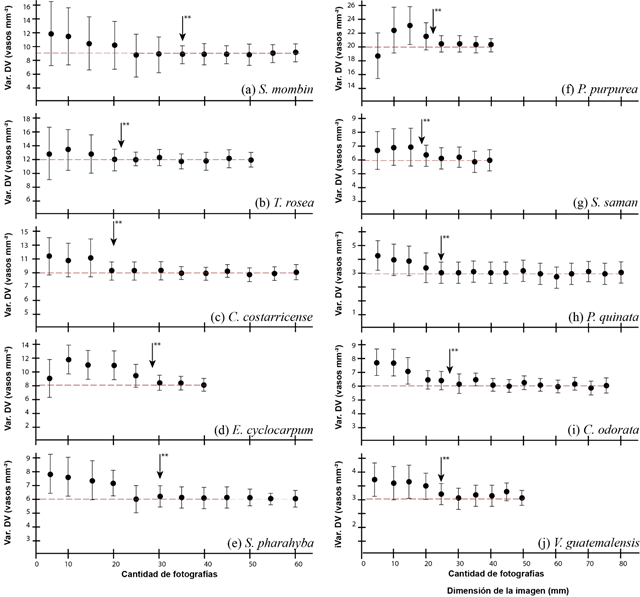
Fig. 3. - Determinación de la cantidad mínima significativa de imágenes macroscópicas de madera para diez especies arbóreas de Costa Rica
La poca funcionalidad de la implementación de menos de 19 imágenes por especie se debe a la pérdida de representatividad de la especie. Pacheco et al., (2020) mencionan que pocas imágenes representativas de una especie generan que haya un error en los datos anatómicos, ya que por efectos de aleatoriedad se encuentran distintas partes de la anatomía de la especie y conforme se aumente la muestra se dará una mayor representatividad de todos los posibles elementos que conforman la madera; con ello se podrá disponer de un set mayor de información. Estudios desarrollados por Andrade Bueno et al., (2020) con especies de Eucalyptus spp. determinaron que los análisis anatómicos con menos de cinco imágenes son poco viables, debido a que se pueden cometer errores en cuanto la representatividad de la especie; además, se puede tener únicamente muestras de madera juvenil, o solo secciones de albura o duramen, lo cual inciden en que se den sesgos en la representación de la especie.
Fioravanti et al., (2017) mencionan que una vez determinada la cantidad de imágenes óptimas por especie se debe evitar trabajar con cantidades de imágenes inferiores que pueden generar sesgos en cuanto a los análisis estadísticos o en descripciones representativas de la especie; aspectos como la distribución de la especie, edad, condiciones ambientales de desarrollo deben ser consideradas al momento de tomar la muestra de imágenes, ya que en muchos casos la utilización de una única procedencia o región puede inferir en la representación (Ayala-Usma et al., 2019), por lo cual no solo se debe pensar en la cantidad de muestras mínimas, sino también en la distribución de individuos y sus condiciones de desarrollo.
Determinación del tamaño mínimo de la imagen en función del diámetro de vasos
Con respecto a la determinación del tamaño óptimo de la imagen, en función del diámetro de vasos (Figura 4), se determinó para la mayoría de las especies una dimensión óptima de 1,25 x 1,25 mm, siendo para las especies T. rosea, C. costarricense y C. odorata la dimensión óptima de 0,62 x 0,62 mm, mientras con P. purpurea la dimensión fue de 0,31 x 0,31 mm. Además, se determinó que las dimensiones inferiores a la óptima se sobreestimó el diámetro de los vasos en conjunto de un incremento significativo de la desviación estándar, lo cual influye en un incremento de la variación.
La determinación de una dimensión mínima de trabajo es fundamental para tener una representación real de la imagen. Machado et al., (2019) destacan que imágenes con una dimensión muy pequeña pierden la representatividad de los elementos anatómicos; aspectos como vasos, parénquimas o fibras pueden disponer de poca representación en la imagen, generando sesgo al momento de hacer cálculos anatómicos. Carlsson y Isaksson (2018) mencionan que en especies latifolias se debe tener cuidado con el tamaño de la imagen; imágenes de tamaño reducido inciden en que la capacidad de identificación de la especie sea baja, debido al corte de vasos y poca presencia de elementos anatómicos dentro de la imagen.
Por su parte, Brown et al., (2020) mencionan que la optimización del tamaño permite el desarrollo de muestreos optimizados en la madera; con ello, definir el tamaño de una muestra permite reducir el problema de hacer muestreos no destructivos o muestreos de bajo impacto al material de estudio.
Determinación del tamaño mínimo de la imagen en función de la densidad de vasos
Con respecto a la determinación de la dimensión fotográfica en función de la densidad de vasos (Figura 5), se según la fotografía disminuyó de dimensiones la densidad tendió a subestimarse, siendo el tamaño óptimo la dimensión de 1,25 x 1,25 mm. Para las especies T. rosea, C. costerricensis y C. odorata la dimensión óptima fue de 0,62 x 0,62 mm; en cambio, para la especie P. purpurea la dimensión óptima fue de 0,31 x 0,31 mm. Posterior a la dimensión óptima, los valores de densidad de vasos tuvieron a estabilizarse y el error se mantuvo homogéneo.
Repetibilidad y reproducibilidad de las condiciones óptimas de muestreo fotográfico
Al analizar la repetibilidad y reproducibilidad de las dimensiones y cantidad de imágenes óptimas, se obtuvieron valores superiores al 90 % en todas las especies, lo que permitió demostrar la viabilidad de los parámetros seleccionados; cantidades menores de fotografías o dimensiones fotográficas inferiores generaron valores inferiores al 60 %.
Según Sousa Fernandes et al., (2019) estos aspectos son de relevancia en estudios de representatividad de una especie. Conforme se dé una capacidad de reproducir un estudio con las mismas condiciones y se den resultados similares, se permitirá disponer de condiciones reales para la comparación de los resultados. Copini et al., (2015) mencionan que en muchos casos es complicado, debido a deficiencias en las metodologías, errores en los procedimientos de colecta y manipulación de datos, omisiones de pasos que inciden que la reproducibilidad del experimento sea escasa y la representatividad de los resultados sea posible de realizar.
Los análisis evidenciaron que dimensiones menores a las determinadas hicieron que la variación de resultados fuera amplia, lo que elevó el error y disminuyó la calidad de la información, aspecto que Marcelo-Peña et al., (2019) considera deficientes en estudios con especies arbóreas, ya que se pueden generar sesgos en los valores anatómicos (Tabla 3).
Tabla 3 - Repetibilidad y reproducibilidad con la cantidad y dimensiones óptimas de las fotografías obtenidas para diez especies forestales de Costa Rica
| Especie | Cantidad mínima de imágenes | Dimensión de la imagen (mm) | Repetibilidad | Reproducibilidad |
| 35 | 1,25 x 1,25 | 92,56 (2,65) | 91,23 (4,56) | |
| 23 | 0,62 x 0,62 | 90,58 (3,26) | 90,88 (3,86) | |
| 30 | 0,62 x 0,62 | 96,50 (4,02) | 95,56 (3,69) | |
| 28 | 1,25 x 1,25 | 90,25 (3,45) | 92,45 (4,02) | |
| 30 | 1,25 x 1,25 | 92,86 (3,75) | 96,25 (4,09) | |
| 23 | 0,31 x 0,31 | 98,55 (2,98) | 91,02 (3,50) | |
| 18 | 1,25 x 1,25 | 91,22 (2,56) | 93,25 (3,78) | |
| 25 | 1,25 x 1,25 | 92,17 (2,77) | 92,05 (4,11) | |
| 26 | 0,62 x 0,62 | 93,35 (3,44) | 91,11 (4,03) | |
| 24 | 1,25 x 1,25 | 94,44 (2,56) | 93,33 (3,80) |
Nota: Valores entre paréntesis corresponden a la desviación estándar
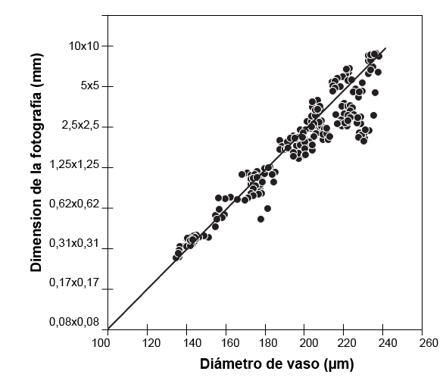
Relación del diámetro del vaso con la dimensión fotográfica
El análisis mostró una relación entre el diámetro del vaso y la dimensión óptima de la fotografía del 73 %; conforme el vaso es más pequeño, el tamaño óptimo de la fotografía es inferior, aspecto que incidió en que especies de vaso pequeño como P. purpurea pudieran funcionar con fotografías con dimensiones inferiores a 1,25 x 1,25 mm (Figura 6). Sin embargo, la gran mayoría de las especies manifestaron que dimensiones inferiores a 1 mm son poco funcionales para que se puedan obtener datos estadísticamente válidos. Esto, debido a la pérdida de representatividad de los datos de los vasos, de ahí que especies con vasos mayores requirieran una imagen mayor. Reinig et al., (2018) encontraron resultados de correlación similares, determinando que la dimensión de las imágenes tenía una correlación del 60 % con respecto al tamaño de vasos, encontrando que en imágenes muy pequeñas en muchos casos se recorta el vaso, generando subestimaciones en su medición; si la imagen es muy pequeña (inferior a 0,5 mm) se corre el riesgo de disponer de imágenes conformadas totalmente por vasos, lo que incide en que la representatividad de la imagen sea nula.
Conclusiones
Se determinó la cantidad mínima fotografías por especie de 19 a 35, siendo Spondias mombin la especie con mayor requerimiento de fotografías con 35 y Caryocar costarricense la especie con menor cantidad de fotografías con 19. Con respecto a la dimensión óptima común de fotografías fue de 1,25 x 1,25 mm, siendo Peltogyne purpurea la especie que se pudo trabajar con menores dimensiones de 0,31 x 0,31 mm; la combinación de la cantidad de fotografías mínimas y la dimensión óptima permitió tener representatividades y reproducibilidades superiores al 90 %. Finalmente, se halló una correlación entre la dimensión de la imagen y el diámetro de vasos, encontrando que según el diámetro de vasos es menor, es posible trabajar con fotografías de menor dimensión con una relación superior al 70 %.











 texto en
texto en