INTRODUCCIÓN
El esófago de Barrett fue descrito en 1950 por el cirujano torácico australiano Norman Rupert Barrett, que informó la presencia de epitelio columnar alrededor de úlceras crónicas en el esófago distal pero, ya desde 1906, Wilder y Tileston establecieron la correlación entre el reflujo gastroesofágico y las úlceras esofágicas, aunque no definieron el término de enfermedad por reflujo gastroesofágico (ERGE). Carrie publicó, en 1950, una serie de 20 casos y fue el primero en sugerir que el tejido gástrico ectópico podría desarrollar adenocarcinoma esofágico (ACE), lo que fue confirmado por Morson y Belcher en 1952. Paull y colaboradores, en 1976, demostraron la presencia de tres tipos diferentes de epitelio columnar (intestinal, cardial y fúndico).1
El concepto básico de resección endoscópica mucosa (REM) fue originalmente descrito por Deyhle y colaboradores, en 1973; al inicio fue considerado como un procedimiento riesgoso, pero después su práctica se generalizó. En 1978 fue introducida en Japón para el tratamiento del cáncer gástrico temprano y posteriormente fue adoptada por Norteamérica y Europa para el esófago de Barrett.2 En años posteriores se realizó el perfeccionamiento de la técnica: Takekoshi, en 1980, desarrolló un método con un endoscopio de doble canal que llamó polipectomía endoscópica con doble asa; Tada y colaboradores, en 1984, describieron la técnica de inyectar, elevar y cortar con asa de polipectomía; en 1992 Inoue incorporó el uso del capuchón (REMC) y Masuda la modificó en 1993 al incorporar el uso de ligas (REML).3
El esófago de Barrett (EB) es una condición esofágica adquirida como complicación de la enfermedad por reflujo gastroesofágico (ERGE) que secaracteriza por la presencia de metaplasia columnar, la que desplaza al epitelio escamoso estratificado normal.4 Desde el punto de vista histológicola Sociedad Británica de Gastroenterología considera cualquier tipo de metaplasia columnar (fúndica, cardial o intestinal); el resto de las sociedades solo la metaplasia intestinal. En cuanto a la extensión de la metaplasia los criterios difieren, algunos sociedades consideran mayor o igual a 1cm y otros no lo tienen en cuenta; en consecuencia surgen los términos de Barrett corto, largo y ultracorto.5
La verdadera prevalencia de EB es difícil de estimar porque muchos de los pacientes son asintomáticos, por lo que requieren de evaluación endoscópica y de confirmación histológica. Las tasas disponibles varían ampliamente, entre el 2% y el 7%, y son mayores en países occidentales con respecto a Asia; Suiza muestra una prevalencia de 1,6%. En los Estados Unidos se estima que 3,3 millones de personas viven con EB, para una prevalencia del 5,6%. En Suramérica se registran cifras de 3,5% en pacientes con síntomas de RGE. Japón exhibe tasas de prevalencia de 0,9 a 1,2%. La relación hombre mujer es de aproximadamente 2:1.6
Su incidencia entre los pacientescon ERGE a los que se les practica endoscopia y biopsia oscila entre el 6 y el 12%; sin embargo, solo del 20 al 25% de los pacientes con EB son diagnosticados.7 Se ha debatido si ha existido un aumento de su incidencia o si es secundario a una mayor conciencia de los peligros de la progresión de la enfermedad y de un mayor uso de la endoscopia para evaluar pacientes con síntomas de reflujo.
Los que padecen EB tienen un riesgo elevado de desarrollar ACE.8 La edad mayor de 65 años, la obesidad central, el tabaquismo y la longitud del EB favorecen la progresión a la displasia y al ACE,9 pero el único factor predictor de desarrollo de ACE es la presencia de displasia, razón por la que su presencia obliga a su vigilancia o su erradicación.
El riesgo de progresión al cáncer en pacientes sin displasia asociada es de 0,2 a 0,5% por año. En los pacientes con displasia de bajo grado (DBG) el riesgo anual es de aproximadamente 0,7% por año y en la de alto grado (DAG) es del 7% anual.10
En el diagnóstico y la evaluación del EB se prefiere el uso de endoscopios con luz blanca que muestran una sensibilidad del 80 al 90%, que mejora cuando se asocia a cromo endoscopia (CE) -ácido acético, azul de metileno o índigo carmín- con magnificación o virtual, como la imagen de banda estrecha (NBI); siempre debe considerarse la variabilidad inter observador.9
El EB presenta un sub registro debido a que la ERGE, su principal factor de riesgo, muchas veces cursa asintomática, además de que una vez que se tiene la sospecha endoscópica no se usan los métodos tintoriales para dirigir la biopsia hacia las posibles zonas de displasia, lo que prevendría su progresión al ACE, enfermedad con aumento de su incidencia en los últimos años.
El objetivo principal de la terapia endoscópica erradicadora (EET, por sus siglas en inglés) es eliminar la metaplasia intestinal (MI) y erradicar la displasia.
En el EB son candidatos a EET los pacientes con:
DAG, si no tienen comorbilidades limitantes para tratamiento
ACE confinado a la mucosa
DBG en situaciones especiales (úlcera, erosión, placa, nódulo, estenosis u otra irregularidad luminal).9
En ACE solo los casos intramucosos (T1m N0 M0) pueden considerarse para tratamiento endoscópico; esto con base en el bajo riesgo (del 1 al 2%) de metástasis a ganglios linfáticos porque cuando involucra la submucosa el riesgo de afección linfática incrementa considerablemente (del 10 al 20%).
En casos de DBG confirmada y sin comorbilidades limitantes la terapia endoscópica es el tratamiento de elección, aunque puede considerarse la vigilancia endoscópica anual. Si durante la vigilancia se encuentran alteraciones mucosas asociadas al desarrollo de ACE (úlcera, erosión, placa, nódulo, estenosis u otra irregularidad luminal) deberá realizarse, como maniobra diagnóstica y terapéutica, preferentemente la REM.11
La terapia endoscópica para el esófago de Barrett se divide en diferentes métodos:
Métodos térmicos: coagulación con argón plasma (APC o hybrid-APC), electrocoagulación multipolar (MPEC), láser terapia (LT), crioterapia (CRx) y radiofrecuencia (RFA)
Métodos químicos: terapia fotodinámica(PFD)
Métodos mecánicos: REM o (mucosectomía) y disección submucosa endoscópica (DES).
Los métodos térmicos y químicos se incluyen en las denominadas técnicas ablativas que no logran recuperar el tejido, los mecánicos logran recuperar muestra para estudio histológico y se les denomina técnicas de resección endoscópica; cuando se combinan estas técnicas suele manejarse el término de terapia híbrida.
Las técnicas aprobadas en la actualidad como primera línea de tratamiento endoscópico del EB son: REM, cuando se observa alguna lesión visible por sutil que sea (nódulos, úlceras o placas) y ablación por RFA para el resto del tejido metaplásico o con displasia sin lesión visible. Otras alternativas con gran efectividad incluyen la crioterapia (CTx) y el APC con su variante de hybrid-APC (logra crear un colchón en la mucosa mediante la inyección de un chorro de solución salina), la PFD ha disminuido su uso por las altas tasas de estenosis.9
La REM es una alternativa terapéutica fácil y poco difundida en el medio a pesar de que sus requerimientos técnicos son sencillos.
La siguiente revisión bibliográfica tiene como objetivo mostrar diferentes aspectos relacionados con la REM, mejorar el conocimiento de los especialistas e intencionar su aplicación en los pacientes con EB con DBG, DAG y en ACE intramucoso.
MÉTODOS
Se realizó una búsqueda bibliográfica a través de PubMed y Google Académico, en inglés y español. Se consultaron, fundamentalmente, revistas científicas de los últimos años contenidas en la base de datos Medline, otras de similar calidad pero que no son parte de Medline y algunas tesis.
RESULTADOS Y DISCUSIÓN
Las terapias endoscópicas están asociadas a bajas mortalidad y morbilidad, pero deben ser aplicadas cuando el endoscopista tiene un adecuado entrenamiento en las técnicas de resección endoscópica, experiencia en el reconocimiento de cambios sutiles en la mucosa y habilidad en alguno de los métodos de tinción.
La REM es una técnica para remover las irregularidades de la mucosa en el EB, elevar el diagnóstico y también favorecer la terapia. El principio básico es elevar la lesión mediante inyección subepitelial de fluidos o el uso de bandas. El falso pólipo creado es removido mediante un asa de polipectomía. La REM puede ser considerada curativa en la DBG, en la DAG y el ACE intramucoso. Expertos recomiendan su uso en lesiones de menos de 20mm.12 Los límites de extensión lateral de la lesión no están bien establecidos, aunque cuando esta compromete las 2/3 o las 3/4 partes de la circunferencia esofágica la posibilidad de estenosis debe tenerse en cuenta, aunque no es una contraindicación absoluta. Es preferida sobre cualquier técnica ablativa o el tratamiento quirúrgico.1 Es la forma más segura de diagnóstico de displasia o enfermedad invasiva temprana en el EB. Su realización debe ser bajo sedación o anestesia general.
La REM incluye los siguientes pasos:13
Identificación de la lesión, incluida su extensión, con la ayuda de la cromoendoscopia
Marcaje endoscópico de los bordes de la lesión
Resección de toda la lesión visible con amplio margen
Identificación y tratamiento de algún área con alguna actividad o riesgo de sangrado
Biopsia del Barrett residual para asegurarse de la presencia de alguna lesión.
Modalidades de la técnica:
Técnica por denudación (stripbiopsy) con endoscopio de doble canal: el área marcada se eleva al inyectar en la submucosa la solución previamente preparada, por el segundo canal se introduce un asa de polipectomía, la que se abre alrededor del área elevada, se cierra y, finalmente, se realiza el corte.
Técnica por denudación (stripbiopsy) con endoscopio estándar: el área se marca, luego se levanta con inyección en la submucosa de una solución fisiológica y, posteriormente, se reseca mediante el cierre de un asa de polipectomía directamente sobre la lesión elevada, al igual que en la técnica de la polipectomía.
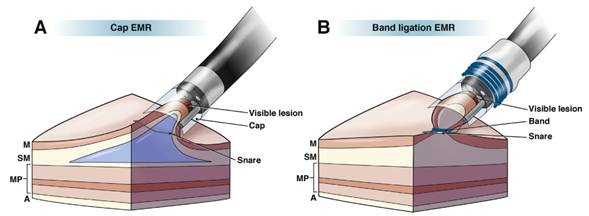
Técnica asistida por el capuchón (cap-assisted): se coloca en el borde distal del endoscopio un cap o capuchón transparente. Se eleva la zona a resecar por inyección submucosa y el asa es pre-abierta en el borde distal del capuchón. La mucosa levantada se aborda con el endoscopio, se succiona dentro del capuchón, se cierra el asa pre-abierta quedando la mucosa dentro del capuchón y, posteriormente, se realiza el corte.
Técnica de ligadura y corte: un capuchón se inserta en el extremo distal del endoscopio, que contiene una o más bandas de goma. La lesión es succionada en el interior del capuchón y la mucosa es capturada por la liberación de una banda de goma. Este pseudopólipo es resecado con un asa de diatermia por debajo de la liga.
Técnica de resección en piecemeal o fragmentada: permite la resección fragmentada de lesiones tumorales con un diámetro mayor de 2cm. Las resecciones fragmentadas son técnicamente más exigentes, consumen mucho tiempo, tienen riego mayor de complicaciones y se asocian con una mayor tasa de recurrencia local. Además, las resecciones fragmentadas van en contra de los principios básicos de la Oncología porque en la evaluación histológica de la radicalidad de la resección no es confiable.
Técnica del paso a paso (SRER, por sus siglas en inglés): es una técnica en la que se elimina el segmento completo de EB en sesiones de REM consecutivas. La recuperación de todo el segmento de EB para la evaluación histológica es ideal porque puede permitir la derivación de la intervención quirúrgica para lesiones avanzadas y conocer el éxito de la técnica y el número de sesiones necesarios.
Las principales técnicas usadas en el EB asociado a displasia:13
Técnica asistida por capuchón (Figura 1 A) y técnica de ligadura y corte (Figura 1 B). Ambas técnicas han demostrado igual eficacia y seguridad, aunque la de ligadura y corte es la preferida por muchos. La REM puede ser usada también en algunos casos que presenten pequeñas áreas residuales después de la terapia ablativa.
Técnica asistida por capuchón:
El capuchón se adhiere al endoscopio de visión frontal. Existen dos tipos: uno oblicuo, con un diámetro externo de 16,5mm para remover muestras de 20-25mm, y otro de 13,5mm de diámetro, con el que se pueden remover lesiones residuales
Con la punta del asa se marcan 2mm por fuera de la superficie de la lesión, se usa la fuente electroquirúrgica, que favorece su reconocimiento después de la distorsión sufrida por la inyección submucosa
Para la inyección de la submucosa se utiliza una solución de azul de metileno, epinefrina (1: 10,000) y solución salina, también se puede utilizar hidroxipropilmetilcelulosa, solución más viscosa que se reabsorbe más lentamente. La cantidad a inyectar es variable, debe ser de forma oblicua para lograr que la lesión se levante correctamente, si esto no se produce (non-lifting sign) indica que la submucosa está comprometida, por lo que debe considerarse la suspensión del procedimiento
Para acomodar el asa de polipectomía en el borde del capuchón se succiona una mucosa sana adyacente para sellar la salida del capuchón, después se introduce por el canal de trabajo el asa semi abierta para lograr que se amolde a todo el borde de este
Se procede a succionar la mucosa seleccionada y se cierra la cesta alrededor de la lesión para formar un pseudopólipo. Si se dispusiera de endoscopio de doble canal se puede introducir una pinza para traccionar la mucosa y acomodarla dentro del capuchón
El corte se realiza con la coagulación de la fuente electroquirúrgica. Las muestras se pueden remover secuencialmente o “guardarlas” en el estómago y retirarlas todas juntas al final del procedimiento
Si es necesario una resección adicional debe repetirse la inyección de solución salina por el riesgo de que la capa muscular se haya involucrado durante el procedimiento, además de que la solución salina tiende a desaparecer en minutos
Al terminar la resección se debe inspeccionar el área para excluir alguna mucosa residual, vasos visibles, exposición de la muscular o si existe perforación.
Técnica de ligadura y corte:
Como en la técnica anterior se marca la lesión entre 2 y 5mm por fuera, lo que puede ser de gran ayuda si se compromete la visibilidad por algún sangrado
Se retira el endoscopio y se monta el dispositivo para ligar. Debe asegurarse que las guías de este dispositivo se mantengan en línea con el canal de trabajo para que no interfieran en la visibilidad. Se procede entonces a reintroducir el endoscopio
Se succiona el área marcada dentro del capuchón y se libera la liga formando el pseudopólipo. La inyección de la submucosa no es necesaria porque la fortaleza de las ligas no es lo suficientemente fuerte para involucrar la muscular propia
El asa se coloca por debajo de la liga y se realiza el corte con coagulación proporcionada por la fuente electroquirúrgica
Si es necesaria una nueva resección se repiten los pasos 3 y 4. Se realizan comenzando en la región distal hacia la proximal o dirigidas a la zona de sospecha. La superposición de un 10% a un 25% entre las resecciones adyacentes asegura que no queden puentes residuales. Las muestras se pueden remover secuencialmente o “guardarlas” en el estómago y retirarlas todas juntas al final del procedimiento
Al terminar la resección se debe inspeccionar el área para excluir alguna mucosa residual, vasos visibles que requieran hemostasia, exposición de la muscular o si existe perforación.14
Estudios han mostrado que la REM permite una mayor congruencia entre los Especialistas en Anatomía Patológica para el diagnóstico histológico de la displasia que el obtenido mediante la biopsia convencional y permite cambios en los resultados finales de la histología en un 49% de los pacientes.15,16
Las biopsias de la lesión realizadas recientemente pueden dejar un cierto grado de inflamación que produce adherencia a planos profundos, lo que puede no tener relación con la provocada por la lesión actual. En estos casos deben esperarse de dos a tres semanas para poder hacer el procedimiento. La cicatriz producida por las terapias ablativas anteriores puede producir fibrosis, que impide la elevación de la mucosa.
Durante el análisis histológico de la muestra obtenida por esta técnica es necesario tener en cuenta algunos aspectos:17
El capuchón pudiera producir daño en la superficie de la muestra resecada, lo que influiría en los resultados histológicos
En muchos pacientes se produce un duplicado de la muscularismucosae producto del daño mantenido debido al reflujo. Se debe tener cuidado para evitar que esta duplicación se interprete como una extensión en profundidad, lo que se confunde con la muscular propia, particularmente si la lámina propia subyacente a estas capas simulan la submucosa. Esto influye en el estadiamiento y, por consiguiente, en la conducta
El asa de diatermia causa contracción de la muscularismucosae, tracciona los bordes de la muestra hacia el área de succión, da la impresión de que los márgenes laterales están más profundos y falsea el resultado.
Una vez terminado los pacientes deben ser tratados con altas dosis de inhibidores de bomba de protones para favorecer la sanación de la úlcera residual.
La aplicación de la REM depende de una correcta identificación de los cambios displásicos. Los endoscopios de luz blanca con alta definición, la cromoendoscopia virtual (NBI) y la cromoendoscopia con endoscopio de luz blanca (WLE) ayudada por colorantes vitales intentan alcanzar este propósito.
Como un recurso disponible en el medio se destaca la NBI, un avance tecnológico de la Olympus que filtra la luz blanca a un ancho de onda de 415 a 540nm que se proyecta sobre la mucosa de color azul y verde que facilita el realce del patrón vascular, las criptas y la superficie mucosa. Tiene una sensibilidad del 47% al 100% y una especificidad del 72% al 100% para la detección de neoplasia en el Barrett.18
El azul de metileno es un colorante vital que tiene la propiedad de ser absorbido por las zonas de metaplasia intestinal, las diferencias del tejido normal y deja las zonas de displasia de color más pálido.
El uso de ácido acético ha tenido un renovado interés en los últimos años. Es un ácido débil que produce blanqueado de la mucosa en cuestiones de segundo o minutos. Las áreas de displasia pierden este blanqueado antes que las no displásicas, por lo que los focos displásicos se resaltan como sitios rojos sobre el fondo blanco. Tholoor demuestra la efectividad de su empleo en su estudio.19
El protocolo de Seattle es el establecido para la vigilancia de los pacientes con EB. Incluye biopsia en los cuatro cuadrantes, cada uno o dos centímetros, con muestra aparte de la mucosa que revele nódulo o irregularidad, comenzando por los pliegues gástricos proximales hacia la parte más alta de la unión escamocolumnar. La adherencia de los endoscopistas a este protocolo es de un 50% y logra identificar la DAG y el ACE en solo el 40% de los pacientes a los que se les realiza endoscopia con WLE.20
Efectividad de la REM y las terapias híbridas en el tratamiento del EB
Las evidencias sobre la efectividad dela REM ha aumentado rápidamente en las últimas dos décadas. Antes del descubrimiento de la RFA fue usada sola o en unión de otras técnicas ablativas como la PFD.
Algunos estudios informan excelentes resultados en el tratamiento del Barrett circunferencial con metaplasia intestinal (CE-IM) con tasas de erradicación entre el 86% al 96% mediante la técnica (SRER).21
Una investigación realizada a 64 pacientes que padecían EB con carcinoma intramucoso a los que se les practicó REM mostró un 97% de remisión, pero tasas de recurrencia de 14%.22 Pech, en estudios de 1000 casos con similares condiciones clínicas, demostró tasas de remisión del 93,8% con 14,5% de recurrencia.23 Anders demuestra tasas de erradicación del 90% para la DAG.24 La REM, como tratamiento único, aumenta en un 30% el riesgo de aparición de lesiones sincrónicas y metacrónicas en el tejido metaplásico adyacente, de ahí que surgen las terapias híbridas.25
La RFA es de las técnicas ablativas más usadas en la actualidad, su combinación con la REM logra la erradicación de la displasia en un 86 y hasta un 94% y la completa erradicación de la MI en un 88 y hasta un 90%.20,26,27 En un metanálisis realizado por expertos de la Clínica Mayo de Rochester se evaluó la recurrencia de MI, displasia o cáncer después de utilizar esta terapia híbrida, se detectaron un 11%, un 7% y un 3% por persona-año durante el primero, el segundo y el tercer año de seguimiento, respectivamente.28
La APC es la única técnica ablativa disponible en solo algunos centros de atención terciaria del país. Esta técnica utiliza el gas argón para trasmitir corriente monopolar sobre los tejidos. Es frecuentemente utilizada como terapia híbrida junto a la REM por ser fácil y barata. Pech y colaboradores, en su estudio, obtuvieron una remisión del 98,7% en esta modalidad terapéutica. Durante un seguimiento promedio por 4,1 años hubo una recurrencia del 6,6%.29 El hybrid-APC se puede utilizar como complemento junto a esta para la ablación completa del epitelio residual sospechoso en las DAG.30
Complicaciones
Las complicaciones de la REM incluyen sangrado, perforación y estenosis. El sangrado puede ocurrir en un 10% de los pacientes; por lo general son inmediatos al procedimiento, los tardíos son raros. Pueden ser manejados mediante la cauterización con corriente bipolar con auxilio del asa de polipectomía, las pinzas hemostáticas, el hemoclip, los polvos hemostáticos, la angiografía o la intervención quirúrgica en caso extremo.31
La perforación es informada en un 3 y hasta un 7% en centros de alto volumen de casos. Puede ser tratada endoscópicamente con el uso de clip estándar, de stents esofágicos y de clips montados sobre el endoscopioo mediante sutura y acompañado de antibióticos y suspensión de la vía oral. La estenosis es la complicación más comunicada, depende de la circunferencia y la magnitud de la mucosa removida por la REM y puede aparecer en el 17% y hasta en el 88% y manejarse mediante dilataciones esofágicas.14,23,32,33
En la serie informada por Tomizawa de 684 con EB a los que se les practicó REM, el sangramiento y las estenosis fueron comunicadas en el 1,2% y el 1%, respectivamente.34
Con la técnica SRER las estenosis fueron mayores (del 27% al 37%);35 la perforación se observó entre el 0,2% y el 1,3%.33
Cuidados después de la EET con REM
Una vez terminado los pacientes deben ser tratados con altas dosis de inhibidores de bomba de protones para favorecer la sanación de la úlcera residual al menos por dos días, analgésicos del tipo de paracetamol solo o en combinación con un opioide del tipo de la codeína cada cuatro horas según sea necesario, con antiácidos del tipo del óxido de magnesio o el carbonato de calcio que ayudan a disminuir el reflujo y los síntomas después del procedimiento y debe recomendarse dieta blanda en los dos y hasta cuatro días siguientes al procedimiento y estar atentos a síntomas como dolor torácico o abdominal, fiebre, disnea, disfagia o hematemesis.
Se debe valorar por consulta dos semanas posteriores al procedimiento y realizar esofagogastroduodenoscopía (EGD) entre las cuatro y las ocho semanas posteriores y,en dependencia de lo observado, se planifica nuevo tratamiento o nueva toma de muestra.36