INTRODUCCIÓN
La enfermedad renal crónica (ERC) es un importante problema de salud a nivel global y tiene altas tasas de prevalencia e incidencia y de morbilidad y mortalidad según la Organización Mundial de la Salud.1
En Cuba el comportamiento es equivalente a lo que se asiste en el mundo actual en virtud de las terapias sustitutivas o de reemplazo de la función renal, las que son más efectivas con repercusión sustancial sobre la mejoría de la calidad de vida de los individuos expuestos; sin embargo, la tendencia hacia la geriatrización y la primacía de la comorbilidad cardiovascular suponen que el riesgo de complicaciones graves y mortales descanse sobre las mismas. Esta situación influye de manera puntual sobre el equilibrio, la economía familiar y los costes en sistemas de salud.2,3,4,5,6
Desde estadios iniciales de la enfermedad el riñón experimenta una merma, de manera progresiva e inexorable, de la capacidad para depurar sustancias tóxicas que contribuyen a la producción de especies reactivas del oxígeno (ERO) y el nitrógeno que actúan sobre los lípidos, los carbohidratos, las proteínas y los nucleótidos, lo que gradualmente desencadena un desequilibrio a favor de sustancias pro-oxidantes y, en consecuencia, el deterioro de sistemas claves en el mantenimiento de la homeostasis celular.
La alteración tisular provocada por el desbalance oxidativo está implícita en varios estados patológicos que incluyen enfermedades cardiovasculares, infecciosas, cáncer, diabetes y trastornos neurodegenerativos, las que exhiben mayor incidencia en la uremia. Esto podría deberse a múltiples factores que incluyen un aumento de la producción de especies reactivas generadas por los leucocitos activados, metales de transición y toxinas de diferente peso molecular.
La uremia per se podría ser una condición asociada al incremento del estrés oxidativo (EO) o a condiciones patológicas capaces de inducir acumulación de especies oxidantes. La producción excesiva de ERO induce daño al tejido, el que resulta en acumulación de aldehídos reactivos, peroxidación lipídica, incremento de la oxidación de tioles en el plasma y daño al ADN.7,8
El trasplante renal (TR) se considera el tratamiento de elección en pacientes con enfermedad renal avanzada porque mejora la supervivencia a largo plazo comparado con el mantenimiento en diálisis. Los receptores de TR llevan consigo, aunque atenuados, los efectos deletéreos de la uremia y de las terapias sustitutivas temporarias y de la medicación inmunosupresora (anticalcineurínicos) vinculados a las secuelas y al accionar sobredimensionado del EO y, con ello, a una acelerada ateroesclerosis a un tiempo prudencial del trasplante.9,10
Se ha descrito que la recuperación de la función del injerto posterior al TR se sustenta en el mejoramiento de biomarcadores de inflamación y EO. Esta mejoría puede ser explicada por la restauración del aclaramiento de toxinas urémicas, la regresión de la hipertrofia ventricular izquierda y un adecuado estado nutricional.11
Por tales razones el objetivo del presente artículo consiste en comparar antioxidantes endógenos, específicamente las enzimas superóxido dismutasa (SOD) y catalasa (CAT) y las concentraciones de glutatión reducido (GSH), con variables hematológicas, hemoquímicas e inmunosupresores en pacientes con TR funcionante.
MÉTODOS
Se realizó una investigación analítica transversal, con diseño de casos y controles, en el Laboratorio de Química sanguínea de la Unidad de Investigaciones Biomédicas (UNIB), ubicado en la Universidad de Ciencias Médicas de Villa Clara, con la colaboración del Servicio de Nefrología del Hospital Provincial Clínico Quirúrgico Universitario “Arnaldo Milián Castro”, ambos de la Ciudad de Santa Clara, Provincia de Villa Clara, en el período comprendido entre abril de 2018 y mayo de 2019.
Se estudiaron un total de 127 individuos que conformaron por dos grupos: el primero comprendió a 54 pacientes con TR funcionante y el segundo a 73 personas supuestamente sanas tomadas como grupo control.
Criterios de inclusión y de exclusión
Ambos grupos incluyeron individuos con edades comprendidas entre 20 y 65 años, de ambos sexos, con más de un año del trasplante, que no presentaran ninguna enfermedad infecciosa o invalidante al momento del estudio y que dieran su consentimiento para participar. Se excluyeron pacientes que no cumplieran el rango de edad, las cifras de creatinina sérica ˂221μmol/l y los con procesos infecciosos al momento del estudio.
Por cada individuo seleccionado se tomaron dos alícuotas de suero, una para el estudio hematológico y hemoquímico efectuado en el Laboratorio Clínico del Hospital y otra para estudios de EO, que fueron transportadas al Laboratorio de Química sanguínea de la UNIB de forma refrigerada según los protocolos establecidos.
Las concentraciones de hemoglobina (Hb) se determinaron por espectrofotometría, mediante el método colorimétrico de cianometa-hemoglobina, usando como reactivo el Hemotest. Se consideraron patológicos (anemia) los niveles de Hb por debajo de 110g/l. La creatinina y el ácido úrico se determinaron por métodos colorimétricos enzimáticos y la albúmina mediante el método colorimétrico del reactivo verde bromocresol, medidos en autoanalizador Hitachi, según las especificidades descritas en los protocolos HELFA. Se consideraron patológicos niveles de creatinina mayores de 114µmol/l, de ácido úrico mayores de 422µmol/l y albúmina menor de 38g/l.
La actividad enzimática Cu-Zn SOD extracelular se realizó mediante el método cinético descrito por Marklund (1990) y la actividad enzimática de CAT por el método de Aebi (1984). Se determinaron, además, las proteínas totales por el método de Lowry (1951) para referir las actividades enzimáticas específicas (UAE/mg de proteínas). El GSH fue determinado mediante su reacción con el reactivo Ellman (Sedlak, 1968) y su concentración se expresó en µM. Las tres técnicas se basaron en métodos espectrofotométricos, los reactivos empleados fueron suministrados por las firmas Merck y HELFA y las comparaciones se realizaron entre casos y controles.
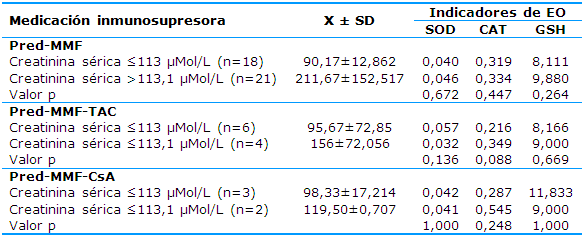
Los medicamentos supresores que se tuvieron en cuenta para la asociación con los niveles de creatinina y, por ende, de la función del aloinjerto fueron prednisona-micofenolato mofetilo® (Pred-MMF), prednisona-micofenolato mofetilo®-tacrolimus® (Pred-MMF-TAC) y prednisona-micofenolato mofetilo®-ciclosporina A® (Pred-MMF-CsA).
Para la recogida de la información se revisaron las historias clínicas de los pacientes. Los resultados de los complementarios de laboratorio clínico y de EO se almacenaron en una base de datos creada en Excel para este fin y fueron exportados previamente al programa estadístico SPSS versión 22. Se determinaron estadígrafos descriptivos (tendencia central y dispersión) en las variables estudiadas. Se analizó la normalidad de los datos en cada grupo mediante la prueba de Komogorov-Smirnov con corrección de Lilliefors y se comprobó que no seguían una distribución gaussiana, de manera que el análisis de comparación entre grupos (trasplantados-sanos) se realizó mediante la prueba no paramétrica U de Mann-Whitney según los rangos medios de cada variable. Se realizaron comparaciones entre subgrupos de pacientes trasplantados según variables hemoquímicas y uso de medicamentos inmunosupresores. En todos los casos se tuvo en cuenta la significación estadística al 95% (p<0,05).
El estudio se acogió a los aspectos éticos descritos en la Declaración de Helsinki,12 basados en las investigaciones biomédicas en humanos, y fue aprobado por el Comité de Ética del centro. El equipo de trabajo explicó los objetivos concretos del estudio a los individuos incluidos, que emitieron su autorización por escrito; se respetaron el principio de autonomía y la confidencialidad de los resultados.
RESULTADOS
La edad promedio de los pacientes trasplantados (54) fue de 44 años, 20 del sexo femenino y 34 del masculino. A pesar del gran mestizaje de la población, y bajo el criterio de observación, el 72% de los individuos eran de raza blanca y el 28% de la no blanca. Presentaban un tiempo promedio de trasplante de 4,68 años. La edad promedio del grupo control (73) fue de 48 años, 46 del sexo femenino y 27 del masculino. La muestra comprendió un 83% de individuos de raza blanca y un 17% de la no blanca.
Las etiologías de la nefropatía originaria de mayor prevalencia en los casos estudiados fueron la nefropatía vascular hipertensiva (37%), la causa no filiada (18%) y la enfermedad glomerular primaria (13%).
Las manifestaciones clínicas más frecuentes fueron la anemia (31%), la hipertensión arterial (20%), las infecciones del tracto urinario recurrentes (11%) y la diabetes postrasplante (9%); el resto de los pacientes (29%) no presentó comorbilidades.
Los estadísticos descriptivos y los resultados de las comparaciones de los antioxidantes endógenos en pacientes trasplantados con respecto al control se muestran en la Tabla 1.
Se observó una disminución significativa de la actividad de las enzimas SOD y CAT, así como de las concentraciones de GSH al comparar ambos grupos.
Tabla 1 Antioxidantes endógenos en pacientes trasplantados con respecto al control
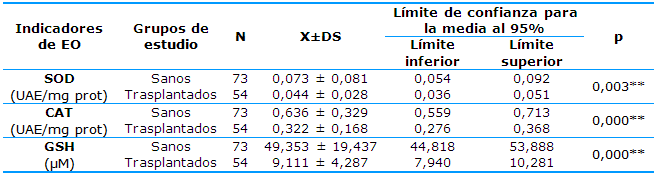
**significación estadística al 99% (p<0,01)
Fuente: datos del Laboratorio de Química sanguínea de la UNIB
El análisis comparativo de los indicadores de EO con las variables hemoquímicas en el grupo trasplantado aparece en la Tabla 2. El 33% de los pacientes presentó niveles de Hb por debajo de 109g/l, el 50% niveles de creatinina por encima de 113,1µmol/l, el 54% niveles de ácido úrico superiores a 422,1µmol/l y solo el 4% evidenció niveles de albúmina por debajo de 38g/l.
A pesar de observarse una diferencia significativa (p=0,049) en la actividad de SOD con respecto a los niveles de albúmina en el grupo de pacientes trasplantados, no resulta suficiente el tamaño del subgrupo con niveles de albúmina por debajo de 38g/l (dos) para llegar a conclusiones. Las demás comparaciones no mostraron diferencias significativas (p>0,05).
Tabla 2 Antioxidantes endógenos y variables hematológicas y hemoquímicas en pacientes con TR
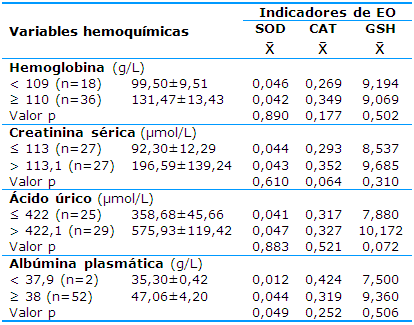
Fuente: Expedientes clínicos, datos de laboratorio
En cuanto a los resultados de la comparación entre los indicadores de EO y los niveles de creatinina según el tratamiento inmunosupresor se evidencia que no existen diferencias significativas al aplicar una u otra combinación de inmunosupresores (Tabla 3).
DISCUSIÓN
Se ha evidenciado que el EO juega un rol esencial en la patogénesis de la inflamación sistémica, la hipertensión, las enfermedades cardiovasculares, el síndrome metabólico y otras complicaciones en receptores de trasplante, lo que incrementa el riesgo de morbilidad y mortalidad. Esto ha sido corroborado en estudios experimentales en animales, en ensayos clínicos controlados y en estudios poblacionales.10,11
En el primer año postrasplante ocurren múltiples eventos inmunológicos e infecciosos como el rechazo agudo, el retardo en la función del injerto, la infección por citomegalovirus, etcétera que, por lo general, desestabilizan al paciente. Debido a esto interesó incluir pacientes con un tiempo de trasplante superior a un año, con el objetivo de analizar indicadores oxidativos dentro de un período de estabilidad.
La generación de ERO después del trasplante se debe, generalmente, a los procesos oxidativos que ocurren en la ERC en estadio 5, la isquemia-reperfusión (I/R) y las drogas inmunosupresoras.13,14
Durante la hipooxigenación en el proceso de isquemia se produce un aumento de hipoxantina que, por la acción de las xantin oxidasa, forma aniones superóxido. Además se acumula ácido araquidónico que propicia la síntesis de endoperóxidos y la liberación de RL (radicales libres). Los RL producidos, entre otros, por neutrófilos y macrófagos, pueden ser liberados tras la exposición a los agentes quimiotácticos, inmunocomplejos o ante la fagocitosis, etcétera. Por otra parte, durante la reperfusión los RL, como el radical hidroxilo, los peroxinitritos y el ácido hipocloroso, se generan desde vías diferentes. El anión superóxido formado por la NADPH oxidasa o la xantin oxidasa es rápidamente transformado a H2O2 por la superóxido dimutasa la que, en presencia del hierro (Fe2+) o del cobre (Cu+), se transforma en un radical hidroxilo. La conversión final de peróxido de hidrógeno al radical hidroxilo requiere de Fe++ que, en circunstancias normales, son continuamente producidos por las células del túbulo. Otras fuentes de RL durante la isquemia/reperfusión son las mitocondrias dañadas, los neutrófilos activados y la producción de peroxinitritos.15,16
La disminución de los niveles de enzimas SOD y CAT en los pacientes trasplantados evidencia un desbalance del sistema de defensa antioxidante, lo que podría traer consigo una eliminación deficiente de ERO y propiciar la interacción del anión superóxido (O2 -) y el óxido nítrico (ON) para formar peroxinitrito (OONO-.). Los peroxinitritos son oxidantes muy potentes capaces de modificar las proteínas, los lípidos y los ácidos nucleicos. La unión del ON al anión superóxido parece ser el responsable de la disminución en la vasorrelajación provocada por el NO después de la I/R.17,18
Por su parte el GSH, que también disminuyó significativamente, es considerado un tiol intracelular barredor de O2 - que protege a los lípidos de membranas y a los grupos tioles proteicos de la peroxidación. Este antioxidante no enzimático tiene el papel principal en la restitución de otros antioxidantes como la vitamina E y el ácido ascórbico a su estado reducido. Su decremento podría deberse a su consumo durante el estado de estrés que induce la enfermedad.19,20
En un estudio realizado por Vostálová y colaboradores21 se evaluaron marcadores relacionados al EO, la función renal y los parámetros metabólicos durante tres meses en pacientes antes y después del TR. Los productos avanzados de oxidación de proteínas, la capacidad antioxidante total y las sustancias reactivas al ácido tiobarbitúrico fueron significativamente disminuidos, mientras que los niveles de GSH aumentaron después del trasplante. La actividad de las enzimas antioxidantes no mostraron cambios significativos durante el período de monitoreo. Estos resultados difieren de los de esta investigación porque se contastó una disminución significativa de SOD, CAT y GSH, aunque en un tiempo diferente de evaluación.
El mismo equipo de investigación21 refirió que la normalización del metabolismo lipídico podría estar asociado con la mejoría de la función renal y la reducción de complicaciones cardiovasculares. Se comprobó que los marcadores de función renal y la filtración glomerular mejoraron sus niveles, mientras que la creatinina disminuyó después del injerto, resultados que también se corroboraron en este trabajo.
Otro aspecto importante en el paciente trasplantado son los protocolos clínicos que incluyen el uso de inmunosupresores, que tienen como objetivo proteger el injerto de la respuesta inmunológica generada por parte del huésped; no obstante su probada eficacia, también se consideran generadores de ERO debido a la toxicidad de las drogas.22
La elección de cual inhibidor de calcineurina (tracolimus o CsA) se debe utilizar deberá estar basada en el perfil de eventos adversos de cada uno de estos dos fármacos y en los riesgos individuales de cada paciente; de esta forma la hipertensión, la hiperlipidemia y el riesgo de rechazo agudo serían un buen argumento a favor del tracolimus, mientras que un riesgo elevado para desarrollo de diabetes (carga genética, obesidad, edad avanzada) irían a favor del empleo de CsA.22,23,24
Estos resultados reflejan que ninguna combinación de inmunosupresores influye en los indicadores de EO. Esto concuerda con Vostálová,25 que estudió a 70 pacientes trasplantados que fueron divididos en dos grupos: unos recibieron CsA y otros recibieron tracolimus; no se encontraron diferencias significativas entre estos dos inhibidores de calcineurina en ninguno de los parámetros de EO medidos. Refirió además que la mejoría de la función renal después del trasplante está relacionada a la reducción en los marcadores de EO, pero independiente de la terapia inmunosupresiva.
CONCLUSIONES
Aunque se observó disminución de antioxidantes endógenos en pacientes con trasplante renal funcional, no se evidenció relación entre estos y las variables hemoquímicas e inmunosupresoras. Se requieren estudios individualizados de la capacidad antioxidante total e indicadores de daño oxidativo a biomoléculas en este grupo de estudio. De igual modo conocer los efectos tóxicos o beneficiosos del medicamento inmunosupresor en el paciente con TR posibilitaría nuevas perspectivas terapéuticas dirigidas a enfrentar la sobrecarga de ERO mediante una pauta antioxidante equilibrada que enlentecería la progresión de la aterosclerosis y, por tanto, las afecciones cardiovasculares.