Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Cirugía
versión On-line ISSN 1561-2945
Rev Cubana Cir v.44 n.2-3 Ciudad de la Habana abr.-sep. 2005
Instituto Nacional de Oncología y Radiobiología
Tumor de Pancoast: tratamiento con intención curativa. Resultados en 36 pacientes (informe preliminar)
Dr. Gilberto Fleites González,1 Dr. José Luis Guerra Mesa,2 Dr. Juan Carlos Collado Otero,3 Dr. Fernando Areces Delgado,4 Dra. Sofía Alsina Sarmiento5 y Dr. Jorge Juan Marinello Guerrero6
RESUMEN
El cáncer de pulmón en forma de tumor de Pancoast afecta a unos 200 cubanos anualmente y es todavía considerado incurable por muchos en Cuba. En el Instituto Nacional de Oncología y Radiobiología se realizó un estudio prospectivo de introducción tecnológica, que consistió en radio-quimioterapia preoperatoria y cirugía ampliada, aplicadas a pacientes con cáncer de pulmón en forma de tumor de Pancoast en etapa potencialmente curable. Entre enero de 1991 y marzo de 2004 se incluyeron 36 pacientes (28 hombres, 8 mujeres, con edad promedio de 51,6 años, mínima de 34 y máxima de 69). Los tipos celulares fueron: adenocarcinoma (21), epidermoide (12), carcinoma de células grandes (2), carcinoma indiferenciado (1). Hubo 28 casos en etapas IIB, 4 en etapa IIIA y 4 en etapa IIIB. Ocurrieron 3 muertes quirúrgicas no relacionadas con la técnica operatoria. La supervivencia a los 3 y 5 años fue de 57 % y 38 %, respectivamente. El tratamiento combinado de radio-quimioterapia y cirugía ampliada logra el control loco-regional y la supervivencia prolongada en muchos pacientes con tumor de Pancoast en etapa localizada.
Palabras clave: Tumor de Pancoast, surco superior, cáncer de pulmón, tratamiento curativo.
En 1838 el cirujano británico Edward Selleck Hare publicó en la Gaceta Médica de Londres un artículo titulado «Tumor que afecta ciertos nervios».1 En 1924, más de 80 años después, Henry Pancoast, radiólogo de Filadelfia, publicó el artículo Importancia de la investigación cuidadosa con rayos roentgen de los tumores torácicos apicales, donde describe 3 casos de «tumores del vértice torácico», que producían un conjunto de síntomas específicos (dolor del miembro superior, parálisis simpática y destrucción ósea) y eran difíciles de diagnosticar mediante radiografías convencionales.2
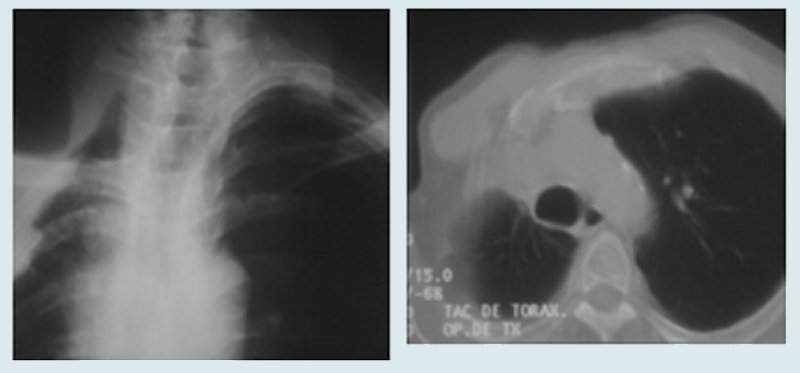
El tumor de Pancoast, también conocido como tumor del surco pulmonar superior, es una forma peculiar de presentación topográfica y biológica del cáncer de pulmón, con invasión predominantemente parietal y tardía diseminación regional o a distancia.3 Su expresión clínica es el síndrome de Pancoast: dolor en el hombro y la espalda, síndrome del plexo braquial (dolor, debilidad y atrofia de distribución cubital en el miembro superior), síndrome de Claude Bernard-Horner (miosis, enoftalmos, ptosis palpebral, anhidrosis). Radiológicamente se carácteriza por la presencia de una radiopacidad en el ápex pulmonar, que puede llegar a destruir las estructuras parietales a ese nivel (Fig. 1). La tomografía axial computadorizada (TAC) y, sobre todo la resonancia magnética nuclear (RM), son de gran valor para definir la invasión parietal. Es importante diferenciar entre un verdadero tumor de Pancoast y un tumor de vértice que secundariamente invade las estructuras parietales para producir un síndrome de Pancoast.
Figura 1. Radiografía simple y TAC de un paciente con tumor de Pancoast.
En 1950 Binkley logra el control sintomático exitoso mediante braquiterapia intersticial.4 En 1956 Chardack y MacCallum reportaron el primer superviviente por tiempo prolongado luego de cirugía y radioterapia.5 La técnica se desarrolla por Shaw y Paulson, quienes en 1961 realizan su publicación definitoria del esquema de tratamiento estándar (radioterapia neoadyuvante seguida de cirugía) y sus detalles técnicos.6 En los últimos diez años se ha establecido la radio-quimioterapia preoperatoria —y no la radioterapia sola— como el método de elección, lo que mejora la tasa de resecciones completas, reduce las recaídas locales y aumenta la supervivencia.7
El cáncer de pulmón es la principal causa de muerte por cáncer en Cuba, tanto para hombres como para mujeres.8 El tumor de Pancoast representa sólo el 5 % del total de casos con carcinoma pulmonar,9 pero si tenemos en cuenta que cada año se detectan unos 4 000 casos nuevos en nuestro país, aproximadamente 200 corresponderán a esta forma de presentación. Cerca de la mitad de ellos podrían ser curados cada año, si se aplicara el tratamiento óptimo.
En 1991 se estableció en nuestro centro el primer protocolo sistematizado de tratamiento con intención curativa de enfermos con tumor de Pancoast, con los objetivos de garantizar el mejor tratamiento disponible a nivel internacional y de evaluar sus resultados en nuestro medio, en particular en cuanto a complicaciones y supervivencia.
MÉTODOS
Se hace un estudio prospectivo de introducción de tecnología, con los pacientes diagnosticados en el Instituto Nacional de Oncología y Radiobiología (INOR) como portadores de un tumor de Pancoast, que cumplieran con los criterios de inclusión para un protocolo de tratamiento con intención curativa en relación con la operabilidad, resecabilidad y curabilidad, en particular para los casos en etapas IIB, IIIA y algunos IIIB.10-12
El criterio diagnóstico de tumor de Pancoast requirió que la extensión de la afección parenquimatosa se limitara al segmento apical o ápico-posterior y que estuviera presente al menos uno de los elementos del síndrome de Pancoast.13
Se analizan 36 pacientes, operados entre el 1.ro de enero de 1991 y el 31 de marzo de 2004. Se aplicó un tratamiento neoadyuvante con radio-quimioterapia y entre las 4 a 8 semanas luego de finalizado se realizó la operación.
La técnica de radioterapia neoadyuvante consistió en 50 Gy de teleterapia, en fraccionamiento de 2 Gy diarios, 5 veces por semana, durante 5 semanas. La radioterapia estuvo dirigida al tumor y a todo el lóbulo pulmonar, la pared costal adyacente, el mediastino superior homolateral y a la fosa supraclavicular homolateral. Para la quimioterapia se utilizó un régimen basado en platino, en aplicaciones semanales o en ciclos cada 21 días, de forma concurrente con la radioterapia. El análisis de la supervivencia global se realizó según el método de Kaplan-Meier.
La operación consistió en una técnica de cirugía ampliada, que incluye:
- Resección pulmonar, generalmente lobectomía superior.
- En bloque con la porción de pared torácica afectada: arcos costales posteriores con su paquete vasculonervioso y músculos intercostales; apófisis transversas y lámina cortical homolateral de vértebras TI, TII y a veces TIII; tronco inferior del plexo braquial (C8 y T1) si estaba invadido o adherido al tumor; cadena simpática dorsal en la vecindad del vértice pulmonar, incluyendo el ganglio estrellado.
- Vaciamiento ganglionar mediastinal: grupo superior homolateral (ganglios 1, 2, 3, 4), más grupos 5 y 6 (en tumores del hemitórax izquierdo).
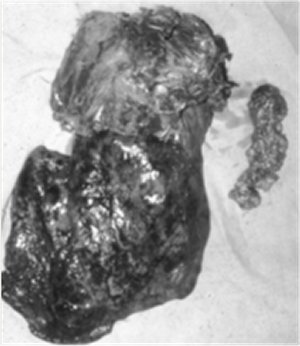
Figura 2. Pieza quirúrgica: lóbulos superior y medio, casquete parietal y vaciamiento ganglionar mediastinal. En algunos casos utilizamos radioterapia o quimioterapia postoperatorias, cuando había dudas con los márgenes oncológicos o cuando se confirmó toma ganglionar mediastinal.
RESULTADOS
Desde enero de 1991 hasta marzo de 2004, se realizó el tratamiento con intención curativa en 36 pacientes con tumor de Pancoast en el INOR. La edad promedio fue de 51,6 años (mínima 34, máxima 69) y hubo 28 hombres y 8 mujeres.
Los síntomas más frecuentes fueron: dolor local (100 %), síndrome del plexo braquial (41 %), síndrome de Horner (13 %), pérdida de peso (10 %). Muchos pacientes presentaban síntomas típicos por más de 3 meses antes de que se hiciera el diagnóstico.
La distribución de tipos celulares fue: adenocarcinoma, 21 pacientes (58,3 %); epidermoide, 12 pacientes (33,3 %); carcinoma de células grandes, 2 pacientes (5,6 %); carcinoma indiferenciado sin precisar, 1 paciente (2,8 %).
La mayoría de los casos (28 pacientes; 77,8 %) se encontraba en etapa IIB (T3 N0 M0) (Tabla 1). Tuvimos 4 casos clasificados como T4 por invasión de la cortical de cuerpos vertebrales. Las metástasis ganglionares fueron poco frecuentes: 1 caso con N1 y 3 casos con N2 por encontrarse aislados ganglios mediastinales superiores homolaterales positivos. Todos los pacientes fueron operados mediante toracotomía posterolateral convencional.
Tabla 1. Estadificación anatomopatológica posquirúrgica o pTNM (pathologicalTumor-Node-Metastasis)
| Etapa | N.o pacientes |
| Etapa pII B: T3 N0 M0 | 28 |
| Etapa pIII A: T3 N1 M0 T3 N2 M0 | 1 3 |
| Etapa pIII B: T4 N0 M0 | 4 |
El tipo de resección pulmonar fue: lobectomía superior (27), bilobectomía superior y media (5), segmentectomía apical (2), neumonectomía (2). Las segmentectomías se realizaron en pacientes con pobre función respiratoria. Las bilobectomías y la neumonectomía se realizaron por dificultades anatómicas encontradas durante la disección cisural o pedicular.
La resección de estructuras parietales vecinas al vértice pulmonar se muestra en la Tabla 2 y corresponde a la modificación de la técnica quirúrgica según el grado de invasión local del tumor en cada caso.
Tabla 2. Estructuras parietales resecadas
| Estructura anatómica | N.o pacientes |
| Costillas (arco posterior) | 0 costilla: 5 1 costilla: 2 2 costillas: 8 3 costillas: 16 4 costillas: 5 |
| Vértebras (porción de cortical) | 2 vértebras: 10 3 vértebras: 13 |
| Ramo inferior de plexo braquial | 4 |
La morbilidad por radioterapia y quimioterapia fue baja. Tuvimos 5 casos con dermatitis radiógena y síndromes eméticos asociados a la quimioterapia. La morbilidad quirúrgica fue baja y consistió fundamentalmente en sepsis de la herida en 3 casos, derrame pleural persistente en 2, neumotórax en 1, arritmia cardíaca en 1 y dolor torácico prolongado en 2. El defecto parietal posterior resultante, claramente visible en los estudios imaginológicos (Fig. 3), tiene muy poca repercusión estética o funcional.
Figura 3. Radiografía simple y TAC luego de la resección por tumor de Pancoast.
Ocurrieron 3 muertes quirúrgicas (8,3 %), que se debieron a un proceso neumónico-atelectásico (1 caso) y a un infarto miocárdico (2 casos).
La supervivencia a los 3 años y 5 años fue del 57 % y 38 % respectivamente, según el método de Kaplan-Meier (excluyendo las tres muertes quirúrgicas), aunque todavía debemos esperar varios años para poder dar cifras definitivas de supervivencia en esta serie.
Sólo ocurrió una recaída local, y 13 casos fallecieron por metástasis a distancia: 2 en pulmón contralateral, 5 en cerebro, 1 en cerebro e hígado, 1 en hígado y huesos, 4 en glándulas suprarrenales. Los pacientes con evolución desfavorable fueron aquellos con invasión de cuerpos vertebrales (T4), adenopatías mediastinales (N2) o presencia de síndrome de Claude-Bernard-Horner, pese a que estas condiciones no impidieron una resección quirúrgica con margen oncológico.
DISCUSIÓN
Muchos de los pacientes estudiados presentaron síntomas típicos por más de 3 meses antes de que se hiciera el diagnóstico. Esta demora puede ser fatal y se debe a la frecuente ausencia de síntomas respiratorios, con predominio de síntomas extrapulmonares, atribuidos a afecciones ortopédicas o neurológicas benignas.14,15
Mientras que en publicaciones de los años 70 y 80 del pasado siglo se reportaba una frecuencia del carcinoma epidermoide similar o superior a la del adenocarcinoma, desde comienzos de los años 90, las dos terceras partes de los casos de tumores de Pancoast correspondieron a adenocarcinomas, lo que se corresponde con la marcada prevalencia del adenocarcinoma como tipo celular más frecuente en el cáncer pulmonar en general, tendencia que se observaba ya desde finales de los años 70 del citado siglo.16
En nuestra serie, las metástasis de ganglios regionales fueron poco frecuentes, lo cual coincide con el reporte de la aparición bastante tardía, en los tumores de Pancoast, de metástasis a ganglios regionales.17
Operamos todos los casos por toracotomía posterolateral convencional, según la técnica originalmente establecida por Shaw y Paulson.6,18 Otra posibilidad es el abordaje anterior, de mayor valor en tumores ápico-anteriores, en particular con invasión de vasos subclavios. Entre las técnicas por vía anterior se destaca la de Dartevelle, consistente en la operación por vía combinada cervical y torácica, que incluye la exéresis de la mitad medial de la clavícula, con un acceso anterior a los vasos cérvico-torácicos, el plexo braquial, el nervio frénico y la cara anterior de los cuerpos vertebrales vecinos.19 Otras técnicas de acceso anterior son la de Masaoka20 y la vía transmanubrio esternal de Grunenwald y Spaggiari.21 Estos métodos son más mutiladores y requieren además una incisión de toracotomía convencional para completar la lobectomía, por lo que en nuestra opinión la reservaríamos sólo para cosos en que se anticipen dificultades con el paquete vásculo-nervioso subclavio, que por otra parte en general no consideramos con las características necesarias para un tratamiento con intención curativa. También crecen los adeptos a operar por una incisión de hemi-valva (hemi-clamshell), en que a partir del extremo anterior de una incisión de toracotomía anterolateral se prolonga la incisión verticalmente por esternotomía media, lo cual proporciona un excelente acceso a toda la parte alta de la cavidad torácica, al mediastino y al paquete vásculo-nervioso subclavio.22,23
En los centros de alto nivel científico en países desarrollados se reporta morbilidad postoperatoria,24 lo cual concuerda con los resultados de nuestra serie.
El análisis de la literatura demuestra que la mortalidad quirúrgica se ha ido reduciendo a lo largo de los años, a medida que se gana en experiencia y mejoran los cuidados intensivos. Mientras Anderson señala el 21 % de mortalidad quirúrgica entre los años 50 y 80,25 Hilaris reportó en 1987 sólo el 0,8 % de mortalidad (1 fallecido entre 129 pacientes operados).26 Sin embargo, la mayoría de los autores muestran resultados más modestos, generalmente por debajo del 10 % de mortalidad quirúrgica.27,28 En los pacientes fallecidos de nuestra serie no se encontraron defectos en la técnica quirúrgica (hemorragia, dehiscencia de sutura), por lo que consideramos que los resultados pudieran mejorar con el refinamiento de los cuidados postoperatorios.
Nuestros resultados en cuanto a supervivencia son halagüeños y coinciden con los reportes internacionales.29-31
Los factores de mal pronóstico señalados en la literatura son: no realización de la radioterapia y quimioterapia preoperatorias, mala respuesta a estas, presencia de T4 por invasión de cuerpos vertebrales, presencia de N2 o N3, borde de sección quirúrgica positivo.32,33 El tipo celular también puede influir en la supervivencia, pues en los adenocarcinomas hay mayor riesgo de aparición de metástasis cerebrales que en los carcinomas epidermoides.34 En cuanto a la estadificación, lógicamente el mejor pronóstico será para la etapa IIB (un tumor de Pancoast por definición no puede nunca clasificarse en etapas I o IIA).
La supervivencia tiene una relación directa con la calidad del tratamiento y la respuesta del paciente a este. Los pacientes de mejor pronóstico son aquellos con una buena respuesta a la radio-quimioterapia neoadyuvante y una resección quirúrgica oncológicamente completa. Okubo informa una supervivencia media a los 5 años del 38,5 % para el total de pacientes tratados por radioterapia y cirugía y enfatiza la importancia de lograr un margen oncológico adecuado durante la operación: cuando subdivide a sus pacientes en aquellos con operación completa («curativa») o incompleta, la supervivencia a los 5 años es del 56 % y 0 % respectivamente.35 Alifano y colaboradores lograron una supervivencia global a los 5 años de 36,2 %, que llegó a 44,9 % en el grupo de casos en que se había logrado una resección completa.36 Martínez-Monge y colaboradores encuentran una supervivencia global a los 4 años de 56 %, que se elevó a 87 % para el grupo en que se consiguió respuesta completa preoperatoria por el tratamiento de radio y quimioterapia.37 Hilaris considera que el paciente con el pronóstico ideal es aquel en etapa IIB o IIIA, con ganglios mediastinales negativos, con buena respuesta a la radioterapia preoperatoria y mientras la supervivencia global en su serie es del 25 %, en el grupo con buena respuesta a la radioterapia fue de 50 %. Cuando los ganglios mediastinales eran negativos, la supervivencia fue de 90 %.26
Los buenos resultados actuales en supervivencia se deben a:
- La aplicación sistemática de radio-quimioterapia neoadyuvante, que mejora la resecabilidad y la tasa de resecciones completas, reduce las recaídas locales y mejora la supervivencia.38
- Una mejor técnica quirúrgica que permite resecciones complejas, en particular de lesiones que afectan vasos subclavios, plexo braquial o columna vertebral.39
Conclusiones
La combinación de radio-quimioterapia y cirugía es el tratamiento de elección para los pacientes con cáncer de pulmón en forma de tumor de Pancoast en etapas IIB, IIIA y algunos IIIB.
Los resultados del tratamiento son satisfactorios: baja morbilidad, aceptable mortalidad, buena supervivencia, aunque para llegar a conclusiones propias debemos esperar por la inclusión y seguimiento prolongado de un mayor número de casos.
REFERENCIAS BIBLIOGRÁFICAS
1. Hare ES. Tumor involving certain nerves. London Medical Gazzette. 1838; 1:16-8.
2. Pancoast HK. Importance of careful roentgen-ray investigations of apical chest tumors. JAMA. 1924; 83:1407-11.
3. Ginsberg RJ, Payne DG, Shamji F. Superior sulcus tumors. En: Aisner J, Arriagada R, Green MR, Martini N, Perry MC (eds). Comprehensive Textbook of Thoracic Oncology. Baltimore: Williams & Wilkins; 1996. pp. 375-87.
4. Binckley JS. Role of surgery and intersticial radon therapy in cancer of the superior sulcus of the lung. Acta Un Int Cancer. 1950; 6:1200-03.
5. Chardac WM, MacCallum JD. Pancoast tumor: five-year survival without recurrence or metastases following radical resection and postoperative irradiation. J Thorac Surg. 1956; 31:535-42.
6. Shaw RR, Paulson DL, Kee JL Jr. Treatment of the superior sulcus tumor by irradiation followed by resection. Ann Surg. 1961;154:29–40.
7. Miyoshi S, Iuchi K, Nakamura K, Nakagawa K, Maeda H, Ohno K, et al. Induction concurrent chemoradiation therapy for invading apical non-small cell lung cancer. Jpn J Thorac Cardiovasc Surg. 2004; 52:120-6.
8. Registro Nacional de Cáncer. Instituto Nacional de Oncología y Radiobiología, Ciudad de La Habana, 2004.
9. Ginsberg RJ, Martini N, Zaman M, Armstrong JG, Bains MS, Burt ME, et al. Influence of surgical resection and brachytherapy in the management of superior sulcus tumor. Ann Thorac Surg. 1994; 57:1440-5.
10. Remmen HJ, Lacquet LK, Van Son JA, Marshies WJ, Cox AL: Surgical treatment of Pancoast tumors. J Cardiovasc Surg (Torino). 1993; 34:157-61.
11. Dartevelle P, Macchiarini P. Surgical management of superior sulcus tumors. Oncologist. 1999; 4:398-407.
12. York JE, Walsh GA, Loug FF, Putman JB, McCutcheon IE, Swissher SG, et al. Combined chest wall resection with vertebrectomy and spinal reconstruction for the treatment of Pancoast tumors. J Neurosurg. 1999; 91(Suppl): 74-80.
13. Muscolino G, Valente M, Andreani S. Pancoast tumours: clinical assessment and long term results of combined radiosurgical treatment. Thorax. 1997; 52:284–6.
14. Bonaventura I, Mir I, Marcos JA, Bashes R, Rami R, Martinez L, et al. Pancoast Syndrome: difficulties in its diagnosis. Rev Clin Resp. 1993; 193:435-7.
15. Bisbinas I, Langkamer VG. Pitfalls and delay in the diagnosis of Pancoast tumour presenting in orthopaedic units. Ann R Coll Surg Engl. 1999; 81:291-5.
16. Vincent RG, Pickren JW, Lane WW, Bross I, Takita H, Houten L, et al. The changing histopathology of lung cancer: a review of 1682 cases. Cancer. 1977; 39:1647-55.
17. Naruke T. Resultados del cáncer de pulmón resecado en base a la nueva clasificación TNM de la UICC. 5ta edición. [en japonés] Gan To Kagaku Ryoho. 1997; 24:2289-95.
18. Paulson DL. Carcinomas in the superior pulmonary sulcus. J Thorac Cardiovasc Surg. 1975; 70:1095–104.
19. Dartevelle P, Levasseur P, Rojas-Miranda A, Merlier M, Le Brigand H. Exerese par voie combinee cervico-thoracique des tumeurs responsables de syndrome de Pancoast-Tobias. Nouv. Presse Med. 1981; 10:1051-4.
20. Masaoka A, Ito I, Yasumitsu T. Anterior approach for tumor of the superior sulcus. J Thorac Cardiovasc Surg. 1979; 78: 413–5.
21. Grunenwald D, Spaggiari L. Transmanubrial osteomuscular sparing approach for apical chest tumors. Ann Thorac Surg. 1997; 63:563-6.
22. Bains MS, Ginsberg RJ, Jones WG, McCormack PM, Rusch VW, et al. The clamshell incision: an improved approach to bilateral pulmonary and mediastinal tumor. Ann Thorac Surg. 1994; 58:30-2.
23. Korst R.J., Burt M.E. Cervicothoracic tumors: results of resection by the "hemi-clamshell" approach. J Thorac Cardiovasc Surg. 1998;115:286-95.
24. Gandhi S, Walsh GL, Komaki R, Gokaslan ZL, Nesbitt JC, Putnam JB Jr, et al. A multidisciplinary surgical approach to superior sulcus tumors with vertebral invasion. Ann Thorac Surg. 1999; 68:1778-84.
25. Anderson TM, Moy PM, Holmes EC: Factors affecting survival in superior sulcus tumors. J Clin Oncol. 1986; 4:1598-603.
26. Hilaris BS, Martini N, Wong GY, Nori D. Treatment of superior sulcus tumor (Pancoast tumor). Surg Clin N Amer. 1987; 67:965-77.
27. Rusch VW, Parekh KR, Leon L, Venkatraman E, Bains MS, Downey RJ, et al. Factors determining outcome after surgical resection of T3 and T4 lung cancers of the superior sulcus. J Thorac Cardiovasc Surg. 2000; 119:1147-53.
28. Alifano M, D'Aiuto M, Magdeleinat P, Poupardin E, Chafik A, Strano S, et al. Surgical treatment of superior sulcus tumors: results and prognostic factors. Chest. 2003; 124:996-1003.
29. Paulson DL. Carcinomas in the superior pulmonary sulcus. J Thorac Cardiovasc Surg. 1985; 70:1095-104.
30. Muscolino G, Valente M, Andreani S: Pancoast tumours: clinical assessment and long-term results of combined radiosurgical treatment. Thorax. 1997; 52:284-6.
31. Sartori F, Rea F, Calabrï F, Mazzucco C, Bortolotti L, Tomio L. Carcinoma of the superior pulmonary sulcus: results of irradiation and radical resection. J Thorac Cardiovasc Surg. 1992; 104:679–83.
32. Stanford W, Berns RP, Tucker AR: Influence of staging in superior sulcus (Pancoast) tumors of the lung. Ann Thorac Surg. 1980; 29:406-9.
33. Inoue K, Sagawa M, Sato M, Ono S, Matsumura T, Sakurada A, et al. Pronóstico de pacientes T3 con cáncer de pulmón no células pequeñas resecado de acuerdo a los órganos invadidos. [en japonés] Kyobu Geka 1998; 51:907-10.
34. Komaki R, Roth JA, Walsh GL, Putnam JB, Vaporciyan A, Lee JS, et al. Outcome predictors for 143 patients with superior sulcus tumors treated by multidisciplinary approach at the University of Texas M. D. Anderson Cancer Center. Int J Radiat Oncol Biol Phys. 2000; 48:347-54.
35. Okubo K, Wada H, Fukuse T, Yokomise H, Inui K, Ike O, et al. Treatment of Pancoast tumors. Combined irradiation and radical resection. Thorac Cardiovasc Surg. 1995; 43:284-6.
36. Alifano M, D'Aiuto M, Magdeleinat P, Poupardin E, Chafik A, Strano S, et al. Surgical treatment of superior sulcus tumors: results and prognostic factors. Chest. 2003; 124:996-1003.
37. Martínez-Monge R, Herreros J, Aristu JJ. Combined treatment in superior sulcus tumors. Am J Clin Oncol. 1994; 17:317-22.
38. Detterbeck FC. Changes in the treatment of Pancoast tumors. Ann Thorac Surg. 2003; 75:1990-7.
39. Shahian DM. Contemporary management of superior pulmonary sulcus (Pancoast) lung tumors. Curr Opin Pulm Med. 2003; 9:327-31.
Recibido: 3 de marzo de 2005. Aprobado: 26 de junio de 2005.
Dr. Gilberto Fleites González. Calle 29 y E, Municipio Plaza de la Revolución. Ciudad de La Habana.
Correo electrónico: gfleites@infomed.sld.cu.
1 Especialista de I Grado en Cirugía General. Investigador Auxiliar.
2 Especialista de I Grado en Cirugía General. Investigador Auxiliar.
3 Especialista de II Grado en Cirugía General. Investigador Auxiliar.
4Especialista de II Grado en Oncología. Investigador Auxiliar.
5 Especialista de II Grado en Oncología. Investigador Auxiliar.
6Especialista de II Grado en Oncología. Investigador Auxiliar.