Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Cirugía
versión On-line ISSN 1561-2945
Rev Cubana Cir v.49 n.2 Ciudad de la Habana abr.-jun. 2010
Secuestro pulmonar
Pulmonary sequestration
José Antonio Hernández Varea,I Ada Hilda de la Concepción de la Peña,II Ernesto Hernández Hernández,III Iris Soberón Varela,IV Rosaura Matilde Pérez Fernández,V Julia Romero FernándezVI
IEspecialista de II Grado en Cirugía. Profesor Auxiliar. Hospital Clinicoquirúrgico Docente «Joaquín Albarrán». La Habana, Cuba.
IIEspecialista de II Grado en Cirugía. Instructor. Hospital Clinicoquirúrgico Docente «Joaquín «Joaquín Albarrán». La Habana, Cuba.
IIIEspecialista de I Grado en Cirugía. Hospital Clinicoquirúrgico Docente «Joaquín Albarrán». La Habana, Cuba.
IVEspecialista de II Grado en Cirugía. Instructor. Hospital Clinicoquirúrgico Docente «Joaquín Albarrán». La Habana, Cuba.
VEspecialista de I Grado en Imaginología. Instructor. Hospital Clinicoquirúrgico Docente «Joaquín Albarrán». La Habana, Cuba.
VIEspecialista de I Grado en Neumología. Hospital Clinicoquirúrgico Docente «Joaquín Albarrán». La Habana, Cuba.
RESUMEN
El secuestro pulmonar es una afección congénita que consiste en la presencia de una masa quística de tejido pulmonar afuncional que puede carecer de una obvia comunicación con el árbol traqueobronquial y recibe toda o la mayor parte de su irrigación sanguínea de vasos anómalos provenientes de la circulación sistémica. Teniendo en cuenta que la presentación de esta afección resulta rara comparada con otras afecciones pulmonares (entre 1 y 2 % de todas las resecciones pulmonares) y que además lo más frecuente resulta su tratamiento definitivo antes de la edad adulta, se presenta el caso de un hombre de 44 años que acudió a consulta por presentar episodios frecuentes de neumonías desde hacía más de 10 años, que fueron diagnosticados como «bronquiectasias». Se discuten los hechos más significativos del origen embriológico de esta afección, características anatomopatológicas, clasificación, diagnóstico imaginológico, detalles del tratamiento quirúrgico y evolución posoperatoria.
Palabras clave: Secuestro pulmonar, malformaciones pulmonares.
ABSTRACT
Pulmonary sequestration is a congenital affection consisting in the presence of a cystic mass of no-functional pulmonary tissue without an obvious communication with tracheobronchial tree and that receives all or most of its bloodstream of the anomalous vessels from systemic circulation. Taking into account that presentation of this affection is rare compared to other pulmonary affections (between the 1% and the 2% of all pulmonary resections) and that also the more usual is its definitive treatment before adulthood. The case of man aged 44 is presented coming to consultation due to frequent episodes of pneumonias from more 10 years ago diagnosed as a bronchiectasis. The more significant facts of embryology origin of this affection including: anatomical and pathological features, imaging diagnosis, surgical treatment details, and postoperative course.
Key words: Pulmonary sequestration, pulmonary malformations.
INTRODUCCIÓN
El término secuestro fue introducido por Pryce en 1946 a partir de la palabra latina secuestrare que significa «que se distingue o diferencia de». El secuestro broncopulmonar es una masa quística de tejido pulmonar afuncional que carece de una obvia comunicación con el árbol traqueobronquial y recibe todo o la mayor parte del suministro sanguíneo de un vaso sistémico anómalo.1
Existen dos formas de secuestro la intralobar y la extralobar. El secuestro intrabolar es más común en lactantes y niños, acumulando el 75 % de los casos de secuestro broncopulmonar y, como característica, comparte la misma pleura visceral con el pulmón normal y el secuestro extralobar acumula el 25 % de los casos en este mismo grupo de edades, tiene una pleura visceral independiente del pulmón normal puede ser tanto intratorácico como subdiafragmático en su localización.2, 3
El secuestro pulmonar se caracteriza por masas de parénquima pulmonar afuncional que no se comunican con el árbol traqueobronquial a través de un bronquio normalmente localizado3 y es, dentro de las anomalías pulmonares, de las más infrecuentes.
El brote del primordio pulmonar emerge de la superficie ventral del intestino anterior entre las 3 a 4 semanas de la gestación. Durante las siguientes 2 semanas, el intestino anterior primitivo completa su división en una tráquea ventral y el esófago dorsal.4,5
La teoría más ampliamente aceptada sobre la embriogénesis del secuestro pulmonar es la «accesoria» en que un brote pulmonar supernumerario emerge caudal al del pulmón normal y migra caudalmente con el esófago. Si el brote emerge antes del desarrollo de la pleura queda atrapado en el pulmón adyacente y se convierte en secuestro intralobar. Si este desarrollo ocurre después de la formación de la pleura el brote crecerá, de manera separada, quedará cubierto por su propia serosa, y se formará un secuestro extralobar.1
La teoría de tracción establece que el secuestro se origina por adherencias embriológicas o compresión mecánica y, por último, la teoría vascular responsabiliza a la persistencia de vasos esplácnicos o insuficiente irrigación de los vasos pulmonares al lóbulo inferior que llevan a degeneración mística.6
La incompleta formación del septum que divide la tráquea del esófago puede resultar en diversos tipos de fístulas traqueoesofágicas. Por otra parte, las anormalidades del brote y el crecimiento ventral del intestino anterior, asumen una amplia variedad de formas anatómicas.7, 8
Estas malformaciones son: secuestro pulmonar, malformación quística adenomatoide congénita, enfisema lobar congénito y quiste broncógeno. La mezcla de estas anomalías simultáneamente parece reafirmar este origen común.9 Teniendo en cuenta lo poco frecuente de esta afección en el adulto10 se presenta este paciente operado en el centro repasando algunos elementos significativos en cuanto a origen, cuadro clínico diagnóstico y tratamiento.
PRESENTACIÓN DEL CASO
Paciente del sexo masculino, mestizo de 44 años de edad, trabajador de la construcción con historia de padecer de procesos infecciosos respiratorios a repetición. Desde 1991 le diagnosticaron bronquitis y además bronquiectasias en la base pulmonar izquierda, ingresó el 18 de junio de 2007 por tos productiva que aumentaba con los cambios de posición con expectoración abundante, dolor infraescapular del lado izquierdo, disnea ocasional, refiere astenia y pérdida de peso de aproximadamente 15 libras y fiebre de 38 a 39 ºC acompañada de escalofríos después de esfuerzos físicos. Dejó el hábito de fumar hace 10 años. Al examen físico no se encuentran alteraciones, salvo disminución del murmullo vesicular en la base pulmonar izquierda.
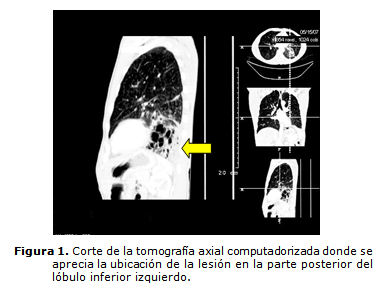
Los complementarios de laboratorio realizados mostraron: hematócrito 0,42, eritrosedimentación 49 mm, leucograma 11,2 por 109 (diferencial Poli 50, linfocitos 48, monocitos 0,01 y eosinófilos 0,01). En los estudios imaginológicos realizados radiografías de tórax (PA y lateral) y tomografía axial computadorizada se constata masa multicavitada de la base izquierda de 8,6 por 9,5 cm, en base izquierda con cavidades de diversos tamaños, algunos de ellos con niveles hidroaéreos (figuras 1 y 2).
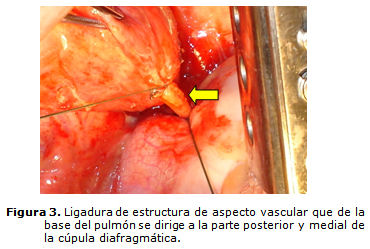
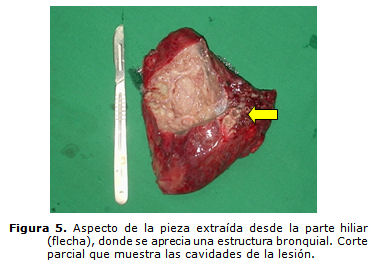
Las pruebas funcionales respiratorias estaban dentro de límites normales. Se operó el paciente el 3 de julio de 2007 en que se encontró en la base del lóbulo inferior pulmonar izquierdo, dentro de la misma pleura visceral, una masa de color grisáceo de 15 por 15 por 6 cm, con adherencias a la pleura parietal un vaso arterial de 3 mm una vez ligado y seccionado (por lo que se supone que in vivo haya sido más grueso) que provenía desde la porción medial y posterior del diafragma; se realizó lobectomía inferior izquierda con el empleo de un suturador mecánico UKB 60. El estudio anatomopatológico informó parénquima en panal de abejas, bronquio permeable y engrosamiento de la pleura (biopsia 1987) (figuras 3, 4 y 5).
DISCUSIÓN
Las malformaciones pulmonares tienen una incidencia del 2,2 % y son raras comparadas con las enfermedades pulmonares adquiridas9,11 además se diagnostican y tratan fundamentalmente en la infancia, por lo que es poco frecuente observarlas en adultos.
El secuestro pulmonar, en particular, acumula del 0,8 al 1,4 % de todas las resecciones pulmonares.1 No hay predisposición familiar y existe un ligero predominio del sexo masculino, que es más obvio en el secuestro extralobar que tiene una relación masculino-femenino de 3:1 frente a 1,5:1 en el intralobar en todos los grupos de edades.12,13
Tradicionalmente desde el trabajo original de Pryce6 se clasifica la afección en secuestro intralobar (SIL) y extralobar (SEL) atendiendo a si el tejido anómalo está envuelto en la misma pleura visceral del lóbulo pulmonar normal (SIL) o envuelto en un saco pleural aparte (SEL) basado en el drenaje venoso: pulmonar en caso de SIL y sistémico en el SEL.
Se describen tres tipos de anormalidades de acuerdo con la distribución de la arteria aberrante:
- Tipo 1: la arteria anómala irriga tejido funcional normal que comunica con el árbol traqueobronquial.
- Tipo 2: la arteria irriga, tanto tejido pulmonar normal, como afuncional que no se comunica con el sistema bronquial.
- Tipo 3: la arteria anómala suministra tejido pulmonar aislado del árbol traqueobronquial.
El origen de la arteria es aórtico en el 74 % de los casos (bien torácico como de la aorta abdominal) el 26 % restante recibe su suministro arterial de otros orígenes como son: subclavia, intercostal, pulmonar, pericardiofrénica, innominada, mamaria interna, celíaca, gástrica, esplénica, renal e incluso de la coronaria izquierda.3,14
La arteria típicamente entra al tejido por la vía del ligamento pulmonar si se origina por encima del diafragma, si el origen es por debajo de este, llegan al tejido secuestrado perforando el diafragma o a través de los hiatos esofágico o aórtico.
Por lo general la arteria es única aunque del 15 al 20 % están descritas múltiples arterias aberrantes. Se reporta habitualmente un calibre que varía de 1 a 15 mm. El secuestro intralobar está localizado en el segmento posterobasal del lóbulo inferior en el 98 % de los casos con predominio del lado izquierdo (66 %).15
La forma de presentación más frecuente de secuestro intralobar es las infecciones pulmonares a repetición con tos, fiebre, dolor torácico y hemoptisis y ocurre, fundamentalmente, antes de la tercera década de la vida.
El secuestro extralobar, raramente, produce síntomas y el diagnóstico se realiza con frecuencia sobre la base de una radiografía de tórax eventual. Más del 50 % de los secuestros extralobares están asociados a otras malformaciones congénitas como son: hernia diafragmática, fístula traqueoesofágica, divertículo epifrénico, pectus excavatum y malformaciones cardíacas.
El diagnóstico, en ocasiones, se realiza durante la reparación de una hernia diafragmática.1 A veces este se hace solo debido a complicaciones, como disfagia, vómitos o hematemesis en los casos donde existe conexión con el esófago.16
Estas presentaciones clínicas son raras así en un estudio en Francia de 61 casos entre 1955 y 1989 existió un 57 % con sepsis respiratorias a repetición, en el 25 % el diagnóstico fue por una radiografía de tórax incidental. Solo el 8 % se quejaba de dolor torácico, el 5 % de disnea y el 3 % de hemoptisis.17
Se señala, de capital importancia, el estudio arteriográfico preoperatorio para evitar el riesgo de lesionar la arteria con el riesgo de que esta se retraiga por debajo del diafragma.
De hecho la mortalidad operatoria en los años 40 del siglo XX, se asocia al desconocimiento de este hecho.18,19 Sin embargo, se piensa que otros medios diagnósticos de imágenes pueden ser utilidad y, razonablemente, pueden sustituir el estudio arteriográfico, como señala Silverman;14 se dispone de nuevas técnicas no invasivas para determinar la irrigación arterial como son la resonancia magnética, el ultrasonido en modalidad Doppler y la tomografía axial computadorizada20-22 que, en este caso resultó muy útil. Sin embargo, hay que señalar que estas modalidades no invasivas pueden detectar grandes vasos anómalos (que por demás es la presentación más frecuente) los vasos pequeños pueden no ser identificados, por lo que se considera ventajoso insistir en el valor de realizar una cuidadosa disección, que puede resultar difícil por la fibrosis resultante de procesos inflamatorios repetidos que la forma de presentación clínica más frecuente y antes de seccionar, preparar pedículos largos que faciliten la ligadura por trasfixión como es clásico desde Jonson y Kirby (Jonson J, Kirby CK. Surgery of the chest. A handbook of operative surgery. The year book publishers. Chicago; 1952).
Con respecto al tratamiento de los pacientes diagnosticados el consenso es realizar la exéresis quirúrgica una vez controlada la infección, en el secuestro extralobar, con frecuencia, se puede realizar la secuestrectomía y en el secuestro intralobar, como es el caso de este paciente, se realiza la lobectomía, ya que las infecciones repetidas hacen desaparecer los planos de clivaje que permitirían una segmentectomía.
Como se señaló, la parte crítica de la intervención es la identificación y control de la arteria nutricia. En el caso de un secuestro asintomático deben sopesarse los riesgos operatorios contra las posibles complicaciones de la afección. Cuando exista descompensación cardíaca (insuficiencia cardíaca congestiva) por shunt arteriovenoso, la arteria aberrante debe ser ligada u ocluida con sustancias trombogénicas bajo guía radiológica o ultrasonográfica.8
En síntesis, aunque más frecuentes en la infancia el secuestro pulmonar puede presentarse a cualquier edad. La forma de presentación clínica más frecuente es la neumonía a repetición en el secuestro intralobar. La tomografía computadorizada fue de gran valor diagnóstico en este paciente.
Este paciente presentó un secuestro intralobar con drenaje venoso pulmonar con arteria aberrante tipo 2 de origen aórtico infradiafragmático. Es importante la disección cuidadosa y la preparación de pedículos vasculares largos que permitan evitar accidentes potencialmente catastróficos.
REFERENCIAS BIBLIOGRÁFICAS
1. Carter R. Pulmonary sequestration. Ann Thor Surg 1959;7:68.
2. Collin P, Desjardins JG, Khan AH. Pulmonary sequestration. J Pediatr Surg. 1987;22:7503.
3. Savic B, Birtel FJ, Tholen W, Funke I-ID, Knoche H. Lung sequestration: report of seven cases and review of 540 published cases. Thorax 1979; 34:96-01.
4. Rodgers BM, Harman K, Johnson AM. Bronchopulmonary foregut malformations. The spectrum of anomalies. Ann Surg. 1986;203(5):517-24.
5. Heithoff KB, Sane SM, Williams HJ, et al. Bronchopulmonary foregut malformations: a unifying etiological concept. Embryology. 1976;126:46-55.
6. Pryce DM. Lower accessory pulmonary artery with intralobar sequestration of lung: a report of seven cases. J Pathol Bacteriol. 1946;58:457-67.
7. Thilenius OG, Ruschhaupt DG, Replogle RL, et al. Spectrum of pulmonary sequestration: association with anomalous pulmonary venous drainage in infants. Pediatr Cardiol. 1983;4:97-103.
8. Sade RM, Clouse M, Ellis FH Jr. The spectrum of pulmonary sequestration. Ann Thorac Surg. 1974; 18:644-658.
9. Evrard V. Congenital lung malformations. World J Surg. 1999;23:1123-32.
10. Leal Mursulí A, Adefna Pérez RI, Ramos Díaz N, Castellanos González JA, Arocha Rodríguez R, Rubio Pampin MM. Secuestro pulmonar intralobar: Reporte de un caso y revisión de la literatura [Serie en Internet] Rev Cubana Cir. 2002;41(4). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-74932002000400009&lng=es&nrm=iso&tlng=es
11. Vogt-Moykoft, I, Rau, B, Branscheid D. Surgery for congenital malformations of the lung. Ann Chir. Ann Chir. 1992;46:141-50.
12. Felker RE, Tonkin ILD. Imaging of pulmonary sequestration. AJR Am J Roentgenol 1990;154:241-9.
13. Sauerbrei E. Lung sequestration: duplex Doppler diagnosis at 12 weeks' gestation. J Ultrasound Med 1992;10:101-5.
14. Silverman ME, White CS, Ziskind A. Pulmonary Sequestration Receiving Arterial Supply From the Left Circumflex Coronary Artery. Chest. 1994;106:948-9.
15. Rubin EM, Garcia H, Horowitz MD, Guerra JJ. Fatal massive hemoptysis secondary to lntralobar sequestration. Chest. 1994;106:954-5.
16. Van Remdonck D, Deneffe G, Verschakelen J. Longsequestratie. Tijdschr. Geneesk.1992;48:91.
17. Sauvenet A, Regnard JF, Calanducci F, Rojas-Miranda A, Dartevelle P, Levasseur P. Les séquestrations pulmonaires: aspects chirurgicaux à propos de 61 observations. Rev Pneumol Clin. 1991:47:126.
18. Harris A, Lewis I. Anomalies of the lungs with special reference to the danger of abnormal vessels in lobectomy. J Thorac Surg. 1940;9:666-71.
19. Kennev U, Eyler WR. Preoperative diagnosis of sequestration of the lung by aortographv. JAMA. 1956;160:1464-5.
20. Ikezoe J, Murayama S., Godwin JD, Done SL, Versehakelen JA. Bronchopulmonary sequestration: CT assessment. Radiology. 1990; 176:375-9.
21. Oliphant L, McFadden RG, Carr TJ, Mackenzie DA. Magnetic resonance imaging to diagnose intralobar pulmonary sequestration. Chest. 1987; 91:500-2.
22. Yuan A, Yang PC, Chang DB, Yu CJ, Kuo SH, Luh KT. Lung sequestration: diagnosis with ultrasound and triplex Doppler technique in an adult. Chest. 1992;102:1880-2.
Recibido: 29 de enero de 2009.
Aprobado: 16 de abril de 2009.
José Antonio Hernández Varea. Hospital Clinicoquirúrgico Docente «Joaquín Albarrán». Avenida 26 e Independencia, Puentes Grandes. Playa. La Habana, Cuba.
Correo electrónico: jose.varea@infomed.sld.cu