Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Cirugía
versión impresa ISSN 0034-7493
Rev Cubana Cir vol.50 no.3 Ciudad de la Habana jul.-set. 2011
ARTÍCULOS DE REVISIÓN
Factores pronósticos relacionados con el cáncer gástrico
Prognostic factors related to gastric cancer
Zenén Rodríguez Fernández,I Luís Piña Prieto,II Ernesto Manzano Horta,III Carmen María Cisneros Domínguez,II Wendy Liseth Ramón FernándezIV
IMáster de Informática en Salud. Especialista de II Grado en Cirugía General. Investigador Agregado. Profesor Auxiliar. Hospital Provincial Docente "Saturnino Lora". Santiago de Cuba, Cuba.
IIMáster en Urgencias Médicas. Especialista de II Grado en Cirugía General. Profesor Auxiliar. Hospital Provincial Docente "Saturnino Lora". Santiago de Cuba, Cuba.
IIIEspecialista de I Grado en Cirugía General. Asistente. Hospital Provincial Docente "Saturnino Lora". Santiago de Cuba, Cuba.
IVEspecialista de I Grado en Medicina General Integral. Residente de tercer año en Cirugía General. Hospital Provincial Docente "Saturnino Lora". Santiago de Cuba, Cuba.
RESUMEN
El carcinoma gástrico es el segundo tumor maligno más frecuente en el mundo, prevalece en países occidentales, pero sobre todo, en asiáticos. Los programas de detección precoz con imágenes y endoscopia oral han permitido el diagnóstico en estadios iniciales e incremento de la supervivencia, aunque el 60 % de los pacientes se diagnostican en estadio III o IV, y la sobrevida global a los 5 años es de 5 a 15 %. El objetivo de esta revisión fue identificar los factores pronósticos relacionados con el cáncer gástrico dependientes del paciente, del propio tumor, y del tratamiento, que puedan incidir en la aparición de la recurrencia tumoral tras la cirugía y ayuden a considerar terapéuticas adecuadas. Las variables biológicas del enfermo no muestran asociación significativa con el pronóstico del cáncer gástrico, a diferencia del grado de invasión de la pared, el compromiso ganglionar y los factores biológicos tumorales. La cirugía es el único tratamiento potencialmente curativo, pero resulta insuficiente para muchos enfermos, a pesar de las linfadenectomías ampliadas. Alrededor de 80 % de los operados presentará una recurrencia con un pronóstico fatal. La quimioterapia, la radioterapia y la inmunoterapia no han cambiado aún notoriamente la historia natural de la enfermedad. El seguimiento posoperatorio no puede ser sistematizado debido a la baja sensibilidad de los métodos para detectar el patrón de recurrencia, así como la ausencia de su tratamiento efectivo. La identificación de los factores pronósticos del cáncer gástrico permite estratificar a los pacientes y seleccionar diferentes tratamientos en un intento de incrementar la supervivencia.
Palabras clave: cáncer gástrico, factores pronósticos, cirugía, linfadenectomía, radioterapia, quimioterapia, inmunoterapia, recurrencia, supervivencia.
ABSTRACT
The gastric cancer is the second more frequent malignant tumor prevailing in western countries but mainly in the Asiatic ones. The programs of early detection with imaging and oral endoscopy allowed to diagnose in initial stages and an increase in survival although the 60 % of patients are diagnosed in III or IV stages and global 5-years survival is from 5 to 15 %. The objective of present review was to identify the prognostic factors related to gastric cancer in dependence of the patient, of the own tumor and of the treatment, which may to affecting the appearance of the tumor relapse after surgery and to help to take into account appropriate therapeutics. In the biological variables of patient there is not a significant association with the prognosis of gastric cancer, unlike the grade of wall invasion, the ganglion involvement and the tumor biological factors. Surgery is the only potentially curative treatment, but it is not enough for many patients despite the wide lymphadenectomies. Around the 80 % of patients operated on will show relapse with a fatal prognosis. Chemotherapy, radiotherapy and immunotherapy have not changed yet in a significant way, the natural history of this disease. The postoperative follow-up can not be systematized due to the low sensitivity of methods to detect the relapse pattern, as well as the lack of its effectiveness treatment. The characterization of the prognostic factors of gastric cancer allows to stratify the patients and to select different treatments trying to increase the survival.
Key words: gastric cancer, prognostic factors, surgery, lymphadenectomy, radiotherapy, chemotherapy, immunotherapy, relapse, survival.
INTRODUCCIÓN
El cáncer gástrico se define como una enfermedad neoplásica localizada en las paredes del estómago, por debajo de la unión cardioesofágica. El carcinoma de estómago es el segundo tumor maligno más frecuente en el mundo después del pulmón,1,2 con 934 000 enfermos nuevos por año en 2002 (8,6 % de todos los casos nuevos de cáncer). El objetivo de esta revisión fue identificar los factores pronósticos relacionados con el cáncer gástrico dependientes del paciente, del propio tumor, y del tratamiento, que puedan incidir en la aparición de la recurrencia tumoral tras la cirugía y ayuden a considerar terapéuticas adecuadas.
Cuba es catalogada entre los países de bajo riesgo,3 y según el Registro Nacional del Cáncer,4 en 2004 se reportó con este tumor un total de 867 pacientes (547 varones y 320 hembras) para una tasa bruta de incidencia por sexos de 9,7 y 5,7 x 100 000 hab, las que se elevan a partir de los 60 años a 49,8 y 26,7 respectivamente. La tasa de mortalidad por cáncer gástrico muestra una tendencia descendente similar a la de los países occidentales. En 20094 el número de defunciones por esta causa ascendió a 775, para una tasa global de 6,9 x 100 000 hab (477 hombres y 298 mujeres) con una tasa de 8,5 y 5,3 x 100 000 h respectivamente, y una razón de tasas por sexos M/F de 1,6, para ocupar el 9no. y 7mo. lugares entre las causas de muerte por tumores malignos por sexos.
El carcinoma gástrico continúa siendo una enfermedad prevalente en los países occidentales. Si exceptuamos la localización cardial, su incidencia desciende de forma gradual, principalmente por el cambio en la composición y conservación de alimentos en refrigeración, además de otros factores ambientales, aunque la morbilidad y mortalidad atribuibles a esta neoplasia siguen siendo altas.5,6 Se han puesto en marcha programas de detección precoz de cáncer gástrico muy costosos, a través de estudios radiográficos y endoscópicos: pesquisa poblacional masiva y selectiva a pacientes sintomáticos, o ambos, en algunos países (Japón, Corea, Chile), lo que ha permitido el diagnóstico de tumores en estadios más precoces y un incremento en la supervivencia de los pacientes.1,6 A pesar de ello, la sobrevida a los 5 años se sitúa entre el 5-15 % globalmente, y alrededor de 60 % de los pacientes se diagnostican en estadio III o IV de la enfermedad, según demuestran distintos estudios realizados en países occidentales.5-8 La cirugía es el único tratamiento potencialmente curativo para estos enfermos, pero alrededor de 80 % presentará una recurrencia, con un pronóstico fatal ante la inexistencia de un tratamiento efectivo.7-9
DESARROLLO
Factores pronósticos
La mayoría de los estudios9-11 coincide en que la supervivencia de los pacientes con carcinoma gástrico es el resultado de la interacción de múltiples factores. En este sentido, se han agrupado las variables pronósticas en 3 categorías relacionadas: con el paciente, con las características del tumor, y con el tipo de tratamiento realizado. El análisis de estas variables asocia el pronóstico de estos enfermos especialmente con algunas características biológicas del tumor y del paciente, categorías relacionadas con el diagnóstico. Es necesario identificar los factores que determinan la historia natural del carcinoma gástrico, para poder agrupar los pacientes con diferente pronóstico y administrar el tratamiento más adecuado de manera individualizada. Todo ello justifica la realización de esta revisión, con el objetivo de identificar los factores relacionados con la evolución del cáncer gástrico dependientes del paciente, del propio tumor, y del tratamiento que pueda incidir en la aparición de la recurrencia tumoral tras la cirugía, y ayude a considerar terapéuticas adecuadas.
Los factores pronósticos relacionados con el diagnóstico del cáncer gástrico se pueden clasificar en 2 categorías: según las características del paciente (edad, sexo, estados inmunológico, nutricional y general, y enfermedades asociadas), y del tumor (localización, tamaño, aspectos macroscópico y microscópico, tipo y grado histológicos, estadificación TNM, citología peritoneal y características biológicas). Los factores pronósticos dependientes del tratamiento del cáncer gástrico se clasifican atendiendo a: resecabilidad y tipo de resección, tipo de linfadenectomía, morbilidad y mortalidad posoperatorias, transfusión preoperatoria, radioterapia, quimioterapia e inmunoterapia.
Factores relacionados con el paciente
Edad y sexo: el cáncer gástrico predomina en el sexo masculino, con una relación de 2,6:1 respecto a las féminas. El sexo femenino se asocia a un mejor pronóstico en algunos estudios. Los grupos de edades más afectados son la séptima y octava décadas de la vida, promedio 65 años, pero si se considera solo a aquellos pacientes pesquisados en etapa precoz (cáncer incipiente), la media desciende a 40-45. La edad menor de 40 años se asocia a tumores con peores características clínicas y patológicas, como los poco diferenciados o con histología de células en anillo de sello.12,13 Sin embargo, aunque en algunas series se ha identificado la edad (> 65-70 años) como un factor pronóstico independiente relacionado con la mortalidad operatoria y la supervivencia,10,11 no se confirma en otros.8,9
Estado inmunológico: está vinculado con la edad, habida cuenta, el deterioro progresivo del sistema inmunológico del anciano puede considerarse como causa y efecto, o ambos, de la enfermedad neoplásica. La función de los mecanismos inmunológicos en la defensa antitumoral es evidente, pero una vez que la enfermedad logra contrarrestar la oposición que le ofrece el sistema inmune y se establece en el organismo, genera mecanismos que inhiben y hacen mucho menos eficiente la respuesta sistémica.14
Estado nutricional: la ingestión de leche, así como la dieta rica en verduras y frutas frescas en los primeros años de vida y durante el tratamiento, pueden mejorar el pronóstico de los enfermos con cáncer de estómago. La pérdida de peso previa al diagnóstico conlleva una peor tolerancia al tratamiento basado en 5-Fluoruracilo, con incremento de su toxicidad, mucositis y síndrome palmo-plantar, secundarios a deficiencias nutricionales de glutamina y vitamina B 6, respectivamente, lo que es señalado como factor independiente de mal pronóstico de supervivencia en estos pacientes.3,5,6
Enfermedades asociadas: pueden relacionarse con mayor índice de enfermedad avanzada metastásica,13,15 o si se considera independiente del estadio, es un factor pronóstico asociado con mayor duración de los síntomas y un nivel socioeconómico bajo o procedencia rural.10
Estado general: los síntomas generales de malignidad (astenia, anorexia y pérdida de peso) se presentan habitualmente en el cáncer avanzado y se relacionan con el pronóstico del enfermo. Con el objetivo de evaluar el estado general preoperatorio son muy útiles las escalas de Orr y Aisner, aceptadas por la OMS para pacientes oncológicos, y el índice de Karnofski.3 Ambas escalas se basan en los síntomas y signos, que dependen, en muchas ocasiones, de la invasión local de las estructuras vecinas, peritoneal o a distancia.
Factores relacionados con el tumor
Desde el punto de vista anatomopatológico,3 los tumores gástricos malignos se clasifican en epiteliales y mesenquimatosos o parenquimatosos. Los epiteliales, que se originan en la mucosa gástrica, son el carcinoma o adenocarcinoma (95 %), el linfoma (4 %) y el tumor carcinoide. Los mesenquimatosos, que se desarrollan a expensas de los distintos elementos del parénquima, pueden ser: leiomiosarcoma, fibrosarcoma y rabdomiosarcoma (se originan en elementos musculares), el liposarcoma (se origina en el tejido graso) y el angiosarcoma (se origina en elementos vasculares). Los sarcomas metastizan por vía sanguínea, y son los de peor pronóstico. Nos referiremos a los carcinomas.
Localización: diversos estudios revelan que los tumores localizados en el tercio distal evolucionan con más manifestaciones clínicas y mayor número de complicaciones (sangrado, estenosis, perforación), y conllevan un pronóstico más favorable que los situados en el tercio proximal,3,5,7 probablemente debido a que estos últimos se asocian con una mayor diseminación linfática, diagnóstico más tardío y aumento de la frecuencia del tipo difuso.
Tamaño: las dimensiones del tumor (< 4, e/ 4-10 y > 10 cm) parecen comportarse como variable de pronóstico independiente en algunos estudios,5,7 pero no en otros, tras el análisis multivariable.8,9 Las características histopatológicas más estudiadas son: aspecto macroscópico (clasificación de Borrmann),15 el tipo histológico (clasificación de Lauren)16 el grado de diferenciación.17
Aspecto macroscópico: en 1926, Borrmann15 hizo la primera clasificación pronóstico de supervivencia del carcinoma gástrico, según el aspecto morfológico de la lesión para cáncer avanzado mayor de 3-4 cm que invade la muscular como mínimo, agrupándolo en estas categorías:
- Tipo I o polipiodeo: circunscrito, solitario, sin ulceración. Es el menos frecuente y de mejor pronóstico.
- Tipo II o ulcerado: igual al anterior, con ulceración central, crecimiento lento y metástasis tardías. Es la forma más frecuente.
- Tipo III o crateriforme: ulcerado, con elevación marginal y diseminación difusa parcial alrededor.
- Tipo IV o difuso: infiltrante, difuso y generalizado, de gran crecimiento. Se distinguen 2 tipos (escirro, con crecimiento infiltrante, muy rico en tejido conectivo; y linitis plástica de Brinton, que ocupa todo el órgano, es el más maligno y de peor pronóstico).
Aspecto microscópico: en 1965, Lauren16 distinguió 2 tipos histopatológicos con valor pronóstico en supervivencia (tipo intestinal y tipo difuso), en los que también se ha observado distinta distribución epidemiológica y diferencia en sus lesiones precursoras. El tipo intestinal (55-60 %) forma estructuras glandulares similares a las glándulas intestinales, se relaciona con factores etiológicos como la dieta, las condiciones ambientales y la infección por Helicobacter pylori;18,19 y el tipo difuso (35-40 %), se caracteriza histológicamente por células que invaden los tejidos sin formar glándulas. Sobre estas lesiones, los factores ambientales tienen poca influencia. Este tipo se asocia con peor pronóstico.
Estos 2 subtipos tienen distintas vías de carcinogénesis.13 El tipo intestinal presenta una serie de lesiones precursoras (gastritis superficial, gastritis atrófica, metaplasia intestinal y displasia).20,21 En este proceso intervienen genes como k-ras13, p-53 y DDC, que participan en diferentes escalones evolutivos. En el tipo difuso no pueden distinguirse lesiones preneoplásicas, y son otros factores moleculares, como la ausencia de caderinas, las que actúan en su carcinogénesis. Por otra parte, aproximadamente el 15 % de los tumores presentan ambas características.
Esta clasificación es la más frecuente en occidente, donde sigue vigente en la actualidad a pesar de no haber sido reconocida por la OMS,17 que acepta la propuesta por Oota, en la cual, el tipo de tumor queda definido por el patrón morfológico predominante y distingue los carcinomas: papilar, caracterizado por prolongaciones epiteliales digitiformes; tubular, que contiene glándulas ramificadas; mucinoso, que produce gran cantidad de mucina; y el de células en anillo de sello, aisladas con gran cantidad de mucina intercelular. Estos 2 últimos son los de peor pronóstico en cuanto a supervivencia, porque se asocian a tumores más avanzados.
Entre las características de las células tumorales se describe el grado nuclear, según el pleomorfismo, la formación tubular y el número de mitosis, que determinan la diferenciación celular y el grado histológico. El mejor factor pronóstico de la biología del tumor es la ploidía del DNA, relacionado con el índice mitótico y la proliferación celular.17,18
Grado histológico: en una revisión retrospectiva sobre 504 pacientes se analizó el grado histológico como factor pronóstico de progresión y supervivencia del carcinoma gástrico, dividiendo los adenocarcinomas según el grado de diferenciación en 3 tipos:17
1. Bien diferenciado: con características histológicas muy parecidas a las del epitelio normal. Son los de mejor pronóstico.
2. Moderadamente diferenciado: intermedio entre el bien y el poco diferenciado. Corresponde al 85 % de los adenocarcinomas.
3. Poco diferenciado o indiferenciado: su histología no se parece a la del epitelio normal. Son de peor pronóstico por su mayor tendencia a hacer metástasis peritoneales, ganglionares y a distancia.
Aunque existe una creencia generalizada de que los carcinomas con formas ulceradas o vegetantes, de tipo intestinal, y bien diferenciados, se asocian con una supervivencia mayor, la mayoría de los estudios con un elevado tamaño muestral no lo confirman tras el análisis multivariable.5,17,18 El estado ganglionar muestra relación directa con el pronóstico de estos enfermos. En el espécimen quirúrgico de una gastrectomía por cáncer deben estudiarse como mínimo 15 ganglios, pues el número de linfonódulos metastásicos, la infiltración de la cápsula o extensión extraganglionar, la distancia entre el tumor y los linfonódulos y su localización, son factores pronósticos con alto nivel de evidencia científica. Por otra parte, el tamaño del tumor, la presencia de necrosis y la distancia entre el tumor y el borde de sección quirúrgica (mínimo 3 cm distal y 5 proximal), la existencia de células tumorales a ese nivel, la invasión vascular linfática, sanguínea, o ambas, la invasión perineural y de la serosa, constituyen factores determinantes del pronóstico del paciente.7-10
Existe un alto nivel de evidencia en cuanto a que el grado de invasión parietal, la invasión linfática y la presencia de metástasis a distancia son las variables pronósticos independientes de primer orden, confirmadas en el análisis retrospectivo de series amplias de tratamiento.7-10 Basado en estos 3 factores se define el sistema de estadificación más utilizado es la clasificación TNM, adoptado en las distintas ediciones, sin apenas modificaciones, por el American Joint Committee on Cancer (AJCC),22 ya que existe una relación directa entre estas 3 categorías y la supervivencia.
Categoría T: tumor primario
- TX: el tumor primario no puede evaluarse.
- T0: no hay evidencia de tumor primario.
- Tis (carcinoma in situ): tumor intraepitelial sin penetración de la lámina propia.
- T1: el tumor invade la lámina propia, muscularis mucosae o la submucosa.
- T1a: el tumor invade la lámina propia o la muscularis mucosae.
- T1b: el tumor invade la submucosa.
- T2: el tumor invade la muscular propia.
- T3: el tumor penetra el tejido conectivo subseroso, sin invasión del peritoneo visceral o estructuras adyacentes.
- T4: el tumor invade la serosa (peritoneo visceral) o las estructuras adyacentes.
- T4a: el tumor invade la serosa (peritoneo visceral).
- T4b: el tumor invade las estructuras adyacentes.
El tumor puede penetrar la muscular propia con extensión a los ligamentos gastrocólico, gastrohepático o al omentum mayor o menor, sin perforar el peritoneo visceral que cubre estas estructuras. En este caso, el tumor es clasificado T3. Si hay perforación de peritoneo visceral que cubre los ligamentos gástricos u omentum, el tumor debe ser clasificado T4.
Las estructuras adyacentes al estómago son: bazo, colon transverso, hígado, diafragma, páncreas, pared abdominal, glándula suprarrenal, riñón, intestino delgado y retroperitoneo. La extensión intramural al duodeno o al esófago se clasifica por la invasión de mayor profundidad en cualquiera de estos sitios, incluido el estómago, y no afecta la clasificación T.
Categoría N: ganglios linfáticos regionales
- NX: los ganglios regionales no pueden evaluarse.
- N0: no hay metástasis en los ganglios linfáticos regionales.
- N1: metástasis en 1 a 2 ganglios linfáticos regionales.
- N2: metástasis en 3 a 6 ganglios linfáticos regionales.
- N3: metástasis en 7 o más ganglios linfáticos regionales.
- N3a: metástasis en 7 a 15 ganglios linfáticos regionales.
- N3b: metástasis en 16 o más ganglios linfáticos regionales.
Los linfonodos regionales son los perigástricos, localizados a lo largo de las curvaturas menor y mayor, y de las arterias gástrica izquierda, hepática, esplénica. El compromiso tumoral de otros ganglios intraabdominales como hepato-duodenales, retro-pancreáticos, mesentéricos y paraaórticos, se considera metástasis a distancia. La designación pN0 debe ser usada si todos los ganglios linfáticos examinados son negativos, sin considerar el total de ganglios extraídos y examinados. Para pN, un espécimen de linfadenectomía regional contendrá ordinariamente, no menos 15 ganglios linfáticos.
Categoría M: metástasis a distancia
- MX: las metástasis a distancia no pueden establecerse.
- M0: no hay metástasis a distancia.
- M1: metástasis a distancia.
Estadificación del cáncer gástrico: comprende estadio anatómico y grupos pronósticos, tanto clínico como patológico. En el clínico se incluye la extensión de la enfermedad antes de cualquier tratamiento y la estadificación después de terapia neoadyuvante, pero antes de la cirugía subsecuente; y en el patológico, la extensión de la enfermedad durante y luego de la cirugía, y la estadificación después de completar la terapia neoadyuvante y la cirugía subsecuente.
Grupo TNM
0 Tis N0 M0
IA T1 N0 M0
IB T2 N0 M0; T1 N1 M0
IIA T3 N0 M0; T2 N1 M0; T1 N2 M0
IIB T4a N0 M0; T3 N1 M0; T2 N2 M0; T1 N3 M0
IIIA T4a N1 M0; T3 N2 M0; T2 N3 M0
IIIB T4b N0 M0; T4b N1 M0; T4a N2 M0; T3 N3 M0
IIIC T4b N2 M0; T4b N3 M0; T4a N3 M0
IV Cualquier T; cualquier N; M1
Estadio
desconocido
En 1962, la Sociedad Japonesa de Gastroenterología definió el cáncer gástrico precoz23,24 como una lesión que afecta la mucosa o submucosa, sin afectar la muscular, y que es independiente de la afectación ganglionar y de su extensión en superficie. Esta entidad constituye alrededor de 40 % de los tumores diagnosticados en Japón, y de 5-15 % en países occidentales. Se asocia a un buen pronóstico, muestra una supervivencia de 90 % con cirugía exclusiva.24 El riesgo de afectación ganglionar se incrementa con la presencia de mayor invasión submucosa, la cual conlleva un peor pronóstico con una supervivencia de 57 %, lo que aconseja tratamiento adyuvante en este grupo de enfermos. Hay que diferenciarlo del tumor in situ (Tis), que es intraepitelial, no penetra la lámina propia, no tiene afectación ganglionar, y su curación mediante la cirugía sería de 100 %.
La Sociedad Japonesa de Gastroenterología, atendiendo a los estudios radiográficos y endoscópicos refinados, propone la clasificación del cáncer gástrico incipiente en 4 tipos: tipo I: elevado; tipo IIa: levemente elevado, no más de 5 mm, en forma de platillo; tipo IIb: plano, liso; IIc: deprimido, hundido (en el tipo II el diagnóstico es difícil y el 50 % escapa al examen); tipo III: excavado o ulcerado; tipo IV: combinación de los anteriores. Es importante señalar que los tipos I y III son de diagnóstico fácil con radiología y endoscopia adecuadas.23,24 La endoscopia oral tiene un 95 % de positividad diagnóstica.
La cromoscopia es el uso de tinciones especiales del tejido con lugol, azul de toluidina, azul de metileno, rojo congo, o índigo carmín durante la endoscopia (cromoendoscopia). Es una técnica usada para estudiar los detalles finos de la mucosa, pues facilita el diagnóstico de las lesiones que pueden pasar inadvertidas con las endoscopias convencionales. Las tinciones permiten reconocer más fácilmente el tejido anormal, por la captación que hace la mucosa de estos colorantes y ayudan a detectar las lesiones en forma rápida y eficiente porque realzan sus bordes y características.25,26 El tinte puede aplicarse mediante inyección o de forma indirecta por ingestión o enemas. La luz azul de longitud de onda corta es absorbida por la hemoglobina y resalta la red capilar cercana a la superficie; la luz verde penetra en la mucosa y reproduce imágenes de los vasos a mayor profundidad. La valoración del patrón vascular permite predecir, con alta sensibilidad, el cáncer gástrico temprano.
El ultrasonido endoscópico tiene una exactitud diagnóstica para la categoría N de 77 %, sensibilidad de 94 % y especificidad 83 % en la correcta clasificación del estadio.27,28 Este estudio tiene una alta efectividad para diferenciar estadios T1 y T2 de los estadios T3 y T4, aunque su problema más común es distinguir los T2 o T3. Muestra mejor rendimiento que la tomografía computarizada y la laparoscopia.29,30
La ecoendoscopia es esencial para diagnosticar el cáncer gástrico temprano, y permite identificar pacientes con carcinoma intramucoso que son candidatos para la resección mucosa endoscópica. La ecotomografía tiene una sensibilidad y especificidad para determinar la presencia de metástasis en hígado de aproximadamente 50 % y >85 % respectivamente.29 La tomografía computarizada, por su parte, alcanza sensibilidad y especificidad para determinar la presencia de metástasis en hígado de 72 % y >85 % respectivamente. Su capacidad de diferenciación entre T2 y T3 es del 73 %, y entre T1/T2 con T3/T4 es del 83 %.29,30 El diagnóstico por tomografía requiere de un estómago vacío, con distensión adecuada mediante 500 ó 700 cc de agua para lograr un contraste negativo del lumen gástrico, con la finalidad de diferenciarlo de las paredes, las cuales aumentan su densidad con el contraste endovenoso administrado para observar las 3 capas parietales del estómago: mucosa (interna, de alta atenuación), submucosa (media, de baja atenuación) y la muscularis propia y serosa (externa, de atenuación intermedia). La tomografía con emisión de positrones (PET) y la resonancia magnética nuclear (RMN) son algo más sensibles que el TAC y la ecotomografía, pero no resultan costo-efectivas, ni se ha demostrado que su utilización modifique la conducta y el pronóstico.29
La biopsia endoscópica permite siempre el diagnóstico histopatológico, aunque a veces puede haber falsos negativos (tumores ulcerados, cáncer de tipo difuso o submucoso), por lo que se aconseja tomar múltiples muestras (generalmente 6 a 8) según protocolos. A veces el hallazgo de una displasia es difícil diferenciarlo de un cáncer gástrico precoz, y obliga a un seguimiento estrecho del paciente, lo que incluye la repetición de la biopsia endoscópica. El hallazgo de una displasia severa supone, de hecho, la indicación de resección gástrica.29,30
Los marcadores serológicos31,32 se han propuesto para identificar sujetos en riesgo de cáncer gástrico, en quienes deben indicarse endoscopia con biopsia y estudios radiográficos. El pepsinógeno es una proenzima producida por la mucosa gástrica, que puede detectarse en sangre. Los niveles de pepsinógeno I y II disminuyen cuando la mucosa gástrica se atrofia; por tanto, reflejan su estado morfológico y funcional, y sirven como marcadores de gastritis crónica atrófica (lesión premaligna) y de cáncer gástrico. En Japón, esta tamización ha superado al método radiográfico en el porcentaje de detección de cáncer gástrico precoz, además de ser más económica y fácil de implementar. Recientemente, se ha propuesto la medición de los niveles de la fracción 17 de la gastrina y del pesinógeno I, asociados a la determinación de anticuerpos contra H. pylori, como marcadores serológicos para la gastritis atrófica y cáncer gástrico, aunque la información disponible no es suficiente.
Actualmente, la laparoscopia33 con o sin videocámara es una herramienta fundamental para la estadificación del cáncer gástrico, a pesar de ser un método invasivo. Tiene las ventajas de permitir una visión directa, posibilita hacer estudio citológico, alcanza una exactitud diagnóstica de 97 %, y evita laparotomías innecesarias en un 25 a 30 % de los pacientes que presentan grado avanzado de diseminación del cáncer, y para los estadios T3 y T4 sin metástasis de órganos a distancia. Unido al grado de invasión parietal, la afección metastásica ganglionar se presenta de forma unánime como el factor pronóstico independiente más importante.5,7-10,23,24
En el drenaje linfático del estómago se describen 16 grupos ganglionares regionales: 1. Cardinales derechos. 2. Cardinales izquierdos. 3. Curvatura menor. 4. Curvatura mayor. 5. Suprapilóricos. 6. Subpilóricos. 7. Gástrica izquierda. 8. Arteria hepática. 9. Tronco celíaco. 10. Hilio esplénico. 11. Arteria esplénica. 12. Ligamento hepatoduodenal. 13. Retropancreáticos. 14. Arteria mesentérica. 15. Arteria cólica media. 16. Arteria aorta.
La Japanese Research Society for the Study of Gastric Cancer (JRSCG), agrupa los linfonódulos regionales en 3 estaciones, niveles o relevos ganglionares:34
- El nivel 1 (N1) los linfonódulos perigátricos, del grupo 1 al 6.
- El nivel 2 (N2) los linfonódulos periarteriales, del grupo 7 al 12.
- El nivel 3 (N3) los linfonódulos del grupo 13 al 16, metástasis a distancia.
Se considera ganglio centinela en el cáncer gástrico a "cualquier ganglio linfático que recibe drenaje directo desde el tumor primario".25,26 En la actualidad hay 2 métodos para su obtención: mediante tinción y por medio de radioisótopos. Ambos se pueden utilizar de forma conjunta, pues la tinción permite ver la extensión linfática en tiempo real, lo que constituye un procedimiento de apoyo al trazador isotópico. El trazador radiactivo que se aconseja usar es 99 Tc coloidal, el cual se administra el día previo a la intervención mediante endoscopia por medio de la infiltración de la submucosa en los 4 cuadrantes del tumor, hasta un total de 2 mL. Su difusión se inicia a las 2 h y permanece en el ganglio hasta unas 20 h. La infiltración de tinta se realiza también por vía endoscópica y en la submucosa de la misma manera que el radioisótopo, pero en el mismo acto operatorio, ya que la difusión de la tinta se inicia en 5 a 15 min. Generalmente en el cáncer gástrico los ganglios centinelas son múltiples y tienen una distribución multidireccional, por lo que también puede utilizarse el método radioguiado. La identificación del ganglio centinela es útil para la realización de la linfadenectomía.
El cáncer gástrico precoz o superficial no significa lo mismo que el cáncer in situ o displasia severa, ni tampoco sugiere una situación clínica temprana, o que indica es una lesión que afecta solo a la mucosa o a la submucosa y puede ser politópico (10 %). Endoscópicamente se distinguen lesiones excrecentes, superficiales y excavadas, y aunque puede coexistir con linfonódulos afectados, tienen un mejor pronóstico. El cáncer gástrico avanzado implica ya infiltración de capas más profundas, es decir, a partir de la muscularis hacia la serosa, y presenta mayor afectación linfonodular con un peor pronóstico. Todo ello se expresa en la supervivencia promedio inversa, según la mayor profundidad del tumor y el compromiso ganglionar. El grado de invasión parietal se correlaciona con la exfoliación de células libres en la cavidad peritoneal y con la presencia de metástasis ganglionares. Así, la mitad de los pacientes con un carcinoma gástrico que infiltra la serosa desarrollarán una recurrencia peritoneal.35
La citología del lavado peritoneal se emplea en la detección de las células exfoliadas desde el tumor, que son viables. El estudio citológico del lavado peritoneal es un factor predictivo de recurrencia independiente importante, porque muestra una gran especificidad y valor predictivo positivo elevado, aunque, su sensibilidad y el valor predictivo negativo son bajos, ya que solo detecta la presencia de células tumorales en menos del 30 % de los tumores en los que está invadida la serosa.35 Por ello, se están utilizando nuevas técnicas de detección, basadas en la determinación de los valores de ARNm, que parecen aumentar la sensibilidad y el valor predictivo negativo de esta prueba.35
Lo marcadores tumorales séricos en el cáncer gástrico resultan útiles como factor pronóstico o medidor de respuesta al tratamiento y de supervivencia. El antígeno carcinoembrionario (CEA) es una proteína de superficie celular que se eleva en 15-65 % de los pacientes, lo cual se correlaciona con afectación ganglionar y metástasis peritoneales. La elevación de CA 125 puede ser un factor predictor de la presencia de metástasis peritoneales, y un factor de mal pronóstico en cáncer gástrico avanzado. Cuando se utilizan conjuntamente el CEA, el CA 19-9 y el CA 72-4, la sensibilidad en la detección de la recurrencia aumenta de forma considerable. El CA 72-4 es el más específico.8-10
Las características biológicas (celulares y moleculares) han sido estudiadas en los últimos años con el fin de conocer cuáles generan una evolución desfavorable, establecer una secuencia oncogenética y explorar nuevas alternativas terapéuticas.3,5,11 Entre las más conocidas figuran algunas proteasas y sus inhibidores, como la urocinasa (uPA), su inhibidor específico del plasminógeno (PAI-126), y algunas metaloproteinasas; así como también moléculas de adhesión, como la E-caderina, que se correlaciona con el proceso de indiferenciación, factores de crecimiento (como VEGF 30), oncogenes, como el c-erbB-2, y genes supresores, como p-53.36,37
El gen p-53, localizado en el cromosoma 17, interviene en la reparación del daño del DNA para lo que interrumpe el ciclo celular e induce a la célula a entrar en apoptosis. Las alteraciones genéticas más frecuentes en tumores humanos son las del gen p-53. En el cáncer de estómago aparece en el 35-50 % de los pacientes, y se correlaciona con invasión serosa, linfática y peor pronóstico en supervivencia. Todas estas características parecen conferir un peor pronóstico, aunque no de forma independiente al TNM, salvo, quizás, la sobreexpresión de urocinasa y PAI-126.36,37
La apoptosis, o muerte celular programada, es parte de la cinética celular normal para un adecuado equilibrio entre la proliferación y muerte celular. La pérdida de la apoptosis espontánea se correlaciona con un peor pronóstico en el carcinoma gástrico. La sobreexpresión de proto-oncogenes vinculados con la apoptosis, como el c-erbB-2 se correlaciona con la variante intestinal, la presencia de metástasis ganglionares y con la supervivencia.36
La angiogénesis interviene en el desarrollo de la neoplasia por aportar nutrientes y favorecer su capacidad metastásica. La cuantificación de la densidad microvascular intratumoral o el análisis de factores angiogénicos (que inciden en el proceso de metástasis), se han descrito como factores pronósticos en el carcinoma gástrico.36
La inestabilidad de microsatélites es una manifestación de un defecto en la reparación del DNA que aparece en el 15-38 % de los pacientes con cáncer de estómago. En algunos estudios se ha visto que los factores angiogénicos intervienen en una fase precoz de la carcinogénesis, pero sin encontrar su valor predictivo; y en otros, se asocia a factores de buen pronóstico, como la localización antral o el tipo intestinal.36
El análisis de todos estos factores biológicos permite tener un mejor conocimiento del pronóstico de los pacientes para adecuar los tratamientos. Además, se pueden utilizar para mejorar la estadificación de la enfermedad mediante la detección precoz de la diseminación, de otra forma no identificable por métodos clínicos, imagenológicos o endoscópicos, mediante el análisis molecular en sangre periférica de PAI-126, antígeno carcinoembrionario (CEA) o citoqueratinas.35-37
Factores de quimiorresistencia
Algunas de estas y otras características tumorales celulares o moleculares son asimismo importantes porque pueden conferir quimiorresistencia, frente a algunos de los fármacos más utilizados en tratamientos coadyuvantes del carcinoma gástrico, entre ellas, se encuentra la presencia de mutaciones en el gen p-53, detectadas en el 40 % de estos tumores, que puede generar resistencia a la adriamicina, el 5-fluorouracilo y el etopósido, y modular a otros factores de quimiorresistencia, como la glucoproteína-P.37 Esta proteína de membrana actúa como bomba expulsora de un amplio abanico de fármacos que impide su acumulación intracelular y su acción citotóxica. Estos hallazgos experimentales tienen su correspondencia clínica en un estudio realizado con carcinomas gástricos irresecables, donde se observó que los tumores sin alteración en el gen p-53 tenían una tasa de respuesta mayor a la quimioterapia, que permitió la resección posterior en algunos enfermos.37 Paralelamente, la sobreexpresión de 2 proteínas, como la timidilato sintetasa y la ERCC, que actúan, respectivamente, en la síntesis y el proceso de escisión y reparación de ADN, pueden tener incidencia en la respuesta a la quimioterapia neoadyuvante basada en 5-fluorouracilo y cisplatino, así como en la supervivencia.38
Recomendaciones para la estadificación del cáncer gástrico
La estadificación macroscópica del cáncer gástrico se debe realizar mediante clasificación japonesa en los cánceres incipientes, clasificación de Borrmann en los avanzados, y según clasificación TNM. A ello debe sumarse la clasificación con base al tipo histológico (Lauren, OMS), el grado de diferenciación celular, y según su localización. La estadificación preoperatoria tiene por objetivo principal establecer la operabilidad del tumor, mediante la detección de metástasis hepáticas, peritoneales, o a mayor distancia. Es recomendable realizar una radiografía simple de tórax inicial. Se debe evaluar la presencia de metástasis hepáticas mediante TAC o ecotomografía como exámenes de primera línea. La laparoscopia preoperatoria puede estar indicada en la sospecha de carcinomatosis peritoneal, principalmente en adenocarcinomas indiferenciados en estadios T3 y T4 sin evidencia de metástasis de órganos a priori. La endosonografía no debe considerarse un examen rutinario para la estadificación del cáncer gástrico, pero, si está disponible, puede ser de utilidad en cánceres tempranos, para diferenciar lesiones T1-T2 de tumores T3-T4. En los pacientes operables, la estadificación se completa con la laparotomía exploradora y el posterior estudio anatomopatológico.
La cirugía es la única alternativa que ofrece posibilidades de curación del carcinoma gástrico: la resección con extirpación tumoral completa macroscópica y microscópica (R0) es un factor pronóstico favorable independiente.7,8 La radicalidad de la resección sobre el pronóstico se centra en la realización de linfadenectomías ampliadas al segundo nivel D2, frente a la estándar limitada al nivel D1, como veremos más adelante.9,10,24 La cirugía oncológica reglada es el tratamiento más efectivo del cáncer gástrico. El período preoperatorio incluye: suspender antihistamínicos H2 una semana antes de la intervención, indicar antibióticos y anticoagulantes profilácticos, preparación del colon, hemodilución normovolémica, entre otras medidas.10 Los criterios de operabilidad son:1 que el estudio preoperatorio no demuestre metástasis a distancia; y las resecciones no curativas, paliativas, cuando no se pueda efectuar resección completa (sangrado, perforación y retención gástrica). Los criterios de inoperabilidad (en pacientes electivos) son: rechazo de la cirugía por el paciente y familiar(es) o ambos, enfermedad grave concomitante que contraindique la cirugía, así como la existencia de metástasis hepáticas, peritoneales o más distantes.
Los criterios de resecabilidad son:1 la resección con intención curativa, o sea, cirugía completa del tumor primario (incluye resección en bloque de órganos invadidos por contigüidad), disección linfática del segundo nivel (D2), y sin enfermedad macroscópica residual (ausencia de diseminación a distancia en estudio preoperatorio o evaluación intraoperatoria). El límite de los márgenes de resección debe ser: proximal > 5 cm y distal > 2-3 cm como mínimo. La esplenectomía y la pancreatectomía distal deben realizarse solo si existe compromiso de estos órganos, y no rutinariamente, porque ensombrecen el pronóstico.5,15 El tipo de resección depende de la localización y estadio del tumor. Se practicará resección mucosal endoscópica en etapa muy inicial. Series de casos en Japón24,34 han descrito remisión del cáncer en cerca de 95 % de los pacientes tratados (cánceres precoces o superficiales de un tamaño no mayor a 20 o 30 mm). Los mejores resultados se obtienen en tumores menores de 2 cm sin afectación ganglionar.24 La técnica no ha sido adoptada ampliamente en occidente.1 Se pueden considerar indicaciones para resección endoscópica, las siguientes:
a) Lesión elevada o plana no superior a 20 mm en su diámetro máximo.
b) Lesión deprimida no superior a 10 mm.
c) Sin cicatriz ulcerosa activa.
d) Adenocarcinoma bien diferenciado.
e) En casos seleccionados se pueden utilizar otras técnicas de ablación endoscópica: laserterapia, inyección de sustancias esclerosantes, entre otras.
Se consideran indicaciones de gastrectomía subtotal las siguientes:1,3
a) Cáncer incipiente: antral, medio o superior (margen proximal libre de al menos 2 cm).
b) Cáncer avanzado: antral de crecimiento lento, Borrmann I a III localizado (margen proximal 5 cm).
c) En todos los casos se debe efectuar biopsia de los bordes de resección.
d) En el cáncer de la región antro-pilórica y parte baja del cuerpo, se hará gastrectomía subtotal distal, resección de ambos epiplones (mayor y menor), y restitución del tránsito intestinal mediante una gastroyeyunostomía (anastomosis tipo Billroth II o en Y de Roux).
e) En el cáncer de la región del cardias se hará una gastrectomía subtotal proximal, con restitución del tránsito mediante la anastomosis del esófago al remanente gástrico (esofagogastrostomía).
La gastrectomía subtotal es la de elección. La gastrectomía total se hará cuando no sea posible realizar la resección parcial por la extensión de la lesión, como en el carcinoma difuso, pues tiene mayor morbilidad y mortalidad, y no mejora la supervivencia a los 5 años, siempre que se respete un margen libre de tumor de 6 cm o superior para el tipo difuso. Se pueden considerar indicaciones de gastrectomía total,1,3 el cáncer incipiente alto o multifocal, y el cáncer avanzado (que no permita margen libre de 5 cm entre borde superior y cardias). La gastrectomía extendida o ampliada se realiza cuando existe infiltración a esófago, páncreas, colon, bazo, diafragma, hígado, intestino delgado, entre otros órganos.
Hace 40 años, la JRSCG estableció la clasificación que agrupa los 16 grupos de linfonódulos regionales en 3 estaciones, niveles o relevos ganglionares (N1, N2 y N3),34 y permite diferenciar las linfadenectomías tanto para las gastrectomías parciales como totales. Si incluye el nivel 1 (N1) los linfonódulos perigátricos, del grupo 1 al 6, constituye la linfadenectomía estándar, limitada o convencional, y se denomina D1 (R1); si incluye los niveles 1 y 2 (N1 y N2) los linfonódulos periarteriales, del grupo 7 al 12, que en promedio son 25 ganglios, se denomina linfadenectomía extendida, ampliada o sistémica D2 (R2). Esta sociedad propone como tratamiento estándar la linfadenectomía ampliada D2, que incluye a los ganglios perigástricos (D1), y la resección en bloque del segundo escalón (D2), en el que se encuentran los ganglios de la arterias hepática, esplénica, tronco celíaco, gástrica izquierda y el omentum. Esta indicación ha sido avalada por múltiples estudios retrospectivos japoneses y asiáticos.34 La mayor ventaja se obtiene en pacientes con T3 o con ganglios positivos. Sin embargo, los dos estudios randomizados europeos no han encontrado beneficio en la linfadenectomía ampliada. El estudio británico39 recoge 737 pacientes. En el grupo con linfadenectomía ampliada encuentra un incremento significativo de la morbilidad y mortalidad, y una disminución en la supervivencia a los 3 años de un 50 a 30 %, atribuible a la pancreato-esplenectomía necesaria para la linfadenectomía D2. El estudio del Dutch Gastric Cancer Group40 reúne a 711 pacientes, y no encontró beneficio en la tasa de recurrencia ni en la supervivencia para el grupo con linfadenectomía D2. En este último resulta un factor pronóstico, independiente de supervivencia, la presencia de márgenes quirúrgicos afectados, y se aconseja la reintervención quirúrgica. Los datos contradictorios existentes indican que la linfadenectomía ampliada puede ser recomendada por cirujanos expertos para no incrementar la morbilidad y mortalidad quirúrgicas.
Los resultados de los estudios que aportan mayor evidencia científica concluyen que continúa por demostrarse la efectividad de la linfadenectomía ampliada al segundo nivel, y, en el caso más favorable, debe limitarse a los estadios IIA, IIB y IIIA, y el incremento de la morbilidad y mortalidad asociadas a este tipo de cirugía podría minimizarse sin la resección de la cola de páncreas, y restringir las esplenectomías a casos seleccionados.41,42 Por muchos años se ha discutido la extensión de la resección ganglionar (limitada o extendida) en casos potencialmente curables, pero no existe evidencia concluyente sobre mayor sobrevida o seguridad de un tipo sobre otro. Los 2 ensayos aleatorizados existentes sugieren que la disección extendida podría mejorar la sobrevida a 5 años en los tumores con infiltración serosa.
Por su parte, los estudios observacionales disponibles sugieren que los resultados de la cirugía dependen de la curva de aprendizaje de quienes la realizan, aunque aumenta el consenso en utilizar la disección de N2 (D2) asociada a la gastrectomía,39-42 pues, cuando se estadifica correctamente la categoría N tras la realización de una linfadenectomía D2, la supervivencia a los 5 años para los N1 es del 53 % y para los N2 del 26 %.9
Finalmente, la presencia de metástasis peritoneales o a distancia, conlleva un pronóstico ominoso. En el caso de la existencia de metástasis hepáticas sincrónicas, el beneficio de la resección quirúrgica solo consigue la curación en un número reducido de pacientes, a diferencia de lo que ocurre en el caso de las metástasis secundarias a carcinoma colorrectal.9 La resección gástrica y la linfadenectomía pueden realizarse por videolaparoscopia de manera segura y perfecta, aun en casos seleccionados, según las características locales de la lesión y constitución anatómica del paciente. Su complejidad exige más preparación en la técnica laparoscópica. Por lo general, requiere una pequeña laparotomía transversa subxifoidea para extraer la pieza. El tiempo quirúrgico fluctúa entre 3-4 h. Con esta técnica se reducen la necesidad de analgesia posoperatoria y la estancia hospitalaria. La reconversión no es numerosa, habida cuenta, los pacientes todavía son seleccionados. En los escasos trabajos sobre el tema no existen inconvenientes oncológicos para su realización (magnitud de la resección, linfadenectomía, recurrencias) y mantiene los mismos principios que para la cirugía convencional.43,44 El acceso videolaparoscópico puede ser utilizado como medio diagnóstico, porque juega un importante papel para estatificar, de manera confiable, la enfermedad, y como técnica quirúrgica, para realizar todas las resecciones gástricas regladas.43,44
Los criterios de irresecabilidad con intención curativa se aplican en los casos de diseminación peritoneal, metástasis a distancia, invasión de las estructuras vasculares principales, e incapacidad de resecciones completas, así como por el pobre estado general del paciente. La resección se considera paliativa,45 si existe compromiso de órganos por vecindad y no se puede resecar en bloque el órgano invadido o la totalidad de los grupos ganglionares comprometidos o los márgenes fueron positivos. La cirugía paliativa puede estar recomendada en pacientes seleccionados, con cáncer avanzado, por ejemplo, en la hemorragia digestiva masiva, síndrome de retención gástrica, o perforación. En la obstrucción pilórica, cuando no sea posible la resección tumoral, se realizará una simple gastroyeyunostomía derivativa.
El estudio histológico para la estadificación definitiva debe establecer lo siguiente:
a) Descripción del tipo macroscópico, localización y tamaño.
b) Profundidad de la invasión: mucosa, submucosa, muscular propia, subserosa, serosa(s).
c) Distancia de márgenes libres.
d) Tipo histológico.
e) Invasión linfática (L) y venosa (V) o linfovascular combinada (LVI) para los registros de cáncer, según el Colegio Americano de Patólogos (CAP).22- Invasión linfo-vascular ausente/no identificada.
- Invasión linfo-vascular presente/identificada.
- No aplicable.
- Desconocida/indeterminada.f) Clasificaciones de Lauren y OMS.
En algunos casos sometidos a cirugía con o sin terapia neoadyuvante, existirá tumor residual (R)22 en el sitio primario después del tratamiento, debido a resección incompleta o enfermedad local y regional extendida más allá del límite posible de resección.
- RX: la presencia de tumor residual no puede ser evaluada.
- R0: no se identifica tumor residual.
- R1: tumor residual microscópico.
- R2: tumor residual microscópico.
Con relación a la cirugía, la supervivencia a los 5 años del carcinoma gástrico fluctúa entre 5 y 15 %, o hasta 32 %.3 En la resección total o subtotal, sin invasión linfática o serosa, la sobrevida es de 47 %, cuando existe una de ellas, de 39 %, y si coinciden ambas, desciende a 20 %.7,8 En la operación paliativa el 87 % de los intervenidos fallecen antes de los 3 años.45 Los japoneses, mediante programas de pesquisa y tamizaje para detección precoz, han elevado el diagnóstico en estadios iniciales hasta un 35 % (en Europa y Estados Unidos permanece entre 10 y 15 %), y mediante la linfadenectomía reportan cifras de supervivencia a los 5 años superiores.34,39,40
Con relación a las transfusiones peroperatorias, es conocido que el grupo sanguíneo A y la anemia perniciosa (déficit de vit B-12) se asocian al cáncer de estómago.7 La cifra de Hb sérica < 10 g/dL se presenta en el 54 % de los pacientes con esta neoplasia, quienes alcanzan tasas de sobrevida quinquenal después de operados de un 12,5 %, cifra inferior a la encontrada en enfermos intervenidos con Hb ³ 10 g/dL, cuya tasa es de 26,2 %. El número de transfusiones peroperatorias (más de 4 unidades) es un factor pronóstico independiente asociado a la morbilidad y mortalidad posoperatorias.10
Los estudios de meta-análisis46 muestran resultados insuficientes con la quimioterapia adyuvante, excepto en Japón y Corea, donde reportan aumento de la supervivencia con su administración por vía intraperitoneal en el posoperatorio, la cual permite a los fármacos alcanzar más concentración en la superficie peritoneal que la infusión intravenosa. Este hecho determina mayor citotoxicidad contra las células neoplásicas exfoliadas a la cavidad peritoneal, responsables ulteriores de la carcinomatosis peritoneal.47 Se debe tener en cuenta el patrón de quimiorresistencia de estas neoplasias para seleccionar a los pacientes que van a ser tratados con quimioterapia, y elegir la asociación de fármacos en función suya, como referimos anteriormente.9,10,37,38
El ensayo MAGIC48 en pacientes con tumores gástricos y de la unión esófago gástrica operables, en que se comparó el régimen EFC (epirubicina, cisplatino y 5 Fluoruracilo en el pre y posoperatorio) contra cirugía sola, demostró mejor sobrevida libre de enfermedad y sobrevida global a 5 años (36 % y 23 %, respectivamente), sin compromiso de la morbilidad y mortalidad operatorias. El efecto es atribuible especialmente a la fase preoperatoria de la quimioterapia. El análisis de subgrupos no demostró variación del efecto de la quimioterapia según el sitio primario del tumor, edad, ni estado sintomático del paciente. La gran mayoría de los efectos adversos asociados a la quimioterapia fueron de grados 0 a 2, según los criterios de toxicidad del National Cancer Institute.
En cáncer avanzado,49 diversas combinaciones de drogas han mostrado pequeños beneficios, con un 30-50 % de tasa de respuesta, y aumento de 3 hasta 6 meses de sobrevida, al comparar quimioterapia con tratamiento de soporte exclusivo. Los tratamientos combinados resultan superiores a la monoterapia, y lo mismo ocurre con los tratamientos a base de 2 ó 3 drogas, aunque a expensas de una mayor toxicidad. La administración de 5 Fluoruracilo en infusión continua exhibe menos muertes por toxicidad que cuando la droga se administra en bolos.
Se recomienda el esquema de quimioterapia siguiente: 5 Fluoruracilo 1 g diario, adriamicina 50 mg/m2 según superficie corporal (SC) y mitomicín C 10-20 mg/dosis. Administrar 6 ciclos cada 6 semanas (días 1-8-28-35). Comenzar el próximo ciclo a los 10 días de concluido el anterior. Continuar con 5 Fluoruracilo por vía oral (tegafur) 1 g diario durante un año. Desde 199949 se ha valorado la utilización de quimioterapia intraoperatoria con mitomicín C: inyectar 10 mg a nivel de la vena porta o de la gastroepiploica derecha, y 10 mg en la cavidad peritoneal, disuelto en 500 mL de solución salina antes del cierre del peritoneo.
No existen estudios con suficiente nivel de evidencia que constaten que la radioterapia pre o intraoperatoria, solas o combinadas en el tratamiento del carcinoma gástrico, consigan disminuir la recurrencia locorregional, ni mejorar la supervivencia obtenida por la cirugía como tratamiento único.
Hasta la fecha solo no se dispone de resultados respecto a quimiorradioterapia neoadyuvante. La administración de quimio-radio-quimioterapia tras la resección quirúrgica, como tratamiento adyuvante en el carcinoma gástrico, según el estudio aleatorizado multicéntrico de MacDonald y otros50 (5 Fluoruracilo y leucovorín-radioterapia-5 Fluoruracilo y leucovorín), demostró mejoría significativa en la supervivencia respecto al grupo de pacientes que fueron tratados únicamente con cirugía. La sobrevida global promedio fue mejor en el grupo tratado (36 y 27 meses, respectivamente), con 32 % de toxicidad moderada o severa (grados III y IV) y 1 % de muertes asociadas a la quimioterapia. El efecto es atribuible a la disminución de las recaídas locorregionales, y por lo tanto, a la radiación. En el estudio, más de la mitad de los pacientes fue sometido a una disección menor de D1 -subóptima- y solo en 10 % llegó a D2. Si bien el estudio no detectó diferencias de sobrevida en los pacientes según el nivel de disección ganglionar, tampoco tenía poder suficiente para evaluarlas.
Los mecanismos inmunológicos en la defensa antitumoral son más efectivos durante las etapas iniciales del tumor y en el control de las micro-metástasis. Estos mecanismos y la obtención de productos inmunomoduladores, con potencial terapéutico, están en estudio a través de múltiples ensayos clínicos. Se estudia la aplicación de antagonistas de receptores de crecimiento y los agentes anti-angiogénesis.14,36 El conocimiento de la inmunobiología tumoral y el desarrollo de los métodos de modulación de la respuesta inmune, convierten a la inmunoterapia en el cuarto pilar de tratamiento del cáncer gástrico, junto con la cirugía, la radioterapia y la quimioterapia. Esta modalidad terapéutica no sustituirá las clásicas, pero desempeñará un papel importante en la prevención y en el tratamiento para erradicar las micrometástasis.14,36
Esquemas de tratamiento médico
Existen tratamientos adyuvantes para pacientes con cáncer gástrico operable que han demostrado beneficios en sobrevida. Los pacientes deben ser informados de estas opciones y de sus potenciales beneficios y efectos adversos, conforme con los ensayos aleatorizados evaluados:
• A los pacientes con tumores localmente avanzados operables sin evidencia de metástasis y con estado funcional 0 o 1 (según clasificación de la OMS), se le puede ofrecer la opción de quimioterapia neoadyuvante con régimen EFC (epirubicina, cisplatino y 5 Fluoruracilo pre y posoperatorio).
• En pacientes operados con resecciones R0, con compromiso de la serosa o ganglios estadios IB a IV M0, puede indicarse un tratamiento a base de quimiorradioterapia posoperatoria.
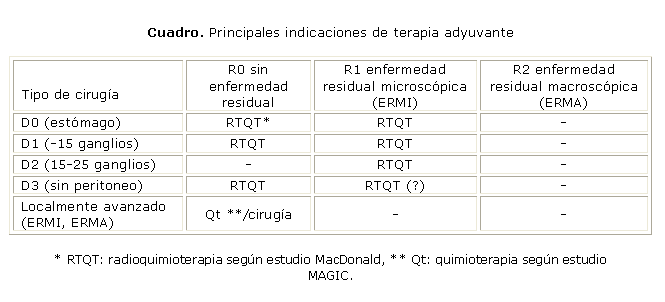
Si bien no existe un consenso formal sobre la materia, cada caso debe evaluarse individualmente. La mayoría de los expertos consultados considera que, a la luz de la evidencia existente, las principales indicaciones de terapia adyuvante serán las expuestas en el cuadro.
La quimioterapia neoadyuvante (MAGIC Trial),48 consta de 3 ciclos preoperatorios y 3 posoperatorios. Cada ciclo, de 3 semanas, consiste en:
- Epirubicin (50 mg/m2) en bolo IV el día 1.
- Cisplatin (60 mg/m2) IV con hidratación el día 1.
- 5-Fluorouracil (200 mg/m2) diario por 21 días en infusión continua.
Se recomienda agregar un mg diario de warfarina para profilaxis de trombosis.
Previo a cada ciclo, se realizará un recuento hematológico completo (electrolitos, urea, creatinina) y pruebas de función hepática. Son recomendables modificaciones a este régimen en pacientes con mielosupresión y trombocitopenia, y del fluorouracilo en aquellos con estomatitis, síndrome mano-pie (eritrodisestesia palmar-plantar), y diarreas. En pacientes con historia de cardiopatía isquémica, hay que evaluar fracción de eyección mediante ecocardiograma. Si esta es menor al 50 %, se debe omitir epirubicina. Si se produce aumento en niveles de creatinina, ajustar dosis de cisplatino según aclaramiento o índice de depuración plasmática. Descontinuar la droga en pacientes con ototoxicidad o daño sensorial significativo.
La quimiorradioterapia adyuvante (MacDonald Trial)50 es como sigue: quimioterapia 20 a 40 días después de la cirugía, con 425 mg/m2 por día de fluorouracil, y 20 mg/m2 por día durante 5 días de leucovorina.
La quimio-radioterapia comienza 28 días después del inicio del primer ciclo de quimioterapia. Consiste en 4 500 Gy a 180 cGy diarios, 5 días a la semana por 5 semanas, sumado a fluorouracilo (425 mg/m2 por día) y leucovorina (20 mg/m2 por día) en bolo IV en los primeros 4 y últimos 3 días de la radioterapia. Un mes después de completar la radioterapia, aplicar 2 ciclos de 5 días de fluorouracil (425 mg/m2 por día) y leucovorina (20 mg/m2 por día), separados por un mes. La dosis de fluorouracilo debe reducirse en pacientes con efectos tóxicos mayores (grados III y IV).
Los 4 500 Gy de radiación se administran en 25 fracciones, 5 días a la semana, al lecho tumoral, los ganglios regionales y 2 cm más allá de los márgenes distal y proximal de la resección. La presencia de lesiones proximales T3 requiere tratamiento del hemidiafragma izquierdo medial. Los campos de radiación incluyen los ganglios perigástricos, celiacos, paraaórticos locales, esplénicos, hepatoduodenales o hepático-portales, y pancreáticoduodenales. Se permite la exclusión de ganglios esplénicos en pacientes con lesiones antrales, si es necesario para respetar el riñón izquierdo. La radiación se administra con al menos 4 MeV photons.
Tratamiento paliativo1
A los pacientes con cáncer avanzado se les puede ofrecer la opción de quimioterapia paliativa con esquema de 5 Fluoruracilo (425 mg/m2) y leucovorina (20 mg/m2) en los días 1 al 5, y continuar cada 21 ó 28 días por 6 ciclos. Todos los pacientes que se encuentran fuera de alcance para tratamiento curativo, deben recibir cuidados paliativos y alivio del dolor según necesidad.
Los criterios de curabilidad se exponen a continuación:1
A: cuando la cirugía se realiza en un paciente con tumor igual o menor a T2, compromiso ganglionar igual o menor al nivel D1, sin metástasis hepáticas ni peritoneales, márgenes de resección libres de tumor y nivel de resección D2.
B: si no se cumplen rigurosamente los requisitos anteriores.
C: se considera cirugía paliativa, siempre que las metástasis peritoneales y hepáticas sean mayores a 1, y radicalidad menor a N (sin resección o incompleta de adenopatías), o borde de resección del tumor positivo de células neoplásicas.
Las pautas de seguimiento son las siguientes:
- Cánceres incipientes sometidos a resección endoscópica: a los 3, 6, 12, 18 y 24 meses se realizará examen clínico, endoscopia y biopsia (anatomía patológica). De los 2 a los 5 años, se realizará examen clínico anual, mientras que endoscopia y TAC a los 3 y 5 años.
- Cánceres incipientes sometidos a gastrectomía: además del examen clínico efectuado por el cirujano, al mes, a los 15 y 21 meses se realizará hemograma y fosfatasa alcalina; a los 8 y 18 meses, se añade TAC de abdomen y Rx de tórax; y al tercer y quinto años, TAC de abdomen y fosfatasa alcalina. El examen clínico se repetirá al año y a los 2 años, y se indicarán los estudios complementarios que se consideren necesarios.
- Cánceres avanzados sometidos a gastrectomía: el examen clínico realizado por el cirujano se repetirá cada 3 meses hasta los 2 años, y cada 6 meses en lo adelante. Se indica hemograma y fosfatasa alcalina a los 3, 12 y 24 meses, así como añadir TAC de abdomen y Rx de tórax semestral, a partir del sexto mes hasta los 5 años.
Las localizaciones locorregional (25 %) y peritoneal (50 %) son las formas más frecuentes de recurrencia en los carcinomas gástricos. El hallazgo exclusivo de metástasis a distancia ocurre en menos de 25 % de los enfermos con recurrencia. La diseminación peritoneal se origina de la exfoliación e implante de células tumorales viables de la neoplasia primaria o de la transección de linfáticos, y aparece durante el seguimiento en más del 50 % de los pacientes en los que el tumor gástrico afecta a la serosa.7-9 Gunderson y Sosin51 describieron el patrón de recurrencia en pacientes con carcinomas gástricos resecados con afección ganglionar tras la realización sistemática de laparotomías (second look) o ante la aparición de sintomatología. En este estudio encontraron que la recurrencia era locorregional exclusiva en el 54 % de los enfermos, y solo detectaron metástasis a distancia de forma exclusiva o combinada en el 6 y 29 %, respectivamente. En estudios donde la recurrencia se ha evaluado a través de exámenes complementarios, las localizaciones peritoneal y a distancia son más frecuentes que la locorregional exclusiva. El patrón de recurrencia parece depender del tipo histológico, y es más habitual encontrar metástasis hepáticas en el tipo intestinal, y diseminación peritoneal en el difuso.52,53
Finalmente, la recurrencia aparece durante los primeros 2-3 años, luego de la resección del tumor primario en el 70 % de los pacientes, y durante el tercero al quinto en el 30 % restante. La recurrencia locorregional o a distancia es infrecuente tras 5 años de la resección.52,53 Los seguimientos de los pacientes con carcinoma gástrico a los que se les ha realizado una resección R0, tienen como objetivo el diagnóstico precoz de la recurrencia para poder mejorar la efectividad del tratamiento. Sin embargo, los protocolos, que incluyen la realización sistemática de exámenes complementarios y marcadores tumorales, no parecen ser superiores a un seguimiento basado en los síntomas y signos clínicos. Esto es atribuible a la dificultad para detectar precozmente la recurrencia peritoneal miliar, que es una forma frecuente en estos enfermos. Entre las más utilizadas se encuentran la endoscopia,27,28 la tomografía computarizada (TC),53 y la determinación de marcadores tumorales.54 La endoscopia es útil para diagnosticar la recurrencia precoz en la luz del tracto digestivo, aunque la aparición de una recurrencia intraluminal ocurre, generalmente, por la extensión de una extraluminal, mientras que la TC abdominal helicoidal es la exploración más utilizada, por ser bastante sensible para detectar recurrencia locorregional, adenopatías metastásicas mayores de 0,8 cm, carcinomatosis en el epiplón mayor, ascitis y metástasis hepáticas, pero su sensibilidad es baja para detectar metástasis focales, las adenopatías metastásicas de pequeño tamaño, y la carcinomatosis peritoneal miliar. La resonancia magnética nuclear (RMN) no ha aportado ventajas significativas sobre la TC en relación con la detección de adenopatías metastásicas, aunque puede ayudar en la evaluación de lesiones hepáticas detectadas mediante TC.
La tomografía con emisión de positrones marcada con fluorodesoxiglucosa (PET-FDG)55 detecta lesiones metastásicas por el aumento de la actividad metabólica en lugar de por las características estructurales de la lesión, y su utilidad en el seguimiento del cáncer gástrico ha sido evaluada en un estudio reciente,55 en el cual, la precisión diagnóstica, la sensibilidad y la especificidad de esta prueba no superó el 70 %, y el valor predictivo negativo fue de 60 %. Además, se ha observado que su sensibilidad puede disminuir cuando se evalúan neoplasias gástricas de tipo histológico difuso con células en anillo de sello, debido a la poca avidez que presenta el moco citoplasmático por la fluorodesoxiglucosa. La realización de la PET-TC combinadas durante el seguimiento incluye la detección de recurrencia desde el punto de vista morfológico y de la actividad metabólica, pero aún no existen estudios en pacientes operados por carcinoma gástrico.
Los marcadores tumorales54 más utilizados en el seguimiento de estos pacientes son el antígeno carcinoembrinario (CEA), el CA 19-9, el CA 72-4 (el más específico), y, más recientemente, el CA 125. El CEA ha sido uno de los más utilizados, pero el incremento del CEA antes o al mismo tiempo que la aparición de la sintomatología, ocurre en la mitad de las recurrencias. Sin embargo, cuando se utilizan conjuntamente el CEA, el CA 19-9 y el CA 72-4, la sensibilidad en la detección de la recurrencia (locorregional y a distancia) aumenta de forma considerable. Finalmente, el CA 125 es un marcador que está presente en las células mesoteliales del peritoneo, y su determinación podría interesar en el seguimiento de estos enfermos, ya que parece que la diseminación peritoneal puede elevar los valores séricos de este marcador.
En resumen, el grado de invasión de la pared y la metástasis ganglionar son los factores pronósticos independientes que comportan un riesgo relativo mayor de recurrencia (locorregional, peritoneal y a distancia), la cual aparece durante los primeros 2-3 años tras la resección del tumor primario en el 70 % de los enfermos, y durante el tercer a quinto año en el 30 % restante. El resultado de la citología del lavado peritoneal puede convertirse en un factor pronóstico muy importante, una vez que se consiga aumentar su sensibilidad y su valor predictivo negativo. El seguimiento posoperatorio no puede ser sistematizado debido a la baja sensibilidad de los métodos para detectar precozmente el patrón de recurrencia: endoscopia, ultrasonido diagnóstico (USD), ultrasonido diagnóstico endoscópico (USE), TC, PET, RMN, marcadores tumorales; así como por la ausencia de su tratamiento efectivo.
Estudios observacionales no han demostrado beneficio en los programas de seguimiento posoperatorio en términos de supervivencia o de detección temprana de complicaciones o recurrencias, sin embargo, es considerado universalmente una buena práctica médica, y sí existe evidencia de que produce efectos beneficiosos sobre la calidad de vida en pacientes oncológicos. Respecto a las recomendaciones sobre este aspecto, todos los centros que atienden enfermos con cáncer gástrico deben poseer un sistema de registro estandarizado, que dé cuenta del proceso diagnóstico y del tratamiento efectuado a cada enfermo, y de los desenlaces clínicos y complicaciones, o efectos adversos observados en corto y largo plazos. Todos los pacientes tratados por cáncer gástrico deben ser sometidos a un seguimiento programado cuyos objetivos son: el diagnóstico precoz de recurrencias, así como el diagnóstico y atención de las complicaciones tempranas o tardías derivadas del tratamiento.
El linfoma gástrico primario3 es un tumor no Hodgkin, para cuyo diagnóstico se siguen los criterios de Dawson:
1. Lesión linfomatosa gástrica que afecta o no ganglios regionales.
2. Ausencia de afectación ganglionar periférica, mediastínica o ambas.
3. Ausencia de afectaciones hepática, esplénica o ambas, excepto por contigüidad.
4. Recuento normal de leucocitos en sangre periférica.
Esta neoplasia constituye el 4 % de los tumores malignos del estómago; su tratamiento es médico-quirúrgico, aunque en la actualidad algunos autores plantean el tratamiento exclusivo con quimio y radioterapia. La supervivencia estimada a los 5 años después de la operación es entre un 40 y 60 %.
REFERENCIAS BIBLIOGRÁFICAS
1. Ministerio de Salud. Guía Clínica Cáncer Gástrico. Serie Guías Clínicas MINSAL Nº 35. Santiago de Chile: MINSAL; 2006. p. 12-43.
2. Parkin MD, Bray JF, Pisani F, Pisani P. Global Cancer Statistics 2002. Cancer J Clin. 2005;55:74-108.
3. Yera Abreu L. Tumores del estómago. En: Enfermedades quirúrgicas del abdomen. Capítulo VIII. García Gutiérrez, Pardo Gómez. Cirugía Tomo III. La Habana: Editorial Ciencias Médicas; 2008. p. 1 160-74.
4. Ministerio de Salud Pública. Dirección Nacional de Registros Médicos y Estadísticas de Salud. Anuario Estadístico de Salud. La Habana; 2009. p. 32-5, 40-9, 53.
5. Jurado C. Cáncer gástrico: visión y misión de un cirujano endoscopista. Revisión de tema. Rev Colombiana Cir. 2008;21(2):85-99.
6. Santoro E. The history of gastric cancer. Gastric cancer: legends and chronicles. Gastric Cancer Japan. 2005;8:71-4.
7. Yan-Quiroz EF, Diaz-Plasencia JA, Burgos-Chávez OA, Rojas-Vergara M, Santillán-Medina J, Vilela-Guillén ES, et al. Factores pronósticos de sobrevida quinquenal de pacientes con carcinoma gástrico avanzado resecable con serosa expuesta. Rev Gastroenterol Perú. 2003;23:184-91.
8. Sdteete G, Lynch O, Madariaga J, Zilic M, Martínez L, Schultz S, et al. Patrón pronóstico de invasión serosa (S2) en carcinoma gástrico. Rev Chilena de Cirugía. Diciembre 2002;54(6):644-8.
9. Calpena R, Lacuela FJ, Oliver I, Cansado P, Pérez F, Costa D, et al. Estado actual del tratamiento multidisciplinario del cáncer gástrico avanzado. Cir Esp. 2003;74(2):69-76.
10. Villafranca E, Arista J, Meiriño R, Dueña MT, Marcos M. Factores pronósticos del carcinoma gástrico. ANALES Sis San Navarra. 2001;24(Suplemento 1):111-20.
11. Casariego E, Pita S, Rigueiro MT, Pértiga S, Rubañal R, García-Rodeja ME, et al. Supervivencia en 2334 pacientes con cáncer gástrico y factores que modifican el pronóstico. Medicina Clínica, Barcelona. 2001;117(10):361-5.
12. Tahara E. Mechanisms of carcinogenesis: contributions of molecular epidemiology. Buffler PA, editor. Lyon: International Agency for Research on Cancer; 2004. p. 327-49.
13. Rodríguez P. Carcinogénesis gástrica. En: Linhares E, Lourenco L, Sano T, editores. Actualización en cáncer gástrico. 2005;25:81-7.
14. Batista Duharte A. Función del sistema inmune en la defensa contra tumores malignos. MEDISAN [serie en internet]. 2003 [citado 10 de octubre de 2010];7(2). Disponible en: http://bvs.sld.cu/revistas/san/vol7_2_03/san11203.htm
15. Bormann R. Geschwuelste des Magens und Duodenum. En: Henke F, Lubarsch D, editors. Handbuch der Spezieller Pathologischen Anatomie und Histologie. Vol. 4. Berlin: Julius Springer; 1926. p. 128-35.
16. Lauren P. The two histologic main types of gastric carcinoma: diffuse and so-called intestinal type carcinoma: an attempt at a histochemical classification. Acta Pathol Microbiol Scand. 1965;64:31-49.
17. Adachi Y, Yasuda K, Inomata M, Sato K, Shiraishi N, Kitano S. Pathology and prognosis of gastric carcinoma. Well versus poorly differentiated type. Cancer. 2000;89:1418-24.
18. Chan A, Chun Yu, Wong Benjamín. Epidemiology of gastric cancer. [monografía en internet]. Walthman (MA): Update 2005 [citado 28 de octubre de 2008]. Disponible en: http://www.uptodate.com
19. Aravena E. Helicobacter pylori y cáncer gástrico. Gastr Latinoam. 2007;18(2):129-32.
20. Rubiano J, Velásquez M. Atrofia, metaplasia y cáncer gástrico, ¿dónde está la evidencia? Rev Colomb Cir. 2007;22:39-45.
21. Hurtado M. Gastritis crónica atrófica, metaplasia intestinal, tratamiento. Rev Colomb Gastroenterol. 2007;22:4-6.
22. Stomach. In: Edge SB, Fritz AG, Byrd DR, Greene FL, Trotti A, Compton CC editors. American Joint Committee on Cancer (AJCC). Cancer Staging Manual. 7th Edition. New York: Springer; 2010. p. 66-75.
23. Casado Martín F, Domínguez Díaz A, Rodríguez Sanjuán JC, López Useros A, Cabrera García M, Moreno Muzas C, et al. Cirugía del cáncer gástrico precoz. Experiencia en 25 años. Gastroenterología y hepatología. 2001;24(9):123-35.
24. Inoue K, Tobe T, Kan N. Problems in the definition and treatment of early gastric cancer. Br J Surg. 2001;78:818-21.
25. Bruno M. Magnification endoscopy, high resolution endoscopy, and chromoscopy, towards a better optical diagnosis. Gut. 2003;52:7-11.
26. Kiesslich R, Arjus M, Neurath F. Endomicroscopy. Gastrointest Endosc. 2007;66:153.
27. Willis S, Truong S, Gribnitz S, Fass J, Schumpelick V. Endoscopic ultrasonography in the preoperative staging of gastric cancer: accuracy and impact on surgical therapy. Surg Endosc. 2000 Oct;14(10):951-4.
28. Kelly S, Harris KM, Berry E, Hutton J, Roderick P, Cullingworth J, et al. A systematic review of the staging performance of endoscopic ultrasound in gastro-oesophageal carcinoma. Gut. 2001 Oct;49(4):534-9.
29. Kinkel K, Lu Y, Both M, Warren RS, Thoeni RF. Detection of hepatic metastases from cancers of the gastrointestinal tract by using non-invasive imaging methods (US, CT, MR imaging, PET): a meta-analysis. Radiology. 2002 Sep;224(3):748-56.
30. Kong SH, Park DO J, Lee HJ, Jung HC, Lee KU, Choe KJ, et al. Clinic pathologic features of asymptomatic gastric adenocarcinoma patients in Korea. Jpn J Clin Oncol. 2004 Jan;34(1):1-7.
31. Adachi Y, Kitano S, Sugimachi K. Surgery for gastric cancer: 10-year experience worldwide. Gastric Cancer. 2001;4:166-74.
32. Miki M. Usefulness of gastric cancer screening using the serum pepsinogen test method. Am J Gastroenterol. 2003;98:735-9.
33. Onate-Ocana LF, Gallardo-Rincon D, Aiello-Crocifoglio V, Mondragon-Sanchez R, de-la-Garza-Salazar J. The role of pretherapeutic laparoscopy in the selection of treatment for patients with gastric carcinoma: a proposal for a laparoscopic staging system. Ann Surg Oncol. 2001;8(8):624-31.
34. Ichikura T, Tomimatsu S, Uefuji K, Kimura M, Uchida T, Morita D. Evaluation of the New American Joint Committee on Cancer / International Union Against Cancer classification of lymph node metastasis from gastric carcinoma in comparison with the Japanese classification. Cancer. 1999;86:553-8.
35. Suzuki T, Ochiai T, Hayashi H, Mori S, Shimada H, Isono K. Peritoneal lavage cytology findings as prognostic factor for gastric cancer. Sem Surg Oncol. 1999;17:103-7.
36. Sánchez Socarrás V. Papel de la angiogénesis en el crecimiento tumoral. Rev Cubana Invest Biomed. 2001;20(3):223-30.
37. Lacueva FJ, Calpena R, Medrano J, Teruel A, Mayol MJ, Graells ML, et al. Changes in P glycoprotein expression in gastric carcinoma with respect to distant gastric mucosa may be influenced by p53. Cancer. 2000;89:21-8.
38. Metzger R, Leichman CG, Danenberg KD, Danenberg PV. ERCC1 mRNA levels complement thymidylate synthase mRNA levels in predictor response and survival for gastric cancer patients receiving combination cisplatin and fluoracil chemotherapy. J Clin Oncol. 1998;16:309.
39. Mc Culloch P, Nita ME, Lazo H. Extended versus limited lymph nodes dissection technique for adenocarcinoma of the stomach. Cochrane Database Syst Rev. 2004;(4):1526-31.
40. Hartgrink HH, van de Velde CJ, Putter H. Extended lymph node dissection for gastric cancer. Who may benefit? Final results of the randomized Dutch gastric cancer group trial. J Clin Oncol. 2004;22:2069-77.
41. Csendes A, Burdiles P, Rojas J, Braghetto I, Diaz JC, Maluenda F. A prospective randomized study comparing D2 total gastrectomy versus D2 total gastrectomy plus splenectomy in 187 patients with gastric carcinoma. Surgery. 2002 Apr;131(4):401-7.
42. Maruyama K, Sasako M, Kinoshita T, Sano T, Katai H, Okajima K. Pancreas-preserving total gastrectomy for proximal gastric cancer. World J Surg. 1995 Jul-Aug;19(4):532-6.
43. Roig J, Gironés J, Pujades M, Codina A, Quesada B. Cirugía laparoscópica en el cáncer gástrico. Cir Esp. 2004;76(6):376-81.
44. Onate-Ocana LF, Gallardo-Rincon D, Aiello-Crocifoglio V, Mondragon-Sanchez R, de-la-Garza-Salazar J. The role of pretherapeutic laparoscopy in the selection of treatment for patients with gastric carcinoma: a proposal for a laparoscopic staging system. Ann Surg Oncol. 2001;8(8):624-31.
45. Hartgrink HH, Putter H, Klein Kranenbarg E, Bonenkamp JJ, van de Velde CJ, Dutch Gastric Cancer Group. Value of palliative resection in gastric cancer. Br J Surg. 2002 Nov;89(11):1438-43.
46. Wagner AD, Grothe W, Haerting J, Kleber G, Grothey A, Fleig WE. Chemotherapy in advanced gastric cancer: a systematic review and meta-analysis based on aggregate data. J Clin Oncol. 2006 Jun 20;24(18):2903-9.
47. Suzuki T, Ochiai T, Hayashi H, Mori S, Shimada H, Isono K. Peritoneal lavage cytology findings as prognostic factor for gastric cancer. Sem Surg Oncol. 1999;17:103-7.
48. Allum W, Cunningham D, Weeden S. Perioperative chemotherapy in operable gastric and lower oesophageal cancer: a randomised, controlled trial (the MAGIC trial, ISRCTN 93793971). Proc Am Soc Clin Oncol. 2003;22:249.
49. González Moreno S, Sugarbaker PH. Comprehensive management of resectable gastric cancer: requirement for optimal clearance, containment and perioperative intraperitoneal chemotherapy. Rev Oncol. 2000;3:129-40.
50. MacDonald JS, Smalley SR, Benedetti J. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med. 2001;345(10):725-30.
51. Gunderson LL, Sosin H. Adenocarcinoma of the stomach: areas of failure in a re-operation series (second or symptomatic look) clinicopathologic correlation and implications for adjuvant therapy. Int J Radiation Oncology Biol Phys. 1998;8:1-4.
52. Yoo CH, Noh SH, Shin DW, Choi SH, Min JS. Recurrence following curative resection for gastric carcinoma. Br J Surg. 2000;87:236-42.
53. Kim KW, Choi BI, Han JK, Kim TK, Kim AY, Lee HJ, et al. Postoperative anatomic and pathologic findings at CT following gastrectomy. Radiographics. 2002;22:323-36.
54. Marrelli D, Pinto E, De Stefano A, Farnetani M, Garosi L, Roviello F. Clinical utility of CEA, CA 19-9 and CA 72-4 in the follow-up of patients with resectable gastric cancer. Am J Surg. 2001;181:16-9.
55. De Potter T, Flamen P, Van Cutsem E, Penninckx F, Filez L, Bormans G, et al. Whole-body PET with FDG for the diagnosis of recurrent gastric cancer. Eur J Nucl Med. 2002;29:525-9.
Recibido: 28 de diciembre de 2010.
Aprobado: 14 de enero de 2011.
Zenén Rodríguez Fernández. Hospital Provincial Docente "Saturnino Lora". Carretera Central y Calle 4tª, reparto Sueño. Santiago de Cuba, Cuba. Correo electrónico: zenen@medired.scu.sld.cu