Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm vol.48 no.4 Ciudad de la Habana oct.-dic. 2014
PRODUCTO NATURAL
Recubrimiento de microesferas de quitosana-ibuprofeno con un complejo interpolimérico pH dependiente
Coating of chitosan-Ibuprofen microspheres with a pH-depending interpolymer complex
MSc. Jomarien García Couce,I Tec. Nancy Bada Rivero,I DrC. Orestes Darío López Hernández,II Tec. Antonio Nogueira Mendoza,III DrC. Pablo Christian Caracciolo,IV DrC. Gustavo Abel Abraham,IV DrC. José Ángel Ramón Hernández,I DrC. Carlos Peniche CovasI
I Centro de Biomateriales (BIOMAT), Universidad de La Habana. La Habana, Cuba.
II DLIP S.A. Lasso. Cotopaxi, Ecuador.
III Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
IV Instituto de Investigaciones en Ciencia y Tecnología de Materiales INTEMA (UNMdP-CONICET). Mar del Plata, Argentina.
RESUMEN
Introducción: el efecto irritante sobre la mucosa gástrica que producen los antiinflamatorios no esteroideos es una de sus principales reacciones adversas. La encapsulación de estos en matrices poliméricas con propiedades entéricas constituye una alternativa tecnológica para solucionar dicho problema.
Objetivo: obtener micropartículas de quitosana cargadas con ibuprofeno recubiertas con un complejo interpolimérico pH dependiente a base de poli(ácido acrílico)/poli(N-vinil-2-pirrolidona)
Métodos: se prepararon micropartículas de quitosana cargadas con ibuprofeno mediante secado por aspersión y se determinó el rendimiento del proceso y la eficiencia de encapsulación. Las micropartículas se recubrieron con un complejo interpolimérico pH dependiente de poli(ácido acrílico)/poli(N-vinil-2-pirrolidona), empleando la técnica de emulsión/evaporación del disolvente. Mediante espectroscopia infrarroja de transformada de Fourier, se comprobó la formación del complejo, y la evaluación morfológica se realizó por microscopia electrónica de barrido. Los estudios de liberación se realizaron en fluido gástrico e intestinal simulados (FGS pH= 1,2; FIS pH= 6,8).
Resultados: en el proceso de obtención de las micropartículas de quitosana y quitosana-ibuprofeno hubo un rendimiento de 69 ± 1 % y 54,4 ± 0,8 % respectivamente. La eficiencia de encapsulación resultó de 46,8 ± 0,7 %. Las micropartículas recubiertas presentaron una superficie rugosa. La formación del complejo se confirmó a través de los cambios observados en la posición de las bandas de absorción de los grupos funcionales involucrados en la formación del enlace por puente de hidrógeno. La liberación de ibuprofeno en FGS resultó del 40 % para las micropartículas sin recubrimiento, mientras que fue despreciable en el caso de las micropartículas recubiertas durante el intervalo de tiempo estudiado.
Conclusiones: los resultados muestran las potencialidades del complejo interpolimérico poli(ácido acrílico)/poli(N-vinil-2-pirrolidona) como cubierta pH dependiente, con vistas a obtener un recubrimiento de tipo entérico que reduzca los efectos adversos sobre la mucosa gástrica de fármacos como los antiinflamatorios no esteroideos.
Palabras clave: complejos interpoliméricos, quitosana, microesferas, secado por aspersión, ibuprofeno.
ABSTRACT
Introduction: the irritating effect on the gastric mucosa caused by non-steroidal anti-inflammatory drugs is one of the main adverse reactions. Their encapsulation in polymer matrices with enteric properties is a technological alternative to solve the problem.
Objective: to obtain ibuprofen-loaded chitosan microparticles coated with a pH dependent interpolymer complex based on poly(acrylic acid)/poly(N-vinyl-2-pyrrolidone).
Methods: Ibuprofen-loaded chitosan microparticles were prepared through the spray drying technique; the yield and the efficiency of encapsulation were evaluated. Microparticles were coated with a pH-dependent interpolymer complex based on poly(acrylic acid)/poly(N-vinyl-2-pyrrolidone) using the emulsion/solvent evaporation technique. The complex formation was verified by Fourier transform infrared spectroscopy and the morphological evaluation was made with the electronic scanning microscopy. Release studies used simulated gastric (SGF, pH= 1.2) and intestinal (SIF, pH= 6.8) fluids.
Results: in the process of obtaining the chitosan and chitosan-ibuprofen microparticles, the yield rates amounted to 69 ± 1 % and 54.4 ± 0.8 % respectively were obtained. The encapsulation efficiency was 46.8 ± 0.7 %. The coated microparticles presented rough surface. Complex formation was confirmed by changes in the position of the absorption bands of the functional groups involved in hydrogen bonding. The release of ibuprofen from uncoated microparticles in simulated gastrointestinal fluid reached 40 % whereas it was neglectable in the coated microparticles during the study interval.
Conclusions: the results show the potential of poly(acrylic acid)/poly(N-vinyl-2-pyrrolidone) interpolymer complex as pH dependent cover for use as enteric coating to reduce the side effects on the gastric mucosa of medications such as non-steroidal anti-inflammatory drugs.
Keywords: interpolymer complex, chitosan, microspheres, spray drying, ibuprofen.
INTRODUCCIÓN
El ibuprofeno (ácido 2-(4-isobutilfenil) propiónico) es un potente antiinflamatorio no esteroideo (AINE) cuyo tiempo de vida media en sangre es de 1,8-2 h. Se utiliza frecuentemente para el alivio sintomático del dolor de cabeza, dental, muscular, neurológico de carácter leve y síndrome febril.1,2 Se descompone en presencia de luz y puede reaccionar con el CO2 atmosférico. Como ocurre con otros AINE, la irritación gástrica es una de las mayores reacciones adversas tras su administración por vía oral.3 Por tanto, la encapsulación en una matriz polimérica resulta una estrategia apropiada para la protección de fármacos frente a los factores externos que puedan inducir una alteración de las propiedades, para reducir la irritación gástrica producida tras su administración y para modificar el perfil de liberación en función del entorno.4
La microencapsulación ha permitido la estabilización de moléculas inestables, la conversión de ingredientes activos líquidos en formas sólidas fácilmente manipulables y almacenables, así como también la inclusión de principios activos incompatibles en una misma forma farmacéutica. Para uso oral, ha sido empleada en el enmascaramiento de olor y sabor, en el incremento del tiempo de vida media del fármaco y para controlar su liberación en uno o más sitios, disminuyendo o eliminando la irritación sobre el tracto gastrointestinal producida por algunos fármacos como los AINE.4-7
Entre los biomateriales empleados para la microencapsulación de fármacos se incluyen los polímeros naturales o biopolímeros y los polímeros sintéticos. La quitosana ha sido de los polímeros naturales más estudiados por sus excelentes propiedades, tales como biocompatibilidad, biodegradabilidad y ausencia de toxicidad, por lo que ha sido aplicada ampliamente en la industria médico-farmacéutica.8,9 A pesar de estas ventajas su solubilidad en medios ácidos limita su empleo en formulaciones para uso oral, dado que se disuelve en el medio ácido estomacal liberando el fármaco contenido en la matriz. Para superar esta seria limitación, las micropartículas de quitosana pueden modificarse por entrecruzamiento o mediante la aplicación de un recubrimiento, reduciendo así la solubilidad y aumentando su resistencia a la degradación química o biológica. Los polímeros acrílicos han sido ampliamente utilizados como material de recubrimiento, especialmente los copolímeros de ácido metacrílico-metacrilato de metilo (Eudragit® RS1, RS2).10 En el presente trabajo se propone una variante para obtener una película con propiedades entéricas, que evite la liberación del fármaco de la matriz en medio ácido. Este recubrimiento se basa en un complejo interpolimérico entre poli(ácido acrílico) y poli(N-vinil-2-pirrolidona) que resulta estable en medio ácido a través de la formación de enlaces intermoleculares de tipo puente de hidrógeno.
MÉTODOS
Se empleó ibuprofeno (IBP, Hubel, China), quitosana (QUI, Aldrich, Mv= 1,14 x 105 g/mol, grado de acetilación= 19,0 ± 0,4 %), poli(ácido acrílico) (PAA, Aldrich, Mv= 450 000 g/mol), poli(N-vinil-2-pirrolidona) (PVP K-90, Fluka, Mw= 360 000 g/mol) y tripolifosfato sódico (TPP, Sigma-Aldrich).
OBTENCIÓN DE MICROPARTÍCULAS DE QUI-IBP MEDIANTE SECADO POR ASPERSIÓN
Para la obtención de micropartículas de quitosana cargadas con ibuprofeno se partió de una disolución de QUI al 2 % (m/v) en ácido acético al 2 % (v/v). El IBP y el TPP se adicionaron a la disolución de quitosana en un 30 % y un 1 %, respectivamente, con relación a la masa del polímero. La suspensión resultante se atomizó en un mini Spray-Dryer B-191 (Büchi Labortechnik AG, Flawil, Suiza) con boquilla de 0,7 µm a una temperatura de entrada de 170 ºC con un flujo de líquido de alimentación a 5 mL/min y una temperatura de salida de 115 ºC.
RECUBRIMIENTO DE MICROPARTÍCULAS DE QUI-IBP CON EL COMPLEJO INTERPOLIMÉRICO PAA/PVP
Las micropartículas cargadas fueron recubiertas con el complejo interpolimérico PAA/PVP mediante la técnica de emulsión/evaporación del disolvente. Se empleó como base oleosa 100 mL aceite de girasol con un 2 % (v/v) de SPAN 80 y como fase acuosa se adicionaron gota a gota 10 mL de la mezcla polimérica PAA/PVP que contenía 50 mg de micropartículas QUI-IBP bajo agitación magnética a 500 r.p.m. durante 30 min. Posteriormente el sistema se calentó a 60 ºC durante 2 h. Finalmente las partículas se lavaron tres veces con una mezcla acetona:agua (70:30) para retirar la fase oleosa y liofilizadas en un lifilizador de plato Virtis (SP Industries, NY, USA, model 2KBTES-55).
EVALUACIÓN MORFOLÓGICA DE LAS MICROPARTÍCULAS
La forma y superficie de las micropartículas de quitosana recubiertas y no recubiertas fueron observadas por microscopia electrónica de barrido (SEM, JEOL Ltd., USA) empleando una tensión de 15 kV, luego de recubrir con Au/Pd.
DETERMINACIÓN DEL RENDIMIENTO Y EFICIENCIA DE ENCAPSULACIÓN
El rendimiento se determinó a partir de la relación entre la masa final de micropartículas obtenidas después del secado por aspersión y la masa inicial de polímero y fármaco atomizados. La eficiencia de encapsulación se determinó a partir de la cuantificación de la cantidad real de ibuprofeno presente en 50 mg de micropartículas previamente disueltas en HCl 1 mol/L. La cuantificación se realizó mediante espectrofotometría UV-Visible (espectrofotómetro UV-Visible GBS Cintra-10) a λ= 264 nm. La determinación se realizó por triplicado.
ESTUDIO DE FORMACIÓN DEL COMPLEJO PAA/PVP
La formación del complejo interpolímerico mediante enlaces intermoleculares por puente de hidrógeno entre los polímeros del recubrimiento se analizó por espectroscopia infrarroja de transformada de Fourier (FTIR). Se trabajó con un espectrofotómetro FTIR con accesorio de reflectancia total atenuada (ATR), Vector 22, Bruker, Alemania. Los espectros se registraron en un intervalo de 4 000 a 600 cm-1 con una resolución de 4 cm-1.
ESTUDIO DE LIBERACIÓN IN VITRO EN FLUIDOS SIMULADOS
Los estudios de liberación se realizaron en fluido intestinal simulado (FIS, pH= 6,8) y fluido gástrico simulado (FGS, pH= 1,2) en ausencia de enzimas. Las micropartículas cargadas sin recubrimiento se dividieron en porciones 50 mg y se colocaron en 100 mL de medio, extrayendo alícuotas a intervalos de tiempo previamente fijados y reponiendo la cantidad extraída con medio fresco. Las partículas recubiertas se colocaron primero en FGS por 2,5 h y posteriormente se cambió el medio de liberación a FIS por otras 6 h. Todos los estudios se realizaron por triplicado a 37 ºC con agitación mecánica a 50 r.p.m. empleando un agitador de paletas. La cantidad de fármaco liberado se siguió por espectrofotometría UV a λ= 264 nm.
RESULTADOS
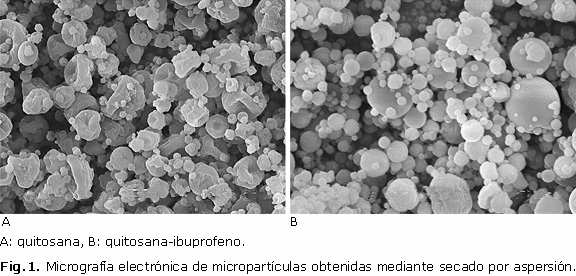
En la figura 1 se muestra la micrografía electrónica de las micropartículas de quitosana y quitosana-ibuprofeno obtenidas mediante secado por aspersión donde se confirma la obtención de micropartículas con morfología y tamaños característicos del proceso de secado por aspersión el cual describe la literatura y el equipo empleado.11-15
La figura 2 muestra la morfología de las partículas del complejo PAA/PVP obtenidas mediante emulsión/evaporación del disolvente a través de la microscopia electrónica de barrido. Las partículas presentan una forma irregular y superficie altamente porosa.
Para corroborar la formación del complejo interpolimérico entre el PAA y la PVP en las condiciones empleadas en el presente trabajo se efectuaron estudios de espectroscopia infrarroja. En la figura 3 se reportan los espectros infrarrojos de ambos polímeros en forma independiente y de las partículas de PAA/PVP obtenidas mediante la técnica de emulsión/evaporación del disolvente en ausencia de las micropartículas de quitosana. En cada caso se señalan las bandas de interés correspondientes para la identificación del complejo interpolimérico formado a través de enlaces por puente de hidrógeno entre los polímeros.
En las figuras 4 y 5 se muestran los perfiles de liberación de ibuprofeno en fluido gástrico y fluido intestinal simulados de las microesferas de quitosana-ibuprofeno obtenidas mediante secado por aspersión y de las partículas de quitosana cargadas recubiertas con el complejo pH dependiente PAA/PVP, respectivamente.
DISCUSIÓN
Como se aprecia en la figura 1, las partículas de quitosana presentan una apariencia colapsada, mientras que en las partículas de quitosana-ibuprofeno la forma predominante es esférica sin exhibir una porosidad apreciable en la superficie. La forma colapsada de las partículas de QUI puede atribuirse al proceso de secado debido a la evaporación del disolvente que genera una corteza externa, y una vez formada esta es que el disolvente aún presente en su interior se evapora resultando en un encogimiento parcial de la partícula.11,12 En el caso de las micropartículas de QUI-IBP, la forma es marcadamente esférica, algunas con cierta rugosidad, pero no colapsadas, lo cual es consecuencia de la presencia del ibuprofeno en la mezcla atomizada.
Según el equipo empleado que dispone de una boquilla con diámetro interno de 0,7 µm, el tamaño de partículas debe ser inferior a 10 µm. Tomando en cuenta la escala de la micrografia, el tamaño de partículas oscila alrededor de los 5 µm, lo cual concuerda con la boquilla empleada y con los resultados reportados por Desai y otros14 en un estudio de obtención de microesferas de quitosana con TPP en el que el tamaño de partículas obtenidas varía de 3,1-10,1 µm. En trabajos de obtención de microesferas mediante secado por aspersión los resultados son similares, microesferas de quitosana-sulfato de condroitina 1,72-6,35 µm,13 microesferas de quitosana-ampicilina 6,2-9,6 µm.15
En cuanto al rendimiento del proceso, se obtuvo un 69 ± 1 % para las microesferas de quitosana y un 54,4 ± 0,8 % para las microesferas de quitosana-ibuprofeno. Otros autores reportan resultados similares y asocian la pérdida de masa al material que queda adherido a las paredes de la cámara y el ciclón, lo cual es inherente al proceso tecnológico cuando se trabaja a escala de laboratorio.11,16,17 La eficiencia de encapsulación alcanzada fue de un 46,8 ± 0,7 %. Ese resultado se debe, entre otros factores, al hecho conocido que cuando se atomiza una suspensión parte de los cristales de fármaco quedan fuera de las microgotas, por lo que no se encapsulan.14 Esta baja eficiencia de encapsulación podría mejorarse desde un punto de vista tecnológico a partir de un estudio de las concentraciones de polímero, fármaco y agente entrecruzante en la mezcla a atomizar.
Las partículas del complejo PAA/PVP obtenidas presentan una superficie porosa y una morfología irregular según se observa en la micrografía mostrada en la figura 2. La porosidad se ve incrementada por el proceso de lavado con la mezcla acetona:agua (70:30) para retirar la fase oleosa con el cual también se retira la parte del polímero que no formó el complejo,18 lo que garantiza que el polímero no complejado sea retirado de las partículas obtenidas.
El complejo entre el PAA y la PVP se forma a través de enlaces intermoleculares por puente de hidrógeno y la espectroscopia infrarroja es una de las técnicas que brinda información para identificarlo. En la figura 3 se observan los espectros de FTIR obtenidos para las sustancias puras, señalándose la banda correspondiente al carboxilo del ácido del PAA a los 1697 cm-1 y la banda del carbonilo de la PVP a los 1 640 cm-1, las cuales están asociadas a los grupos funcionales que intervienen en el enlace por puente de hidrógeno. El espectro correspondiente al complejo muestra cambios en la posición de estas bandas. La banda asociada al carboxilo del PAA se desplaza hacia valores superiores (de 1697 cm-1 a 1716 cm-1), mientras que la banda de carbonilo de la PVP lo hace hacia valores inferiores (de 1640 cm -1 a 1630 cm-1). El cambio de posición en estas bandas evidencia la ocurrencia de enlaces por puente de hidrógeno entre ambos polímeros y, por ende, la formación del complejo.19-21 Estos resultados están avalados por reportes previos en los cuales se efectuaron estudios comparativos de esta técnica con otras de mayor exactitud, como la calorimetría diferencial de barrido y la resonancia magnética nuclear protónica y de 13C, en las que se comprueba que el corrimiento de las bandas analizadas se debe a la formación del complejo.19
Los perfiles de liberación a partir de las partículas de quitosana-ibuprofeno mostrados en la figura 4 reflejan una clara diferencia entre la cantidad liberada en ambos fluidos. El factor de mayor incidencia en este resultado es el pH del medio, puesto que el ibuprofeno es muy poco soluble a pH< 4,5 pues a pH ácido se encuentra muy poco disociado (pKa entre 4,5 y 5).22-24 En consecuencia, la liberación en FGS es mucho menor que la observada en FIS, pues la primera está condicionada por la difusión producto de la penetración del medio en las partículas, mientras que en la segunda, marcadamente superior, confluyen la difusión y la solubilización del ibuprofeno ya que a pH> 6 se encuentra disociado y aumenta su solubilidad. Se observa además que la liberación en FIS ocurre de forma controlada en el tiempo, alcanzándose casi el 100 % de la liberación en el intervalo de tiempo estudiado.
Una vez obtenidos estos resultados se realizó el estudio de liberación para las partículas recubiertas con el complejo PAA/PVP. El perfil obtenido se muestra en la figura 5 donde se observa que la liberación es prácticamente despreciable en FGS debido a que a pH ácido las partículas de complejo (estable a pH< 5) son insolubles. Una vez cambiado el medio a FIS (pH= 6,8), el ibuprofeno se libera al medio circundante producto de la disociación del complejo y la consecuente desprotección de las partículas de quitosana cargadas del fármaco. Este resultado es satisfactorio puesto que en los ensayos de disolución reportados en la USP 30-NF25 referidos a formulaciones de liberación retardada la cantidad liberada en medio ácido no puede exceder el 10 %.25 Otro ejemplo concreto reportado es que para una formulación con cubierta entérica de bisacodilo la tableta no puede desintegrarse hasta después de 1 h de agitación en FGS26 y nuestro sistema es estable en este medio por más de 2 h. A partir de lo anterior, podemos valorar el recubrimiento a base de este complejo como una alternativa con características similares y con un menor costo que las cubiertas de tipo entérica a base de polímeros acrílicos conocidos en el mercado como Eudragit. Además de ello favorece que llegue un mayor porcentaje del fármaco a la zona intestinal para aquellos que como el ibuprofeno presentan una mayor solubilidad y absorción en FIS.
Se puede concluir que el recubrimiento obtenido con el complejo interpolimérico PAA/PVP impide la liberación del fármaco ocluido en la matriz de quitosana a un pH= 1,2. La aplicación de este material como cubierta pH dependiente muestra potencialidades para emplearse como recubrimiento de tipo entérico evitando la liberación del fármaco en el estómago, reduciendo así los efectos adversos sobre la mucosa gástrica de fármacos como los antiinflamatorios no esteroideos y favoreciendo la liberación en la zona intestinal de aquellos cuya absorción ocurre en este sitio.
Agradecimientos
Los autores agradecen el soporte financiero de la Red Iberoamericana de Nuevos Materiales para el Diseño de Sistemas Avanzados de Liberación de Fármacos en Enfermedades de Alto Impacto Socioeconómico RIMADEL del Programa CYTED (P210RT0084).
REFERENCIAS BIBLIOGRÁFICAS
5. Ding X, Alani AWG, Robinson JR. Extended-release and targeted drug delivery system. In: Troy DB, editor. The Sicence and Practice of Pharmacy. 21th ed. USA: Remington, Lippincott Williams & Wilkins; 2002. p. 939-64.
22. Jiang B, Hu L, Gao C, Shen J. Ibuprofen-loaded nanoparticles prepared by a co-precipitation method and their release properties. Intern J Pharmaceutics. 2005;304:220-30.
24. Arida AI, Al-Tabakha MM. Encapsulation of ketoprofen for controlled drug release. Eur J Pharm Biopharm. 2007;66:48-54.
25. The United States Pharmacopeia, USP 30. The National Formulary, NF 25 (USP30-NF25). The dissolution procedure: development and validation. Rockville: Mack Printing; 2007.
26. The United States Pharmacopeia, USP 30. The National Formulary, NF 25 (USP30-NF25). Bisacodyl Delayed-Release Tablets. Rockville: Mack Printing; 2007.
Recibido: 27 de julio de 2014.
Aprobado: 30 de agosto de 2014.
Jomarien García Couce. Centro de Biomateriales. Universidad de La Habana. Ave. Universidad s/n e/G y Ronda. Vedado. Plaza de La Revolución. La Habana. Cuba. CP10400.