Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm vol.49 no.4 Ciudad de la Habana oct.-dic. 2015
ARTÍCULO DE REVISIÓN
Abacavir: una revisión actualizada sobre sus propiedades y aplicaciones
Abacavir, an updated review on its properties and applications
Lic. Carlos Luis Rabeiro Martínez, MSc. Alina Martinez Rodríguez, Lic. Rosario Gravier Hernández, Lic. Yusimit Bermudez Alfonso, Dra.C. Lizette Gil del Valle
Departamento Farmacología Clínica, Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
RESUMEN
El Plan Estratégico Nacional para la Prevención y Control de las ITS/VIH/sida, 2014-2018 en Cuba establece un grupo de acciones entre las que se encuentra la estandarización y optimización de esquemas de terapia antirretroviral, adecuación del inicio del tratamiento a las recientes recomendaciones de la Organización Mundial de la Salud, mejorar la calidad de la atención, la adherencia y la reducción del costo de los medicamentos. Para cumplir estas tareas se prevé introducir en el Cuadro Básico de Medicamentos algunos antirretrovirales genéricos cubanos para incrementar las posibles combinaciones de Terapia Antirretroviral de Alta Eficacia a disposición de los pacientes que viven con el virus de la inmunodeficiencia humana y sustituir importaciones. Se realizó una revisión bibliográfica exhaustiva para la actualización de la comunidad médica y científica; se examinaron las principales características del abacavir: propiedades químico‒físicas del principio activo, sus presentaciones comerciales, mecanismo de acción, farmacocinética y resistencia, reacciones adversas e interacciones, aplicaciones terapéuticas, dosificaciones, ajustes de dosis y seguridad en el embarazo. Para ello se consultaron un total de 58 artículos que incluyeron revisiones bibliográficas, trabajos originales, fichas técnicas, libros, conferencias y reportes. El abacavir es un antirretroviral relativamente nuevo y ampliamente recomendado por las guías de tratamiento por su efectividad demostrada.
Palabras clave: antirretrovirales, abacavir, medicamento genérico, VIH, Terapia Antirretroviral de Alta Eficacia.
ABSTRACT
The National Strategic Plan for the Prevention and Control of the IST/HIV/ aids, 2014-2018 in Cuba establishes a group of actions such as the standardization and optimization of antiretroviral therapy schedules, adaptation of the beginning of the treatment to the recent recommendations of the World Health Organization, the improvement of the quality of care, the adherence to and the reduction of the cost of medications. For the purpose of complying with these tasks, it is anticipated to introduce in the basic drug listing some Cuban generic antiretroviral drugs to increase the possible combinations of the Highly Active Antiretroviral Therapy available for patients who live with the human immunodeficiency virus and to reduce imports. An exhaustive literature review was made for the update of the medical and scientific community knowledge. This article analyzed the main characteristics of abacavir such as chemical-physical properties of the active principle, their commercial presentations, mechanism of action, pharmacokinetics and resistance, adverse reactions and interactions, therapeutic applications, dosages, dose adjustments and safety at pregnancy. To this end, a total of 58 articles were consulted including literature reviews, original papers, technical records, books, lectures and reports. Abacavir is a relatively new antiretroviral, widely recommended by treatment guidelines on account of its proven effectiveness.
Keywords: anti-Retroviral Agents, abacavir, generic medication, HIV, Highly Active Antiretroviral Therapy.
INTRODUCCIÓN
En la actualidad la infección por el VIH/sida es considerada una pandemia.1 El número de personas que viven con VIH aumenta cada año a pesar del esfuerzo que realizan diferentes organizaciones a nivel internacional para prevenir la transmisión y controlar la infección. Según cifras expuestas por el Programa Conjunto de las Naciones Unidas sobre el VIH/sida (ONUSIDA) y publicadas por la Organización Mundial de la Salud (OMS) en el 2013, se estima que hasta el 2012 existían 35,3 millones de personas infectadas por VIH. Solo 13 millones de seropositivos tenían acceso a tales terapias y como consecuencia 1,6 millones habían fallecidos por sida.2
La terapia antirretroviral de alta eficacia (Tarvae) constituye hoy la única herramienta efectiva contra la infección persistente del VIH, permitiendo a los pacientes obtener importantes mejoras en su salud y su calidad de vida, así como disminuir la mortalidad y la morbilidad asociadas a la infección.3 Por tanto, deben mantenerse las exigencias a los políticos y a las compañías farmacéuticas, para que hagan más accesibles estos fármacos a los necesitados.
En Cuba, antes del 2001, no era universal el acceso a la Tarvae, la aparición de enfermedades oportunistas y la muerte eran frecuentes. Razón por la cual el país adopta la producción de antirretrovirales (ARV) genéricos para su empleo en el tratamiento de los pacientes VIH positivos cubanos, como una parte esencial de la política de salud.4 Como consecuencia de esta estrategia el acceso al tratamiento ARV fue aumentando de forma progresiva hasta alcanzar el 100 % de los casos adultos y pediátricos con criterio de tratamiento en el año 2003.5 Hasta el 2014 existían 18 270 personas seropositivas, de ellas 12 026 recibían Tarvae de acuerdo con las pautas de tratamiento vigentes.6
Después de más de una década de emplearse ARV genéricos nacionales (estavudina (d4T), lamivudina (3TC), zidovudina (AZT), indinavir (IDV) y nevirapina (NVP)) como primera línea en los esquemas de tratamiento la resistencia a estos se incrementa.7,8 El país se prepara en estas condiciones para la producción de nuevos genéricos que al ser incluidos en su arsenal terapéutico, garantizarán que los pacientes cubanos dispongan de nuevas combinaciones de ARV para el control de la infección por VIH. También en este sentido amortizar los eventos asociados a los esquemas previamente empleados y mantener los niveles de efectividad en un nuevo escenario de la Tarvae que pretende ser empleada como alternativa de prevención.9
Los fármacos ARV actúan sobre diferentes etapas necesarias para la replicación viral. Hasta la fecha, los más extendidos son aquellos que actúan sobre la enzima transcriptasa inversa (TI) viral y los que actúan sobre la enzima proteasa; aunque ya existen fármacos capaces de inhibir otros sitios, tales como los inhibidores de la fusión y los inhibidores de la enzima integrasa.10
Dentro del grupo de los ARV inhibidores de la enzima TI análogos de los nucleósidos (ITIAN) se encuentra el abacavir (ABC), un fármaco carboxílico sintético, que fue aprobado por la FDA en diciembre de 1998, comercializado por GlaxoSmithKline con el nombre comercial Ziagen®. Fue desarrollado con la idea de mejorar la potencia de los análogos de nucleósidos, así como la biodisponibilidad y la entrada en el sistema nervioso central.11,12 En Cuba hay 878 pacientes tratados con este medicamento.13 El ABC se obtiene a través de financiamiento aportado por proyectos con el Fondo Mundial. La producción de un genérico cubano de ABC garantiza la sostenibilidad de las estrategias nacionales para el tratamiento de las personas viviendo con VIH/sida, así como permite tratar a un mayor número de individuos.
DESARROLLO
PROPIEDADES QUÍMICO-FÍSICAS DEL PRINCIPIO ACTIVO ABACAVIR
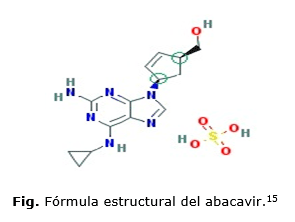
El principio activo de ABC es el sulfato de ABC cuyo nombre químico es (1S,4R)-4-[2-amino-6-(ciclopropilamino)-9H-purina-9-il]-2-ciclopenteno-1-metanol sulfato (figura). El que presenta un peso molecular de 67 074 312 g/mol, apariencia en estado sólido es de color blanquecino, ligeramente soluble en agua (77,0 mg/mL a 25 °C), liposolubilidad baja (Log P es de 1,2 a 25 °C) y se comporta como un ácido débil (Pka de 5,01).14 Estas propiedades químico-físicas influyen sobre las características farmacocinéticas y farmacodinámicas del fármaco.
FORMA FARMACÉUTICA
El ABC se comercializa en forma de comprimidos de 300 mg y de solución oral con 20 mg/mL o en asociación con otros ITIAN a dosis fijas (combos) (Kivexa® comprimidos que contienen 3TC 300 mg y ABC 600 mg; Trizivir® comprimidos con AZT 300 mg, 3TC 150 mg y ABC 300 mg 3,10,16 ; Triumeq® comprimidos con dolutegravir 50 mg, ABC 600 mg y 3TC 300 mg).17-19
La formulación de solución oral de ABC está compuesta por ABC 20 mg/mL y como excipientes sorbitol, sacarina de sodio, citrato de sodio, ácido cítrico anhídro, parahidroxibenzoato de metilo, parahidroxibenzoato de propilo, propilenglicol, maltodextrina, ácido láctico, triacetato de glicerilo, saborizantes naturales y artificiales (fresa y plátano), agua purificada. Es indicada fundamentalmente para el uso en los niños mayores de tres meses de edad con un peso menor que 14 kg y para esos pacientes en los cuales el fármaco en forma de comprimidos resulte inadecuado.20
Los comprimidos de ABC se presentan en forma de tabletas recubiertas de ABC que contienen 300 mg y emplean como excipientes celulosa microcristalina, carboximetilalmidón de sodio, estearato de magnesio, sílice coloidal anhidra, triacetina, hipromelosa, dióxido de titanio, polisorbato 80 y óxido de hierro amarillo.20
MECANISMO DE ACCIÓN
El ABC es un análogo sintético del nucleósido guanosina que inhibe la enzima TI viral. Esta actividad inhibitoria depende de la transformación intracelular de la molécula de ABC a carbovir trifosfato. El ABC es un profármaco.21
La conversión enzimática de ABC a carbovir trifosfato involucra diferentes pasos y enzimas. El ABC penetra en la célula de forma pasiva y es fosforilado por la enzima adenosina fosfotransferasa a ABC monofosfato, el cual a su vez se convierte en carbovir monofosfato mediante una enzima citosólica. Seguidamente, el carbovir monofosfato es fosforilado por quinasas intracelulares a carbovir trifosfato. La conversión del fármaco al derivado trifosfato activo puede ocurrir tanto en las células sanas como en las infectadas por el virus. Una vez formado el carbovir trifosfato compite con el deoxiguanosina-5-trifosfato (dGTP), substrato usual de la TI.21
La incorporación del carbovir trifosfato, en lugar del dGTP, en la cadena de ADN proviral produce la terminación prematura de la síntesis de ADN, debido a la ausencia del grupo hidroxilo 3' en el fármaco, que impide la formación de enlaces 5'‒‒˃3' y por tanto la elongación del ADN viral.21
Este ARV ha mostrado sinergia in vitro en combinación con la NPV y AZT y muestra actividad aditiva en combinación con ddI, 3TC y d4T.23
CARACTERÍSTICAS FARMACOCINÉTICAS
Absorción: la absorción del ABC por la vía oral es buena, con una biodisponibilidad absoluta en adultos del 83 %. El tiempo que tarda en alcanzar la concentración máxima (tmáx) después de la dosis oral es de 1,5 horas en el caso del comprimido y de 1h en el caso de la solución oral, mientras que la concentración máxima (Cmax) en suero es aproximadamente 3 µg/mL. La concentración necesaria para inhibir la replicación del VIH-1 en un 50 % (DI50) es de 0,08 µg/mL cuando el fármaco se administra a la dosis habitual de 600 mg/día en dos dosis diarias.24,25
Los alimentos retardan la absorción e influyen en la Cmax, pero no afectan de manera general el valor del Área Bajo la Curva (AUC, por sus siglas en inglés) 11,95 µgh/mL (600 mg/día), por esto puede ingerirse con o sin alimentos.24,25
La administración de los comprimidos triturados conjuntamente con una pequeña cantidad de comida semisólida o de líquido, no tiene un impacto en las propiedades farmacocinéticas y, por consiguiente, no altera el efecto clínico, asumiendo que el paciente triture, transfiera e ingiera inmediatamente el 100% del comprimido.23
Distribución: después de una administración intravenosa el volumen aparente de distribución es de 0,8 L/Kg, lo cual indica que el ABC penetra libremente en los tejidos. Presenta una buena penetración en elsistema nervioso central, alcanzando en el líquido cefalorraquídeo entre un 30-44 % del AUC plasmática. Su unión a proteínas plasmáticas es moderada, aproximadamente en un 49 %, a concentraciones terapéuticas; esto sugiere poca tendencia a interacciones con otros productos a través del desplazamiento de la unión a proteínas plasmáticas.24,25
Metabolismo: el ABC es biotransformado en el hígado, fundamentalmente mediante la acción de las enzimas alcohol deshidrogenasa y glucuroniltransferasa, produciendo dos metabolitos mayoritarios, el derivado 5'-ácido carboxílico y el 5'-glucurónido respectivamente, lo cual representa un 66% de la dosis inicial administrada.23 La participación de isoenzimas del Citocromo P450 en el metabolismo del fármaco es limitada. El ABC también puede es fosforilado intracelularmente por diferentes enzimas citosólicas para formar carbovir trifosfato, el fármaco activo.24-26
Eliminación: la eliminación del ABC es por la vía del metabolismo hepático con una subsecuente excreción de metabolitos en la orina. Los metabolitos y el ABC inalterable en la orina constituyen cerca del 83 % del ABC administrado, el resto es eliminado en las heces fecales.24-26
En los estudios realizados con dosis única, el tiempo de vida media (t1/2) fue de 1,54±0,63 horas. Después de la administración intravenosa, el aclaramiento total fue de 0,80±0,24 L/h por Kg (media±SD).24-26
El t1/2 intracelular en el estado de equilibrio del carbovir trifosfato metabolito activo del sulfato de ABC, es aproximadamente de 20,6 horas.24
RESISTENCIA
En estudios in vitro de cepas aisladas de VIH-1 resistentes al ABC, se han identificado cambios genotípicos específicos en los codones K65R, L74V, Y115F, M184V/I, TAM, complejos de inserción 69 y Q151M de la TI.24 Los ensayos realizados in vivo tanto en pacientes que recibían la terapia por vez primera como en aquellos que ya la estaban recibiendo, evidencian una alta frecuencia de selección para M184V/I seguida de las variaciones en L74V, K65R y Y115F.23
La resistencia fenotípica al ABC requiere la mutación en M184V con al menos otra de las mutaciones seleccionada para el ABC. La resistencia cruzada entre ABC y otros ITIANs es limitada, cuando solo existen mutaciones en M184V/I. Mientras que la presencia conjunta de la mutación M184V con la K65R da lugar a resistencia cruzada entre el ABC, tenofovir (TDF), ddI y 3TC. La presencia de M184V con L74V origina resistencia cruzada entre el ABC, ddI y 3TC, y la presencia de M184V con Y115F da lugar a la resistencia cruzada entre el ABC y 3TC.23
Por otro lado, TDF y ABC poseen vías de resistencia comunes y su administración simultánea podría asociarse a periodos más cortos de control viral.27
REACCIONES ADVERSAS
ABC es un fármaco generalmente bien tolerado.28 Los efectos adversos más frecuentes son náuseas, dolor abdominal, malestar general y cefaleas, descritos en alrededor del 7 % de los pacientes que han participado en los estudios de desarrollo clínico.10 En el estudio CNAAB3003 realizado con pacientes adultos que recibían ABC conjuntamente con 3TC y AZT fueron reportados nauseas en 47 % de los pacientes, vómitos 16 %, diarreas 12 % y pérdida del apetito en 11 % de los pacientes.21
El efecto adverso más característico y grave del ABC es una reacción de hipersensibilidad (RHS) que aparece aproximadamente en 3,7 % de pacientes. Suele manifestarse como un síndrome multiorgánico con una erupción cutánea eritematosa que generalmente aparece en las seis primeras semanas de tratamiento, aunque puede hacerlo más tardíamente, asociada a síntomas más inespecíficos como fiebre, náuseas, vómitos, malestar, diarrea, mialgias o artralgias.29-32 Las pruebas de laboratorio realizadas a pacientes que experimentan una RHS al medicamento, reportan alteraciones que incluyen linfopenia y aumento en las concentraciones séricas de enzimas hepáticas (creatina quinasa).21 Existe una clara predisposición genética para la RHS a ABC, asociada principalmente al haplotipo HLA-B*570 1, presentándola más de la mitad de pacientes con este alelo, entre 48-61 %, y siendo absolutamente excepcional en pacientes sin el mismo, entre 0-4 %. En el ensayo clínico PREDICT en el grupo en que se realizó el cribado prospectivo no se observó ningún caso de RHS a ABC confirmada inmunológicamente.23,30,33
El conocimiento que se tiene del mecanismo por el cual se produce la RHS es escaso, pero se sabe que el inadecuado metabolismo del ARV unido a un sistema inmune susceptible son cofactores importantes para su desarrollo.29,34 En algunos individuos, se forma un metabolito químicamente reactivo que se detoxifica inadecuadamente, llevando a la activación del sistema inmune y finalmente a un daño celular.35
Actualmente se recomienda la determinación del HLA-B*5701 a todos los pacientes antes de comenzar tratamiento con ABC. 30 Si es positivo a la prueba, no se debe prescribir y si se prescribe sin conocer el HLA B*5701, debe informarse al paciente y estar alerta para detectar síntomas de la RHS. El manejo clínico del paciente con RHS se basa absolutamente en una terapia de soporte, retiro de ABC (así como todos los otros ARV administrados en ese momento) e hidratación intravenosa. En caso necesario pueden indicarse antieméticos y analgésicos por un período corto de tiempo. Los antipruríticos y corticoesteroides generalmente no proporcionan mucho alivio.10,29,30,36
Algunos estudios sugieren que el ABC incrementa el riesgo de daño cardiovascular.37-40 Mientras que otros estudios incluyen un metanálisis de múltiples ensayos de ABC (9 639 pacientes, 7 485 personas‐año de seguimiento) no encontraron una asociación entre el uso de este ITIAN y riesgo de infarto de miocardio.41 Las guías terapéuticas de GESIDA/PNS indican que a pesar de no haber datos para concluir que la combinaciones con ABC incrementan el riesgo de padecer infarto de miocardio este debe ser empleado con precaución en pacientes con riesgo cardiovascular elevado por el posible incremento en el riesgo de padecerlo.30
El uso de ABC u otro ITIAN ha sido asociado con acidosis láctica potencialmente fatal y hepatomegalia severa con esteatosis. La terapia con ABC debe interrumpirse en cualquier paciente con cuadro clínico o resultados del laboratorio sugestivos de acidosis láctica o de hepatotoxicidad (las señales de hepatotoxicidad incluyen hepatomegalia y esteatosis, aún en ausencia de un aumento marcado en las concentraciones séricas de aminotransferasas).21,42
INTERACCIONES
Los resultados experimentales in vitro y el conocimiento de las rutas metabólicas del ABC, indican que las interacciones potenciales, mediadas por el complejo enzimático citocromo P450 entre ABC y otros productos medicinales (ej. Inhibidores de Proteasas (IP)) que sí son biotransformados en dicho complejo, son bajas. El citocromo P450 no tiene un papel determinante en el metabolismo de ABC y este a su vez tampoco ha demostrado que a las concentraciones terapéuticas inhiba al citocromo. En los estudios clínicos no se ha mostrado que haya interacciones clínicamente significativas entre el ABC, AZT, y 3TC.23
Los inductores enzimáticos potentes como rifampicina, fenobarbital y fenitoína, por su acción sobre la glucuroniltransferasa, pueden producir una ligera disminución en las concentraciones del plasma de ABC.23 El tipranavir también es un inductor de esta enzima por lo que no se recomienda su combinación con el ABC en el los esquemas terapéuticos.16
Etanol: el metabolismo del ABC se ve alterado por la administración concomitante con etanol. Ocurre un aumento del 41 % en el AUC y del 26 % en el t 1/2,43 probablemente porque ambas sustancias son sustrato de la enzima alcohol deshidrogenasa por la cual compiten. Este resultado no es considerado clínicamente significativo.
Metadona: en estudios farmacocinéticos donde se administra de forma concomitante ABC y metadona, se ha observado una reducción en Cmax del 35 % y un retardo de una hora en tmax para el ABC, estos cambios no son considerados clínicamente relevantes. En este estudio el ARV aumento en un 22 % el aclaramiento sistémico de metadona.16,23,30
Ribavirina: como el ABC y la ribavirina, un nucleósido sintético de la guanosina, comparten la misma ruta de fosforilación. Se ha propuesto una posible interacción intracelular entre estos fármacos, que podrían ocasionar una reducción en los niveles de los metabolitos fosforilados de ribavirina y por consiguiente una disminución en la respuesta virológica sostenida frente al virus de Hepatitis C en aquellos pacientes con coinfección VIH/VHC.44
Retinoides: los compuestos retinoides son eliminados por la vía de la alcohol deshidrogenasa y la glucuroniltransferasa, por lo que posiblemente interactúen con el ABC, pero la relevancia clínica de esta interacción no ha sido estudiada.23
Además se estudia la interacción con otros medicamentos tales como el ganciclovir (Cytovene®), trimetoprim-sulfametoxazol (Bactrim® Septra®).45
APLICACIONES TERAPÉUTICAS
El ABC en combinación con AZT y 3TC ha producido una reducción media de aproximadamente 2 log10 en los niveles plasmáticos de ARN viral 11 ,46,47 y su uso conjunto con tres o más ARV también puede ser parte de una terapia exitosa de rescate.47-51
La dosis recomendada de ABC en pacientes mayores de 12 años es de 600 mg al día. Esta dosis puede administrarse como 300 mg dos veces al día o como 600 mg una vez al día. En niños mayores de tres meses: 8 mg/kg (máx. 300 mg)/12h.16,23,24
En niños menores de 12 años se recomienda la administración de comprimidos ABC en función de grupos de peso (tabla). El régimen de dosis para pacientes pediátricos que pesan entre 14-30 kg está basado principalmente en un modelo farmacocinético. Ya que no puede conseguirse una dosis tan precisa con esta formulación se aconseja un estrecho seguimiento de la seguridad en estos pacientes.23,24
No existen suficientes datos de seguridad para recomendar el uso de ABC en bebés menores de 3 meses. Los escasos datos disponibles indican que una dosis de 2 mg/kg en neonatos de menos de 30 días proporciona valores de AUC parecidos o superiores en comparación con la dosis de 8 mg/kg administrada a niños mayores.23,24
Pacientes de edad avanzada: actualmente no se dispone de datos farmacocinéticos en pacientes mayores de 65 años.3,23,30
Insuficiencia renal: no es necesario ajustar la dosis de ABC en pacientes con disfunción renal. No obstante, no está recomendado en pacientes con enfermedad renal en fase terminal.3,23,30
Insuficiencia hepática: se ha estudiado la farmacocinética de ABC en pacientes con insuficiencia hepática leve, que recibían una única dosis de 600 mg. Los resultados indicaron que, por término medio, el valor de AUC de ABC aumentó 1,89 veces y la semivida aumentó 1,58 veces por lo que se recomienda utilizar la solución oral (10 mL/12h). No hay datos disponibles en pacientes con insuficiencia hepática moderada, por tanto, no se recomienda el uso de ABC a menos que se considere necesario. Si se utiliza el fármaco en pacientes con insuficiencia hepática leve o moderada, será necesario realizar una estrecha monitorización y, si es posible, se recomienda controlar los niveles plasmáticos del fármaco. ABC está contraindicado en pacientes con insuficiencia hepática grave.3,23,30
En mujeres embarazadas, después del primer trimestre de exposición, los resultados en más de 800 casos y en más de 1 000 casos después del segundo y tercer trimestre de exposición al medicamento, no indican ninguna malformación o efecto fetal/neonatal de ABC. En base a esos datos, el riesgo de malformación es poco probable en los seres humanos.23
RECOMENDACIONES DE ACUERDO A LOS RESULTADOS OBTENIDOS EN DIFERENTES ESTUDIOS
De acuerdo con el estudio CNA30024 la eficacia antiviral de ABC es equivalente a AZT combinados con 3TC y efavirenz (EFV).49
El estudio CNA30021 demostró la equivalencia de la pauta de tratamiento administrada dos veces al día y la pauta administrada una vez al día del ABC, aunque se observó que las RHS a ABC fueron más frecuentes en el grupo que se le administrado una vez al día.50
La combinación ABC+3TC tiene una eficacia similar a AZT+3TC con menor riesgo de lipoatrofia y ha demostrado la no inferioridad frente a la pauta TDF+3TC cuando ambas se administran con Lopinavir / Ritonavir. Es posible que el riesgo de fracaso virológico sea mayor con la pauta ABC+3TC que con la pauta TDF+3TC en pacientes con carga viral plasmática (CVP) elevadas cuando ABC+3TC se administra con EFV o Atazanavir / Ritonavir (HEAT y ACTG 5202).52-54
Las combinaciones de ITIAN de elección para esquemas de inicio son TDF+ Emtricitabina (o 3TC) o ABC+3TC (o Emtricitabina). Siempre que sea posible se recomienda el uso de nucleósidos coformulados ABC+3TC para ser empleados con precaución en pacientes con CVP˃100 000 copias/mL si el tercer fármaco es EFV o Atazanavir / Ritonavir.3,30
Se ha comprobado la equivalencia de AZT+3TC+ABC frente a AZT+3TC+IDV para alcanzar CVP <400 copias/mL, pero en los pacientes con CVP˃100 000 copias/mL, el esquema con ABC era inferior al de IDV para conseguir CVP inferior a 50 copias/mL (CNA3005).3,46
El tratamiento con AZT+3TC+ABC con o sin TDF debería ser usado solamente cuando no pueda ser utilizada una pauta con inhibidores de la transcriptasa inversa no análogos o IP/Ritonavir.30
Sustitución o simplificación con ABC
- Existe evidencia de que la supresión virológica y la mejoría inmunológica alcanzadas de forma estable con un esquema que incluye uno o varios IP, se mantienen adecuadamente, e incluso mejoran, al sustituir el IP por ABC.30
- La mejoría del perfil lipídico se ha evidenciado de forma más intensa y más consistente en estudios en los que la simplificación se ha realizado con NVP, ABC o Atazanavir sin potenciar.30
- En pacientes sin fracaso previo a los ITIAN no existen diferencias notables en eficacia entre EFV, NVP o ABC cuando sustituyen a un IP. No se recomienda simplificar de un IP a ABC si el paciente ha recibido tratamientos subóptimos previos con ITIAN.55
- Las pautas con d4T y AZT (particularmente junto con IP clásicos y EFV) han evidenciado un mayor riesgo de lipoatrofia56 y su sustitución por ABC o TDF o por pautas sin ITIAN se asocia a una mejoría de la misma.57
- Al sustituir el TDF por ABC se ha observado un efecto positivo sobre el tejido óseo en pacientes con osteopenia/osteoporosis, producido por la disminución de los marcadores de deterioro óseo y el incremento de los niveles plasmáticos de esclerostina.58
CONCLUSIONES
El ABC es un ITIAN con propiedades interesantes: buena disponibilidad oral, alcanza concentraciones terapéuticas en el sistema nervioso central, interactúa poco con otros fármacos y tiene un balance riesgo/beneficio adecuado. Su introducción como genérico cubano representa una oportunidad valiosa para el tratamiento de los pacientes cubanos con VIH/sida. Se recomienda divulgar oportuna y sintéticamente las características de este fármaco entre los profesionales de la salud cubana como una herramienta importante para el uso racional y seguro del ABC.
REFERENCIAS BIBLIOGRÁFICAS
1. Delgado R. Características virológicas del VIH. Enferm Infecc Microbiol Clin. 2011;29(1):58-65.
2. ONUSIDA. Informe sobre la epidemia mundial de sida. Génova: ONU. 2013.
3. AIDSinfo. Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents 2013. [access december 2014]. Available from: http://aidsinfo.nih.gov/guidelines2013
4. Pérez J. Approaches to the management of HIV/AIDS in Cuba: case study (Perspectives and practice in antirretroviral treatment). WHO. 2004.
5. Aragones C, Sánchez L, Campos J, Pérez J. Antiretroviral therapy adherence in persons with HIV/AIDS in Cuba. MEDICC Rev. 2011;13(2):17-23.
6. Colectivo de autores. Informe estadísticas MINSAP. Reunión Técnica de sida. 2013-2014.
7. Pérez L, Alemán J, Correa C, Pérez J, Fonseca C, Aragonés C, et al. Molecular epidemiology of antiretroviral resistance in therapy-experienced HIV-1 patients in Cuba (2009). Tenth International Congress on Drug Therapy in HIV Infection 7-11 November 2010; Glasgow, UK.
8. Kouri V, Alemán Y, Pérez L, Pérez J, Fonseca C, Correa C, et al. High frequency of antiviral drug resistance and non-B subtypes in HIV-1 patients failing antiviral therapy in Cuba. Journal of Clinical Virology 2012 7-11 November 2010; 55:348– 55.
9. MINSAP. Plan Estratégico Nacional ITS-VIH/sida 2014-2018. La Habana; 2013.
10. Ribera E. Características de los fármacos antirretrovirales. Enferm Infecc Microbiol Clin. 2011;29(5):362-91.
11. McDowell J, Lou Y, Symonds W. Multiple-dose pharmacokinetics and pharmacodynamics of abacavir alone and in combination with zidovudine in human immunodeficiency virus-infected adults. Antimicrob Agents Chemother. 2000;44:2061-7.
12. Información procedente de las fichas técnicas americanas de los productos (FDA and First Data Bank, Inc) [access 5 Dic 2010]. Available from: http://www.rxlist.com/drugs/alphaa.htm
13. MINSAP. Sidatrat. 2014 [Consultado 13 Abril 2015]. Disponible en: http://www.informatica2013.sld.cu/index.php/informaticasalud/2013/paper/viewFile/225/191
14. Montvale N. Physicians' Desk Reference. Medical Economics Co. 55th ed. 2001.
15. PubChem. 2D Structure [access 24 April 2015]. Available from: http://pubchem.ncbi.nlm.nih.gov/compound/441384#section=Top
16. Colectivo de autores. Guía de manejo antirretroviral de las personas con VIH 5ed. México: Censida; 2012.
17. Weller S, Chen S, Borland J, Savina P, Wynne B, Piscitelli S. Bioequivalence of a Dolutegravir, Abacavir, and Lamivudine Fixed-Dose Combination Tablet and the Effect of Food. J Acquir Immune Defic Syndr. 2014;66(4):393-8.
18. Walmsley S, Antela A, Clumeck N, Duiculescu D, Eberhard A, Gutiérrez F, et al. Dolutegravir plus abacavir-lamivudine for the treatment of HIV-1 infection. N Engl J Med. 2013;369(19):1807-18.
19. Greig S, Deeks E. Abacavir/Dolutegravir/Lamivudine Single-Tablet Regimen: A Review of Its Use in HIV-1 Infection. Drugs. 2015;75(5):561.
20. Tabla de especialidades farmacéuticas comercializadas que pueden ser utilizadas para la administración por SE, con los excipientes y características fisicoquímicas recogidas en la bibliografía. Nutr Hosp. 2006;21(4):11-128.
21. Bethesda M. American Society of Health-System Pharmacists. In: McEvoy G, editor. American Hospital Formulary Service-Drug Information; 2003.
22. Vademecum. Abacavir [access 14 April 2015]. Available from: http://www.iqb.es/cbasicas/farma/farma04/a012.htm
23. Ficha técnica Ziagen 300 mg [access 13 April 2015]. Available from: www.ema.europa.eu/docs/es_ES
24. Fichas técnicas europeas de los antirretrovirales [access 3 Nov 2010]. Available from: http://www.ema.europa.eu
25. Martínez J. Farmacocinética y farmacodinámica de los principales antirretrovirales. Aids Caber J. 2003;6(2):116-23.
26. McDowell J, Chittick G, Ravitch J. Pharmacokinetics of [14C]abacavir, a human immunodeficiency virus type 1 (HIV-1) reverse transcriptase inhibitor, administered in a single oral dose to HIV-1-infected adults: a mass balance study. Antimicrob Agents Chemother 1999;43:2855-61.
27. Gilliam B, Sajadi M, Amoroso A, Davis C, Cleghorn F, Redfield R. Tenofovir and abacavir combination therapy: lessons learned from an urban clinic population. AIDS Patient Care STDS. 2007;21(4):240-6.
28. Dando T, Scott L. Abacavir plus lamivudine. A review of their combined use in the management of HIV infection. Drugs. 2005;65:28-302.
29. Hewitt R. Abacavir Hypersensitivity Reaction. Clinical Infectious Diseases. 2002;34:1137-42.
30. Panel de Expertos de Gesida. Plan Nacional sobre el Sida. Documento de consenso del Grupo de Estudio de Sida/Plan Nacional sobre el Sida respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana (actualización enero 2010). Enferm Infecc Microbiol Clin. 2010;28(362):1–91.
31. Tangamornsuksan W, Lohitnavy O, Kongkaew C, Chaiyakunapruk N, Reisfeld B, Scholfield N. Association of HLA-B*5701 Genotypes and Abacavir-Induced Hypersensitivity Reaction: A Systematic Review and Meta-Analysis. J Pharm Pharm Sci. 2015;18(1):68-76.
32. Crovella S, Biller L, Santos S, Salustiano A, Brandao L, Guimaraes R, et al. Frequency of HLA B*5701 allele carriers in abacavir treated-HIV infected patients and controls from northeastern Brazil. Clinics. 2011;66(8).
33. Mallal S, Phillips E, Carosi G, Molina J, Workman C, Tomazic J. HLA-B*5701 screening for hypersensitivity to abacavir. N Engl J Med. 2008;358(6):568-79.
34. Martin M, Kroetz D. Abacavir Pharmacogenetics - From Initial Reports to Standard of Care. Pharmacotherapy. 2013;33(7):765-75.
35. Hess D, Rieder M. The role of reactive metabolites in immunemediated adverse drug reactions. Ann Pharmacother. 1997;31:1378–87.
36. Clay P, Rathbun R, Slater L. Management protocol for abacavirrelated hypersensitivity reaction. Ann Pharmacother. 2000;34:247-9.
37. Sabin C, Worm S. Use of nucleoside reverse transcriptase inhibitors and risk of myocardial infarction in HIV-infected patients enrolled in the D:A:D study: a multi-cohort collaboration. Lancet. 2008;371(1417-1126).
38. El-Sadr W, Lundgren J. Strategies for Management of Antiretroviral Therapy (SMART) Study Group. CD4+ countguided interruption of antiretroviral treatment. N Engl J Med. 2006; 355:2283-96.
39. Obel N, Farkas D, Kronborg G, Larsen C, Pedersen G, Riis A, et al. Abacavir and Risk of Myocardial Infarction in HIV-infected Patients on Highly Active Antiretroviral Therapy: A Population-based Nationwide Cohort Study HIV Medicine. Blackwell Publishing. 2010;11(2):130-6.
40. Li R, Yang C, Chan S, Hoi M, Lee S, Kwan Y. Relaxation effect of abacavir on rat basilar arteries. PLoS One. 2015;10(4). Pubmed Central PMCID:4390379.
41. Cutrell A, Hernandez J, Yeo J. Is abacavir-containing combination antiretroviral therapy associated with myocardial infarction? No association identified in pooled summary of 54 clinical trials. 17th International AIDS Conference; Mexico DF; 2008.
42. Rakesh D, Stephen G. Severe metabolic acidosis and Fanconi syndrome during stavudine and abacavir therapy in a resource-limited setting. Brazilian Journal of Infectious Diseases. 2012;16(6).
43. McDowell J, Chittick G, Stevens C, Edwards K, Stein D. Pharmacokinetic interaction of abacavir (1592U89) and ethanol in human immunodeficiency virus-infected adults. Antimicrob Agents Chemother. 2000;44(6):1686-90.
44. Soriano V, Puoti M, Sulkowski M, Cargnel A, Benhamou Y, Peters M. Care of patients coinfected with HIV and hepatitis C virus: 2007 updated recommendations from the HCV‐HIV International Panel. AIDS. 2007;21(9):1073-89.
45. Staszewski S. Coming therapies: abacavir. Int J Clin Pract 1999;103:35-8.
46. Staszewski S, Keiser P, Montaner J. Abacavir-lamivudine-zidovudine vs. indinavir-lamivudine-zidovudine in antiretroviral-naïve HIV-infected adults: a randomized equivalence trial. JAMA. 2001;285:1155-63.
47. Kost R, Hurley A, Zhang L. Open-label phase II trial of amprenavir, abacavir, and fixed-dose zidovudine/lamivudine in newly and chronically HIV-1-infected patients. J Acquir Immune Defic Syndr. 2001;26:332-9.
48. Katlama C, Clotet B, Plettenberg A. The role of abacavir (ABC, 1592) in antiretroviral therapy-experienced patients: results from a randomized, double-blind, trial: CNA3002 European Study Team. AIDS. 2000;14:781-9.
49. DeJesus E, Herrera G, Teofilo E, Gerstoft J, Buendia C, Brand J. Abacavir versus zidovudine combined with lamivudine and efavirenz, for the treatment of antiretroviral-naive HIV-infected adults. Clin Infect Dis. 2004;39(7):1038-46.
50. Moyle G, DeJesus E, Cahn P, Castillo S, Zhao H, Gordon D. Abacavir once or twice daily combined with once-daily lamivudine and efavirenz for the treatment of antiretroviral-naive HIV-infected adults: results of the Ziagen Once Daily in Antiretroviral Combination Study. J Acquir Immune Defic Syndr. 2005;38(4):417-25.
51. Podzamczer D, Ferrer E, Sanchez P, Gatell J, Crespo M, Fisac C. Less lipoatrophy and better lipid profile with abacavir as compared to stavudine: 96-week results of a randomized study. J Acquir Immune Defic Syndr. 2007;44(2):139-47.
52. Smith K, Fine D, Patel P. Efficacy and safety of abacavir/lamivudine compared to enofovir/emtricitabine in combination with once‐daily lopinavir/ritonavir through 48 weeks in the HEAT Study. 15th Conference on Retroviruses and Opportunistic Infections; Boston, Massachusetts; 2008.
53. Smith K, Fine D, Patel P. Similarity in efficacy and safety of abacavir/lamivudine compared to tenofovir/emtricitabine in combination with QD lopinavir/ritonavir (LPV/r) over 96 weeks in the HEAT study. 17th International AIDS Conference; Mexico DF: OMS; 2008.
54. Sax P, Tierney C, Collier A. ACTG 5202: shorter time to virologic failure with ABC/3TC than TDF/FTC in treatment‐naïve subjects with HIV RNA >100,000. 17th International AIDS Conference; Mexico DF: OMS; 2008.
55. Hoogewerf M, Regez R, Schouten W, Weigel H, Frissen P, Brinkman K. Change to abacavir-lamivudine-tenofovir combination treatment in patients with HIV-1 who had complete virological suppression. Lancet. 2003;362(9400):1979-80.
56. Moyle G, Sabin C, Cartledge J, Johnson M, Wilkins E, Churchill D. A randomized comparative trial of tenofovir DF or abacavir as replacement for a thymidine analogue in persons with lipoatrophy. AIDS. 2006;20(16):2043-50.
57. Riddler S, Haubrich R, DiRienzo A, Peeples L, Powderly W, Klingman K. Class-sparing regimens for initial treatment of HIV-1 infection. N Engl J Med. 2008;358(20):2095-106.
58. Negredo E, Diez-Pérez A, Bonjoch A, Domingo P, Pérez-Álvarez N, Gutierrez M. Switching from tenofovir to abacavir in HIV-1-infected patients with low bone mineral density: changes in bone turnover markers and circulating sclerostin levels. J Antimicrob Chemother. 2015. Pubmed Central PMCID: 25769303.
Recibido: 21 de abril de 2015.
Aprobado: 26 de junio de 2015.
Carlos Luis Rabeiro Martínez. Departamento Farmacología Clínica, Instituto de Medicina Tropical "Pedro Kourí". Autopista "Novia del Mediodía" Km 6½.La Lisa. La Habana Cuba. Teléfono: 72553236. Correo electrónico: crabeiro@ipk.sld.cu