Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med vol.55 no.3 Ciudad de la Habana jul.-set. 2016
TRABAJO ORIGINAL
Enfermedad celiaca silente en pacientes con diabetes mellitus tipo 1
Silent celiac disease in patients with type 1 diabetes mellitus
Raúl Emilio Real Delor,I Nelson Rafael Ortiz Gaona,II Luis Alberto Escurra AmarillaIII
I Hospital Nacional (Itauguá, Paraguay).
II Facultad de Medicina. Universidad Nacional de Itapúa. Encarnación, Paraguay.
III Hospital Nacional. Itauguá, Paraguay.
RESUMEN
Introducción: la enfermedad celiaca es una afección autoinmune inducida por el gluten en personas genéticamente susceptibles. Presenta diversas formas clínicas y puede estar asociada a la diabetes mellitus tipo 1.
Objetivos: determinar la frecuencia de enfermedad celiaca en pacientes con diabetes mellitus tipo 1 y describir sus características clínicas en este tipo de pacientes.
Métodos: estudio observacional descriptivo, de corte transverso, prospectivo, realizado en 41 pacientes de ambos sexos, mayores de 14 años, afectos de diabetes mellitus tipo 1.
Resultados: se detectaron valores elevados de anticuerpo IgA antitransglutaminasa hística en cuatro sujetos, de los cuales tres aceptaron se les realizara la endoscopia digestiva alta; en todos ellos se encontraron resultados histopatológicos compatibles con enfermedad celiaca. Ninguno presentaba síntomas clásicos de malabsorción intestinal. La glucemia media del último mes fue estadísticamente superior en los DM1 con enfermedad celiaca en comparación con DM1 sin esa enfermedad (p < 0,004).
Conclusión: la frecuencia de enfermedad celiaca en diabetes mellitus tipo 1 fue 9,7 %. La forma clínica hallada correspondió a la silente.
Palabras clave: enfermedad celiaca; diabetes mellitus tipo 1; anticuerpo IgA antitransglutaminasa hístico (ATG); frecuencia; Paraguay.
ABSTRACT
Introduction: celiac disease is an autoimmune disorder induced by gluten in genetically susceptible individuals. It presents various clinical forms and it may be associated with type 1 diabetes mellitus.
Objectives: determine the frequency of celiac disease in patients with type 1 diabetes mellitus and describe its clinical features in these patients.
Methods: a prospective observational, descriptive, study was performed in 41 patients of both sexes, older than 14 years, who were affected by type 1 diabetes mellitus.
Results: high levels of transglutaminase IgA histic antibody were detected in four subjects, three of them accepted upper endoscopy; compatible histopathologic results they were found with celiac disease in all of them. None had classic symptoms of intestinal malabsorption. The mean blood glucose level of the last month was statistically higher in DM1 with celiac disease compared with DM1 without the disease (p < 0.004).
Conclusion: the frequency of celiac disease in type 1 diabetes mellitus was 9.7%. The clinical form found corresponded to the silent form.
Keywords: celiac disease; Type 1 diabetes mellitus; transglutaminase IgA histic antibodies (ATG); frequency; Paraguay.
INTRODUCCIÓN
La enfermedad celiaca (EC) es una afección sistémica autoinmune inducida por el gluten de la dieta en personas genéticamente susceptibles y en quienes produce lesiones características en la mucosa intestinal, que llevan a un estado de malabsorción.1
En el año 2012, Sapone y otros, propusieron la creación de un grupo de tres enfermedades llamada "desórdenes relacionados al gluten": la alergia al gluten, la EC y la sensibilidad anormal al gluten.2 Solo la EC tiene criterios diagnósticos bien definidos.
La prevalencia de la EC es más elevada en europeos donde alcanza proporciones del 2 % en la población general. En los Estados Unidos es tan frecuente como en Europa: 0,5 - 2 %.1 En Sudamérica es propio de sujetos con ascendencia mediterránea.3 En el Paraguay no se tienen aún datos de prevalencia de la EC a nivel del país. De hecho, no es rentable el tamizaje de EC en la población general, sino en grupos de riesgo.1 Pero se tienen datos de la incidencia: 5 a 10 casos nuevos de EC por mes.4
La EC, por lo general, es más frecuente en las mujeres, con una relación 7:3. Estudios genéticos demuestran que aparece en sujetos susceptibles y con el antígeno de histocompatibilidad HLA-DQ2 en el 90 % y HLA-DQ8, en el 10 % restante.1,2 Puede manifestarse con un amplio espectro clínico, que se agrupa en cuatro formas clínicas: manifiesta, latente, potencial, silente o subclínica.5
Existen numerosas enfermedades asociadas a la EC, sobre todo enfermedades autoinmunes como diabetes mellitus tipo 1 (DM1) y tiroiditis crónicas autoinmunes.6 Por dicho motivo, las guías y consensos recomiendan investigar a las personas con mayor probabilidad de presentar la enfermedad porque puede hallarse en forma oligosintomática o silente.7,8 Esas personas constituyen los llamados grupos de riesgo de EC, pues tienen una prevalencia más alta de esta enfermedad que la población general. Entre estos grupos de riego se hallan los pacientes con DM1.9,10
El diagnóstico de EC se sospecha con la detección serológica del anticuerpo IgA antitransglutaminasa (ATG), prueba altamente específica y sensible, objetiva en su interpretación y de menor costo.11 Posteriormente, debe confirmarse con biopsias duodenales.12
La DM1 es una afección caracterizada por pérdida absoluta de secreción de insulina, originada en un proceso autoinmune que destruye las células beta de los islotes pancreáticos. Más del 90 % de los sujetos con EC y 60 % - 70 % de los DM1 expresan el mismo antígeno HLA DQA1*0501 y DQB1*0201.9 La EC puede hallarse en estado silente o subclínico en los DM1 en proporciones que varían entre 1 % y 16 %.13
La EC no diagnosticada en los diabéticos puede ser causa de mal control metabólico en esos pacientes: dificultad para subir de peso y crecer en talla, tendencia a la hipoglucemia, anemia ferropénica, hipoalbuminemia.14,15
La detección de las formas clínicas poco evidentes de EC es muy importante, porque con el tratamiento mejora el pronóstico de la enfermedad, se previenen complicaciones graves como la osteoporosis, aparición de otras enfermedades autoinmunes y las neoplasias del tubo digestivo (linfomas y carcinomas).16 La hipoglucemia o el difícil control metabólico es otra característica de la EC no diagnosticada en la DM1.17
La DM1 pertenece a los grupos de riesgo de EC, por lo que se recomienda la detección activa de esta enteropatía, aún en sujetos asintomáticos.7-10 El pronóstico mejora tras el diagnóstico y tratamiento de la EC, incluso en sujetos asintomáticos. 18 Un tema discutible es la calidad de vida cuando existen múltiples restricciones dietéticas.19
El Hospital Nacional (Itauguá, Paraguay) es un centro de referencia de alta complejidad de la red de salud pública en el país. En las salas de internación del Departamento de Medicina Interna se atienden con frecuencia estos diabéticos y otros asisten a control ambulatorio en la Unidad de Diabetología. La detección rutinaria de la EC no es aún rutinaria en la DM1 por lo que esta investigación tiene el propósito de evidenciar la coexistencia de estas enfermedades autoinmunes.
Los objetivos de esta investigación fueron describir las características demográficas, clínicas y de laboratorio, de los DM1, así como determinar la frecuencia de EC en estos pacientes, escribir los síntomas de los sujetos con EC y comparar los parámetros de laboratorio entre los sujetos con ATG positivo y negativo.
MÉTODOS
Estudio observacional descriptivo, de corte transverso, prospectivo, realizado en hombres y mujeres, mayores de 14 años, afectos de DM1, que acudieron a consulta en el Hospital Nacional entre 2013 y 2015.
Fueron incluidos los pacientes con DM1, diagnosticada por los criterios clínicos de la OMS,50 a los cuales se les determinó ATG e IgA sérica. Fueron excluidos los conocidos celiacos y los sujetos con conocida deficiencia de IgA. El muestreo fue no probabilístico, de casos consecutivos. Se determinaron las siguientes variables: edad, sexo, índice de masa corporal, glucemia en ayunas, hemoglobina glicada, ATG, IgA sérica, edad de inicio de la DM1, dosis de insulina diaria, edad de la menarquia, resultado de biopsia duodenal y síntomas sugestivos de EC: diarreas, dolor abdominal, constipación, meteorismo, aftas y pérdida de peso. Estos datos fueron sometidos a estadística descriptiva para hallar la frecuencia. La comparación de las variables cuantitativas se realizó con análisis bivariado: prueba t Student no pareada para variables continuas de distribución normal. Se utilizó el programa estadístico Epi Info 7® para los cálculos mencionados.
Reclutamiento: a los pacientes con DM1 que consultaron en la Unidad de Diabetología o se internaron en el Hospital Nacional, se les explicó sobre la EC y el estudio de investigación. Se les leyó el consentimiento informado y luego de prestar su acuerdo, los autores realizaron las mediciones antropométricas y el llenado de una ficha técnica. A continuación se remitió a los pacientes al Servicio de Inmunología del Laboratorio del Hospital Nacional para determinar ATG e IgA sérica. La detección de ATG en suero se realizó por el método de ELISA empleando un reactivo comercial: anti transglutaminasa IgA enzyme inmunoassay kit (The Binding Site LTD, Birmingham, England). La lectura de los resultados se efectuó en un lector de microplaca a 450 nm. La detección de IgA sérica total se hizo por el método de inmunodifusión radial basado en la técnica de Fahey - Mc Kelvey y Mancini usando reactivo IgA humano, kit - Bindarid (The Binding Site LTD, Birmingham, England). La lectura se efectuó con lupa especial con regla milimetrada incorporada. La ATG se consideró positiva a todo valor ≥ 12 U / mL y el déficit de IgA a todo valor < 70 mg / dL.
En los casos con resultado positivo, se solicitó al paciente y / o familiar la realización de una endoscopia digestiva alta en el Hospital Nacional. El estudio anatomopatológico se realizó en el Departamento de Anatomía Patológica del hospital. Si el estudio resultaba compatible con EC, se informaba al paciente y sus familiares sobre esta afección, se les educaba sobre la dieta libre de gluten y eran remitidos a la Fundación Paraguaya de Celiacos (www.fupacel.org.py). La DM1 fue tratada siempre, según el criterio del diabetólogo y los médicos internistas.
Aspectos éticos
Los diabéticos autorizaron voluntariamente la realización del estudio laboratorial, no se sacó provecho de sujetos vulnerables, minoritarios ni dependientes, no fueron sometidos a riesgos innecesarios y los casos de EC detectados se beneficiaron del tratamiento. Se protegió al máximo la confidencialidad. Los resultados fueron entregados a los médicos tratantes para que determinaran la conducta terapéutica adecuada. Los pacientes que rehusaron la realización del estudio laboratorial o la biopsia duodenal, siguieron siendo atendidos en el Hospital Nacional sin ningún tipo de discriminación. Los costos de estos estudios fueron gratuitos en el Hospital Nacional. El protocolo fue evaluado y aprobado por el Comité de Ética de la Universidad del Pacífico.
RESULTADOS
Se incluyeron 41 diabéticos. La relación hombres / mujeres fue 1:15. La edad media fue 27 ± 7 años (rango 14 - 47 años). El IMC medio fue 24,30 ± 3,64 kg / m2 (rango 17,30 - 35 kg / m2). Se hallaron todos los estados nutricionales: desnutrición (1 caso: 2,4 %), normal (20 casos: 48,8 %), preobesidad (15 casos: 36,6 %) y obesidad (5 casos: 12,2 %). La glucemia media del último mes fue 334,7 ± 144,4 mg / dL (rango 100 - 724 mg / dL) y la HbA1c media: 9,8 ± 3,3 % (rango 5,1 - 18,3 %). La edad media al momento del diagnóstico de DM1 en 40 sujetos fue 15,5 ± 5 años (rango 5 - 30 años), pues un caso fue incluido en su inicio como cetoacidosis. La dosis media de insulina en los sujetos que no habían comenzado con DM1 fue 38 ± 21 U/día.
La ATG resultó positiva en cuatro sujetos (frecuencia 9,7 %). En estos casos positivos, el valor medio de ATG fue 165 ± 43 U / mL (rango 107-200 U / mL). Ningún diabético presentó deficiencia de IgA sérica.
De los 4 sujetos positivos, tres correspondieron al sexo femenino (75 %). Ninguno de ellos era desnutrido. Solo un paciente, con valor de ATG 200 U / mL, se negó a la biopsia duodenal endoscópica. Los hallazgos anatomopatológicos fueron: dos casos con Marsh 2 y uno, con Marsh 3. Entre los síntomas intestinales sugestivos de EC, solo hubo un caso con dolor abdominal inespecífico. Ninguno presentó aftas a repetición y la edad de la menarquia en esas tres mujeres fue a 13, 15 y 17 años, respectivamente.
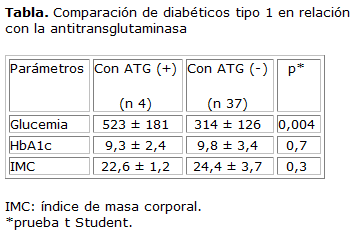
Se compararon variables clínicas y de laboratorio entre los sujetos con ATG (+) y (-). Se halló que la glucemia media de los diabéticos con ATG (+) fue estadísticamente mayor que la de los sujetos con ATG (-) (tabla).
En un solo caso había antecedente familiar consanguíneo de EC, pero el paciente diabético investigado resultó con ATG (-). Un solo diabético era, además, afecto de otra enfermedad autoinmune (enfermedad inflamatoria intestinal), pero su resultado de ATG también resultó (-).
DISCUSIÓN
Durante muchos años, la EC permaneció como una afección rara. Actualmente, la incidencia por esta enfermedad va en aumento porque ha mejorado la difusión de sus formas clínicas y los métodos diagnósticos son más accesibles. Además, es más conocida tanto en epidemiología como en fisiopatología y su relación con otras enfermedades autoinmunes. Por estos motivos se justifica la búsqueda de EC en pacientes con enfermedades autoinmunes.8-10
La frecuencia de EC en DM1 reportada en diversas series es similar a la de este estudio (9,7 %).13 En el Paraguay existe un estudio similar realizado en 64 sujetos con DM1 de un hospital universitario, donde encontraron un valor muy similar de EC (9,3 %).20 Estas cifras son mucho más elevadas que en la población general en diversos países (0,5 - 1 %).1 Esta es una de las justificaciones para la búsqueda activa de la EC y confieren a la DM1 el estatus de grupo de riesgo. La EC tiene un predominio en el sexo femenino.1 En este trabajo se encontró una predominancia de EC en dicho sexo, lo que resalta al género femenino como factor de riesgo para enfermedades autoinmunes.6
La EC provoca trastornos en el crecimiento, con la consecuente talla y peso bajos. Pero como la afectación duodenal es "en parches" o zonas, muchas veces el intestino distal compensa la absorción de nutrientes y estos trastornos citados no son evidentes.12 La presentación clínica de la EC suele ser frecuentemente asintomática o con síntomas leves. Se describe que < 10 % de DM1 con EC presentan síntomas gastrointestinales.21,22 Con respecto a los síntomas de EC, solo uno de los casos con ATG (+) presentaba dolores abdominales inespecíficos. En un solo caso la menarquia parecía retrasada (17 años), aunque se debe catalogar con tal denominación pasado recién los 18 años.5
Las determinaciones serológicas recomendadas actualmente para el cribado de EC son ATG y anticuerpo IgA antiendomisio pues poseen un valor predictivo y negativo cercano al 100 %. La ATG IgA a títulos muy elevados, como los obtenidos en este estudio, tienen elevada sensibilidad (> 90 %) y especificidad (98 %) por lo que muchos autores preconizan iniciar el tratamiento dietético, aún sin confirmación histológica. Los hallazgos histopatológicos demuestran la efectividad de este cribado serológico.7,8 La estadificación en March 2 y 3 detectadas en esta serie indica grado avanzado de daño duodenal aunque llama la atención la escasa sintomatología de estos sujetos. De ahí la denominación de EC silente o subclínica.9,10
Se describe 4 % - 10 % de deficiencia de IgA en pacientes celiacos, con los consecuentes falsos negativos en ATG IgA. En este trabajo se encontró que ninguno de los DM1 investigados presentó deficiencia de IgA. En caso de encontrarse esta deficiencia se requeriría el dosaje de inmunoglobulinas, la determinación de la fracción IgG o del HLA.11
Entre las enfermedades autoinmunes más frecuentemente asociadas se describe la tiroiditis. Entre los pacientes investigados se encontró solo un caso con enfermedad autoinmune (enfermedad inflamatoria intestinal), el cual resultó negativo para EC. Lastimosamente, en este estudio, no se investigó simultáneamente la presencia de anticuerpos antitiroideos ya que es frecuente la asociación de EC y DM1 con la tiroiditis crónica.23
En cuanto al control metabólico de esta serie, la glucemia media de los diabéticos celiacos fue estadísticamente mayor que las glucemias de los no celiacos (tabla). Akirov y otros24 encontraron también que las glucemias eran superiores en los DM1 con EC en comparación con los DM1 (p < 0,005). Esto se explica como consecuencia del estado de la malabsorción intestinal. Se han publicado trabajos en donde las comparación de HbA1c entre DM1 con EC, y sin ella, no fueron significativos.25 En el análisis de la HbA1C se encontró un resultado similar a los descritos previamente y no fue significativo 9,3 ± 2,4 % vs. 9,8 ± 3,4 % (tabla). Todas estas discrepancias, además de la frecuencia de hipoglucemias en los diabéticos con EC activa, mantienen abierto el debate de si se justifica o no detectar y tratar esta enteropatía que muchas veces está silente.26 Pero no se debe obviar la evidencia de mayor riesgo de otras complicaciones de la EC no tratada: anemia ferropénica, osteoporosis y neoplasias del tubo digestivo.16
En esta investigación se intentó evaluar la edad de inicio de la ingesta de gluten en los pacientes enrolados y la duración de su lactación, pero por falta de memoria de los familiares fue imposible recabar estos datos. Existe evidencia de que la ingesta precoz de gluten en los infantes y la escasa lactación son factores de riesgo para la aparición de formas graves de EC y otras enfermedades autoinmunes.27-30
En conclusión, la ATG resultó positiva en 4 sujetos. En estos casos positivos el valor medio de ATG fue 165 ± 43 U/mL y en 3 de ellos se confirmó EC por biopsia duodenal. La frecuencia de EC en DM1 fue 9,7 %. La glucemia media de los diabéticos celiacos fue estadísticamente mayor que los no celiacos.
Conflictos de intereses
Los autores declaran no tener conflictos de interés comercial ni de otro tipo en cuanto a la realización ni la publicación del presente estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Fasano A, Catassi C. Clinical practice. Celiac disease. N Engl J Med. 2012 Dec 20; 367(25):2419-26.
2. Sapone A, Bai JC, Ciacci C, Dolinsek J, Green PH, Hadjivassiliou M, et al. Spectrum of gluten-related disorders: consensus on new nomenclature and classification. BMC Med. 2012 Feb 7;10:13
3. Parra-Medina R, Molano-Gonzalez N, Rojas-Villarraga A, Agmon-Levin N, Arango MT, Shoenfeld Y, et al. Prevalence of celiac disease in latin america: a systematic review and meta-regression. PLoS One. 2015 May 5;10(5):e0124040.
4. Real Delor RE, Arza G, Chamorro ME, Dalles I, Ibarra Douglas A. La enfermedad celiaca en el Paraguay. Rev Nac (Itauguá). 2011 Dic;3(2):7-15
5. Real Delor RE. Influencia de la enfermedad celiaca en el ciclo vital de la mujer. Tendencias en Medicina. 2014;IX(9):41-51. [citado 5 diciembre 2015] Disponible en: http://www.tendenciasenmedicina.com/Imagenes/imagenes45/art_05.pdf
6. Diamanti A, Capriati T, Bizzarri C, Ferretti F, Ancinelli M, Romano F, et al. Autoimmune diseases and celiac disease which came first: genotype or gluten? Expert Rev Clin Immunol. 2016 Jan;12(1):67-77.
7. Downey L, Houten R, Murch S, Longson D; Guideline Development Group. Recognition, assessment, and management of coeliac disease: summary of updated NICE guidance. BMJ. 2015 Sep 2;351:h4513.
8. Ludvigsson JF, Bai JC, Biagi F, Card TR, Ciacci C, Ciclitira PJ, et al. Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology. Gut. 2014;63:1210-28.
9. Husby S, Koletzko S, Korponay-Szabó IR, Mearin ML, Phillips A, Shamir R, et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr. 2012 Jan;54(1):136-60.
10. Bai JC, Fried M, Corazza GR, Schuppan D, Farthing M, Catassi C, et al. World gastroenterology organisation global guidelines on celiac disease. J Clin Gastroenterol. 2013 Feb;47(2):121-6.
11. Byrne G, Feighery CF. Celiac Disease: Diagnosis. Methods Mol Biol. 2015;1326:15-22.
12. Walker MM. Histopathology diagnosis of coeliac disease - clinicopathological correlation is key! Gastroenterol Hepatol Bed Bench. 2015 Fall;8(4):309-10.
13. Dogan B, Oner C, Bayramicli OU, Yorulmaz E, Feyizoglu G, Oguz A. Prevalence of celiac disease in adult type 1 patients with diabetes. Pak J Med Sci. 2015 Jul-Aug;31(4):865-8.
14. Scaramuzza AE, Mantegazza C, Bosetti A, Zuccotti GV. Type 1 diabetes and celiac disease: The effects of gluten free diet on metabolic control. World J Diabetes. 2013 Aug 15;4(4):130-4.
15. Bakker SF, Tushuizen ME, von Blomberg ME, Mulder CJ, Simsek S. Type 1 diabetes and celiac disease in adults: glycemic control and diabetic complications. Acta Diabetol. 2013 Jun;50(3):319-24.
16. Han Y, Chen W, Li P, Ye J. Association Between Coeliac Disease and Risk of Any Malignancy and Gastrointestinal Malignancy: A Meta-Analysis. Medicine (Baltimore). 2015 Sep;94(38):e1612.
17. Kurien M, Mollazadegan K, Sanders DS, Ludvigsson JF. A nationwide population-based study on the risk of coma, ketoacidosis and hypoglycemia in patients with celiac disease and type 1 diabetes. Acta Diabetol. 2015 Dec;52(6):1167-74.
18. Kotze LM, Skare T, Vinholi A, Jurkonis L, Nisihara R. Impact of a gluten-free diet on bone mineral density in celiac patients. Rev Esp Enferm Dig. 2016 Feb;108(2):84-8.
19. Assor E, Marcon MA, Hamilton N, Fry M, Cooper T, Mahmud FH. Design of a dietary intervention to assess the impact of a gluten-free diet in a population with type 1 Diabetes and Celiac Disease. BMC Gastroenterol. 2015 Dec 21;15(1):181.
20. Ramírez Benítez AI, Miranda Ojeda MC, Ferreira L, Palacios Lugo MF, Jiménez González JT. Enfermedad celiaca y diabetes mellitus tipo 1: asociación y características clínicas. Rev Virtual Soc Parag Med Int. marzo 2014;1(1):8-17.
21. Joshi R, Madvariya M. Prevalence and clinical profile of celiac disease in children with type 1 diabetes mellitus. Indian J Endocrinol Metab. 2015 Nov-Dec;19(6):797-803.
22. Szaflarska-Popławska A. Coexistence of coeliac disease and type 1 diabetes. Prz Gastroenterol. 2014;9(1):11-7.
23. Kurien M, Mollazadegan K, Sanders DS, Ludvigsson JF. Celiac Disease Increases Risk of Thyroid Disease in Patients With Type 1 Diabetes: A Nationwide Cohort Study. Diabetes Care. 2015 Dec 17. pii: dc152117.
24. Akirov A, Pinhas-Hamiel O. Co-occurrence of type 1 diabetes mellitus and celiac disease. World J Diabetes. 2015 Jun 10;6(5):707-14.
25. Tanpowpong P, Broder-Fingert S, Katz AJ, Camargo CA Jr. Features of children with positive celiac serology and type 1 diabetes mellitus. Pediatr Int. 2015 Oct;57(5):1028-30.
26. Narula P, Porter L, Langton J, Rao V, Davies P, Cummins C, et al. Gastrointestinal Symptoms in Children With Type 1 Diabetes Screened for Celiac Disease. Pediatrics. 2009;124:e489-e495.
27. Lionetti E, Castellaneta S, Francavilla R, Pulvirenti A, Tonutti E, Amarri S, et al. Introduction of gluten, HLA status, and the risk of celiac disease in children. N Engl J Med. 2014 Oct 2;371(14):1295-303.
28. Pinto-Sánchez MI, Verdu EF, Liu E, Bercik P, Green PH, Murray JA, et al. Gluten Introduction to Infant Feeding and Risk of Celiac Disease: Systematic Review and Meta-Analysis. J Pediatr. 2015 Oct 20. pii: S0022-3476(15)01045-8.
29. Davanzo R, Romagnoli C, Corsello G. Position Statement on Breastfeeding from the Italian Pediatric Societies. Ital J Pediatr. 2015 Oct 24;41:80.
30. Chmielewska A, Pieścik-Lech M, Szajewska H, Shamir R. Primary Prevention of Celiac Disease: Environmental Factors with a Focus on Early Nutrition. Ann Nutr Metab. 2015;67 Suppl 2:43-50.
Recibido: 10 de marzo de 2016.
Aceptado: 25 de marzo de 2016.
Raúl Emilio Real Delor . Centro Médico-Hospital Nacional, Ruta Gral. Marcial Samaniego Km 6. Itauguá, Paraguay. raulemilioreal@gmail.com raulemilioreal@yahoo.com.ar