Introducción
La familia Coronaviridae, perteneciente al orden Nidovirales, contiene dos subfamilias, Coronavirinae y Torovirinae. Los coronavirus son un grupo amplio de virus que infectan a mamíferos y aves y producen una amplia variedad de enfermedades.1 La familia Coronaviridae, se divide en cuatro géneros, alfa, beta, gamma, y delta. Dos de esos géneros contienen virus que infectan al ser humano (HCoV): alfa coronavirus (HCoV-229E y HCoV-NL63) y beta coronavirus (HCoV-HKU1, HCoV-OC43, coronavirus del síndrome respiratorio del oriente medio [MERS-CoV], coronavirus del síndrome respiratorio agudo grave SARS-CoV). Todos los HCoV, son fundamentalmente patógenos respiratorios.2
Los coronavirus adquiridos en la comunidad (no SARS-CoV, MERS-CoV) son ubicuos, el más comúnmente aislado es HCoV-OC43 seguido de HCoV-NL63. Estos virus tienen comportamiento estacional, las infecciones respiratorias por coronavirus son más frecuentes en invierno. Esta familia de patógenos, es responsable de alrededor de 10 % de las infecciones agudas de vías respiratorias superiores que ocurren en la comunidad.2 La reinfección es común, presumiblemente por lo efímero de la respuesta inmune antiviral efectiva, y la posibilidad de variación antigénica dentro de la especie.3
El 31 de diciembre de 2019, 27 casos de neumonía de etiología desconocida se notificaron en Wuhan, provincia de Hubei, China.4 La enfermedad, conocida a partir del 12 de enero de 2020 como COVID-19,5 era producida por un nuevo HCoV que, a partir del 11 de febrero recibiría el nombre de SARS-Cov-2 dada su semejanza genómica con el SARS-CoV,6 se ha propagado por todo el planeta y amenazado la estabilidad global no solo por el número de infecciones, enfermos y muertes, sino también por el daño psicológico y económico que produce.7) El 11 de marzo del 2020, la Organización Mundial de la Salud declaró la COVID-19 como pandemia.8
El epicentro de la pandemia, inicialmente en China, se posicionó luego en Europa fundamentalmente en Italia y España y hoy se localiza en los Estados Unidos de América (EE. UU.) donde la cifra de infectados crece aceleradamente y amenaza con colapsar la infraestructura de salud de ese país. La tendencia actual sugiere su desplazamiento hacia América del sur y África.9,10
SARS-CoV-2 probablemente afecta menos a los niños, tanto en la frecuencia como en severidad, que a los adultos.11,12,13,14,15,16 Una revisión sistemática plantea que, solo entre 1 y 5 % de pacientes afectados por COVID-19 pertenece al rango de edad pediátrico.17) Aunque los sistemas de vigilancia y los criterios para realizar los test diagnósticos para la infección por SARS-CoV-2, han variado en el tiempo y en las diferentes áreas geográficas, en las publicaciones de diferentes países (China, Corea del sur, Italia, Suiza, Reino Unido, y Estados Unidos de América) la proporción de casos pediátricos de COVID-19 en relación con casos de adultos, tiene la misma situación.18,19,20,21,22,23,24
A pesar de la diseminación mundial de la infección por SARS-CoV-2, la epidemiologia y los patrones clínicos de la COVID-19 aún no están bien esclarecidos, particularmente para la edad pediátrica. El objetivo de este trabajo es caracterizar clínica y epidemiológicamente 183 casos pediátricos infectados por SARS-CoV-2 en Cuba.
Métodos
Estudio descriptivo, trasversal realizado en el periodo comprendido entre 11 de marzo y 29 de abril del 2020 en Cuba.
La edad pediátrica se define de 0 a 18 años, el diagnóstico de infección por SARS-CoV-2 fue definido por reverso transcripción/reacción en cadena de la polimerasa (RT-PCR, por sus siglas en inglés, reverse transcription polymerase chain reaction) positivo para los genes E y P del SARS-CoV-2, realizado en secreciones respiratorias obtenidas mediante hisopado nasal y faríngeo. Se analizaron las variables: edad, sexo, fuente de infección, manifestaciones clínicas, alteraciones radiológicas y complicaciones. Los datos se recolectaron en una hoja de Excel y se expresaron en valores absolutos y porcentajes. La investigación se aprobó por el Comité de Ética de la Investigación del Hospital Pediátrico Universitario “Eliseo Noel Caamaño”.
Resultados
En el periodo analizado se diagnosticaron 1619 pacientes con la COVID- 19 en Cuba, de estos 183 pertenecen al rango de edad pediátrico (11,30 %). En la distribución de los pacientes pediátricos infectados por el SARS-CoV2 por intervalos de edad, se aprecia que los mayores de 5 años fueron los más afectados y el grupo de 15-18 años el que mayor número de casos aportó (Tabla 1). La edad promedio de los casos fue 10,36 años con límites entre 19 días de nacido a 18 años
Tabla 1- Distribución de los pacientes estudiados según la edad
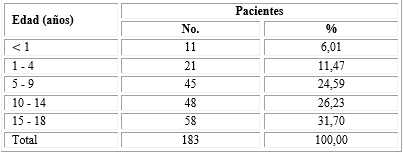
Fuente: Datos oficiales. Minsap, 2020.
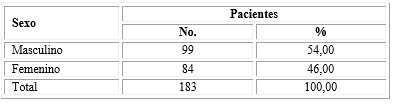
La distribución de los pacientes según sexo muestra ligero predominio del sexo masculino con 54,0 % contra 46,0 % del sexo femenino (Tabla 2).
En los 183 pacientes estudiados, en 98,36 % se pudo definir la cadena epidemiológica (Tabla 3).
Tabla 3- Distribución de los pacientes estudiados según fuente de contagio

Fuente: Datos oficiales. Minsap, 2020.
De los 183 niños infectados por SARS-CoV-2, 108 no presentaron síntomas clínicos, por lo que solo 41,00 % de los pacientes pediátricos diagnosticados con la COVID 19 en el periodo estudiado presentaron manifestaciones clínicas de la enfermedad. Entre los síntomas, aunque estos fueron variados, destacan la tos y la fiebre como los más frecuentes y en orden de frecuencia, las manifestaciones digestivas (diarreas, vómitos), manifestaciones cutáneas (urticaria en 1 paciente, rash eritemato/papular fino en 4 pacientes). Un paciente de 9 meses de edad, 0,5 % de los casos, se presentó con estatus convulsivo como complicación de encefalitis en el curso de la COVID-19, requirió ventilación mecánica invasiva. Ningún otro paciente presentó complicaciones. No hubo fallecidos (Tabla 4).
Tabla 4- Manifestaciones clínicas en pacientes pediátricos diagnosticados con COVID 19

Fuente: Datos oficiales. Minsap, 2020.
Solo 16/183 pacientes presentaron alteraciones pleuropulmonares en la radiografía de tórax, lo cual se corresponde con solo 8,7% de los casos estudiado (Tabla 5).
Tabla 5- Presencia de alteraciones radiológicas en pacientes pediátricos con COVID-19

Fuente: Datos oficiales. Minsap, 2020.
De los 183 pacientes estudiados solo en 7 (3,82 %) de ellos se mantuvo el RT-PCR-RT positivo para SARS-CoV-2 a los 14 días después del diagnóstico.
Discusión
En la presente serie se describen las características clínicas y epidemiológicas de 183 pacientes pediátricos, 82,52 % de los pacientes tenían 5 años o más, con un promedio de edad de 10 años, datos similares se han planteado en otras publicaciones 14) y rango de edad entre 19 días de nacido a 18 años. El ligero predominio de sexo masculino en la muestra coincide con lo registrado por otros autores 24
En el periodo de tiempo estudiado se diagnosticaron en Cuba 1619 pacientes infectados por SARS-CoV-2, de estos 183, el 11,30 % correspondió a la población pediátrica, proporción superior a lo encontrado en la mayoría de las publicaciones internacionales.18,19,20,21,22,23,24 Esta diferencia se pudiera deber a la eficacia de los mecanismos de vigilancia epidemiológica establecidos en el país, aseveración que se justifica en la alta proporción de niños infectados por SARS-CoV-2 que resultaron asintomáticos (59,00 %) en la presente serie. En este grupo de niños los pilares fundamentales que sustentaron el diagnóstico, fueron los datos epidemiológicos, fundamentalmente la trazabilidad a través de contactos y estrictos controles de foco, solo en 1,64 % de los diagnosticados no sé demostró la fuente de contagio. En nuestra opinión los porcentajes tan bajos de afectación pediátrica, (1 a 5 %) tal y como se describe en otros países,18,19,20,21,22,23,24) muy inferiores a los registrados en nuestra investigación, deben ser interpretadas con cautela, dado que la incidencia puede variar en función del número de casos analizados, y es posible que, si el cribado se realiza en pequeño porcentaje de pacientes pediátricos, sobre todo en aquellos que presentan sintomatología evidente, se. podría enmascarar un porcentaje superior de casos que pueden pasar desapercibidos por tener cuadros leves o asintomáticos.
Los hallazgos clínicos descritos en la presente investigación muestran que, los pacientes pediátricos afectados por COVID-19 presentaron un cuadro clínico de menor severidad, cuando se comparan con los casos de COVID-19 en pacientes adultos descritos en la literatura internacional.25) En la serie descrita solo 0,5 % de los pacientes presentó complicaciones, y no hubo fallecido. De acuerdo a la literatura revisada, los principales síntomas en pacientes pediátricos afectados por COVID-19 son la tos y la fiebre, como ocurre en cualquier enfermedad respiratoria viral común.26 Similar patrón clínico se describe en la serie aquí presentada, la fiebre fue de baja intensidad y desapareció en las primeras 72 horas en la mayoría de los casos; la tos estuvo presente en aproximadamente 50 % de los casos sintomáticos. En un reducido número de pacientes se observaron alteraciones radiográficas compatibles con neumonía/bronconeumonía, características similares a lo encontrado por otros autores,27) asimismo, la frecuencia de otros síntomas clínicos descritos en este trabajo como la cefalea, rinorrea, las manifestaciones digestivas, cutáneas, y neurológicas coinciden con lo publicado por otros investigadores.28
La población pediátrica clásicamente se ha considerado de alta vulnerabilidad a las enfermedades infecciosas, los niños son más susceptibles que los adultos a la mayoría de las enfermedades infecciosas y muestran mayor letalidad en esta etapa de la vida,29,30,31,32 sin embargo, la COVID-19, comparada con otras pandemias o epidemias por enfermedades virales, ha mostrado en general, menor número de casos afectados y muy baja mortalidad en pacientes pediátricos.33 Este peculiar patrón clínico se ajusta al descrito en la presente investigación. Otras dos enfermedades provocadas por nuevos coronavirus, como son el SARS-CoV y MERS-CoV (síndrome respiratorio agudo severo y síndrome respiratorio del Oriente Medio) también han mostrado un bajo nivel de afectación en la población pediátrica.15
Los mecanismos que justifican las diferencias en cuanto a severidad y susceptibilidad entre niños y adultos en el contexto de la infección por SARS-CoV-2, aún no están esclarecidos. Varias hipótesis se han propuesto, entre ellas, inmadurez y expresión diferenciada del sistema de la enzima convertidora de angiotensina 2 (ECA2) entre niños y adultos.34) Es conocido que el SARS-CoV-2 utiliza la ECA2 para infectar la célula hospedadora, además necesita una serina proteasa transmembrana (TMPRSS2), para que ocurra y se establezca eficientemente el proceso invasivo de la célula.35 Estudios previos demuestran que ECA2 se expresa de manera más abundante en células epiteliales ciliadas bien diferenciadas y es menos abundante su expresión en la población pediátrica,36) lo que justificaría, al menos parcialmente, la mayor resistencia a la infección por SARS-CoV-2 en niños. Otros múltiples eventos probablemente estén implicados en esta resistencia de los niños ante la infección, entre ellos, la probabilidad de que los esquemas de vacunación en la infancia entrenan al sistema inmune innato y favorecen una respuesta inmune inespecífica eficaz ante la infección por el nuevo coronavirus, por otra parte, la inmadurez inmunológica disminuye las probabilidades de una respuesta exuberante inmune/inflamatoria perjudicial para el hospedero (elemento central en la patogenia conocida de la COVID-19) y además, la alta frecuencia de exposición e infección por virus comunes, dotan a la población pediátrica de un repertorio de linfocitos T de memoria altamente heterogénea y flexible con probabilidad de respuesta cruzada contra SARS-CoV-2.28
Indudablemente, características propias de la edad adulta también pudieran favorecer la mayor susceptibilidad y severidad ante la infección por SARS-CoV-2, incluye, además de los fenómenos de inmunosenescencia, mayor prevalencia de afecciones crónicas como la diabetes mellitus, enfermedad pulmonar obstructiva crónica y enfermedades cardiovasculares, factores que predisponen a la condición crítica en el curso de la COVID-19 28
En la serie que describimos en el presente trabajo, un lactante (9 meses) necesitó ventilación mecánica invasiva en el curso de un estatus convulsivo, como complicación de una encefalitis por SARS-CoV-2. Las propiedades neurotrópicas y neuroinvasivas de los coronavirus se han descrito en humanos.37,38 El SARS-CoV-2 probablemente invade el sistema nervioso central a través de infección directa a las células endoteliales y utilización de los leucocitos como “caballo de Troya” (migran en el interior de la célula y atraviesan la barrera hemato/encefálica) y de la vía neuronal (incluye trasferencia trans-sináptica a través de neuronas infectadas), el receptor del virus (ECA2) se encuentra exuberantemente expresado en neuronas, astrocitos, y oligodendrocitos, principalmente en Locus Niger, ventrículos, giro temporal medio, corteza cingulada posterior, y bulbo olfatorio. Otro mecanismo de daño neurológico lo constituyen los disturbios neurológicos mediados por la grave disfunción inmune/inflamatoria, caracterizada por un estado de hipercitocinemia mantenido.39) Los trastornos neurológicos provocados por coronavirus incluyen, convulsiones, encefalomielitis, y encefalitis.37) Las complicaciones neurológicas en pacientes adultos con COVID-19 son relativamente comunes e incluyen cefalea, vértigo, alteraciones de la conciencia, desordenes del gusto y el olfato, accidente vascular encefálico, y convulsiones.40,41,42,43,44) Otras alteraciones neurológicas se han descrito como varios casos con síndrome de Guillain Barré, incluida diferentes variantes como el síndrome de Miller-Fisher caracterizado por ataxia, arreflexia y oftalmoplejia.38) Es de destacar que el paciente más grave de los 183 pacientes estudiados por nuestro grupo de trabajo, fue el niño de 9 meses diagnosticado como encefalitis, lo que coincidió con la literatura revisada que plantea que los niños menores de 1 año están entre los más susceptibles a las formas más grave de COVID-19.45
Se ha notificado la persistencia o la recurrencia de RT-PCR-TR positivo para SARS-CoV-2 en fluidos respiratorios altos, semanas después del inicio de los síntomas en pacientes con diagnóstico de COVID-19, incluso después de varios RT-PCR-TR negativos.46 Según la literatura revisada, la duración de excreción de ARN viral en secreciones respiratorias es variable; con un amplio rango de variabilidad y duración proporcional a la envergadura de la sintomatología clínica.47,48,49 La probabilidad de aclarar la presencia del ARN viral en la primera semana del diagnóstico es muy elevada en infecciones asintomáticas comparadas con las sintomáticas.50) Los hallazgos en el presente trabajo demuestran que 96,2 % de los niños estudiados infestados por SARS-CoV-2, no presentaron ARN viral detectable en secreciones naso/faríngeas a los 14 días del diagnóstico, lo que se corresponde con los resultados de otra investigación,51) que estudia series de pacientes con sintomatología leve o asintomática, similar a la aquí descrita. En contraste, otra investigación en la que se estudiaron pacientes con sintomatología moderada, la duración media de excreción viral en secreciones naso/faríngeas fue de 24 días y el paciente en que más se prolongó esta excreción, se extendió a 42 días.52 Sin embargo, la excreción prolongada o recurrente de ARN viral en secreciones respiratorias altas, no necesariamente indica posibilidad de transmitir la infección, probablemente existe un umbral de carga viral por debajo de la cual la capacidad de infección es improbable, algunos estudios sitúan este nivel en 106copias/ml.53,54 Existen evidencias que sugieren que la mayor probabilidad de trasmisión ocurre en los estados tempranos de la infección,55,56,57,58,59) la carga viral en secreciones respiratorias alcanza sus mayores valores inmediatamente después del comienzo de los síntomas y se mantiene en valores relativamente altos (competente en cuanto a probabilidad de transmisibilidad) en los primeros 8 días después del inicio de los síntomas.53 La presencia de virus con capacidad de infectar 9 días después del comienzo de los síntomas es poco probable en pacientes cuyos síntomas clínicos han desaparecido.48,60,61
La investigación presento limitaciones en el hecho de que incluyó un número restringido de pacientes con sintomatología moderada o severa, la mayoría de los niños infectados por SARS-CoV-2 fueron asintomáticos.
Finalmente, podemos concluir que se encuentra un mayor porcentaje de pacientes pediátricos infectados por SARS-CoV-2 en Cuba en comparación con la información en la mayoría de las investigaciones internacionales, lo que pudiera estar relacionado con la mayor eficacia de los sistemas de vigilancia establecidos en el país. La sintomatología clínica de los pacientes infectados por SARS-CoV-2 no difiere de las infecciones respiratorias virales comunes, con predominio de fiebre y tos; la excreción viral se aclaró de las secreciones respiratorias en menos de 14 días en más de 90 % de los pacientes. La posibilidad de manifestaciones neurológicas, aunque infrecuente, constituye una complicación de elevada severidad en el curso de la COVID-19. No se registraron fallecidos en la serie aquí presentada.
Es Recomendable ampliar el estudio incluyendo un mayor número de pacientes con sintomatología moderada o grave.