Introducción
La atresia esofágica (AE) es una malformación congénita enfrentada con frecuencia por el cirujano pediátrico cuya solución quirúrgica se conoce como el “epítome de la cirugía moderna”.1) En Cuba la tasa de incidencia es de 0,1 por cada 1000 recién nacidos vivos y la mortalidad no está publicada en su totalidad.2
En el Centro Territorial de Cirugía Neonatal de las provincias orientales radicado en Holguín, se regionaliza la atención a afecciones quirúrgicas complejas de las cinco provincias orientales del país, la enfermedad representó 20,7 % de las afecciones quirúrgicas intervenidas en los últimos diez años con una supervivencia general de 94,4 %.3,4,5 La corrección quirúrgica de esta afección constituye uno de los grandes paradigmas de la cirugía del recién nacido, debido a que las modalidades de tratamiento cambiaron mucho en las últimas décadas en un reflejo fiel del acelerado desarrollo de la cirugía neonatal y pediátrica.
La capacidad para solucionar esta malformación y la supervivencia que se obtiene en su tratamiento, son indicadores de la calidad de la atención que brinda determinado centro pediátrico.1) La protocolización de las medidas de diagnóstico y tratamiento médico quirúrgico constituyen el objetivo de la guía presentada.
Concepto
La atresia del esófago es una anomalía congénita caracterizada por la falta de continuidad de la luz de este órgano con frecuencia asociada a una fístula a la tráquea.
Epidemiología
La incidencia de la AE es de 1 por cada 3500 recién nacidos vivos, aunque varía geográficamente. Es más frecuente en varones primogénitos e hijos de madres de piel blanca. Existe mayor riesgo de presentarse si la edad materna es avanzada (el riesgo se duplica para las mujeres de 35 a 40 años y se triplica en las mayores de 40). El riesgo de recurrencia entre los padres de un niño con AE es de 0,5 a 2 %, lo que aumenta hasta el 20 % cuando más de un hijo se ha visto afectado.1
Etiología
La etiología se considera heterogénea y multifactorial e involucra múltiples mecanismos genéticos así como sus complejas interacciones con el entorno.6) Teorías como la fusión incompleta de los pliegues laterales o fracaso de la recanalización de la luz esofágica y la proliferación exagerada del epitelio son consideradas insuficientes para explicar las malformaciones típicas de AE. Una hipótesis actual sugiere que la AE puede ser componente de una neurocrestopatía cefálica dada la asociación con anomalías cardiovasculares, malformaciones del timo, tiroides, paratiroides y de la cara.
El proceso morfogenético fundamental parece ser un reordenamiento en la formación del intestino anterior proximal. En la patogénesis de la AE están implicados teratógenos del medio ambiente como es la exposición prolongada a las píldoras anticonceptivas y a estrógenos durante el embarazo, el hipertiroidismo y la diabetes materna, han sido implicados en la patogénesis.7
Clasificación
Numerosos esquemas de clasificación han sido utilizados para la AE pero las propuestas reflejan diferencias en la terminología, aun cuando se trata de las mismas variedades anatómicas. En 1944 Ladd implantó una forma numérica de clasificación usando nomenclatura romana; este sistema fue modificado por Gross con la introducción de un sistema alfabético que sigue siendo de uso frecuente en la actualidad (Fig. 1).8,9
En 1962, Swenson retorna a una clasificación numérica y usa números arábigos en lugar de los números romanos.10 Tantas clasificaciones introdujeron cierto grado de confusión por lo que algunos autores prefieren utilizar nombres descriptivos y trabajar con los subtipos de la anomalía (Fig. 2).
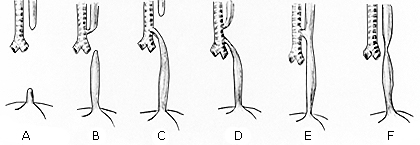 Fuente: Gross R. Surgery of Infancy and Childhood. Philadelphia: W B Saunders; 1953.9
Fuente: Gross R. Surgery of Infancy and Childhood. Philadelphia: W B Saunders; 1953.9Fig. 1 Clasificación anatómica de Gross.
 Fuente: Holcomb and Ashcraft's Pediatric Surgery. 7th Ed. Philadelphia: W B Saunders Company; 2020.1
Fuente: Holcomb and Ashcraft's Pediatric Surgery. 7th Ed. Philadelphia: W B Saunders Company; 2020.1Fig. 2 Clasificación de la atresia esofágica.
La incidencia de los subtipos de AE se comporta de la siguiente manera: la AE con fístula traqueoesofágica (FTE) distal resulta la más frecuente y representa 84 %, la AE sin fístula 6 %, la FTE sin atresia 4 %, la AE con fístula doble 1 % y la AE con FTE proximal 5 %.
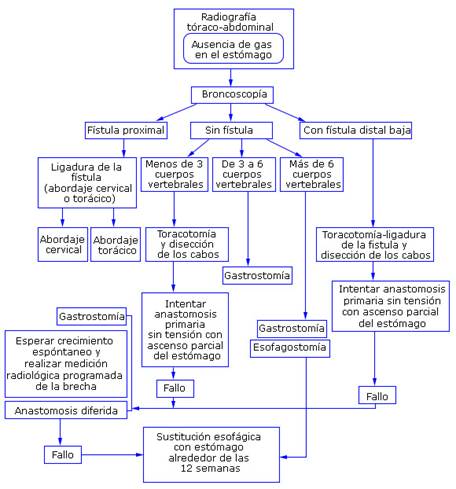
Un nuevo concepto ha sido introducido en las últimas décadas con implicaciones en la estrategia terapéutica, en base a la distancia existente entre ambos bolsones esofágicos: el concepto de AE de brecha larga, para referirse a las variedades anatómicas en las que la distancia entre los bolsones impide la anastomosis primaria; esta denominación es aplicable a la llamada AE pura o sin FTE, a la AE con FTE proximal y a la AE con FTE distal muy baja.11 Varios autores plantean que una separación mayor de dos centímetros o más de tres cuerpos vertebrales entre los bolsones, debe ser considerada una brecha larga.12,13,14) La persistencia de cualquier distancia que después de la disección quirúrgica de ambos cabos impida la anastomosis también ha sido usada para definir este concepto.14,15
Diagnóstico positivo
Diagnóstico prenatal
A diferencia de muchos problemas pediátricos congénitos, la AE no es comúnmente diagnosticada en el periodo prenatal. La detección prenatal por ecografía se basa en el hallazgo de una burbuja gástrica pequeña o ausente y de polihidramnios asociados. Con estos criterios, el valor predictivo de la ecografía prenatal es de 20 a 40 %,16 sin embargo, cuando uno de ellos o ambos se unen a la presencia del llamado “signo del bolsón”, consistente en la presencia del bolsón esofágico ciego en el cuello o el mediastino fetal superior, especialmente visibles después de la semana 26 de gestación, su valor predictivo aumenta hasta 60 % a 100 %, con 80 % de sensibilidad.17) La resonancia magnética fetal en tiempo real puede ser útil en el diagnóstico prenatal de AE.18
Cuadro clínico
La mayoría de los recién nacidos con AE son sintomáticos en las primeras horas de vida. El signo clínico más temprano es la salivación excesiva con crisis de tos y cianosis tras el nacimiento, que se alivian con la aspiración. Por lo general, la primera alimentación es seguida de regurgitación, tos y crisis de asfixia o broncoaspiración. Otras características son la dificultad respiratoria progresiva, la dificultad para deglutir, y la incapacidad de pasar un catéter de alimentación o succión a través de la boca hasta el estómago. El abdomen puede estar distendido si existe una fístula distal y la dificultad respiratoria puede llegar a ser significativa debido a la neumonitis química por el paso de secreciones digestivas al árbol traqueo-bronquial.1,6
Exámenes complementarios
Radiografía simple tóraco-abdominal
El diagnóstico de AE se confirma mediante el paso de una sonda no flexible hacia el esófago hasta el punto en el que se encuentre resistencia. Unos pocos mililitros de aire pueden ser inyectados como agente de contraste para distender el bolsón esofágico superior y con la sonda fija en el sitio de la posible obstrucción, la radiografía de tórax y abdomen en vistas frontal y lateral permitirá identificar el bolsón esófago superior ciego6 (Fig. 3).
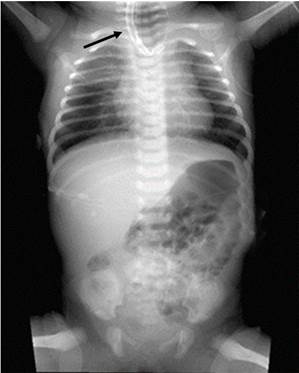 Fuente: Holcomb and Ashcraft's Pediatric Surgery. 7th Ed. Philadelphia: W B Saunders Company; 2020.1
Fuente: Holcomb and Ashcraft's Pediatric Surgery. 7th Ed. Philadelphia: W B Saunders Company; 2020.1
Fig. 3 Radiografía anteroposterior de tórax y abdomen donde se observa señalado con flecha el bolsón esófago superior ciego.
El catéter enrollado en el bolsón esofágico superior, también sugiere el diagnóstico de AE pero el catéter a usar debe ser rígido, de lo contrario puede enrollarse en la parte superior del esófago normal y falsear el diagnóstico. Por otra parte, el diagnóstico de la EA debe ser cuestionado cuando la punta del catéter pasa más allá de la carina. La perforación traumática causa un falso divertículo y también puede llevar a un juicio erróneo por lo que el procedimiento debe realizarse de forma gentil. En ocasiones, el catéter puede descender a través de la tráquea y la fístula distal hacia el estómago.1
Si es necesario, se puede instilar cuidadosamente entre 0,5 a 1 mL de bario diluido al bolsón esofágico superior, para confirmar el diagnóstico. Bajo fluoroscopia cuidadosamente controlada, el bario también puede utilizarse para detectar una FTE proximal, sin embargo, su presencia en el árbol traqueo-bronquial es más probable que represente contraste aspirado a través de la laringe que a través de una fístula.1
La presencia de aire en el estómago es signo de FTE distal. Su ausencia plantea la posibilidad de algunas de las variedades de brecha larga, lo que debe ser considerado al definir la estrategia de tratamiento y el plan quirúrgico.19) Con la radiografía de abdomen simple podrían descartarse otras posibles malformaciones digestivas.20
Traqueoscopia
Resulta imprescindible la realización de una exploración endoscópica de la vía respiratoria superior en el preoperatorio para confirmar o descartar la existencia de una fístula proximal, la cual puede ser sugerida por un bolsón superior muy pequeño o muy corto. Usualmente se realiza una traqueoscopia, rara vez es necesario explorar los bronquios. El examen permite además descartar las hendiduras laringotraqueales, tiene gran valor diagnóstico y puede influir en la estrategia quirúrgica.21
Otros exámenes complementarios
La evidencia clínica de otras anomalías congénitas debe tenerse en cuenta en la evaluación diagnóstica de la AE dada su alta incidencia que alcanza hasta 70 %, por lo que otras pruebas adicionales deben incluir a la ecocardiografía, la ecografía renal y el análisis cromosómico. De hecho, no es raro que el hallazgo de una malformación ano-rectal, preceda a los signos y síntomas clínicos de una AE concomitante.1,6
Tratamiento
Preoperatorio
La neumonitis por aspiración y el reflujo de ácido gástrico a través de la fístula son los problemas preoperatorios más crítico para un recién nacido con AE con FTE por lo que el tratamiento preoperatorio inmediato incluye:
Aspiración continua a baja presión del bolsón esofágico superior preferentemente con sonda de doble lumen diseñada con este propósito.
Colocación del paciente en posición sentada y erguida para minimizar el reflujo a través de la FTE. Algunos autores sostienen que colocar la cabeza erguida en posición prona es más efectivo para reducir este reflujo.22
Cobertura antibiótica de amplio espectro y fisioterapia pulmonar, usualmente con cefalosporinas de tercera generación.
Fluidoterapia intravenosa con dextrosa al 10 % y solución salina hipotónica para mantener fluidos, electrolitos y glicemia dentro de límites normales.
Uso de análogos de la vitamina K.
Puede ser necesario el uso de ventilación mecánica prefiriéndose las modalidades a baja presión o como alternativa, la ventilación de alta frecuencia. El empleo de modalidades a base de altas presiones puede producir sobre-distensión e incluso rotura gástrica.22
Cirugía
La cirugía implica dos tipos de procedimientos: la anastomosis primaria por vía extrapleural o la reparación diferida por etapas.
Técnica quirúrgica
Generalmente el tratamiento quirúrgico de la AE no se considera un procedimiento de emergencia. Por lo tanto, hay tiempo para confirmar el diagnóstico en un centro de cirugía neonatal y para evaluar las anomalías asociadas.23
En la variedad más frecuente (AE con FTE distal) la meta es la ligadura de la fístula con anastomosis esofágica termino-terminal.
El tratamiento se puede realizar a través de una toracotomía o utilizando un abordaje toracoscópico. El lado de entrada al tórax será el opuesto al arco aórtico y la aorta descendente. Si se detecta un arco aórtico derecho en el periodo previo a la cirugía, el cambio hacia el lado izquierdo es apropiado sobre todo si se ha elegido un abordaje toracoscópico, pero si se ha se ha llevado a cabo una toracotomía derecha, la anastomosis se puede lograr desde ese lado aunque existe una mayor dificultad técnica y posibilidad de accidentes quirúrgicos en este entorno.1,6
En pacientes con arco aórtico y aorta descendente normalmente situados a la izquierda, se realiza toracotomía derecha siguiendo los siguientes principios:
El paciente se coloca en decúbito lateral izquierdo y una pequeña almohadilla se sitúa debajo del tórax para aumentar los espacios intercostales de ese lado. El brazo derecho se ubica sobre la cabeza (Fig. 4).
 Fuente: Holcomb and Ashcraft's Pediatric Surgery. 7th Ed. Philadelphia: W B Saunders Company;2020.1
Fuente: Holcomb and Ashcraft's Pediatric Surgery. 7th Ed. Philadelphia: W B Saunders Company;2020.1
Fig. 4 Paciente colocado en posición para una toracotomía derecha.
La sonda de aspiración se mantiene in situ con el objetivo de hacer más fácil la identificación del bolsón proximal.
Se prefiere el acceso extrapleural, para proteger el espacio pleural en caso de fuga anastomótica pero no hay evidencia objetiva de que este abordaje sea mejor que la vía transpleural. La técnica quirúrgica inicia con la localización de la fístula distal que debe pasar exactamente por debajo de la vena ácigos, la cual en ese caso se secciona y liga con sutura absorbible entre 3/0 a 4/0. Si la fístula distal se origina más cefálicamente en la tráquea, la vena se puede conservar para un acceso venoso que resulta muy conveniente.1,6,23
Se realiza la ligadura y sección de la fístula bien cerca de la tráquea tratando de preservar tantos ramos vagales como sea posible; el esófago proximal se identifica fácilmente pidiéndole al anestesiólogo que introduzca unos centímetros la sonda de aspiración esofágica, con lo cual el esófago se insinúa hacia el tórax lo que facilita su disección en sentido posterior y lateral. No está justificada la disección extensa en esta área porque esto puede dañar la tráquea o las paredes del esófago e interferir con la inervación de la porción esofágica superior.1,6,23
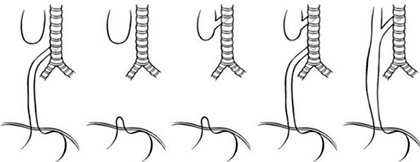
Por último, se realiza anastomosis termino terminal en un solo plano de sutura, con suturas absorbibles 5/0 anudando internamente en la pared posterior; la sutura se realiza sobre una sonda nasogástrica fina que se deja como férula (sonda trans-anastomótica) y que permitirá la alimentación temprana en el periodo posoperatorio (Fig. 5)
No se utiliza drenaje torácico de manera rutinaria, aunque su colocación puede valorarse si se utiliza la vía extrapleural.23
Reparación toracoscópica
Esta modalidad está siendo ampliamente acogida en el mundo. Normalmente esta vía utiliza tres trócares de 2,5 a 5 mm de acceso transpleural e instrumental de este calibre para identificar y ligar la FTE, movilizar el bolsón esofágico proximal y realizar una anastomosis término terminal similar a la que se realiza en una toracotomía abierta. La reparación toracoscópica es técnicamente exigente y requiere habilidad y desarrollo tecnológico pues la anastomosis resulta difícil debido a limitaciones de espacio y la necesidad de anudar a tensión.24,25,26,27,28,29
En las variedades correspondientes a la brecha larga, la conducta dependerá de la variedad anatómica de que se trate; la estrategia será trazada antes o durante el acto quirúrgico e implicará siempre un período variable entre cuatro, seis y hasta 12 semanas, en el que se tratará de restablecer la continuidad esofágica o se decidirá sustituir definitivamente el órgano.14,15) Se define la estrategia a seguir para precisar la modalidad terapéutica (Fig. 6).
La vía toracoscópica también resulta de utilidad en estos casos para evaluar la anatomía, identificar los cabos e iniciar el protocolo de anastomosis diferida sin necesidad de realizar una toracotomía.29
Complicaciones
Los principales predictores de complicaciones incluyen intubación preoperatoria, peso inferior a 2500 g, atresia de brecha larga, fuga anastomótica, intubación posoperatoria de más de cuatro días e incapacidad para alimentarse a final del primer mes.
Las complicaciones se clasifican en tempranas (dehiscencia anastomótica, estenosis esofágica y recurrencia de la fístula) y tardías (reflujo gastroesofágico, traqueomalacia, enfermedades respiratorias y desordenes del peristaltismo esofágico).1,6,30
Pronóstico
Las tasas de supervivencia de los pacientes con AE con o sin FTE han mejorado notablemente en los últimos 50 años hasta alcanzar cifras entre 85 a 95 %. La clasificación de Spitz es el sistema pronóstico más usado actualmente y se ha modificado recientemente por Okamoto y otros, como se muestra (Cuadro).31
Cuadro Predictores de supervivencia en casos de atresia esofágica*
| Tipo | Descripción | Riesgo | Supervivencia (%) |
|---|---|---|---|
| I | Sin anomalía cardiovasc. mayor, Peso al nacer ≥ 2000 g | Bajo | 100 |
| II | Sin anomalía cardiovasc. mayor, Peso al nacer < 2000 g | Moderado | 81 |
| III | Con anomalía cardiovasc. mayor, Peso al nacer ≥ 2000 g | Relativamente alto | 72 |
| IV | Con anomalía cardiovasc. mayor, Peso al nacer < 2000 g | Alto | 27 |
*Modificación de Okamoto de la clasificación de Spitz. Esophageal atresia: Prognostic classification revisited.31
Seguimiento
El seguimiento es complejo y prolongado, por lo que en cada paciente se impone un programa específico de atención al estado nutricional, el neurodesarrollo, el estado psicológico y especialmente a las complicaciones, limitaciones y posibles intervenciones quirúrgicas pendientes derivadas de la corrección inicial.32,33,34
Seguimiento posoperatorio inmediato
En esta etapa, si se ha logrado la anastomosis primaria, está indicado el inicio precoz de la alimentación por sonda, entre 24 a 72 h después de la intervención, incluso en pacientes ventilados, a través de la sonda trans-anastomótica fina colocada con este fin en el procedimiento quirúrgico.35,36
Entre el 7mo. y 10mo. día posoperatorio se retira la sonda y en horario diurno se prueba el inicio de la vía oral. Una fístula proximal olvidada en el acto quirúrgico o la recanalización de la fístula se pueden poner de manifiesto al momento de iniciar la alimentación, por lo que el proceso será supervisado por el especialista. Si se ha cumplido de forma satisfactoria la alimentación por vía oral y es seguro que el neonato traga sin dificultad se realiza el primer esofagograma.
Este procedimiento debe realizarse en condiciones ideales bajo control fluoroscópico, con contraste no baritado y por personal especializado, por lo que el neonato será movilizado de su sala solo en presencia del radiólogo, el cirujano y el neonatólogo. La realización precoz de este procedimiento antes del 7mo. día puede revelar un falso estrechamiento del área de la sutura por edema, por lo que en esta etapa el estudio tiene poco valor diagnóstico.
Seguimiento posoperatorio mediato
Aunque el paciente esté completamente asintomático se requiere de una consulta de control mensual durante el primer año, que se espaciará a trimestral hasta los tres años.
En cada control se indicarán los complementarios necesarios para la evaluación del desarrollo nutricional y el crecimiento.
El esofagograma de control deberá realizarse entre los seis meses y el año de vida. La evidencia de dificultad para deglutir es indicación inmediata de esofagograma a cualquier edad, bajo las condiciones ante descritas. En caso de evidencias de estrechamiento de la luz esofágica se realizará endoscopia esofágica que decidirá la necesidad de instaurar un plan de dilataciones.37