Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Salud Animal
versión On-line ISSN 2224-4700
Rev Salud Anim. vol.40 no.1 La Habana ene.-abr. 2018
ARTÍCULO ORIGINAL
Ventajas de la vitrificación con relación a la congelación en eyaculados de ovino
Vitrification advantages in relation to the conventional freezing in sheep ejaculates
José Ernesto Hernández-Pichardo1*, Lidia Karen Moreno-Peña2, María del Carmen Navarro-Maldonado3, Demetrio Alonso Ambriz-García3, José Luís Rodríguez-Suástegui1
1Laboratorio Manejo de la Reproducción, Universidad Autónoma Metropolitana-Xochimico. Calzada del Hueso 1100, Colonia Villa Quietud, Coyoacán 04960. México, CDMX.
2Clínica privada. México, CDMX.
3Universidad Autónoma Metropolitana Unidad Iztapalapa, México.
RESUMEN
Para evaluar las ventajas de la vitrificación, con relación a la congelación convencional, se utilizaron 40 eyaculados de ovino. De cada eyaculado se determinó el volumen, la concentración y los espermatozoides normales, con valores de 0,8 mL, 1519X106 y 95 %, respectivamente. Cada eyaculado se dividió en una fracción para congelar y otra para vitrificar. Para la congelación se utilizaron pajillas de 0,5 mL y para la vitrificación gotas de 60 µL. La concentración en ambos métodos fue de 50x106 espermatozoides/mL. Antes y después de la criopreservación se evaluó la movilidad progresiva (MP); en semen fresco fue de 81 % y se observó una diferencia (p<0,05) con relación al semen criopreservado, pues fue mayor la movilidad (p<0,05) en semen descongelado (50 %) que en el calentado (36 %). Al analizar los resultados de la viabilidad se observó una disminución importante (p<0,05) del semen fresco (70 %) en comparación con el semen descongelado (51 %) y calentado (54 %). Cuando se evaluó la viabilidad y el estado acrosomal de los espermatozoides, solo en los vivos con acrosoma intacto (VCA) se observaron diferencias (p<0,05) entre el semen fresco (64 %) con respecto al semen descongelado (45 %) y calentado (47 %), pero no así en los espermatozoides vivos sin acrosoma (VSA) (6 %, 6 % y 7 %, respectivamente), en los espermatozoides muertos con acrosoma (MCA) (19 %, 29 % y 27 %, respectivamente) y en los espermatozoides muertos sin acrosoma (MSA) (11 %, 19 % y 18 %, respectivamente). Las dos técnicas de criopreservación mostraron resultados similares; sin embargo, la vitrificación requiere menor tiempo de trabajo, de material y de equipo, lo cual disminuye el costo del proceso y puede realizarse en cualquier laboratorio.
Palabras clave: congelación, vitrificación, semen, ovino.
ABSTRACT
Forty sheep ejaculates were used to evaluate the vitrification advantages in relation to the conventional freezing. From each ejaculate, the volume, concentration and normal sperm were determined, with values of 0.8 mL, 1519X106 and 95 %, respectively. Subsequently, each ejaculate was divided into two fractions of equal concentration, one to freeze and another to vitrify. Zero point five mL straws were used for freezing and 60 μL drops for vetrification. Sperm concentration in both methods was 50x106 sperm/mL. Before and after cryopreservation, the progressive mobility (PM) was evaluated in fresh semen and it was 81 %. There was a difference (p<0.05) in relation to the cryopreserved semen, since mobility was greater (p<0.05) in thawed sperm (50 %) than in heated sperm (36 %). When analyzing viability results, a significant decrease (p<0.05) was observed in fresh semen (70 %), compared to the thawed (51 %) and heated sperm (54 %). When evaluating the acrosomal status and sperm viability, there were differences (p<0.05) between the fresh sperm (64 %) with respect to the thawed (45 %) and heated (47 %) in the live sperm with acrosomal reaction (VCA). This did not happened in the live sperm without acrosomal reaction (VSA) (6 %, 6 % and 7 %, respectively), in the dead acrosome-reacted sperm (MCA) (19 %, 29 % and 27 %, respectively), and in the dead sperm without acrosomal reaction (MSA) (11 %, 19 % and 18 %, respectively). It is concluded that, although both cryopreservation techniques showed similar results, vitrification has certain advantages such as that it requires less work time, material and equipment, decreasing the cost of the process and it can be applied in any laboratory.
Key words: freezing, vitrification, semen, ovine.
INTRODUCCIÓN
A principios del siglo XX se reportó la criopreservación de espermatozoides adicionando un crioprotector permeable (glicerol) al diluyente (1). A esta técnica se le conoce como congelación lenta o convencional e implica el enfriamiento y el equilibrio a 5 °C durante 4 h; en la actualidad, la congelación se realiza mediante vapores de nitrógeno líquido (NL2) (2).
Esta técnica se ha utilizado durante décadas, pero tiene algunos inconvenientes; el principal es la formación de cristales de hielo intra y extracelulares, que dan origen a cambios osmóticos que ocasionan daños a los espermatozoides (3). Entre los daños más frecuentes están las alteraciones de la membrana plasmática, el daño a nivel mitocondrial, el deterioro en la integridad del ADN y las alteraciones del citoesqueleto que provocan efectos negativos en la viabilidad y la movilidad espermática, características esenciales para la fecundación (4).
Una alternativa que se ha propuesto para evitar la formación de cristales de hielo es la vitrificación, que consiste en diluir el semen en una solución concentrada de un crioprotector no permeable (2), que generalmente es sucrosa (0,25 M) (3); con ella la dilución adquiere una consistencia viscosa que se solidifica sin la formación de hielo, pasa a un estado vítreo parecido al vidrio cuando se realiza una congelación ultrarrápida de los espermatozoides (15000 a 30000 ºC/min) al sumergirlos en NL2 (5-9).
Al reducir la formación de hielo intracelular, que es la causa primaria de muerte celular, se produce una mayor tasa de supervivencia después del calentamiento, en comparación con la congelación convencional (2,6). Entre las ventajas de la vitrificación se encuentran que es un método simple, rápido (duración de 2 a 30 min) (1) y más rentable que la congelación convencional, ya que no se requiere de un medio específico de criopreservación ni de equipo especializado de congelación, lo que reduce los costos de producción y puede efectuarse fácilmente en cualquier laboratorio (7,10).
La vitrificación de espermatozoides se ha investigado, principalmente, en humanos (3,7,11,12), pero existe poca información en cuanto a la vitrificación de espermatozoides en ovinos (2,10), a pesar de que en esta especie la criopreservación de espermatozoides se aplica en programas reproductivos o de conservación (2). Debido a la escasa investigación que existe con relación al uso de métodos alternativos para preservar semen de ovino, el objetivo del presente trabajo fue determinar las ventajas de la vitrificación con relación a la congelación en eyaculados de ovinos domésticos (Ovis aries).
MATERIALES Y MÉTODOS
El estudio se realizó en el laboratorio “Manejo de la Reproducción” de la Universidad Autónoma Metropolitana Unidad Xochimilco. Se obtuvieron 40 eyaculados de ovinos, a los cuales se les determinó el volumen, la movilidad progresiva, la concentración, la morfología, así como la viabilidad y el estado acrosomal de los espermatozoides. Posteriormente, cada eyaculado se dividió en dos grupos para realizar ambos tratamientos: congelación convencional o vitrificación.
Obtención y evaluación del semen
El semen se obtuvo de sementales Ovis aries tipo criollo adultos, con fertilidad probada, dieta equilibrada y agua ad libitum. Se colectaron tres eyaculados por semana, durante 14 semanas, mediante vagina artificial (VA). Después de la obtención, las muestras se transportaron al laboratorio en un termo a 37,5ºC, en un tiempo no superior a 20 min. En el laboratorio se colocaron en un baño de agua a 37,5ºC, y se evaluaron las siguientes características:
- Volumen: se determinó utilizando un tubo graduado según la metodología descrita por Valdez (13).
- Movilidad progresiva: se evaluó colocando en un portaobjetos una gota de semen previamente diluido y se cubrió con un cubreobjetos. Su análisis se realizó con un objetivo de 10X de un microscopio triocular en campo claro (Carl Zeiss, EUA) con platina térmica (14).
- Concentración: se calculó utilizando una cámara de Neubauer, previa dilución de 1:200 en una pipeta de Thomas, con un objetivo de 40X (15).
- Morfología: se determinó mediante un frotis de espermatozoides con una tinción de eosina-nigrosina (1:1/V:V) (16).
- Viabilidad y estado acrosomal de los espermatozoides: se utilizó la doble tinción de Isotiocianato de fluoresceína con aglutinina de cacahuate (FITC-PNA; Sigma, L7381) e Ioduro de propidio (IP; Sigma P4170) descrita por Hernández et al. (17), que consistió en tomar 100 µL de cada muestra de semen, adicionándole 5 µL de FITC-PNA (200 µg/mL) y 5 µL de IP (200 µg/mL), e incubando a 38,5ºC durante 5 min.
De esta suspensión se tomaron 10 µL y se añadieron 10 µL de paraformaldehído al 1,6 % para realizar el frotis, que se observó bajo microscopio de epifluorescencia (Eclipse E600, Nikon, Japón) a 400 aumentos. La tinción con FITC-PNA se evaluó con un filtro B-2A (Filtro azul, Exc 450-490 nm), que permite observar un color verde a nivel acrosomal, mientras que la tinción con IP se evaluó con un filtro G-2A (filtro verde, Exc 510-560 nm), que permite observar un color rojo a nivel nuclear. El estado funcional de los espermatozoides se clasificó de acuerdo a los siguientes patrones de tinción:
- Espermatozoides vivos con acrosoma intacto (VCA): células espermáticas con tinción verdea nivel acrosomal, sin tinción roja a nivel posacrosomal.
- Espermatozoides vivos sin acrosoma (VSA): células espermáticas sin tinción verde a nivel acrosomal y sin tinción roja a nivel posacrosomal.
- Espermatozoides muertos con acrosoma (MCA): células espermáticas con tinción verdea nivel acrosomal y con tinción roja a nivel posacrosomal.
- Espermatozoides muertos sin acrosoma (MSA): células espermáticas sin tinción verde a nivel acrosomal y con tinción roja a nivel nuclear. Se contaron 100 espermatozoides por frotis.
Una vez determinadas las características de cada eyaculado, se llevó a cabo el protocolo de congelación o vitrificación.
Protocolo de congelación
La congelación de los espermatozoides se realizó según lo descrito por Miclea et al. (18), utilizando un diluyente comercial (Triladyl, Minitübe, Alemania), que se diluyó a 1:1:3 (V:V) de Triladyl, con yema de huevo y agua bidestilada, respectivamente. La cantidad de diluyente que se adicionó al eyaculado fue para obtener una concentración final de 50X106 espermatozoides/mL. Posteriormente, el semen diluido se enfrió lentamente durante 2 h hasta llegar a 5ºC y se mantuvo a esta temperatura durante 2 h más, para luego envasarlo en pajillas de 0.5 mL. Las pajillas se expusieron a vapores de NL2 durante 13 min (6 cm de la superficie del tanque de N2), para después colocarlas en recipientes de plástico y estos últimos en bastones, para finalmente sumergirlas en NL2.
Protocolo de vitrificación
Para la vitrificación, el semen se centrifugó a 1000 g durante 3,5 min y luego se resuspendió en medio TEST a base de: N-[Tris-(hidroximetil)-metil]-2-amino–etanosulfónico ácido 210,6 mM, Hidroxi-metilaminometano 95,8 mM, D-glucosa10,1 mM, suplementado con 6 % de yema de huevo y 0,1 M de sacarosa (10) para obtener una concentración de 50x106 espermatozoides/mL. Esta suspensión se refrigeró por 30 min. Para el proceso de vitrificación, se formaron gotas de 60 µL que se dejaron caer directamente en el NL2 (10). Para su conservación se colocaron dos gotas vitrificadas en un criovial (Nunc®), que se sumergió en NL2.
Protocolo de descongelación y calentamiento
La descongelación se realizó a una temperatura de 37 ºC, durante 45 seg (19). El calentamiento del semen vitrificado se llevó a cabo según lo descrito por Pradiee et al. (10), con ligeras modificaciones que consistieron en colocar dos gotas a una temperatura de 60ºC durante 16 seg, para posteriormente colocarlas durante 5 min en 700 µL de TEST precalentado a 37ºC; luego se procedió a evaluar las características espermáticas de movilidad, viabilidad y estado acrosomal,
Análisis estadístico
Para determinar si existen diferencias estadísticamente significativas entre las características evaluadas en semen fresco, congelado y vitrificado, se utilizó la prueba de Chi cuadrado (x2) del paquete estadístico NCSS 2007. En las evaluaciones de VCA, VSA, MCA y MSA se utilizó la prueba de proporciones (Excel 2016), con un nivel de confianza p<0,05 para ambas pruebas (20).
RESULTADOS
La Tabla 1 presenta el promedio de las características espermáticas (volumen, concentración y morfología normal), obtenidas de 40 eyaculados de ovino.

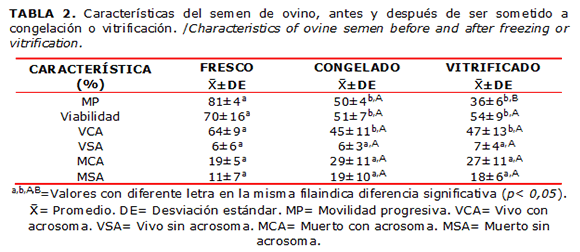
En la Tabla 2 se muestran los promedios de movilidad progresiva y viabilidad en semen fresco, los cuales disminuyeron significativamente (p<0,05) después de la congelación y vitrificación; se observó una mayor movilidad (p<0,05) en el semen descongelado que en el calentado. Por otra parte, la viabilidad no mostró diferencia significativa (p>0,05) entre ambas técnicas de criopreservación. Los resultados de viabilidad y estado acrosomal muestran que en semen fresco los espermatozoides VCA disminuyeron significativamente (p<0,05) después de la congelación y vitrificación, sin observarse diferencia (p>0,05) entre ambas técnicas. Respecto a los espermatozoides clasificados, como VSA, MCA y MSA, no se observaron diferencias significativas (p>0,05) entre el semen fresco, congelado y vitrificado.
DISCUSIÓN
El éxito de la criopreservación depende de la calidad inicial de las células, de tal forma que los espermatozoides de baja calidad son menos criorresistentes (8), de ahí la importancia de evaluar el eyaculado en fresco. En este estudio, el promedio de volumen de los eyaculados obtenidos fue de 0.8 mL, lo cual coincide con lo reportado por Sorensen (21), que señala un rango de 0.8 a 1.2 mL en eyaculados de ovino.
Las concentraciones de espermatozoides de ovino varían de 455x106 a 4515x106 espermatozoides/mL (22); el promedio de la concentración de los eyaculados obtenidos en este estudio (1519x106 espermatozoides/mL) está dentro de este rango. El porcentaje de espermatozoides con morfología normal fue de 95 %, que se halla entre los valores previamente reportados para esta especie, del 93 a 98 % (13,23,24).
Se ha informado que la criopreservación tiene un impacto negativo sobre la movilidad de los espermatozoides (25); esta característica resulta esencial para que los espermatozoides migren a través del tracto reproductivo de la hembra (fecundación in vivo) o para encontrar al ovocito en un medio de fertilización (fertilización in vitro); también es importante para que los espermatozoides penetren la matriz extracelular (zona pelúcida) del ovocito (3). En el presente estudio se observó un efecto negativo de la criopreservación sobre los espermatozoides de ovino (O. aries), ya que al tener el semen fresco una movilidad espermática inicial de 81 %, posterior a su descongelación, disminuye significativamente (p<0,05): 50 % para espermatozoides descongelados y 36 % para espermatozoides calentados; aunque fue mejor la movilidad (p<0,05) en semen descongelado que en calentado.
Esta tendencia fue reportada por Jiménez-Rabadán et al. (2) en ovinos, donde obtuvieron una mayor movilidad en semen descongelado (34,6 %) con respecto al calentado (0,7 %); mientras que Pradiee et al. (10), trabajando con semen de Mouflon, reportaron 25 % y 3 % de movilidad, respectivamente. Ambos autores realizaron la vitrificación utilizando diluciones de sucrosa con glicerol que produjo un efecto negativo sobre la calidad del semen; la movilidad mejoró (21,9 %) cuando solo se usó sucrosa a una concentración de 100 mM (10). Sin embargo, este resultado es inferior al del presente estudio y puede deberse al método de obtención de la muestra, pues los autores utilizaron electroeyaculador (EE) y en este estudio se utilizó VA, lo cual coincide con Rivera (26), quien reportó eyaculados de mejor calidad logrados mediante VA que con EE.
La viabilidad disminuyó significativamente en el semen fresco (70 %) con respecto al semen descongelado (51 %) o calentado (55 %), pero sin existir diferencias significativas entre ambas técnicas. Estos resultados son similares a los reportados por Mohamed en 2015 (3), quien, evaluando semen de humano, no observó diferencia en la viabilidad entre semen congelado y vitrificado al utilizar dos técnicas de selección espermática para la criopreservación (doble centrifugación o swim-up). En la doble centrifugación, el autor reporta viabilidades de 18,2 % y 20,4 % en semen descongelado y calentado, respectivamente; mientras que con la técnica de swinm-up obtuvo 32,3 % y 35,8 %, respectivamente ( 3). Estos resultados son inferiores a los del presente estudio, posiblemente debido al manejo previo a la criopreservación. Se ha mencionado que las centrifugaciones pueden causar daño a la célula espermática debido a mecanismos mediados por un aumento en la producción de especies reactivas de oxígeno (ERO), que pueden generar daños tanto en el ADN como en la membrana plasmática (27). Otras causas pueden ser la calidad inicial del semen con que se trabajó. En este trabajo la viabilidad espermática inicial fue de 70 %, mientras que Mohamed (3) trabajó con viabilidades de 37,3 % y 65,3 % para la técnica de doble centrifugación y swim-up, respectivamente; además de existir una diferencia significativa en la criosensibilidad entre los gametos de las diferentes especies (8).
En lo que respecta a la evaluación del acrosoma, se sabe que esta estructura, unida al núcleo del espermatozoide madurado, contiene enzimas proteolíticas que son liberadas para disolver la zona pelúcida durante la fertilización (28). En el presente estudio los espermatozoides VCA disminuyeron en el semen descongelado y calentado (45 % y 47 %, respectivamente) en comparación con el semen fresco (64 %). Sin embargo, estos resultados son superiores al 20,7 % y 1,1 % de espermatozoides VCA en semen de ovino descongelado y calentado, respectivamente, reportados por Jiménez et al. (2). Los autores utilizaron un diluyente comercial (Biladyl) y una combinación de sucrosa con glicerol para la vitrificación; esta última combinación se ha reportado que afecta la membrana espermática (10,14). Por otra parte, Isanchenko et al. (29), trabajando con semen calentado de humano, observaron 55 % de espermatozoides VCA al utilizar una pajilla doble para la criopreservación. Se ha informado que este tipo de envase protege a los espermatozoides de la criocapacitación, por lo que se conserva un mayor porcentaje de espermatozoides con acrosoma intacto (30).
De acuerdo con lo observado en este estudio, se concluye que la congelación y la vitrificación de espermatozoides dan resultados similares, con excepción de la movilidad, la cual fue mayor en la congelación que en la vitrificación. Sin embargo, la vitrificación tiene ciertas ventajas sobre la congelación de espermatozoides, debido a que requiere de menor tiempo de trabajo, materiales y equipos, lo cual disminuye el costo del proceso.
1. Horta F, Alzobi H, Jitanantawittaya S, Catt S, Chen P, Pangestu M, et al. Minimal volume vitrification of epididymal spermatozoa results in successful in vitro fertilization and embryo development in mice. Asian J Androl. 2016;18:1-6.
2. Jiménez-Rabadán P, García-Ávarez O, Vidal A, Maroto-Morales A, Iniesta-Cuerda M, Ramón M, et al. Effects of vitrification on ram spermatozoa using free-egg yolk extenders. Cryobiology. 2015;71:85-90.
3. Mohamed SAM. Slow cryopreservation is not superior to vitrification in human spermatozoa; an experimental controlled study. Iran J Reprod Med. 2015;13:633-644.
4. Sánchez R, Mansilla M, Risopatrón J, Schulz M, Isachenko V, Isachenko E. Vitrificación de espermatozoides en mamíferos. Spermova. 2015;5(2):213-222.
5. Liebermann J, Nawroth F, Isachenko V, Isachenko E, Rahimi G, Tucker MJ. Potential Importance of Vitrification in Reproductive Medicine.BiolReprod. 2002;67:1671-1680.
6. Pyne DG, Liu J, Abdelgawad M, Sun Y. Digital Microfluidic Processing of Mammalian Embryos for Vitrification. Plos One. 2014;9(9):e108128.
7. Slabbert M, Du Plessis SS, Huyser C. Large volume cryoprotectant-free vitrification: an alternative to conventional cryopreservation for human spermatozoa.Andrologia. 2015;47:594-599.
8. Kopeika J, Thornhill A, Khalaf Y. The effect of cryopreservation on the genome of gametes and embryos: principles of cryobiology and critical appraisal of the evidence. Hum Reprod Update. 2015;21:209-227.
9. Kuznyetsov V, Moskovtsev SI, Crowe M, Lulat AGM, Librach CL. Vitrification of a small number of spermatozoa in normozoospermic and severely oligozoospermic samples. Syst Biol Reprod Med. 2015;61:13-17.
10. Pradiee J, Esteso MC, Castaño C, Toledano DA, Lopez SA, Guerra R, Santiago MJ. Conventional slow freezing cryopreserves mouflon spermatozoa better than vitrification. Andrologia. 2016;49:1-7.
11. Sánchez R, Schulz M, Risopatrón J, Isachenko V, Isachenko E. Vitrificación de espermatozoides: una alternativa a la inyección intracitoplasmática de espermatozoides en paciente con oligoastenozoospermia severa. Rev Int Androl. 2013;11:36-39.
12. Chen Y, Li L, Qian Y, Xu C, Zhu Y, Huang H, et al. Small-volume vitrification for human spermatozoa in the absence of cryoprotectants by using Cryotop. Andrologia. 2015;47:694-699.
13. Valdez JD. Efecto del dodecil sulfato iónico adicionado a un diluyente libre de yema de huevo sobre la calidad del semen ovino congelado. [Tesis de Maestría en Reproducción Animal]. 2013. Universidad de Cuenca, Ecuador. http://dspace.ucuenca.edu.ec/bitstream/123456789/500/1/Tesis.pdf
14. Ruiz GL, Sandoval MR, Santiani AA. Evaluación de la calidad espermática del semen ovino posdescongelación al emplear dos fuentes energéticas y dos crioprotectores. Rev Inv Vet. 2015;26:49-56.
15. Escudero PJ. Preservación de semen ovino mediante vitrificación y congelamiento lento, utilizando diferentes diluyentes comerciales. 2015. [Tesis de Ingeniero Zootecnista]. Escuela Superior Politécnica de Chimborazo. Riobamba, Ecuador. http://dspace.espoch.edu.ec/bitstream/123456789/5256/1/Trabajo%20de%20Titulaci%c3%b3n.pdf
16. Cueto M, Gibbons A, García, VJ, Wolff M, Arrigo J. Obtención, procesamiento y conservación del semen ovino. INTA. Bariloche. 2010;1-14.
17. Hernández PJE, Ducolomb Y, Romo S, Kjelland EM, Fierro R, Casillas F, et al. Pronuclear formation by ICSI using chemically activated ovine oocytes and zonapellucida bound sperm. J AnimSciBiotechnol. 2016;7:65.
18. Miclea V, Zahan M, Nagy S, Miclea I, Rusu A, Varo-Ghiuru F. Freezing of spermatozoa from Tigaie Rams belonging to the hill ecotype. Anim Sci Biotechnol. 2011;44:294-296.
19. Ramónez CJ. Evaluación de dos agentes crioprotectores no permeables y un diluyente comercial (triladyl) en la congelación de semen bovino. Tesis de Maestría en Reproducción Animal. 2013. Universidad de Cuenca, Ecuador. http://dspace.ucuenca.edu.ec/bitstream/123456789/4535/1/Tesis.pdf
20. Daniel W, Chad C. Biostatistics. A foundation for analysis in the health Science.WileyPress, USA. 2013:pp. 261.
21. Sorensen AM. Reproducción Animal. Principios y prácticas. McGraw-Hill, México. 1984.
22. Brito FI, Valencia MJ, Balcázar SA, Angulo MR, Mejía VO. Congelación de semen de carnero en pellets con los diluyentes Tris-glucosa-yema de huevo o Lactosa-yema de huevo. Ava Invest Agro. 2004; 8:1-9.
23. Hernán GV, Huanca LW, Raymundo T, Huerta OS, Ramos DD. Uso de dilutores hipertónicos en la criopreservación de semen ovino. Rev Inv Vet. 2009;20:41-46.
24. Cabrera VP, Orellana ChJ, Pantoja AC. Efecto de dos dilutores sobre la motilidad e integridad de la membrana espermática en semen congelado de ovinos. Rev Inv Vet. 2010;21:154-160.
25. Mohammad AK, Maryam A, Iman H, Ali N. Vitrification of neat semen alters sperm parameters and DNA Integrity. Urol J. 2014;11:1465-1470.
26. Rivera BO. Inseminación con semen fresco en ovinos. Monografía para obtener el título de Médico Veterinario Zootecnista. Universidad Autónoma Agraria. 2014. Coahuila. http://repositorio.uaaan.mx:8080/xmlui/bitstream/handle/123456789/7138/OSCAR%20RIVERA%20BARRON.pdf?sequence=1
27. Urrego R, Ríos A, Olivera AM, Camargo O. Efecto de la centrifugación sobre la membrana plasmática y el ADN de espermatozoides bovinos. Rev Colomb Cienc Pec. 2008;21:1-2.
28. Zou Y, Yin T, Chen S, Yang J, Huang W. On-Chip Cryopreservation: A Novel Method for Ultra-Rapid Cryoprotectant-Free Cryopreservation of Small. Plos One. 2013;8:e61593.
29. Isachenko V, Maettner R, Petrunkina AM, Sterzik K, Mallmann P, Rahimi G, et al. Vitrification of Human ICSI/IVF spermatozoa without cryoprotectants: New capillary technology. J Androl. 2012; 33: 462-468.
30. Sánchez GR. Presente y futuro de la andrología. Rev Med Clin Condes. 2014;25:14-24.
Recibido: 16/11/2017
Aceptado: 6/3/2018
*Autor para correspondencia: José Ernesto Hernández-Pichardo. E-mail: embrioninvitro@hotmail.com














