INTRODUCCIÓN
La ehrlichiosis monocítica canina (EMC) es una enfermedad multisistémica, de sintomatología compleja y signos clínicos muy inespecíficos, que afecta a los perros domésticos (1,2,3). Es producida por la bacteria Ehrlichia canis, rickettsia intracelular obligada, altamente pleomórfica, Gram negativa, que infecta monocitos y macrófagos. Se transmite por garrapatas del complejo Rhipicephalus sanguineus sensu lato, especie más común que infesta a los perros (4).
Para el diagnóstico de este patógeno se utilizan diferentes técnicas, como los frotis de sangre y de capa leucocitaria, debido a que este microorganismo se caracteriza por la presencia de cuerpos de inclusión intracitoplasmáticos (mórulas) en células mononucleares (monocitos) y ensayos serológicos y de PCR (5,6).
Debido al potencial zoonótico que posee esta rickettsia, a nivel mundial se han incrementado las investigaciones con el objetivo de determinar el impacto que esta tiene sobre la salud humana y animal. En Cuba, los estudios que se reportan son limitados y se orientan hacia el diagnóstico de la enfermedad en perros con sospecha clínica de ehrlichiosis (7,8), lo que indica que cuando el animal permanece asintomático se obvia la etapa subclínica. León et al. (8) lograron visualizar E. canis en frotis de sangre, de perros de la raza Pastor Alemán, con signos clínicos compatibles con la enfermedad y con antecedentes de infestación por garrapatas.
El presente trabajo tuvo como objetivo estudiar la presencia de E. canis en perros domiciliados, aparentemente sanos, de cuatro municipios del occidente del país, mediante la visualización de frotis sanguíneo y de capa flogística.
MATERIALES Y MÉTODOS
La investigación se realizó entre septiembre de 2013 y agosto de 2014. Se estudiaron 253 perros domiciliados, aparentemente sanos, de diferentes raza, edad y sexo, de cuatro municipios del occidente de Cuba de las provincias La Habana (Habana del Este, Boyeros y Cotorro) y Mayabeque (San José de las Lajas).
A cada uno de los perros se les extrajo 3 mL de sangre venosa, mediante punción de la vena cefálica, con agujas hipodérmicas calibre 21G en tubos para extracción de sangre por sistema de vacío de 4 mL (BD Vacutainer®) con 7,2 mg de EDTA como anticoagulante. Las muestras de sangre se trasladaron al laboratorio inmediatamente y se dividieron para su evaluación por frotis de sangre venosa (152 muestras) y de capa flogística (101 muestras).
Para obtener la capa flogística se llenaron los capilares de sangre venosa y se centrifugaron a 12000 rpm en microcentrífuga (Jouan, Inglaterra) durante 10 min. Posteriormente, se eliminó el extremo del capilar donde se encontraba el paquete de glóbulos rojos; el contenido de la capa flogística se depositó en una lámina portaobjeto y se extendió, según lo descrito por el Manual de la Organización Mundial de Sanidad Animal para Animales Terrestres (9).
Ambos frotis se secaron a temperatura ambiente, se fijaron con Metanol absoluto (Uni-Chem) y se tiñeron durante 30 min con solución de Giemsa al 10 % (10). La observación se realizó en un microscopio óptico (Leica DM750, Inglaterra) con objetivo de inmersión 100X y ocular 10X. Se analizaron 20 campos por lámina como mínimo en la periferia del frotis (cola del frotis sanguíneo).
Los resultados de ambos frotis sanguíneos se compararon por el método Wald por corrección, con el programa CompaProWin 2.0.1 (11).
RESULTADOS Y DISCUSIÓN
Se visualizaron mórulas compatibles con E. canis (Fig. 1) en 6/152 (3,94 %) frotis de sangre venosa, de acuerdo con las características morfológicas previamente descritas por Nyindo et al. (12) y Tesouro y Sainz (13), como la forma, la localización y el tamaño. A pesar de que el diagnóstico se realizó en animales aparentemente sanos, los resultados sugieren que los animales donde se visualizaron las mórulas se encontraban en la fase aguda de la enfermedad donde, en ocasiones, los síntomas pueden ser inespecíficos, variables, e incluso pasar desapercibidos, y los animales no ser diagnosticados clínicamente (1).
Algunos de los perros diagnosticados como negativos por frotis sanguíneo pudieran encontrarse cursando la fase subclínica de la enfermedad, donde los animales no manifiestan signos clínicos (14). La expresión y la severidad de estos síntomas clínicos dependerán de la patogenicidad de E. canis, de los niveles de la rickettsemia y de la presencia de coinfecciones (15,16).
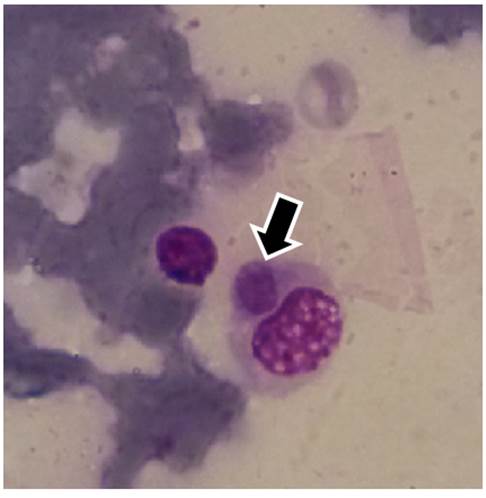
Figura 1 Mórula compatible con E. canis en monocito de un perro domiciliado, visualizada en frotis de sangre teñido con Giemsa, mediante microscopía óptica (1000X)./ Morula compatible with E. canis in a monocyte of a domestic dog, visualized in blood smears stained with Giemsa by optical microscopy (1000X).
Los resultados coinciden con los obtenidos por Woody y Hoskins (17), quienes reportaron un bajo porcentaje de animales positivos en los frotis sanguíneos (4 %), debido a que en la fase aguda de la enfermedad se produce una baja y fluctuante rickettsemia, que disminuye aún más en las fases subclínica y crónica, lo que propicia la aparición de falsos negativos.
En un estudio aleatorio realizado en perros domiciliados del estado de Salvador de Bahía, en Brasil, se reportó una baja frecuencia de animales positivos a E. canis por frotis sanguíneo, lo que pudo ser explicado porque los animales se encontraban en la fase subclínica o crónica de la enfermedad (18).
En investigaciones realizadas en perros atendidos en clínicas veterinarias de diferentes estados de Brasil, se mostraron también bajos porcentajes de detección de E. canis en monocitos (19,20,21). Sin embargo, a pesar de que estos animales mostraban signos clínicos compatibles con la EMC, los porcentajes de animales positivos por frotis sanguíneo fueron inferiores a los obtenidos en el presente estudio, lo que demuestra la variabilidad en la presentación y manifestación de los síntomas clínicos y su relación con los resultados del diagnóstico (1).
En el frotis de capa flogística existen mayores probabilidades de visualizar mórulas de E. canis en monocitos, debido a la concentración de las células de la serie blanca. Sin embargo, en este estudio no se encontraron diferencias significativas entre los resultados de ambos frotis y solo se visualizaron mórulas compatibles con E. canis en 8/101 (7,9 %) frotis de capa flogística, lo que igualmente sugiere que estos animales se encontraban en la fase aguda de la enfermedad, a pesar de que no mostraban signos clínicos (Fig. 2).
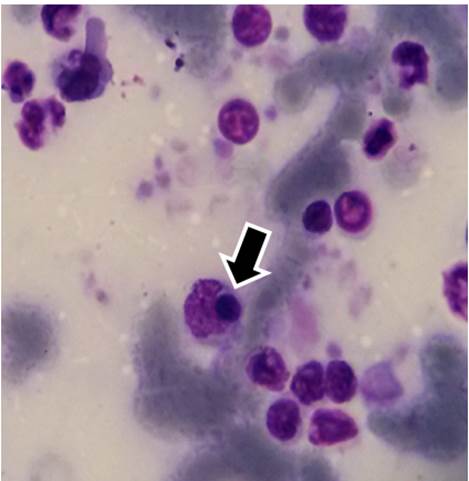
Figura 2 Mórula compatible con E. canis en monocito de un perro domiciliado, visualizada en frotis de capa leucocitaria teñido con Giemsa, mediante microscopía óptica (1000X)./ Morula compatible with E. canis in a monocyte of a domestic dog, visualized in leukocyte layer smears stained with Giemsa by optical microscopy (1000X).
Resultados inferiores se reportaron por Faria et al. (22); estos autores diagnosticaron 5,7 % perros positivos a E. canis con signos clínicos compatibles con la enfermedad. Sin embargo, los resultados son diferentes cuando se compara el diagnóstico directo para E. canis en capa leucocitaria con el realizado en otras muestras, como ganglios linfáticos y médula ósea (5).
En un frotis de sangre venosa, donde se observó mórula compatible con E. canis en monocito, también se visualizó mórula compatible con A. platys en plaquetas (Fig. 3), para una frecuencia de coinfección de 0,66 %.
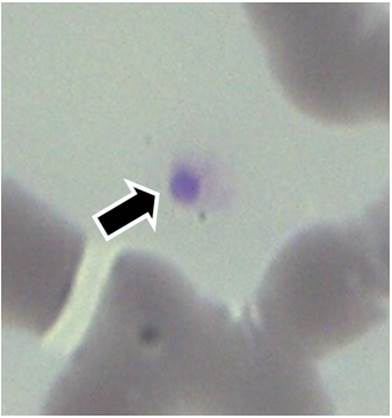
Figura 3 Corpúsculo de inclusión compatible con Anaplasma platys en plaquetas de un perro domiciliado, visualizada en frotis de sangre teñido con Giemsa, mediante microscopía óptica (1000X)./ Inclusion corpuscle compatible with Anaplasma platys in platelets of a domestic dog, visualized in blood smears stained with Giemsa by optical microscopy (1000X).
A. platys se reportó en Cuba por Silva et al. (23) mediante PCR anidada, en 16 % de muestras de sangre procedentes de perros domiciliados aparentemente sanos.
La coinfección de E. canis y A. platys encontrada en el presente estudio se puede deber a que la garrapata R. sanguineus es el principal vector de estos agentes (24,25), y en esta garrapata también se ha descrito la presencia de ambos patógenos (26).
Varios autores reportan en perros domiciliados, aparentemente sanos y perros con signos clínicos compatibles con hemoparasitosis, la detección de coinfecciones por PCR anidada entre E. canis y otros hemoparásitos, entre las que se encuentran: E. canis con A. platys (16,09 %) y E. canis con A. platys y B. canis (1,95 %) (27); E. canis con A. platys y B. canis vogeli y E. canis con A. platys y H. canis (28). Estos autores también detectaron coinfección entre E. canis y B. gibsoni en garrapatas R. sanguineus s.l.
En perros de la India también se encontró que el 11,5 % de perros de refugio, de dos ciudades con clima tropical y subtropical húmedo, estaban coinfectados (29).
Los resultados del presente estudio demostraron la presencia de mórula intracitoplasmática de E. canis en monocitos y de coinfecciones con A. platys en perros domiciliados aparentemente sanos. Estos resultados constituyen la premisa de posteriores investigaciones para estimar la prevalencia del patógeno en estas poblaciones de perros, dado el potencial zoonótico de este hemoparásito y la necesidad de tomar medidas para su control con el enfoque de Una Salud.














