Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión On-line ISSN 1819-4087
cultrop vol.39 no.2 La Habana abr.-jun. 2018
ARTÍCULO ORIGINAL
Adaptación de vitroplantas de Acrocomia aculeata, con la aplicación de HMA y Biobras-16
Adaptation of Acrocomia aculeata vitroplants, with the aplication of AMF and Biobras-16
Dr.C. Alejandro F. Hernández,I Dr.C. Rodolfo R. Plana,I Raquel R. Bonato,II Elis BorcioniII
I Instituto Nacional de Ciencias Agrícolas (INCA), Carretera Tapaste, Km 3½, Gaveta Postal 1. San José de las Lajas, Mayabeque. Cuba. CP 32700.
II Laboratorio OIKOS, Departamento de Botánica, Sector de Ciencias Biológicas, Universidad Federal de Paraná, Centro Politécnico, Jardín de las Américas, Curitiba, Paraná, Brasil. C. Postal 19031.
RESUMEN
Se llevó a cabo un experimento en la Universidad Federal de Paraná, Brasil, el cual se estableció y desarrolló bajo condiciones controladas de invernadero. El objetivo de la investigación fue obtener una metodología para mejorar el proceso de adaptación de plántulas de la palmera oleaginosa Acrocomia aculeata (Jacq.) Lodd. ex mart., obtenidas a partir del cultivo in vitro de embriones cigóticos. Se utilizó un sustrato compuesto por suelo y arena de rio lavada en proporción (3:1) y se aplicó a las plántulas los productos: Hongos Micorrízico Arbusculares (HMA) y un Análogo Espirostánico de Brasinoesteroide (Biobras-16), con un total de cuatro tratamientos, los cuales fueron: 1-Testigo, 2-Inoculación de las plantas con HMA y una aplicación de Biobras-16 al trasplante, 3- Inoculación de las plantas con HMA y 4- Inoculación de las plantas con HMA y dos aplicaciones de Biobras-16, una al momento del trasplante y otra 30 días después. Los resultados obtenidos, mostraron que el mejor tratamiento fue el número 2, en el cual las vitroplantas fueron inoculadas con HMA y se les realizó una aspersión foliar con Biobras-16 al momento del trasplante, lo cual produjo un incremento en los diferentes índices de crecimiento y desarrollo de las plantas con respecto a los demás tratamientos.
Palabras clave: aclimatación, brasinoesteroides, hongos, inoculación, palmas oleaginosas.
ABSTRACT
An experiment was carried out at the Federal University of Paraná, Brazil, which was established and developed under controlled conditions of greenhouse. The aim of this research was to obtain a methodology to improve the adaptation process of seedlings of the oil palm Acrocomia aculeata (Jacq.) Lodd. ex mart., obtained from the in vitro culture of zygotic embryos. A substrate composed of soil and river sand washed in proportion (3:1) was used and the following products were applied to the seedlings: Arbuscular Mycorrhizal Fungi (AMF) and a Spirostic Analogue of Brassinosteroid (Biobras-16), with four treatments, which were: 1-Control, 2-Inoculation of the Plants with AMF and one application of Biobras-16 to the transplant, 3- Inoculation of the plants with AMF and 4- inoculation of the plants with AMF and two applications of Biobras-16, one at the transplant time and another 30 days later. The results showed that the best treatment was the number 2, in which the vitroplants were inoculated with AMF and a foliar spray was performed with the Biobras-16 at the time of transplantation, which produced an increase in the different growth and development rates of the plants with respect to the other treatments.
Key words: acclimatization, brassinosteroids, fungi, inoculation, palm oils.
INTRODUCCIÓN
La producción de aceites vegetales a partir de nuevas fuentes como son las palmas se ha ido incrementando paulatinamente desde la década de los 90 hasta nuestros días debido al aumento de la demanda de su uso a nivel global, debido a que poseen una amplia utilización, que va desde satisfacer las crecientes necesidades alimentarias de la población, hasta la producción industrial de jabones, cosméticos y el uso de lubricantes y biodiesel como fuente de energía renovable (1,2). La agroindustria de la palma de aceiteElaeis guineensis, es responsable de suplir casi el 40 % de las necesidades de aceites y grasas de la población mundial (3); sin embargo, la especie Acrocomia aculeata, segunda en volumen productivo por superficie, ha ido cobrando en las últimas décadas un desarrollo importante, debido a que se adapta mejor a suelos de menor calidad y es menos exigente en agua (1).
Sin embargo, en los países en que se producen aceites a partir de A. aculeata, principalmente en Paraguay y Brasil, la cosecha de los frutos en su mayor parte se hace por medio del extractivismo familiar a partir de plantas que crecen de forma natural (4).
Durante el último quinquenio se ha estado trabajando en domesticar la especie para poder organizar la cosecha con menores costos, seleccionando el material de plantación, ya que posee mucha variabilidad genética y así lograr plantas que tengan los caracteres más homogéneos, lo cual permitirá una mayor eficiencia productiva (5).
Una vez seleccionado el material de plantación, deben producirse plantas de forma acelerada con características homogéneas, siendo uno de los métodos a utilizar la multiplicación in vitro a partir de embriones cigóticos. Con el objetivo de obtener una metodología para mejorar el proceso de adaptación de las vitro plantas a condiciones ex vitro, se desarrolló un trabajo de investigación bajo condiciones controladas, con la aplicación de dos bioproductos, los Hongos Micorrízico Arbusculares (HMA), los cuales son de gran ayuda en la solubilización y absorción de nutrientes para las plantas (3,6) y un análogo espirostánico de Brasinoesteroide, del cual algunas de sus formulaciones han demostrado estimular el crecimiento cuando las plantas son sometidas a estrés. Existen buenos resultados en tratamientos realizados en adaptación de vitroplantas y en el tratamiento de plantas de otros cultivos sometidas a estrés, como la producción de plantas en viveros, y otros tipos de producciones vegetales (7,8).
MATERIALES Y MÉTODOS
El trabajo experimental se llevó a cabo bajo condiciones controladas en un invernadero modelo Van der Hoeven con sistema automático de programación de temperatura y humedad relativa, que mantuvo todo el tiempo la temperatura media entre 25 y 26 oC y la humedad relativa al 70 %, perteneciente al departamento de Fitotecnia y Fitosanitarismo, Sector de Ciencias Agrarias de la Universidad Federal de Paraná, Curitiba, Brasil. Para llevar a cabo el experimento se utilizaron vitroplantas obtenidas a partir del cultivo in vitro de embriones cigóticos de A. aculeata en el laboratorio de cultivo de tejidos de dicha universidad, obtenidas en medio de cultivo Woody Plant Medium (WPM) (Lloyd y McCrown 1980). Los embriones utilizados se obtuvieron a partir de semillas de plantas seleccionadas en la Finca “Campanario”, municipio Bodoquena, estado de Mato Grosso del Sur.
Se establecieron cuatro tratamientos experimentales, los cuales tuvieron tres réplicas de diez plantas cada uno (Tabla I).
El sustrato utilizado estuvo compuesto por suelo+arena de rio lavada. En proporción (3:1 v/v), mostrándose su composición química en la Tabla II y la composición granulométrica en la Tabla III.
Composición de los bioproductos y el fertilizante mineral utilizados. Forma de preparación y aplicación
Los Hongos Micorrízico Arbusculares (HMA) utilizados para la inoculación, correspondientes a la serie EcoMic®, producto comercial patentado y producido en Cuba por el Instituto Nacional de Ciencias Agrícolas (INCA), utilizándose la especie Glomus cubense (9), con un contenido de 40 esporas por gramo. El mismo se aplicó colocando dos gramos de producto en polvo en el interior del hoyo hecho en el sustrato de la bolsa que recibiría la planta a adaptar.
El análogo espirostánico de brasinoesteroide utilizado para la aplicación asperjada se correspondió con “Biobras-16”, que es producido por el Laboratorio de Productos Naturales de la Facultad de Química de la Universidad de La Habana, Cuba, el cual tiene una concentración de 1 g L-¹. Para ser aplicado, se preparó a una concentración de 0,05 mg L-1, mezclándolo en agua, agitado y asperjado en forma de rocío hasta punto de goteo a las plantas después de trasplantadas o en el momento que le correspondiese según el tratamiento (Tabla I). Para aplicar el bioproducto se utilizó un asperjador de mano.
La fertilización de las plántulas en adaptación se realizó con el producto comercial “Nutriverde” fórmula líquida (6-6-8 + micro nutrientes), a razón de 2 ml del fertilizante líquido en tres litros de agua. Se aplicó de forma pareja al sustrato de las bolsas a razón de 25 ml en cada una y luego se dio un riego ligero; esta fertilización se realizó en dos momentos, cuando las plantas tenían 180 días de trasplantadas y a los 210 días.
Variables estudiadas:
-
La evaluación final de las plantas se realizó cuando estas tenían 399 días después del trasplante (ddt).
-
Altura de las plantas: se midió con una cinta métrica desde el cuello de la planta hasta el ápice.
-
Diámetro de los tallos: se midió con un Vernier a una altura de un centímetro por encima del cuello de la planta.
-
Número de hojas emitidas: se contó el número de hojas emitidas.
-
Largo promedio de las hojas: se midió con una cinta métrica la longitud en cm. de cada una de las hojas por planta y se sacó el promedio de las mismas.
-
Masa seca de las diferentes partes de las plantas y total en el muestreo final: una vez extraídas las plantas seleccionadas, se separaron por secciones raíces, cormo, tallo, hojas y raquis. Se tomó el peso verde pesando las diferentes partes en balanza técnica con 0,01 g de precisión. Una vez pesadas se pusieron en estufa hasta peso seco constante, y se pesaron nuevamente.
-
Para determinar la colonización radical por los HMA, se tomaron 200 mg de raíces de cada muestra que se tiñeron con azul tripan (10), posteriormente se utilizó el método de los interceptos para cuantificar la colonización micorrízica (11). La densidad visual se determinó por medio de la evaluación de la ocupación fúngica del hongo en la raíz de cada intercepto asignándosele un nivel a los porcentajes de ocupación (12).
-
Determinación de área foliar de las plantas: se utilizó para ello el método de los discos, según (Watson & Watson 1953) citado por Vidal (13), sacando un promedio de 10 discos de 1 cm -2 por planta en hojas de diferente estado de desarrollo y un total de nueve plantas muestreadas por tratamiento. Posteriormente se secaron en estufa de circulación forzada a temperatura de 70 oC, hasta peso constante. Tanto las hojas como los discos extraídos a cada planta, se pesaron en balanza analítica con error (± 1 mg), pudiéndose así calcular en base a los discos de área y peso promedio conocido, el área foliar de las plantas.
Extracción de nutrientes por las Plantas
Para determinar la extracción de nutrientes hecha por las plantas en el período evaluado, se envió al laboratorio las muestras secas de plantas completas por cada tratamiento para la extracción de los nutrientes en ellas contenidos, utilizándose el método de Dumas para la determinación de N y el método Nitroper para las determinaciones de P, K, Ca, Mg y S expresados en mg/gr. Después en base a la media de la materia seca por planta por cada tratamiento, se calculó la cantidad de nutrientes extraídos.
Método empleado para el trasplante de tubo a bolsa
Durante el proceso de pase de tubo a bolsa con sustrato, se tuvo mucho cuidado de poner a funcionar con anterioridad en el interior del invernadero el sistema de riego por micro aspersión antes de realizar el trasplante de las vitroplantas, con el objetivo de aumentar la humedad relativa dentro del local y minimizar el estrés de las plántulas al realizar el trasplante.
Las vitroplantas fueron trasplantadas de los tubos a pequeñas bolsas de polietileno (3x7 cm) que contenían un sustrato de suelo+arena descrito con anterioridad. Se retiró con agua estéril y la ayuda de un frasco lavador, los restos de medio de cultivo de las raíces de las vitroplantas. Las pequeñas bolsas donde fueron colocadas las vitroplantas estaban depositadas a su vez dentro de cajas plásticas trasparentes con tapa, las cuales contenían 30 bolsas cada una.
En el caso de las plantas que se inocularon con HMA, se aplicó el bioproducto en forma de polvo a razón de dos gramos por bolsa, momentos antes del trasplante, depositándose en el hoyo que se hizo en la bolsa que había sido previamente humedecida para recibir la plántula.
La aplicación de Biobras-16 se realizó según correspondió por tratamiento y momento (Tabla I); una vez terminado el trasplante, las plantas fueron asperjadas y cerradas las cajas plásticas, colocándose sobre una mesa. Estas cajas plásticas trasparentes con tapa, y dimensión de 35 cm largo x 20 cm de ancho x 10 cm de profundidad y tapa con 10 cm de altura sobre el eje del cierre, hacen la función de cámara húmeda para la adaptación de las vitro-plantas. Las plantas se mantuvieron en la etapa de cámara húmeda durante los primeros 30 días y se fueron abriendo poco a poco hasta que 10 días más tarde las tapas fueron retiradas definitivamente.
Las vitroplantas ya adaptadas en las bolsas pequeñas, fueron trasplantadas a los tres meses de edad a bolsas de polietileno negro de mayor tamaño (18x30 cm) que contenían un sustrato con la misma composición al utilizado en las bolsas pequeñas. Las mismas se colocaron sobre una mesa de madera cubierta con nylon distribuyéndose en un diseño de bloques al azar de cuatro tratamientos y tres repeticiones, teniendo cada tratamiento 10 plantas.
El riego de las plantas se llevó a cabo cada siete días en las cajas de adaptación, después que estas se extrajeron de las mismas y se trasplantaron, el riego se realizó cada tres días.
Análisis estadístico
Los datos correspondientes a porcentaje fueron transformados por la fórmula arc sen √x y las medias de los conteos por la fórmula √(x+1)para hacer los análisis estadísticos.
Los datos obtenidos se analizaron por medio de un Análisis de Varianza de clasificación simple. En los casos en que se encontró diferencia significativa entre los tratamientos, se realizó la comparación de medias mediante la prueba de rangos múltiples de Duncan, y para el procesamiento estadístico se utilizó el programa Statgraphics plus, versión 5.
RESULTADOS Y DISCUSIÓN
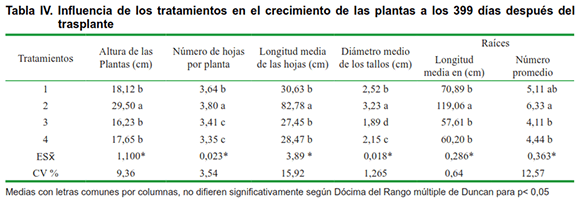
En la Tabla IV se muestran los resultados del efecto de los diferentes tratamientos aplicados a las vitroplantas en fase de adaptación.
Como se puede apreciar en la tabla, los mejores resultados se obtuvieron cuando el sistema radical de la planta se inoculó con HMA, y se aplicó Biobras-16 al momento del trasplante (tratamiento 2). Las variables altura de las plantas, longitud media de las hojas y número promedio de raíces por planta mostraron diferencias significativas con el resto de los tratamientos, lo que demuestra la existencia de sinergismo entre los dos bioproductos aplicados. Resultados similares en cuanto a la aplicación de Biobras-16, fueron obtenidos en la adaptación de vitroplantas de banano (14); sin embargo, se puede apreciar que cuando se realizó la inoculación del sistema radical con HMA, y se hacen dos aplicaciones de Biobras-16, una al momento del trasplante, y otra 30 días después del trasplante (Tratamiento 4), se obtiene un menor crecimiento de las plantas.
Esta respuesta no coincide con los trabajos del autor antes citado, el cual obtiene un mayor crecimiento de las plantas con la inmersión de las raíces de las vitroplantas en una solución de Biobras-16 por 15 minutos antes del trasplante y una aplicación foliar a concentración de 0,02-0,2 ?mol L-1 ,15 días posteriores al trasplante.
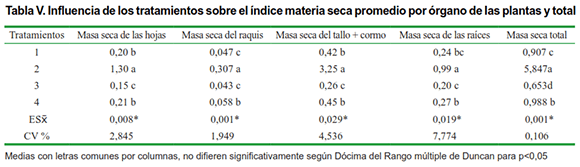
Con respecto al índice materia seca acumulada por las plantas por órgano y total, también se puede apreciar que el tratamiento 2 tiene la mayor cantidad de materia seca acumulada al momento del muestreo final con diferencias significativas con el resto de los tratamientos (Tabla V), seguida del tratamiento 4, donde se inoculó el sistema radical de las plantas con HMA y se hicieron dos aplicaciones de Biobras-16.
Experimentos realizados con la aplicación de los brasinoesteroides en varios cultivos agrícolas, demostraron que con aspersiones foliares de ese bioproducto, a concentraciones de 0,1 mg L-1 se promovió marcadamente el crecimiento de las plantas en altura, grosor del tallo, longitud de la raíz principal, la masa seca por planta, el área foliar y la fotosíntesis (15–17).
En cuanto a adaptación y crecimiento estimulado por los HMA, Schultz (2001) (3), se reportó que plántulas de E. guineensis propagadas in vitro e inoculadas con 12 aislamientos de HFMA (Hongos Formadores de Micorriza Arbuscular), mostraron un aumento en la supervivencia durante la etapa de endurecimiento entre el 83 y 100 %, mayor crecimiento tanto radical como de la parte aérea, y un incremento en la toma de fósforo, siendo las especies más eficientes Glomus manihotis, Entrophospora colombiana, Acaulospora mellea y Acaulospora appendicula. En trabajos realizados con inoculaciones con HMA en palma de aceite, pero propagadas a partir de semilla sexual, se han obtenido importantes resultados al realizar la inoculación de las plantas en fase de vivero, observándose que después del trasplante a campo, las plantas inoculadas sobrepasan en altura y formación de materia seca al menos en tres veces a las plantas que no fueron inoculadas, con diferencias altamente significativas entre ellas (18–21).
Por otra parte además de los beneficios ya conocidos de la simbiosis con las micorrizas, como son la ayuda no solo a una toma de nutrientes más eficiente por la planta, sino también contribuye a la tolerancia al déficit hídrico, la resistencia al ataque de patógenos, y al acortamiento al tiempo de aviveramiento de las plantas (22), la tolerancia a niveles altos de metales pesados y la agilización de crecimiento en etapas tempranas del desarrollo, especialmente bajo condiciones de vivero (23). También sobre tolerancia de las palmáceas al déficit hídrico cuando su sistema radical se encuentra realizando simbiosis con HMA se cita el caso de la especie Coccotrinax readii Quero (20).
En cuanto al tratamiento 3 (plantas inoculadas con HMA al momento del trasplante), las plantas no mostraron un incremento del crecimiento como se esperaba, por tener el sustrato en el cual se están desarrollando un pH bastante ácido y un alto contenido de aluminio como se puede apreciar en la Tabla II, el cual no es el adecuado para la especie Glomus cubense, ya que esta se adapta mejor a pH que van desde ligeramente ácidos a neutros (21).
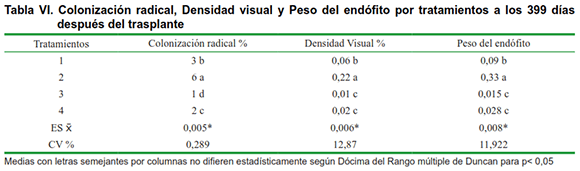
Probablemente la aplicación de Biobras-16 actúa como un anti estresante ante el efecto de la acidez sobre las simbiosis que se lleva a cabo en las plantas inoculadas, lo cual se puede corroborar en la Tabla VI donde se observa también que el tratamiento 3 (plantas inoculadas con HMA al momento del trasplante), la colonización radical, es casi nula con respecto al tratamiento 1 (testigo), donde obviamente existe una cepa de HMA nativa del suelo, que es más abundante y coloniza con mayor intensidad pero que es poco eficiente, pues las plantas tienen poco crecimiento y desarrollo lo cual se puede apreciar en la Tabla VII.
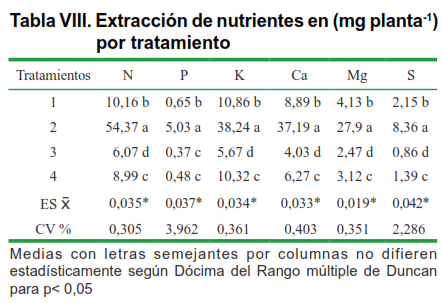
En la tabla VII se muestra el área foliar de las plantas por tratamiento, donde el tratamiento 2, muestra también una mayor área foliar que el resto de los tratamientos, producto del sinergismo entre HMA y Brasinoesteroide ya que la solubilización y absorción de nutrientes por ese tratamiento es mayor que en el resto, lo cual se observa en la Tabla VIII.
Los macro y micro elementos extraídos por las plantas, se encuentran en una mayor cantidad en el tratamiento 2, demostrándose la absorción de elementos que realizó la planta producto del sinergismo (Tabla VIII).
CONCLUSIONES
Los resultados obtenidos mostraron que aplicando el tratamiento donde se combina la inoculación del sistema radical de las plantas trasplantadas con HMA, especie Glomus cubense, aplicando 2 g del producto en el hoyo de la bolsa que recibió la plántula, y haciendo la aplicación del Análogo Espirostánico de Brasinoesteroide (Biobrás- 16) al momento del trasplante y antes del cierre de la cámara húmeda en la fase de adaptación, se pueden obtener los mejores resultados en el crecimiento y desarrollo de las plantas obtenidas a partir del cultivo in vitro de embriones cigóticos de Acrocomia aculeata.
AGRADECIMIENTOS
Se agradece al programa CAPES-MES Cuba, por brindar las facilidades de una beca de estudio de posgrado, por medio de la cual se pudo llevar a cabo el presente trabajo, en el marco del proyecto: Subsídios ao cultivo e manejo sustentável de espécies vegetais fontes de produtos florestais não madeiráveis (PFNM-OIKOS).
BIBLIOGRAFÍA
1.Hernández-Zardón AF. La palma corojo, un recurso natural para la producción sostenible de aceite. Cultivos Tropicales. 2016;37(4):13–33. doi:10.13140/RG.2.2.30257.99687
2. Sánchez P, Márquez LME, Castillo MM, Hernández QT. Plantas oleaginosas: fuente de biocombustibles y biolubricantes. La Ciencia y el Hombre, Revista de Divulgación Científico Técnica de la Universidad Veracruzana [Internet]. 2013;XXVI(1). Available from: http://www.uv.mx/cienciahombre/revistae/vol26num1/articulos/plantas-oleaginosas.html
3. Rivera M, Yurany D, Caicedo AF, Campos S, Galindo C, Romero HM. Hongos formadores de micorrizas arbusculares (HFMA) en palma de aceite. Bogotá Colombia: Centro de Investigación en Palma de Aceite, Cenipalma,: Colciencias; 2014.
4. Costa DA, Trogello E, Borghetti RA, Santos de Souza David. Macaúba: palmeira de extração sustentável para biocombustível. Colloquium Agrariae. 2014;10(2):105–92. doi:10.5747/ca.2014.VIO.a112
5. Pimentel LD, Bruckner CH, Manfio CE, Motoike SY, Martinez HEP. Substrate, lime, phosphorus and topdress fertilization in macaw palm seedling production. Revista Árvore. 2016;40(2):235–44. doi:10.1590/0100-67622016000200006
6. Castillo Sallé A, Montañez Massa A, Docampo Romero R, Rodríguez Bruno P, Cabrera Bologna D, Zoppolo Goldschmidt R. Micorrización de portainjertos de manzano micropropagados. Cultivos Tropicales. 2016;37(Especial):7–12.
7. Núñez-Vázquez M, Pérez-Domínguez G, Martínez-González L, Reyes-Guerrero Y, Coll-García Y. Análogos espirostánicos de brasinoesteroides estimulan el crecimiento de plántulas de arroz (Oryza sativa L.) cv. INCA LP-7 sometidas a estrés por NaCl. Cultivos Tropicales. 2016;37(4):152–9. doi:10.13140/RG.2.2.13952.64006
8. Núñez Vázquez M, Reyes Guerrero Y, Rosabal Ayán L, Martínez González L. Análogos espirostánicos de brasinoesteroides y sus potencialidades de uso en la agricultura. Cultivos Tropicales. 2014;35(2):34–42.
9. Rodríguez Y, Dalpé Y, Séguin S, Fernández K, Fernández F, Rivera R. Glomus cubense sp. nov., an arbuscular mycorrhizal fungus from Cuba. Mycotaxon. 2011;118(1):337–47. doi:10.5248/118.337
10. Phillips JM, Hayman DS. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society. 1970;55(1):158–61. doi:10.1016/S0007-1536(70)80110-3
11. Giovannetti M., Mosse B. An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots. New Phytologist. 1980;84(3):489–500. doi:10.1111/j.1469-8137.1980.tb04556.x
12. Trouvelot A, Kough JL, Gianinazzi-Pearson V. Mesure du taux de mycorhization VA d’un système radiculaire. Recherche de méthodes d’estimation ayant une signification fonctionnelle. In París Francia: Institut national de le recherche agronomique; 1986. p. 222–7.
13. Vidal, P. Comparación de métodos de estimación de índice de Área Foliar en el cultivo del algodón (Gossypiumhirsutum L.) [Internet] [Tesis de Ingeniero Agrónomo]. [República Argentina]: Facultad de Ciencias Agrarias. Universidad Nacional del Nordeste; 2012. 120 p. Available from: http://inta.gob.ar/sites/default/files/script-tmp-inta_tesis_pablo_vidal_comparacin_area_foliar_en_algo.pdf
14. Izquierdo H, Núñez M, González MC, Proenza R. Efectos de la aplicación de un análogo espirostánico de brasinoesteroides en vitroplantas de banano (Musa spp.) durante la fase de aclimatización. Cultivos Tropicales. 2012;33(1):71–6.
15. Wang Yuqin, Luo Wenhua, Xu Rujuan. Effect of epibrassinolide on growth and fruit quality of watermelon. Plant Physiology Communications (China). 1994;30:423–5.
16. Takatsuto S, Kamuro Y, Watanabe T, Noguchi T, Kuriyama H. Synthesis and plant growth promoting effects of brassinosteroid compound TS303. Proceedings of the Plant Growth Regulation Society of America. 1996;23:15–20.
17. Alvarado Ruffo K, Rodríguez L, Blanco A, Daquinta M, Coll F. Influencia de diferentes concentraciones de BIOBRAS-16 en el enraizamiento ex vitro de brotes de ruda. Biotecnología Vegetal [Internet]. 2007 [cited 2018 Apr 5];7(2). Available from: https://revista.ibp.co.cu/index.php/BV/article/view/367
18. Rivera MYD, Acevedo EC, Romero HM. Efecto de la micorrización arbuscular sobre el crecimiento y desarrollo de plántulas de palma de aceite en etapa de previvero. Cenipalma. 2013;175:4.
19. Galindo Castañeda T, Mauricio Romero H. Mycorrhization in oil palm (Elaeis guineensis and E. oleifera x E. guineensis) in the pre-nursery stage. Agronomía Colombiana. 2013;31(1):95–102.
20. Polanco G, Carrillo L, Espadas C, Reyes-García C, Guadarrama P, Orellana R. Asociación micorrízica arbuscular en coccothrinax readii quero. Tropical and Subtropical Agroecosystems [Internet]. 2013 [cited 2018 Apr 5];16(2). Available from: http://www.redalyc.org/resumen.oa?id=93928324011
21. Rivera R, González P, Hernández-Jimenez A, Martín Alonso GM, Ruiz L, Fernández K, et al. La importancia del ambiente edáfico y del pH sobre la efectividad y la recomendación de cepas eficientes de HMA para la inoculación de los cultivos. In VIII Congreso de la Sociedad Cubana de la Ciencia del Suelo La Habana ,Cuba: Instituto de Suelos; 2015. p. 4.
22. Dreyer B. Retrospectiva hacia una época mágica: las micorrizas de palmeras. Eubacteria. 2016;36:51–5.
23. Guerra SBE. Potencial simbiótico y contribución de la micorriza arbuscular en la disminución de aluminio en Palma aceitera (Elaeis guineensis Jacq.) utilizando inóculos nativos propagados en condiciones de estrés ácido. [Internet]. [Costa Rica]: Universidad Nacional Heredia; 2014. 210 p. Available from: http://docinade.com/wp-content/uploads/2015/04/POTENCIAL-SIMBI%C3%93TICO-Y-CONTRIBUCI%C3%93N-DE-LA-MICORRIZA-ARBUSCULAR-EN-LA-DISMINUCI%C3%93N-DE-ALUMINIO-EN-PALMA-ACEITERA-Elaeis-guineensis-Jacq.-UTILIZANDO-IN%C3%93CULOS-NATIVOS-PROPAGADOS-EN-CONDICIONES-DE-ESTR%C3%89S-%C3%81CIDO.-Be.pdf
Recibido: 07/09/2017
Aceptado: 27/03/2018
Dr.C. Alejandro F. Hernández, Instituto Nacional de Ciencias Agrícolas (INCA), Carretera Tapaste, Km 3½, Gaveta Postal 1. San José de las Lajas, Mayabeque. Cuba. CP 32700. Email: zardon@inca.edu.cu