Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.60 n.2 Ciudad de la Habana Mayo-ago. 2008
Aislamiento del virus linfotrópico de células T humano tipo I de un paciente con paraparesia espástica tropical: primer reporte en Cuba
Isolation of human T cell lymphotropic virus type 1 from a patient affected by tropical spastic paraparesis: first report in Cuba
Leonor Navea LeyvaI; Marta Dubed EchevarríaII; Giselle Álvarez SeguíIII; Madeline Blanco de ArmasIV; Felipe Díaz HerreraV; Ramón Beguerías SantosVI; Héctor Manuel Díaz TorresVII
I Especialista de II Grado en Microbiología. Investigador Auxiliar. Laboratorio de Investigaciones del SIDA (LISIDA).
II Licenciada en Biología. Máster en Virología. Investigadora Auxiliar. LISIDA.
III Licenciada en Biología. Investigadora Agregada. LISIDA.
IV Licenciada en Bioquímica. Investigadora Auxiliar. LISIDA.
V Licenciado en Bioquímica. Aspirante a Investigador. LISIDA.
VI Especialista de II Grado en Neurología. Hospital Clínico-Quirúrgico "Hermanos Ameijeiras".
VII Especialista de I Grado en Medicina Interna. Máster en Infectología. Investigador Auxiliar. LISIDA.
RESUMEN
Introducción: la paraparesia espástica tropical o mielopatía asociada a HTLV-I (PET/MAH) es una afección neurológica crónica etiológicamente ligada al virus linfotrópico de células T humano tipo I (HTLV-I).
Objetivo: realizar la confirmación serológica de la infección y el aislamiento del virus linfotrópico de células T humano tipo I, a partir de las células mononucleares de sangre periférica, de una paciente con un cuadro clínico compatible con paraparesia espástica tropical.
Métodos: las células mononucleares de sangre periférica se cocultivaron durante 35 d. La detección viral se realizó por inmunofluorescencia específica de membrana y reacción en cadena de la polimerasa para los genes tax, pol y gag.
Resultados: se confirmó la presencia de anticuerpos contra el virus linfotrópico de células T humano tipo I en el suero. Se observó un incremento del número de células positivas por inmunofluorescencia indirecta en el monitoreo secuencial y se detectó la presencia de ADN proviral en las células mononucleares de sangre periférica.
Conclusiones: los resultados evidenciaron el aislamiento del virus y corroboraron, por primera vez en Cuba, la asociación entre el virus linfotrópico de células T humano tipo I y paraparesia espástica tropical.
Palabras clave: Virus linfotrópico de células T humano tipo I (HTLV-I), aislamiento, reacción en cadena de la polimerasa, genes tax, pol y gag, paraparesia espástica tropical.
ABSTRACT
Background: Tropical spastic paraparesis or HTLV-I-associated myelopathy (TSP/HAM) is a chronic neurological disease etiologically linked to human T-cell lymphotropic virus type I (HTLV-I).
Objective: to serologically confirm infection by and isolation of HTLV-I from the peripheral blood mononuclear cells from a patient who presented with a clinical picture similar to that of tropical spastic paraparesis.
Methods: peripheral blood mononuclear cells were co-cultured for 35 days. Viral detection by membrane- specific immunofluorescence and polymerase chain reaction of genes tax, pol and gag were performed.
Results: The presence of antibody to human T cell lymphotropic virus type I in serum was confirmed. Indirect immunofluorescence in the sequential monitoring made it possible to observe an increase of the number of positive cells whereas proviral DNA was detected in the peripheral blood mononuclear cells.
Conclusions: these results support the evidence of viral isolation and confirmed, for first time in Cuba, the association between HTLV-I and TSP.
Key words: Human T cell lymphotropic virus, polymerase chain reaction, genes tax, pol and gag, tropical spastic paraparesis (TSP).
INTRODUCCIÓN
La gran mayoría de los individuos infectados por el virus linfotrópico de las células T humanas tipo I (HTLV-I) permanecen asintomáticos durante su vida y solo alrededor de 1 a 5 % desarrollan enfermedades relacionadas con esta infección; dentro de estas se incluyen la leucemia/linfoma T del adulto (LLTA), paraparesia espástica tropical o mielopatía asociada al HTLV-I (PET/MAH), así como otras afecciones por disfunción inmunológica o por inmunodeficiencia. Los mecanismos por los cuales algunas personas las desarrollan no se encuentran esclarecidos por completo en la actualidad. Algunos estudios sugieren que tanto los factores genéticos del huésped como los diferentes subtipos de este virus están asociados con el riesgo de padecer una u otra manifestación clínica.1-3
El HTLV-I se clasifica filogenéticamente en 6 subtipos bien caracterizados (Ia-If). El Ia se considera cosmopolita e incluye cepas de todas las regiones geográficas en las que este retrovirus se ha reportado.4 Las de mayor prevalencia son Japón, cuenca del Caribe, América Central y América del Sur, sureste de los EE. UU., África Central y las Islas de Melanesia, pero se han detectado individuos infectados en todos los continentes.5 Se transmite por las vías sexual, parenteral y vertical; en esta última, fundamentalmente a través de la lactancia materna.6,7
El aislamiento viral se puede realizar tanto de células mononucleares periféricas (CMSP) como de células mononucleares del líquido cefalorraquídeo de pacientes con PET, mediante el cocultivo con linfocitos de donante sano. Un cultivo positivo constituye la forma más concluyente para demostrar el agente causal de una infección. Entre las técnicas para la detección del virus en cultivo se encuentran la reacción en cadena de la polimerasa (RCP) y la inmunofluorescencia indirecta (IFI).8
En Cuba se ha reportado 0,037 % de seroprevalencia de anticuerpos contra HTLV-I en diferentes grupos estudiados y desde 1989 se han diagnosticado 26 individuos infectados, 4 de ellos fallecidos por LLTA y 2 que han desarrollado manifestaciones clínicas compatibles con PET (Confirmación del inmunodiagnóstico de retrovirus en Cuba. Hematología Habana 2005. Resumen 11-43 ISBN 959-7164-88-4) En este trabajo el propósito fue realizar la confirmación serológica de infección por HTLV-I y obtener el aislamiento de este retrovirus de las CMSP, de una paciente cubana con características clínicas compatibles con PET.
MÉTODOS
Paciente: mujer de 30 años de edad, de la raza negra, procedente de la ciudad de Camagüey, hija de inmigrantes haitianos y madre fallecida por complicaciones de proceso neurológico crónico que evolucionó a la paraplejia. En la historia de la enfermedad actual se recogió que desde hace 10 años comenzó a presentar dolor lumbar persistente y dificultad para la marcha, acompañada de disestesias y parestesias en miembros inferiores. Posteriormente, se añadieron trastornos para la evacuación de la orina compatible con vejiga neuropática y constipación intestinal rebelde. Al examen neurológico se comprobó marcha lenta en tijeras, debilidad proximal y espasticidad bilateral de miembros inferiores, hiperreflexia con clonus aquiliano, signo de Babinsky bilateral y signo de Hoffman. La exploración de los pares craneales, la taxia y la sensibilidad superficial y profunda resultó normal. La progresión lenta, sin períodos de remisión, permitió plantear el diagnóstico presuntivo de PET.
Muestras: se tomó muestra de sangre periférica de la paciente para obtener suero y CMSP, previo consentimiento informado, según protocolo de trabajo para infección y enfermedad por retrovirus humanos aprobado en el Hospital "Hermanos Ameijeiras".9
Las muestras de CMSP para cocultivo se obtuvieron de sangre periférica de donantes voluntarios sanos con estudios serológicos negativos de anticuerpos contra HTLV-I.
Estudio serológico: las muestras de suero de la paciente y de los donantes voluntarios se analizaron mediante el sistema inmunoenzimático ELISA de pesquisaje (DAVIH HTLV-I) y el western blot DAVIH-BLOT-HTLV-I como confirmatorio, ambos de Laboratorios DAVIH, La Habana, Cuba, siguiendo las indicaciones del fabricante. Se considera positiva la muestra con reactividad contra la gp 46 del gen env, combinada con reactividad contra al menos una proteína del gen gag (DAVIH-BLOT HTLV-I. Manual de Instrucciones. La Habana. Laboratorios DAVIH. 1991:1-13)
Aislamiento viral: las CMSP de la paciente se obtuvieron por centrifugación de la sangre total (Sigma 1200 X G) sobre gradiente de Ficoll, el anillo de células se lavó 2 veces con solución de tampón fosfato (PBS) mediante centrifugación (Sigma 800 X G). Las células obtenidas se cultivaron en medio RPMI 1640 (Gibco), suplementado con 10 % de suero fetal bovino (Hyclone), 40 µg/mL de gentamicina (Sigma) y 20 µg/mL de fitohemaglutinina (DAVIH FHA, Laboratorios DAVIH) por 3 d a 37 °C y atmósfera húmeda con 5 % de CO2. Transcurrido este tiempo se cocultivaron con CMSP de donante sano, previamente estimulados con FHA durante 48 h y se les adicionó medio de cultivo fresco con 10 U/mL de interleucina 2 (IL-2) (ICN-Biochemical INC).10 Las CMSP de donantes sanos se obtuvieron a partir de donaciones de sangre liberadas de los bancos de sangre acorde con los resultados de los ensayos de pesquisaje que se utilizan por el Programa de Medicina Transfusional de Cuba y en LISIDA se someten a otro inmunoensayo enzimático de la firma ORGANON TEKNIKA (VIRONOSTIKA HTLV-I/II).
La multiplicación viral se monitoreó semanalmente durante 35 d. Para este propósito se tomó una alícuota del cultivo y se realizó inmunofluorescencia indirecta (IFI), que se consideró positiva cuando se detectó inmunofluorescencia específica de membrana siguiendo la metodología y los criterios de interpretación referidos por Sandstrom y otros.11
También se realizó la detección viral mediante RCP de las CMSP de la paciente antes y después del cultivo de estas células in vitro.
Preparación de las láminas para la IFI: se tomaron 2 x 106 células por mL del cocultivo, se lavaron y se resuspendieron en PBS, de esta suspensión se aplicaron 10 µL en las láminas portaobjeto, se dejaron secar y se fijaron con acetona durante 10 min. Estas láminas se conservaron a - 20 ºC hasta su uso.
Suero de reactividad conocida para inmunofluorescencia: suero humano procedente de individuo seropositivo al HTLV-I, libre de anticuerpos contra VIH 1 y 2, negativo a antígeno de superficie del virus de la hepatitis B y de anticuerpos contra el virus de la hepatitis C y que contiene alto título de anticuerpos contra las principales proteínas estructurales del HTLV-I. Este suero constituye patrón de referencia del LISIDA y se caracterizó con el sistema de Western Blot Cambridge Biotech Corporation y HTLV Blot 2.4 Genelabs Diagnostic.
Inmunofluorescencia indirecta: se tomaron 10 µL de una dilución de suero de reactividad conocida contra HTLV-I (1:10), este volumen se añadió a láminas portaobjeto recubiertas con células del cocultivo, se incubó a 37 ºC en una cámara húmeda durante 30 min, se lavó 3 veces con PBS, 5 min por cada lavado y una vez secas se adicionó conjugado fluorescente anti-IgG humana en dilución de trabajo 1:50, los controles se sometieron a iguales condiciones de incubación y lavado. Como control positivo se utilizaron láminas cubiertas con células MT2 crónicamente infectadas con HTLV-I y como control negativo CMSP de donante sano. La lectura se realizó con un microscopio fluorescente (Opton Standard 25, Alemania).11
Se consideró positiva si más de 25 % de las células de la impronta mostraron fluorescencia de membrana específica.
Reacción en cadena de la polimerasa: el ADN se obtuvo de las CMSP, por el método de Proteinasa K/SDS, extracción con fenol-cloroformo-alcohol isoamílico y precipitación en etanol.
Para el desarrollo de la técnica se emplearon 3 juegos diferentes de oligonucleótidos cebadores, específicos de HTLV-I, los oligos HTL 116/117 para el gen gag, HTL 140/ 141 que amplifican una región del gen tax y HTL 128/ 129 que reconocen una región del gen pol.2,4 La RCP se realizó por duplicado en todas las muestras, se empleó 10 mL de Buffer Taq 10x, 200 mM de cada dNTPs, 100 pmol de cada cebador, 2,5 U de Taq polimerasa y 1 mg de ADN, en un volumen final de 50 mL.12 Como control positivo se empleó ADN de células MT2 y como control negativo CMSP de donante sano.
Los productos amplificados se visualizaron mediante una corrida electroforética en un gel de agarosa tipo VII 3 % teñido con BrEt 0,5 mg/mL. Se utilizó como patrón de peso molecular 50 mg de pGEM (2 645 pares de bases-36 pares de base) (Promega).
RESULTADOS
El estudio serológico por ELISA detectó anticuerpos contra el HTLV-I y el western blot demostró reactividad específica contra las proteínas 19, 24, 28, 36 y 53 del gen gag, 40 del gen tax y 46 del gen env del virus, lo que confirma la positividad al HTLV-I.
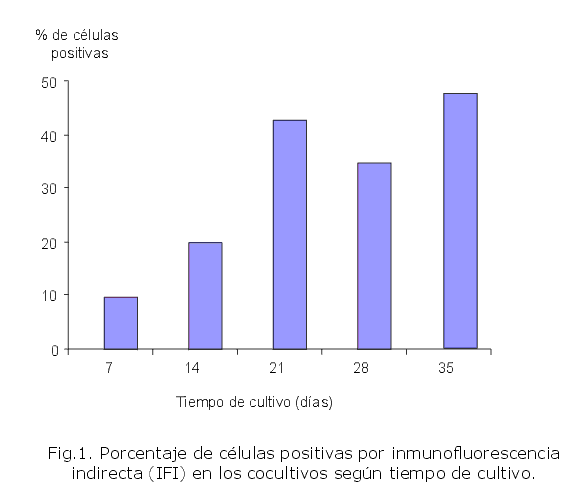
Los cocultivos se caracterizaron por una rápida proliferación celular en las primeras 2 semanas, con un marcado descenso de la viabilidad celular, a partir de esa fecha, lo cual coincidió con un incremento del número de células positivas por inmunofluorescencia de membrana (fig. 1).
La presencia del ADN proviral se detectó en las CMSP de la paciente y de las procedentes del cultivo positivo mediante la reacción en cadena de la polimerasa para los genes gag, tax y pol. En la figura 2 se observa el producto amplificado de la muestra estudiada. La talla de los productos obtenidos se corresponde con 200 pb para el gen gag, para tax 159 pb, y 119 pb para el gen pol.

DISCUSIÓN
La PET/MAH, mielopatías crónicas causadas por el HTLV-I, se han reportado en diferentes partes del mundo, entre las que se encuentran la región del Caribe y América del Sur. Los pacientes afectados se han reconocido por sus manifestaciones clínicas y la confirmación del diagnóstico se ha basado en técnicas serológicas, virológicas y moleculares.1,8
En Cuba se han realizado estudios serológicos en diferentes grupos poblacionales, uno de estos comprendió el análisis de personas con vínculos familiares, donde varios miembros de un núcleo se diagnosticaron y confirmaron como portadores de este virus.13-17 En este caso en particular, con ascendencia haitiana, país donde la PET es frecuente como enfermedad centinela indicadora de alta prevalencia de HTLV-I y en el que además se recogió como antecedente que la madre falleció de una prolongada enfermedad neurológica, semejante a la que padece la paciente estudiada, se puede sospechar la probabilidad de transmisión vertical.
En este estudio se pudo identificar el HTLV-I en la paciente por evidencias serológicas y el aislamiento a partir del cocultivo de las CMSP, lo que se corroboró desde los 7 d de cultivo con expresión de los antígenos virales específicos identificados por inmunofluorescencia. La respuesta serológica incluyó reactividad específica a la p40 (tax) y p19, que unida a los cocultivos positivos pueden ser usados como marcadores de la replicación del virus en individuos infectados.18,19
Una replicación activa persistente del HTLV- I unida a una fuerte respuesta inmune constituyen factores importantes en la patogénesis de esta enfermedad, a diferencia de los pacientes con LLTA, en los que se ha observado menor carga viral y débil respuesta inmune.20,21
El aislamiento es una técnica laboriosa, costosa, propia de laboratorios de investigación, que resulta una herramienta útil, no solo como prueba definitiva de infección, sino de importancia en los estudios de patogenia, caracterización viral, ensayos terapéuticos y de vacunas. En Cuba solo se habían reportado aislamientos de HTLV-I de pacientes con LLTA o de individuos asintomáticos;22 por lo que la obtención de este en una paciente con PET resulta un aporte importante al estudio de las diferentes cepas que circulan en el país y sirve de base para estudios de caracterización molecular.
La inmunofluorescencia se considera una técnica efectiva para la detección de los antígenos virales en células y tejidos, cuando se realiza cuidadosamente es muy sensible y específica para detectar antígenos del HTLV-I en células de cultivo. En este estudio sirvió como técnica confirmatoria para establecer la positividad del cultivo.23
La RCP antes y después del cultivo confirmó los resultados serológicos y virológicos obtenidos, permitió amplificar secuencias del genoma a partir de ADN proviral con el uso de oligonucleótidos que amplifican regiones altamente conservadas: genes tax, pol, y gag del HTLV-I y facilitó la tipificación del retrovirus al diferenciarlo del HTLV-II al nivel molecular.
La demostración de la presencia de anticuerpos, el aislamiento y la detección del ADN proviral del HTLV-I en las muestras analizadas, corroboraron el diagnóstico clínico y la asociación entre HTLV-I y PET.
Estos resultados confirman, por primera vez, la asociación de la infección por HTLV-I en una paciente cubana con cuadro clínico compatible con PET, además de aportar nuevas evidencias de la circulación de este retrovirus en Cuba, no solamente asociado a enfermedades hematológicas. Desde el punto de vista epidemiológico, plantea la necesidad de completar el pesquisaje de contactos sexuales y familiares, y de mantener la vigilancia sobre las enfermedades etiológicamente relacionadas.
REFERENCIAS BIBLIOGRÁFICAS
1. Gallo R C. History of the discoverus of the first human retroviruses: HTLV-I y HTLV-II. Oncogene. 2005;24:5926-30.
2. Furukawa Y, Yamashita M, Usuku K, Izumo Sh, Nakagawa M, Asami M. Phyylogenetic subgroups of human T cell lymphotropic virus (HTLV) type I and the tax gene and theirs association with differents risks for HTLV-I-associated myelopathy/tropical spastic paraparesis. J Infect Dis 2000;182:1343-9.
3. Barmak K, Harhaj E, Grant C, Alefantis T, Wigdahl B. Human T cell leukemia virus type I induced disease: Pathways to cancer and neurodegeneration. Virology. 2003;308(1):1-12.
4. Azran I, Schavinsky-Khrapunsky Y, Priel E, Huleihel M, Aboud M. Implications of the evolution pattern of human T-cell leukemia retroviruses on their pathogenic virulence (Review). Int J Mol Med. 2004;14:909-15.
5. Feuer G, Green P L. Comparative biology of human T-cell lymphotropic virus type 1 (HTLV-1) and HTLV-2. Oncogene. 2005;24:5996-6004.
6. Masao M, Jeang K. Human T-cell leukemia virus type I at age 25: A progress report. Cancer Res. 2005;65(11):4467-70.
7. Shuh M, Beilke M. The human T-cell leukemia virus type 1 (HTLV-1): New insights into the clinical aspects and molecular pathogenesis of adult T-cell leukemia/lymphoma (ATLL) and tropical spastic paraparesis/HTLV- associated myelopathy (TSP/HAM). Microsc Res Tech. 2005;68:176-96.
8. Segurado A, Domínguez RB, Muniz MR, Fink MC, Marchiori P, Scaff M, et al. Molecular detection and isolation of human T-cell lymphotropic virus type I ( HTLV-I) from patients with HAM/TSP in Sao Paulo, Brasil. Clin Diag Virol. 1998;9:(17-23).
9. Díaz HM. Infección y enfermedad por retrovirus humanos en Manual de Prácticas Médicas del Hospital Hermanos Ameijeiras. ISBN 978-959-212-283-3. La Habana: CENDA Reg. 2938-2006
10. WHO-UNAIDS. Guidelines for Standard HIV Isolation and Characterization Procedures. 2nd ed., Geneva:WHO/HTTP/IVR/HVI 02.01; 2002
11. Sandstrom EG, Schooley RT, Ho DD, Bryngton R, Sarngaharan MG, Maclane ME, et al. Detection of human anti HTLV-III antibodies by indirect inmunofluorescence using fixed cells. Transfusión. 1985;25:308-12.
12. Rolo F, Blanco M, Mato J, Lubián AL, Díaz H. Confirmación de la presencia en Cuba del virus linfotrópico de las células T humanas mediante la reacción en cadena de la polimerasa. Rev Cubana Med Trop. 1997;49(3):204-8.
13. Lubián AL, Díaz HM, Silva E, Pérez MT, Cruz O, De la Fuente JL, et al. Seroprevalencia de la infección por HTLV-I en diferentes grupos de riesgo estudiados en Cuba. Rev Cubana Med. 1998;37(4):199-204.
14. Hernández P, Rivero R, Ballester J.M, Navea L, Matutes E, Yamagushi K, et al. Very low seroprevalence of HTLV-I/II in Cuba: antibodies in blood donors and in hematological and nonhematological patients. Vox Sang. 1991;61:272-8.
15. Navea L, Noa E, Lubian AL, Pérez MT, Carnot J, Rivero R. Screening of anti HTLV-I antibody in sera from HIV infected persons and patients with hematological and neurological diseases in Cuba. Japón: Proceeding of the Fifth International Conference on Human Retrovirology HTLV; 1992.
16. Silva E, Guevara MT, Lubián AL, De la Fuente JL, Navea L, Cruz O. Pesquisaje de anticuerpos contra el virus Linfotrópico de las células T humanas tipo I (HTLV-I) en donantes de sangre y grupo de riesgo. Rev Cubana Med Trop. 1997;49(1):24-7.
17. Rivero RA, Hernández P, Suárez O, Hidalgo-Gato R, Navea L, Yamaguchi K, et al. Detección de anticuerpos contra el HTLV-I / II en pacientes cubanos con insuficiencia renal crónica en hemodiálisis. Sangre. 1992;37(3):205-6.
18. Shari L, Margaret E, Marriott S. Relationship between anti-Tax antibody responses and cocultivatable virus in HTLV-I-infected rabbits. Virology. 1998;250:60-6
19. Kibler K V, Jeang K. Human T-cell leukemia virus type I: 25 years of progress and challenges. J Biomed Sci. 2005;12:7-11.
20. Marriott S J, Semmes O J. Impact of HTLV-I Tax on cell cycle progression and the cellular DNA damage repair response. Oncogene. 2005;24:5986-95.
21. Bangham C, Osame M. Cellular immune response to HTLV-1. Oncogene. 2005;24:6035-46.
22. Muñío JE, Díaz H, Carnot J, De Castro R, Navea L, Rodríguez I. Leucemia/linfoma T del adulto. Primer caso en Cuba. Rev Cubana Med. 2003;42(3).
23. Sullivan MT, Mucke H, Kadey SD, Fang CT, Willians AE. Evaluation of indirect immunofluorescence assay for confirmation of human immunodeficiency virys type 1 antibody in U.S. blood donor sera. J Clin Microbiol. 1992;30(9):2509-10.
Recibido: 6 de septiembre de 2007.
Aprobado: 4 de febrero de 2008.
Dra. Leonor Navea Leyva. Calle 21 No 1110 e/ 14 y 16 Vedado, Plaza, Ciudad de La Habana. Teléf.: 8300441. Correos electrónicos: riverora@infomed.sld.cu; cicdc@infomed.sld.cu














