Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.61 n.2 Ciudad de la Habana Mayo-ago. 2009
ARTÍCULO ORIGINAL
Estudio seroepidemiológico de la leptospirosis humana en el departamento del Valle del Cauca, Colombia
Seroepidemiological situation of human leptospirosis in Valle del Cauca, Colombia
Myriam Astudillo HernándezI; Andrés González RodríguezII; Niurka Batista SantiestebanIII; Mayelín Mirabal SosaIV; Jorge Menéndez HernándezV
I Maestra en Microbiología. Universidad del Valle, Colombia.
II Máster en Microbiología. Instituto Finlay, Ciudad de La Habana, Cuba.
III Ingeniera Química. Instituto Finlay. Ciudad de La Habana, Cuba.
IV Licenciada en Matemática. Instituto Finlay. Ciudad de La Habana, Cuba.
V Especialista de I Grado en Epidemiología. Instituto Finlay. Ciudad de La Habana, Cuba.
RESUMEN
OBJETIVO: confirmar serológicamente la ocurrencia de leptospirosis humana en casos presuntivos procedentes del departamento del Valle del Cauca, estudiar variables clínico-epidemiológicas asociadas a la enfermedad e identificar los serogrupos de Leptospira más prevalentes en la región.
MÉTODOS: se analizaron 150 muestras séricas colectadas en fase aguda, de casos con sospecha clínica y con riesgo epidemiológico de leptospirosis. Fueron evaluadas mediante hemoaglutinación indirecta y microaglutinación tomando como criterio de confirmación de la enfermedad la presencia de un título por microaglutinación mayor o igual que 1:800. Se analizaron datos epidemiológicos de interés así como síntomas y signos presentados en cada caso.
RESULTADOS: las técnicas serológicas empleadas permitieron definir 31 casos confirmados (20,6 %) y 16 casos probables (10,6 %). Icterohaemorrhagie fue el serogrupo de mayor reactividad serológica tanto en casos confirmados como probables. Los síntomas más comunes fueron fiebre (89,3 %), cefalea (86,7 %) y mialgias (77,3 %). Síntomas de leptospirosis severa como ictericia e insuficiencia renal fueron observados en 36 % y 6,7 % de los casos, respectivamente. Cerca de 70 % de los casos confirmados o probables procedía de zonas urbanas y 85 % resultó de hombres con un promedio de edad de 40 años. Los factores de riesgo más frecuentes fueron la exposición a roedores o animales domésticos (95,7 %) y aguas potencialmente contaminadas (36,2 %).
CONCLUSIONES: los resultados del presente estudio sugieren que la leptospirosis constituye un problema de salud pública en el Valle del Cauca, región suroccidental de Colombia.
Palabras clave: leptospirosis, Colombia, serogrupos, síntomas clínicos.
ABSTRACT
OBJECTIVE: to serologically confirm the occurrence of human leptospirosis in presumptive cases from the department of Valle del Cauca in Colombia, to study clinical-epidemiological data associated to the disease and to find out the most prevalent leptospiral serogroups.
METHOD: a total of 150 serum samples collected during the acute phase from clinically suspected patients of having leptospirosis were analyzed. Samples were evaluated by indirect hemagglutination and microagglutination tests, taking a microagglutination titer equal to or greater than 1:800 as definition of confirmed case. Epidemiological data as well as symptoms and signs of interest were analyzed.
RESULTS: these serological techniques allowed defining 31 confirmed cases (20.6%) and 16 probable cases (10.6 %). Icterohaemorrhagiae was the serogroup with the higher serological reactivity in both confirmed and probable cases. Most common symptoms were fever (89.3 %), headaches (86.7 %) and myalgias (77.3 %). Symptoms of severe leptospirosis like jaundice and renal failure were observed in 36 % and 6.7 % of cases, respectively. About 70 % of confirmed or probable cases came from urban areas and 85 % of them were men aged 40 years as average. The epidemiological risk factors were exposure to rats and domestic animal (95.7 %) and potentially contaminated water (36.2 %).
CONCLUSIONS: the results of the present study suggest that leptospirosis is a public health problem in Valle del Cauca, a region located on the south west of the country.
Key words: leptospirosis, Colombia, serogroups, clinical symptoms.
INTRODUCCIÓN
La leptospirosis es probablemente la zoonosis bacteriana de más amplia distribución mundial, con gran impacto en la salud pública y en la economía de países ricos y pobres.1,2 La enfermedad ha dejado de ser considerada solo un riesgo ocupacional o recreacional característico de zonas rurales, para convertirse en una enfermedad emergente con grandes brotes en zonas urbanas.2,3 Mamíferos domésticos y salvajes, reptiles y anfibios pueden servir como hospederos de mantenimiento para casi 250 serovares patógenos del género Leptospira.1
En Colombia existen pocos estudios referentes a la epidemiología de la leptospirosis humana. A pesar de ser la enfermedad de notificación obligatoria no se conoce con exactitud el nivel de incidencia o las serovariedades circulantes. Algunos estudios de seroprevalencia sugieren una importante incidencia de la infección en humanos;4-7 sin embargo, existen escasos registros de la enfermedad en convalecientes.8 El amplio espectro de síntomas clínicos inespecíficos, las limitaciones en el diagnóstico diferencial de laboratorio, unido en muchos casos a la falta de sospecha clínica por parte del personal médico en casos de inaparente riesgo epidemiológico, determinan el subregistro de los casos de leptospirosis.
El departamento del Valle del Cauca, con una población de más de 4 millones de habitantes, se encuentra ubicado en la región suroccidental de Colombia. Su capital, Santiago de Cali, es la tercera ciudad más poblada del país y uno de sus principales núcleos económicos. El presente estudio se desarrolló con el objetivo de demostrar la ocurrencia real de la enfermedad en pacientes con síntomas clínicos compatibles con leptospirosis, determinar los serogrupos de Leptospira circulantes más frecuentes y las variables clínico-epidemiológicas de interés en casos confirmados o probables, procedentes del departamento del Valle del Cauca.
MÉTODOS
Cepas de Leptospira
Para la realización de la técnica de microaglutinación (MAT),9,10 se empleó un cepario de referencia que contenía una cepa representativa de cada uno de los 24 serogrupos patógenos de Leptospira (tabla 1). Todas las cepas fueron suministradas por el Laboratorio Internacional de Referencia para el Diagnóstico de Leptospirosis del Royal Tropical Institute, Holanda. Para su empleo como antígenos MAT, las cepas fueron subcultivadas en medio EMJH (Difco, EE. UU.) e incubadas durante 7 d bajo cultivo estático. La concentración de antígeno en cada caso fue ajustada mediante el empleo de una cámara de Petroff-Hausser.
Tabla 1. Cepas de Leptospira empleadas como antígenos MAT
| Especie | Serogrupo | Serovar | Cepa |
Leptospira interrogans | Canicola | Canicola | Hond Utrecht IV |
| Icterohaemorrhagiae | Copenhageni | M 20 | |
| Australis | Bratislava | Jez Bratislava | |
| Sejroe | Hardjo | Hardjoprajitno | |
| Bataviae | Bataviae | Swart | |
| Autumnalis | Autumnalis | Akiyami A | |
| Djasiman | Djasiman | Djasiman | |
| Hebdomadis | Hebdomadis | Hebdomadis | |
| Pyrogenes | Pyrogenes | Salinem | |
Leptospira borgpetersenii | Ballum | Ballum | Mus 127 |
| Javanica | Javanica | Veldrat Batavia 46 | |
| Mini | Mini | Sari | |
| Tarassovi | Tarassovi | Perepelitsin | |
Leptospira kirschneri | Pomona | Mozdok | 5621 |
| Cynopteri | Cynopteri | 3522 C | |
| Grippotyphosa | Grippotyphosa | Moskva V | |
Leptospira weilii | Celledoni | Celledoni | Celledoni |
| Sarmin | Sarmin | Sarmin | |
| Leptospira noguchii | Louisiana | Louisiana | LSU 1945 |
| Panama | Panama | CZ 214 | |
| Leptospira meyeri | Ranarum | Ranarum | ICF |
| Leptospira santarosai | Shermani | Shermani | 1342 K |
| Leptospira fainei | Hurstbridge | Hurstbridge | BUT 6T |
| Leptospira inadai | Manhao | Lichuan | L 130 |
Muestras séricas
Muestras de suero colectadas en fase aguda a un total de 150 casos con sospecha clínica de leptospirosis fueron remitidas desde diferentes centros asistenciales de la red pública, del departamento del Valle del Cauca a la Universidad del Valle en el período 2003-2006. Todas las muestras fueron convenientemente conservadas a - 20 °C hasta su evaluación.
Técnicas serológicas
Todas las muestras séricas fueron evaluadas mediante la técnica de hemoaglutinación indirecta (HAI)10 y microaglutinación (MAT).1 La técnica HAI se realizó con el empleo de eritrocitos frescos de carnero sensibilizados con antígeno género-específico de Leptospira biflexa. La sustancia sensibilizante de eritrocitos (SSE) utilizada como antígeno en esta técnica fue suministrada por los Laboratorios Labiofam de Cuba, se inició el análisis con una dilución 1:20. La MAT fue desarrollada con el uso de antígenos vivos correspondientes a los 24 serogrupos patógenos de Leptospira (tabla 1), que inició con una dilución 1:100.
Fueron definidos como casos confirmados de leptospirosis aquellos cuyas muestras séricas alcanzaron títulos MAT iguales o superiores a 1:800.2 Se definieron como casos probables aquellos cuyas muestras séricas mostraron títulos MAT iguales o superiores a 1: 20011 y menores que 1:800.
Análisis de variables clínico-epidemiológicas
Todas las muestras séricas evaluadas fueron acompañadas de una ficha clínico-epidemiológica con datos del paciente como sexo, edad, lugar de residencia, contacto con animales, exposición a aguas potencialmente contaminadas y síntomas clínicos. Se empleó el test c2 o la prueba exacta de Fisher para comparar las variables de sexo, lugar de residencia, contacto con animales o aguas contaminadas y síntomas clínicos. La prueba no paramétrica de Mann-Whitney fue utilizada para analizar las edades de los pacientes.12 En todas las comparaciones se empleó un nivel de significación de 5 % (p< 0,05).
RESULTADOS
Evaluación serológica de casos presuntivos
De las 150 muestras séricas evaluadas, 120 (80 %) mostraron algún nivel de hemoaglutinación frente al antígeno género-específico, aunque solo 51 muestras (34 %) evidenciaron una fuerte reacción de aglutinación con títulos HAI ³ 1:40. La evaluación por MAT indicó un total de 63 muestras (42 %) reactivas frente a alguna de las serovariedades patógenas de Leptospira, pero solo 47 muestras (31,3 %) mostraron títulos MAT ³ 1:200, de ellas 31 muestras (20,6 %) con títulos MAT ³ 1:800 y de estos, 29 (19,3 %) mostraron títulos ³ 1:1600 (tabla 2).
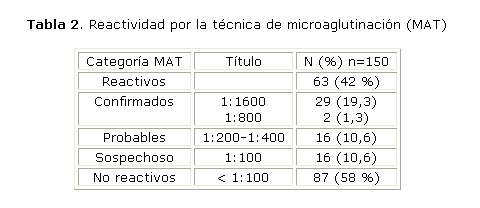
De forma general, la evaluación serológica permitió definir 31 casos confirmados (20,6 %) y 16 casos probables (10,6 %).
La evaluación por MAT de los casos presuntivos analizados permitió definir además serogrupo de Leptospira de importancia epidemiológica en la región. Icterohaemorrhagiae fue el serogrupo de mayor reactividad serológica dentro de los 31 casos considerados como confirmados (Fig.). Un número inferior de casos confirmados mostró una mayor reactividad serológica a otros serogrupos patógenos como Bataviae, Cynopteri, Canicola, Mini y Shermani. Icterohaemorrhagiae también constituyó el serogrupo de mayor reactividad serológica en casos de leptospirosis probable y de forma general en todos los casos reactivos (Fig.).
Variables clínico-epidemiológicas
Fueron analizadas variables clínico-epidemiológicas de interés en todos los casos presuntivos de leptospirosis estudiadas (tabla 3); 85,1 % de los casos confirmados o probables fueron hombres con un promedio de edad de 40,6 años. La proporción de hombres respecto a mujeres fue significativamente mayor entre los casos confirmados o probables que entre los no confirmados (p= 0,0032).
Tabla 3. Variables clínico-epidemiológicas analizadas en el estudio
| Casos confirmados o probables | Otros | Total de casos | ||||
| n | % | n | % | n | % | |
| Datos epidemiológicos | ||||||
| Hombres | 40 | 85,1 | 61 | 59,2 | 101 | 67,3 |
| Edadesa | 5-72 | 40,6 | 2-77 | 34,7 | 2-77 | 36,6 |
| Ambientes urbanos | 32 | 68,1 | 63 | 61,2 | 95 | 63,3 |
| Contacto con reodeores o animales domésticos | 45 | 95,7 | 101 | 98,0 | 146 | 97,3 |
| Contacto con aguas potencialmente contaminadas | 17 | 36,2 | 47 | 45,6 | 64 | 42,7 |
| Síntomas y signos | | | | | | |
| Fiebre | 41 | 87,2 | 93 | 90,3 | 134 | 89,3 |
| Cefalea | 38 | 80,8 | 92 | 89,3 | 130 | 86,7 |
| Mialgias | 36 | 76,6 | 80 | 77,7 | 116 | 77,3 |
| Ictericia | 26 | 55,3 | 28 | 27,2 | 54 | 36,0 |
| Náuseas | 13 | 27,6 | 25 | 24,3 | 38 | 25,3 |
| Dolor abdominal | 11 | 23,4 | 26 | 25,2 | 37 | 24,7 |
| Diarreas | 10 | 21,3 | 17 | 16,5 | 27 | 18,0 |
| Vómitos | 10 | 21,3 | 20 | 19,4 | 30 | 20 |
| Oliguria | 7 | 14,9 | 14 | 13,6 | 21 | 14,0 |
| Insuficiencia renal | 6 | 12,8 | 4 | 3,9 | 10 | 6,7 |
| Sufusión conjuntival | 6 | 12,8 | 10 | 9,7 | 16 | 10,7 |
| Hemorragias | 2 | 4,2 | 6 | 5,8 | 8 | 5,3 |
| Irritación meníngea | 1 | 2,1 | 3 | 2,9 | 4 | 2,7 |
| Anorexia (inapetencia) | 1 | 2,1 | 4 | 3,9 | 5 | 3,3 |
| Artralgias | 1 | 2,1 | 3 | 2,9 | 4 | 2,7 |
| Erupción cutánea | 1 | 2,1 | 6 | 5,8 | 7 | 4,7 |
| Miocarditis | 1 | 2,1 | 0 | 0 | 1 | 0,7 |
| Muerte | 1 | 2,1 | 0 | 0 | 1 | 0,7 |
a: se indica el rango (mínima-máxima) y la media de edades de cada grupo.
Cerca de 70 % de los casos confirmados o probables viven en la ciudad de Cali, capital del departamento del Valle del Cauca; un número importante de estos casos declaró posible contacto con roedores o animales domésticos y un número menor estuvo expuesto a aguas potencialmente contaminadas.
La mayoría de los casos confirmados o probables mostraron síntomas compatibles pero no patognomónicos de leptospirosis, como fiebre (89,3 %), cefalea (86,7 %) y mialgias (77,3 %). Un signo de leptospirosis severa como la ictericia se presentó mayoritariamente entre los casos confirmados o probables (p= 0,0032). Padecieron insuficiencia renal 12,8 % de los casos confirmados o probables y 3,9 % de los no confirmados, pero esta diferencia no fue estadísticamente significativa (p= 0,0718). Uno de los casos confirmados falleció; mostró un cuadro típico de leptospirosis severa caracterizado por fiebre, cefalea, mialgias, sufusión conjuntival, ictericia, oliguria e insuficiencia renal.
DISCUSIÓN
El diagnóstico de la leptospirosis se realiza a menudo mediante métodos serológicos por causa de la menor sensibilidad y lentitud del crecimiento en cultivo o la poca disponibilidad de métodos moleculares como la reacción en cadena de la polimerasa (RCP), en la mayoría de los laboratorios. A pesar de que la MAT continúa siendo la técnica de referencia para el diagnóstico serológico y estudios seroepidemiológicos, otras técnicas alternativas han sido descritas y utilizadas con éxito en la detección temprana de la enfermedad.1,2 La hemoaglutinación indirecta (HAI) ha demostrado una elevada sensibilidad y especificidad en el diagnóstico de la leptospirosis, es un ensayo rápido y sencillo, permite el estudio inicial de un gran número de muestras en corto tiempo y no requiere personal con elevada experiencia ni equipo costoso, por lo que se recomienda su uso en laboratorios de diagnóstico con pocos recursos.10,13
Dado que la totalidad de las muestras analizadas en el presente estudio correspondían a sueros no pareados tomados en fase aguda, fueron analizados tanto por MAT como por HAI para incrementar la fiabilidad de los resultados. Al no disponer de segundas muestras séricas para evaluar seroconversión, los títulos MAT inferiores a 1:100 resultarían carentes de utilidad práctica para el diagnóstico con monosueros, por lo que se consideró esta dilución como la inicial de trabajo en la técnica de microaglutinación.
Para la definición de casos confirmados y probables se tuvieron en cuenta criterios internacionalmente reconocidos.2,11 Numerosos laboratorios consideran un título MAT ³ 1:800 en un monosuero como indicativo de infección reciente o en curso.2,14,15 Asimismo se empleó el criterio del Centro para el Control de Enfermedades Infecciosas de EE. UU. para la definición de caso probable, correspondiente a un título MAT ³ 1:200.2,11 Teniendo en cuenta estos criterios, fue confirmada la enfermedad en 31 (20,6 %) de los 150 casos presuntivos analizados, mientras 16 casos adicionales (10,6 %) fueron definidos como probables, de los 103 casos restantes solo 30 (20 %) fueron negativos por las 2 técnicas serológicas empleadas; esto sugiere que el número de casos confirmados pudiera ser muy superior con la toma de una segunda muestra en fase convaleciente. La frecuente limitación en la colección de muestras pareadas posibilita que muchos casos considerados "no probables" por una técnica serológica dada, constituyan en realidad casos no detectados de infección reciente o en curso, con bajos títulos de anticuerpos en la fase aguda de la enfermedad. Por consiguiente, resultará importante la evaluación de casos presuntivos mediante más de una técnica serológica de probada especificidad, sobre todo en estadios iniciales de la enfermedad, para incrementar la sensibilidad en el diagnóstico temprano.
Estudios serológicos anteriores sugieren una importante incidencia de la infección en humanos en Colombia. La prevalencia de anticuerpos a Leptospira en habitantes de los alrededores de la ciudad de Cali resultó en 23,3 % en un estudio reciente.7 En el Caribe colombiano se reporta una prevalencia de 13,1 %,6 mientras en el departamento de Antioquia se registró una prevalencia de 22,4 % en grupos humanos de riesgo.4 Muy pocos estudios registran la confirmación de la enfermedad en casos presuntivos. Un caso de leptospirosis grave con insuficiencia respiratoria severa fue reportado en Cali en 1998.8 Hallazgos histopatológicos compatibles con la enfermedad fueron reportados en necropsias de 4 fallecidos en Barranquilla en 1997.16 El presente estudio demuestra, según criterios serológicos reconocidos al nivel internacional, la ocurrencia de la enfermedad en un número importante de casos clínicamente compatibles procedentes del departamento del Valle del Cauca.
La MAT es una técnica serogrupo específica.2 La evaluación serológica por MAT, con el empleo como antígenos de cepas representativas de los 24 serogrupos patógenos de Leptospira, permitió analizar serovariedades de interés epidemiológico. Icterohaemorrhagiae constituyó el serogrupo de mayor reactividad serológica tanto en casos confirmados como probables; más de la mitad de estos casos reaccionaron de manera única o mayormente a este serogrupo, por lo que pudiera constituir la causa más frecuente de infección por leptospirosis en la región epidemiológica analizada. Estudios recientes de seroprevalencia en perros de la ciudad de Cali indicaron también a este serogrupo como el de mayor reactividad serológica.17
Aunque posibles reacciones paradójicas o respuestas anamnésticas pueden enmascarar al serogrupo infectante, especialmente en muestras séricas tomadas en fase aguda2 y resulta imprescindible el aislamiento microbiológico para determinar con certeza el serovar infectante, la reactividad serológica obtenida por MAT durante el diagnóstico brinda importante información sobre las serovariedades circulantes.18 Durante la epidemia de leptospirosis severa ocurrida en Brasil en 1996, 90 % de los casos de leptospirosis confirmada o probable mostraron los mayores títulos al serogrupo Icterohaemorrhagiae por la MAT.19 Un número importante de estos casos correspondía a monosueros de fase aguda con títulos MAT³ 1: 800. El ulterior serotipaje de aislamientos clínicos identificó al serogrupo Icterohaemorrhagiae en 13 de 15 aislamientos. Asimismo, en un estudio caso-control realizado tras la epidemia de leptospirosis severa en Nicaragua en 1995, el serogrupo de mayor reactividad serológica en humanos fue Canicola,20 con dos de tres aislamientos clínicos de este serogrupo. Los resultados obtenidos en el presente estudio sugieren que el serogrupo Icterohaemorrhagiae y en menor grado otros serogrupos como Bataviae, Cynopteri, Canicola, Mini y Shermani resultan de importancia epidemiológica en la región del Valle del Cauca. La clasificación serológica de aislamientos clínicos autóctonos permitirá corroborar estos resultados, definir serovares de mayor interés, identificar posibles fuentes de infección, evaluar la eficacia de vacunas comerciales o diseñar nuevas formulaciones vacunales (o ambos).
Analizando las variables clínico-epidemiológicas, los datos del presente trabajo están en concordancia con lo reportado por otros autores en cuanto a sexo, edad y síntomas más frecuentes. Comúnmente los hombres adultos jóvenes padecen la enfermedad con mayor frecuencia dada la exposición al riesgo, incluso en casos de leptospirosis urbana.15,19 La enfermedad puede ser indistinguible desde el punto de vista clínico de otras enfermedades febriles endémicas en regiones tropicales como fiebre tifoidea, malaria o dengue.1-3 Fiebre, cefalea, mialgias, náuseas, vómitos y dolores abdominales son síntomas comúnmente observados en brotes de leptospirosis y dengue, muchas veces concurrentes en una misma zona epidemiológica.19,21 La identificación de la leptospirosis dependerá en gran medida de la sospecha clínica de los médicos y la indicación del diagnóstico diferencial, aun en casos de riesgo epidemiológico inaparente o desconocido. La enfermedad es potencialmente fatal en casos severos, muestra inclusive mayores niveles de letalidad que el dengue durante brotes concurrentes.21 Un porcentaje importante de los casos confirmados o probables detectados en nuestro estudio evidenciaron síntomas de leptospirosis severa como ictericia (36 %) e insuficiencia renal (6,7 %), uno de estos casos falleció. El diagnóstico confirmatorio de la enfermedad muchas veces no logra realizarse durante la fase aguda, por lo que no deberá retrasar el tratamiento antimicrobiano ante la sospecha clínica, más aún ante síntomas y signos con pobre pronóstico. Durante la epidemia de leptospirosis severa en Brasil, 80 % de las muertes ocurridas no lograron completar la toma de muestra para la confirmación serológica de la enfermedad.19
Los resultados del presente estudio sugieren que la leptospirosis constituye un problema de salud pública en el Valle del Cauca. La enfermedad no solo se manifiesta como un problema ocupacional de zonas rurales, porque cerca de 70 % de los casos confirmados o probables identificados radican en ambientes urbanos. Un alto índice de estos pacientes registró la presencia de roedores en sus casas, mientras estudios recientes sugieren un importante papel de los perros en la transmisión de la enfermedad en ambientes urbanos del departamento.17 Medidas de prevención y control debieran ser implementadas para garantizar un control eficaz de la enfermedad, incluidas la higienización y desratización, la inmunización de animales domésticos y afectivos, el control de perros abandonados y la vacunación de personas expuestas a riesgo.
AGRADECIMIENTOS
Los autores desean agradecer la colaboración brindada por la Secretaría de Salud Departamental del Valle del Cauca para la realización de este trabajo bajo convenio con la Universidad del Valle, muy en especial a la doctora Beatriz Olaya y al doctor Humberto Escobar, así como el apoyo de los Laboratorios Delta, Medellín, Colombia.
REFERENCIAS BIBLIOGRÁFICAS
1. Faine S, Adler B, Bolin C, Perolat P. Leptospira and leptospirosis, 2nd ed. Melbourne: MedSci; 1999.
2. Levett PN. Leptospirosis. Clin Microbiol Rev. 2001;14(2):296-326.
3. McBride AJA, Athanazio DA, Reis MG, Ko AI. Leptospirosis. Curr Opin Infect Dis. 2005;18(5):376-86.
4. Ochoa JE, Sánchez A, Ruiz I. Epidemiología de la leptospirosis en una zona andina de producción pecuaria. Rev Panam Salud Publica. 2000;7(5):325-31.
5. Orrego A, Giraldo G, Ríos B, Valencia PA. Leptospirosis en personas de riesgo de quince explotaciones porcinas y de la central de sacrificio de Manizales, Colombia. Arch Med Vet. 2003;35(2):205-13.
6. Najera S, Alvis N, Babilonia D, Alvarez L, Mattar S. Leptospirosis ocupacional en una región del Caribe colombiano. Salud Pública Mex. 2005;47(3):240-4.
7. Ferro BE, Rodriguez AL, Perez M, Travi BL. Seroprevalencia de infección por Leptospira en habitantes de barrios periféricos de Cali, Colombia. Biomédica. 2006;26(2):250-7.
8. Hoyos JA, Arango JH, De Lima E. Leptospirosis icterohemorrágica. Presentación de un caso. Colombia Med. 1998;29(1):43-6.
9. Sulzer CR, Jones WL. Leptospirosis. Methods in laboratory diagnosis (revised edition). CDC: Departament of Health, Education and Welfare Publication; 1976. p. 76-82.
10. Faine S. Guidelines for the control of leptospirosis. Geneva: World Health Organization; 1982.
11. Centers for Disease Control and Prevention. Case definitions for infectious conditions under public health surveillance. Morb Mortal Wkly Rep. 1997;46(RR-10):49.
12. López PR. Diseño estadístico de experimentos. La Habana: Editorial Científico-Técnica; 1988.
13. Levett PN, Whittington CU. Evaluation of the indirect hemagglutination assay for diagnosis of acute leptospirosis. J Clin Microbiol. 1998;36(1):11-4.
14. Russell K, Montiel M, Watts D, Lagos-Figueroa R, Chauca G, Ore M, et al. An outbreak of leptospirosis among Peruvian military recruits. Am J Trop Med Hyg. 2003;69(1):53-7.
15. Ooteman MC, Vago AR, Koury MC. Evaluation of MAT, IgM ELISA and PCR methods for the diagnosis of human leptospirosis. J Microbiol Meth. 2006;65(2):247-57.
16. Pérez JA. Hallazgos histopatológicos en necropsias de leptospirosis. Colombia Med. 1997;28(1):4-9.
17. Rodríguez AL, Ferro BE, Varona MX, Santafé M. Evidencia de exposición previa a Leptospira en perros callejeros de Cali. Biomédica. 2004;24(3):291-5.
18. Levett P. Usefulness of serologic analysis as a predictor of the infecting serovar in patients with severe leptospirosis. Clin Inf Dis. 2003;36(4):447-52.
19. Ko AI, Reis MG, Ribeiro Dourado CM, Johnson WD, Riley LW, Salvador Leptospirosis Study Group. Urban epidemic of severe leptospirosis in Brazil. Lancet. 1999;354(9181):820-5.
20. Trevejo RT, Rigau-Perez JG, Ashford DA, McClure EM, Jarquin-Gonzalez C, Amador JJ, et al. Epidemic leptospirosis associated with pulmonary hemorrhage-Nicaragua, 1995. J Infect Dis. 1998;178(5):1457-63.
21. LaRocque R, Breiman R, Ari M, Morey R, Janan F, Hayes J, et al. Leptospirosis during dengue outbreak, Bangladesh. Emerg Inf Dis. 2005;11(5):766-9.
Recibido: 8 de julio de 2008.
Aprobado: 25 de febrero de 2009.
Dra. Myriam Astudillo Hernández. Universidad del Valle. Calle 4B 36-00, Santiago de Cali, Colombia. Teléf.: (57-2) 554 2496, Fax: (57-2) 554 2468. Correo electrónico: myrastud@univalle.edu.co; myrsatud@yahoo.com














