Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760
Rev Cubana Med Trop vol.64 no.3 Ciudad de la Habana jul.-sep. 2012
ARTÍCULO ORIGINAL
Producción in vitro de interferón gamma en ratones vacunados con ´Mycobacterium habana´ frente a antígenos de Mycobacterium tuberculosis
In vitro interferon gamma production in mice vaccinated with ´Mycobacterium habana´ against Mycobacterium tuberculosis antigens
MSc. Iliana Valdés Hernández,I Dr. C. Ernesto Montoro Cardoso,I Dr. Rogelio Hernández-PandoII
I Centro Colaborador OPS/OMS. Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba
II Instituto de Ciencias Médicas y Nutrición "Salvador Zubirán". México DF., México.
RESUMEN
Introducción: el desarrollo de nuevas vacunas antituberculosas requiere de la caracterización de la respuesta de inmunidad celular, inducida por el nuevo candidato vacunal frente a los antígenos principales de Mycobacterium tuberculosis.
Objetivo: determinar el potencial inmunogénico de ´Mycobacterium habana´ TMC-5135, cuando se usa como vacuna subcutánea en ratones Balb/c.
Métodos: en este estudio se inocularon subcutáneamente ratones Balb/c con la cepa viva ´Mycobacterium habana´ TMC-5135 y se determinó la producción in vitro de IFN gamma en cultivos celulares de pulmón, bazo y ganglios inguinales estimulados con antígenos solubles totales y el antígeno 85b. Como grupo control se vacunaron ratones con BCG subcepa Phipps.
Resultados: particularmente en los ganglios linfáticos inguinales, ambos antígenos indujeron mayor producción de IFN gamma en los ratones vacunados con ´Mycobacterium habana´que con BCG.
Conclusiones: los resultados justifican la realización de nuevas investigaciones usando ´Mycobacterium habana´ TMC-5135 como candidato vacunal para prevenir la tuberculosis.
Palabras clave: tuberculosis, IFN gamma, ´Mycobacterium habana´, vacuna.
ABSTRACT
Introduction: development of new antituberculosis vaccines requires the characterization of the cell-mediated immune responses induced by mycobacterial antigens.
Objective: to determine the immunogenic potential of ´Mycobacterium habana´ TMC-5135 when using subcutaneous vaccine in Balb/c mice.
Methods: in this study, Balb/c mice were inoculated subcutaneously with live ´Mycobacterium habana´ TMC-5135. The production of IFN gamma in cell suspensions obtained from the lungs, the spleen and the lymph nodes after stimulation with mycobacterial antigens Ag85b or culture filtrate antigens (CFA) was recorded.
Results: the production of IFN gamma after stimulation with CFA and Ag85b was higher in mice vaccinated with ´M. habana´ than in animals immunized with BCG.
Conclusions: these results encourage new research on ´M. habana´ as vaccinal candidate against tuberculosis.
Key words: tuberculosis, IFN gamma, ´Mycobacterium habana´, vaccine.
INTRODUCCIÓN
La creciente morbilidad y mortalidad mundial de la tuberculosis (TB), así como la emergencia de cepas multidrogorresistentes y extremadamente resistentes y el aumento de la infección por el VIH, presentan un nuevo escenario en el control de esta enfermedad.1 A pesar de la disponibilidad de antibióticos eficientes y de la aplicación extendida de la vacunación con BCG, la TB se encuentra fuera de control en muchos países en vías de desarrollo.2,3
En la actualidad, la única vacuna disponible para prevenir la TB en la población humana es la BCG. Desde su introducción en 1921, se calcula que se han administrado más de 2,5 billones de dosis, lo cual la convierte hasta el momento actual en la vacuna más utilizada en humanos. La BCG tiene como ventajas su bajo costo y seguridad, sin embargo, cuenta con la gran desventaja de que proporciona protección solo contra la infección primaria y las formas graves de TB, esto muestra una actividad limitada en los individuos ya infectados y en la reactivación de la infección latente.4
A pesar del rechazo inicial mostrado por la comunidad científica internacional con respecto al uso de bacterias vivas como vacunas, se ha demostrado que estas constituyen potentes estimuladores de la respuesta inmune protectora contra la TB. Su principal ventaja radica en la expresión de todo el arsenal de antígenos micobacterianos y la capacidad de estos de estimular combinaciones de diferentes poblaciones de células T.5,6
´Mycobacterium habana' fue aislado la primera vez por Valdivia y otros, en 1971, a partir de esputos provenientes de pacientes con enfermedad pulmonar indistinguible de la TB.7,8 A pesar de que su perfil bioquímico y serológico es similar al de Mycobacterium simiae serotipo I, existen diferencias antigénicas e inmunogénicas lo suficientemente distintivas como para mantener el término ´M. habana´ para aquellas cepas aisladas originalmente en Cuba.9 Más aún, esta familia de bacterias son atenuadas y existen evidencias en modelos experimentales de que la vacunación con la cepa ´M. habana´ TMC-5135 confiere protección contra la infección por Mycobacterium tuberculosis, Mycobacterium leprae, Mycobacterium ulcerans y Leishmania donovani.10-14 El objetivo del presente estudio fue determinar el potencial inmunogénico de ´M. habana´ TMC-5135, cuando se usa como vacuna subcutánea en ratones Balb/c. Para esto se determinó la producción de IFN gamma en suspensiones celulares obtenidas de órganos diversos de ratones vacunados con esta cepa y BCG, después de estimularlos in vitro con antígenos de M. tuberculosis.
MÉTODOS
Bacterias
Se empleó la cepa ´Mycobacterium habana´ TMC-5135, perteneciente a la colección del Laboratorio Nacional de Referencia de Tuberculosis y Micobacterias del Instituto de Medicina Tropical "Pedro Kourí", la cual se encuentra también en la colección internacional Trudeau Mycobacterium Collection (Trudeau Institute, Saranac Lake, NY 12983, USA). Como control de inmunogenicidad se empleó la cepa BCG-Phipps (Philadelphia), que carece de las regiones genéticas RD1 y RD2.15
Animales de experimentación
Se utilizaron ratones Balb/c, machos, entre 8 y 12 semanas de vida del Instituto de Ciencias Médicas y Nutrición "Salvador Zubirán", México DF, México.
Preparación del inóculo
Las cepas se sembraron en medio líquido Middlebrook 7H9 (Becton Dickinson, Sparks, MD) suplementado con 5 % de albúmina-dextrosa-catalasa (ADC, Becton Dickinson, Sparks, MD) y se incubaron a 37 ºC durante 3 semanas. La biomasa bacteriana se resuspendió en PBS/Tween-80 0,05 % y los agregados celulares se dispersaron empleando 10 ciclos de vórtex de 1 min. Finalmente, las suspensiones se centrifugaron a 1 500 rpm durante 15 min y se colectaron los sobrenadantes. El conteo bacteriano se realizó en microscopio de fluorescencia con cámara de Neubauer empleando diacetato de fluoresceína como indicador de viabilidad. La suspensión bacilar se ajustó a 8 000 bacterias/100 µL.15
Inoculación y sacrificio
Se inocularon subcutáneamente en la base de la cola 3 grupos de 4 ratones con 8 000 bacterias vivas ´M. habana´ TMC-5135, el grupo control correspondió a ratones Balb/c de la misma edad y número vacunados con la cepa BCG-Phipps. Después de 15, 30 y 60 d de la vacunación, los animales se sacrificaron por exanguinación y se colectaron los pulmones, bazos y ganglios linfáticos inguinales. Todos los procedimientos se realizaron en gabinetes de seguridad biológica clase II, ubicados en instalaciones para animales con un nivel de bioseguridad III. El protocolo experimental fue realizado bajo las normas éticas de los institutos participantes, siguiendo las leyes internacionales para el manejo y cuidado de los animales de experimentación.16
Preparación de las suspensiones celulares
Los órganos colectados se depositaron inmediatamente en 2 mL de medio RPMI suplementado con 0,5 mg/mL de colagenasa tipo 2 (Worthington, NJ, USA) e incubados por 1 h a 37 ºC. A continuación, estos fueron macerados y lavados con el mismo medio. Las células se centrifugaron a 1 500 rpm durante 5 min. Se desechó el sobrenadante y los glóbulos rojos se eliminaron con solución de lisis para eritrocitos. Posterior al lavado, las células se resuspendieron en medio RPMI suplementado con L-Glutamina 2 mM, 100 U/mL de penicilina, 1 µg/mL de estreptomicina y suero fetal bovino 10 %. Las suspensiones celulares se contaron con azul tripano 0,4 % (Sigma) y se ajustaron a 106 células/mL. Los cultivos para la determinación de IFN gamma se realizaron en placas de 96 pocillos de fondo plano (Costar).17
Estimulación celular
Los cultivos celulares se incubaron con los antígenos solubles totales (CFA) que correspondieron a una preparación de antígenos obtenida de sobrenadantes de cultivo de M. tuberculosis cepa H37Rv y el antígeno recombinante puro Ag 85b, a una concentración de 5 µg/mL.17 Como controles positivo y negativo de estimulación se emplearon la Concanavalina A y medio RPMI solo, respectivamente. Con el objetivo de establecer el tiempo óptimo de producción de IFN gamma para los cultivos celulares de los ratones vacunados con la cepa ´M. habana´ TMC-5135, los órganos colectados el día 15 posterior a la vacunación se sometieron a 24, 48 y 72 h de estimulación antigénica. Los cultivos celulares de los ratones vacunados con BCG-Phipps se estimularon con los mismos antígenos durante 72 h.17
Producción de IFN gamma
En cada uno de los momentos previamente señalados, las células se centrifugaron y en el sobrenadante se cuantificó IFN gamma a través de un sistema comercial de ELISA (Pharmingen. San Diego, CA, USA), siguiendo las instrucciones del fabricante. El experimento se realizó por duplicado y la concentración de IFN gamma se expresó como la concentración media (pg/mL) ± desviación estándar (DE). El índice de estimulación antigénica con respecto al control (E/C) se calculó con la fórmula:
Una relación E/C mayor que 3 se consideró como una respuesta positiva.18,19 Una vez establecido el tiempo óptimo de exposición al estímulo antigénico, este se empleó en los experimentos siguientes (días 30 y 60 posvacunación).
Análisis estadístico
Se calculó la desviación estándar para cada uno de los estímulos antigénicos, en los diferentes tiempos de estimulación. Se realizó la prueba de T para muestras pareadas (IC 52,31-100,25; IC 100,25-126,53) con el objetivo de determinar la significación estadística de los niveles de IFN gamma. Un valor de p< 0,05 se consideró como significativo.
RESULTADOS
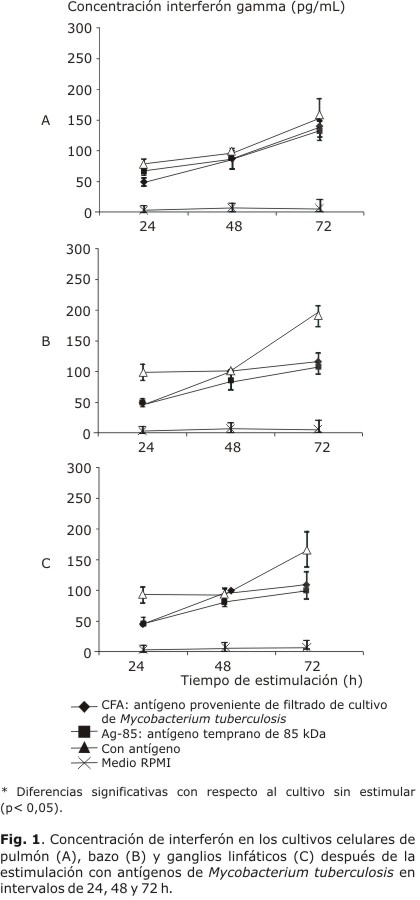
En la figura 1 (A, B y C) se muestra la cinética de producción de IFN gamma en diferentes tiempos de estimulación con antígenos de M. tuberculosis, luego de 15 d de recibir la inoculación con `M. habana´ TMC-5135. Para todos los órganos analizados, los mayores niveles de producción (p< 0,05) se observaron en las de 72 h de incubación.
Los niveles de IFN gamma en respuesta a la estimulación con Ag85b y CFA fueron similares, mostraron diferencias significativas con el control negativo. Las concentraciones de IFN obtenidas a las 72 h de estimulación antigénica se muestran en la tabla. Los cultivos de células de los ganglios linfáticos mostraron los valores más altos cuando se estimularon con CFA o Ag85b; estos fueron de 40,4 y 32,8, respectivamente.
Teniendo en cuenta que a las 72 h de estimulación se obtuvo la producción máxima de IFN gamma, las mediciones en los 30 y 60 d posvacunación se analizaron bajo las mismas condiciones.
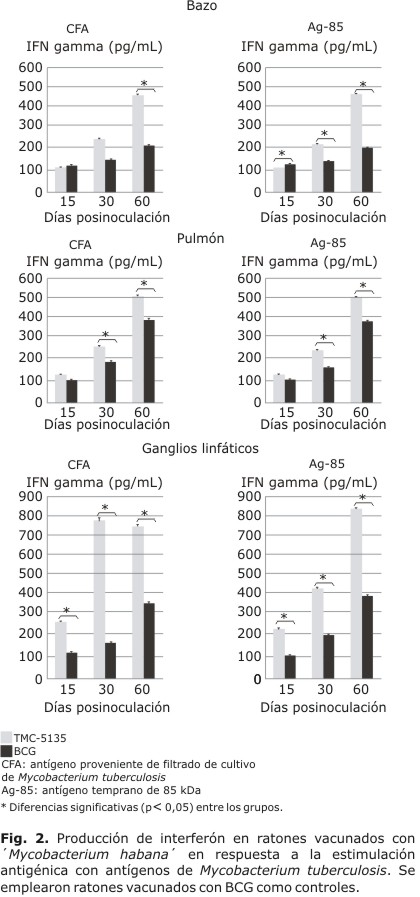
Se comparó la inmunogenicidad de ´M. habana´ y BCG cuantificando la producción de IFN gamma en suspensiones celulares obtenidas del bazo, los pulmones y ganglios linfáticos estimulados con los diferentes antígenos y a diferentes tiempos posinoculación (Fig. 2). La producción de IFN gamma en presencia de CFA y Ag85b fue ascendente en todos los órganos analizados hasta el final del experimento. Igual comportamiento tuvo el grupo vacunado con BCG, sin embargo, la cantidad de esta citocina fue significativamente menor desde el día 30 posvacunación en los pulmones y bazo.
Los resultados más relevantes corresponden a la respuesta observada en los ganglios linfáticos regionales. En estos órganos se observaron diferencias significativas entre el grupo de ensayo y el control, desde el inicio del experimento. Luego de 2 meses de la administración de `M. habana´ los valores de IFN gamma fueron el doble de los registrados en el grupo vacunado con BCG.
DISCUSIÓN
Tradicionalmente, la mayoría de las vacunas contra las enfermedades infecciosas consisten en patógenos vivos atenuados que inducen una fuerte respuesta inmunológica. El principal obstáculo en el desarrollo de este tipo de inmunógeno radica en la dificultad de lograr un nivel razonable de atenuación sin afectar su inmunogenicidad.20 Las micobacterias ambientales en general son organismos atenuados que comparten un número no despreciable de antígenos entre sí y con M. tuberculosis, lo que las convierte en blanco de las investigaciones en el campo del desarrollo de vacunas antituberculosas. Mycobacterium microti y Mycobacterium vaccae constituyen algunos ejemplos de los más estudiados.20
Desde su primo aislamiento, ´M. habana´ despertó gran interés por su poder inmunogénico. Raj y otros demostraron la seguridad de la vacunación intravenosa con esta micobacteria tras la observación de una reducción significativa de la carga bacilar hasta una total esterilización en los pulmones de los ratones infectados, sin evidencias de lesiones pulmonares.11
Los correlatos de protección constituyen variables inmunológicas con valor predictivo en la protección contra la reinfección. Existe consenso internacional en cuanto a la dificultad para encontrar parámetros útiles, que puedan ser correctamente extrapolados desde el modelo experimental hasta los humanos.20,21 A pesar de esta situación está demostrado que el control de la infección micobacteriana se caracteriza por la participación de células T CD4+, productoras de citoquinas tipo I, en particular IFN gamma.21,22 En nuestro estudio los cultivos celulares de los principales órganos de los animales vacunados se estimularon in vitro con antígenos de M. tuberculosis, con el objetivo de cuantificar la producción de esta citoquina.
La respuesta inducida con el Ag85b resultó más eficiente en los animales que se inmunizaron con ´M. habana´ que en los vacunados con BCG. El complejo antigénico 85 está conformado por 3 proteínas con actividad transferasa de ácidos micólicos: Ag85a, Ag85b y Ag85c (32A kDa, 30 kDa y 32-kDa, respectivamente); el Ag85b es el componente mayoritario en este complejo.22,23 Se ha demostrado de modo experimental que esta molécula constituye una fracción relevante dentro de las proteínas secretadas por M. tuberculosis. De igual forma, Jyothi y otros, así como Chaturvedi y otros, coinciden al afirmar que el Ag85b constituye el antígeno de secreción temprana más importante al purificar sobrenadante de cultivo en fase log de ´M. habana´ TMC-5135.24,25 La fuerte inducción inmunológica que se genera tras la inoculación de una cepa viva explica los altos niveles de IFN gamma encontrados, luego de la estimulación in vitro con este antígeno.
Por su parte, la estimulación con CFA mostró los más altos niveles de IFN gamma en los animales inmunizados con ´M. habana´. Esta observación sugiere una estrecha relación entre las proteínas secretadas por ambas especies micobacterianas. Los antígenos solubles, en su conjunto, constituyen estimuladores tempranos de la respuesta inmune protectora debido a su rápida aparición en el desarrollo de la infección.11,23,25,26 La producción ascendente de IFN gamma durante el transcurso del experimento sostiene la hipótesis de que los bacilos vivos funcionan como inductores potentes de la respuesta de activación de la inmunidad celular.25.La menor respuesta encontrada en los ratones inmunizados con BCG pudiera estar relacionada con el hecho de que esta cepa no presenta las regiones RD1 y RD2, las cuales codifican para antígenos de secreción con un reconocido potencial inmunogénico.27 La selección de esta cepa de BCG para la comparación con ´M. habana´ fue porque esta subcepa resultó la más eficiente entre otras 10 para inducir de manera experimental protección contra M. tuberculosis.15
Independientemente del antígeno empleado en la estimulación, los ganglios linfáticos evidenciaron la mayor respuesta inmunológica desde los primeros 15 d y hasta 2 meses después de la vacunación. Estos fueron extraídos de la región inguinal, que corresponden a los órganos linfoides secundarios más cercanos al sitio de inmunización. En ellos se efectúa la presentación antigénica como paso inicial de la respuesta inmune adaptativa, funcionando como sitios de convergencia del sistema de vasos que colectan el líquido tisular procedente de los tejidos aledaños. De igual forma, el empleo de microorganismos vivos garantiza una estimulación antigénica constante en estos órganos, lo cual se manifiesta en mayores niveles de producción de citoquinas.27,28
El IFN gamma como molécula inmunomoduladora aumenta la actividad citotóxica y fagocítica de los macrófagos. De igual forma induce la expresión de moléculas del MHC clase I y II en las células dendríticas y otras células presentadoras de antígenos, así como incrementa el desarrollo y la diferenciación de las células Th1. La demostración de una elevada producción de IFN gamma por los cultivos celulares realizados a partir de los órganos de ratones inoculados con ´M. habana´ y la importancia de esta citoquina en la respuesta inmune protectora contra las micobacterias, avala la realización de estudios futuros que empleen ´M. habana´ como candidato vacunal contra la TB.
AGRADECIMIENTOS
Este trabajo contó con el soporte financiero de CONACyT (J200.754/2004), México y el Proyecto Nacional "Desarrollo de nuevas vacunas contra la tuberculosis", perteneciente al Ministerio de Ciencia, Tecnología y Medio Ambiente (CITMA), Cuba.
REFERENCIAS BIBLIOGRÁFICAS
1. Achkar JM, Casadevall A, Glatman-Freedman A. Immunological options for the treatment of tuberculosis: evaluation of novel therapeutic approaches. Expert Rev Anti Infect Ther. 2007;5:461-74.
2. McMurray DN. Recent progress in the development and testing of vaccines against human tuberculosis. Inter J Parasitol. 2003;33:547-54.
3. Ginsberg AM. What's new in Tuberculosis vaccines. Bull World Health Organization. 2002;80:483-8.
4. Hernández-Pando R. Nuevas vacunas contra la TB. Rev Salud Pública de México. 2007:E211-7.
5. Kaufmann SHE, McMichael AJ. Annulling a dangerous liaison: vaccination strategies against AIDS and tuberculosis. Nature Medicine Supplement. 2005;11:33-44.
6. Baumann S, Eddine AN, Kaufmann SHE. Progress in tuberculosis vaccine development. Current Opinion Immunol. 2006;18:438-48.
7. Valdivia JA, Suárez R, Echemendía M. Mycobacterium habana, probable nueva especie dentro de las especies no clasificadas. Bol Hig Epidemiol. 1971;9:65-73.
8. Valdivia JA. Mycobacterium habana: Clinical and epidemiological significance. Ann Soc Belg Med Trop. 1973;53:263-6.
9. Mederos LM, Valdivia JA, Sampere MA, Valero-Guillén PL. Analysis of lipids reveals differences between ´Mycobacterium habana´ and Mycobacterium simiae. Microbiology. 1998;144:1181-8.
10. Gupta HP, Singh NB, Mathur IS, Gupta SK. ´Mycobacterium habana´, a new immunogenic strain in experimental tuberculosis of mice. Indian J Exp Biol. 1979;17:1190-3.
11. Raj PP, Srivastava S, Jain SK, Srivastava BS, Srivastava R. Protection by live ´Mycobacterium habana´ vaccine against Mycobacterium tuberculosis H37Rv challenge in mice. Indian J Med Res. 2003;117:139-45.
12. Sing NB, Celia TA, Lave RE, Rees RJW, Colston DMJ. Vaccination of mice against Mycobacterium leprae infection. Infect Immun. 1989;57:653-5.
13. Singh NB, Mathur IS, Gupta HP, Srivastava A. A novel immunogenic strain ´Mycobacterium habana´ against M. ulcerans (Buruli ulcer) infection in mice. Curr Sci. 1981;50:994-6.
14. Anuradha A, Zehra K, Katiyar JC, Gupta HP, Singh NB. Vaccination of hamster with ´M. habana´ against Leishmania donovani infection. Curr Sci. 1995;69:90-3.
15. Castillo-Rodal AI, Castañón-Arreola M, Hernández-Pando R, Calva JJ, Sada-Díaz E, López-Vidal Y. Mycobacterium bovis BCG substrains confer different levels of protection against Mycobacterium tuberculosis infection in a Balb/c model of progressive pulmonary tuberculosis. Infect Immun. 2006,74:1718-24.
16. National Research Council. Guía para el Cuidado y Uso de los Animales de Laboratorio. México DF: Halam México S.A de C.V.; 2002.
17. Infante E, Aguilar LD, Bianco MV, Cataldi A, Bigi F, Hernández-Pando R. Immunogenicity and protection induced by Mycobacterium tuberculosis mce-2 and mce-3 mutants in a Balb/c mouse model of progressive pulmonary tuberculosis. Vaccine. 2006;24:2333-42.
18. Al-Attiyah R, Madi NM, El-Shamy ASM, Wiker HG, Andersen P, Mustafa AS. Cytokine profiles in tuberculosis patients and healthy subjets in response to complex and single antigens of Mycobacterium tuberculosis. FEEMS Immunol Med Microbiol. 2006;47:254-61.
19. Pérez AB, Sierra B, Delgado I, Rodríguez R, Guzmán MG. Ensayo de linfoproliferación antígeno específico al virus dengue con células T humanas. Rev Cubana Med Trop. 2000;52:197-202.
20. Van Ham SM, Samson JN, Bos NA, Damoiseaux J, Laman JD, Wauben MHM. Vaccination Immunology: Prevention and beyond. Immunol letters. 2009,122:101-3.
21. Ottenhoff TH, de Boer T, Verhagen CE, Verreck FA, van Dissel JT. Human deficiencies in type I cytokine receptors reveal the essential role of type I cytokines in immunity to intracellular bacteria. Microbes Infect. 2000;2:1559-66.
22. Araujo Z, Acosta M, Escobar H, Baños R, Fernández C, Rivas-Santiago B. Respuesta inmunitaria en Tuberculosis y el papel de los antígenos de secreción de Mycobacterium tuberculosis en la protección, patología y diagnóstico. Revisión. Invest Clin. 2008;49:411-41.
23. Malen H, Softeland T, Wiker HG. Antigen análisis of Mycobacterium tuberculosis H37Rv culture filtrate proteins. Scand J Immunol. 2008;67:245-52.
24. Jyothi MD, Garg SK, Singh NB. Mechanisms involved in protective immune response generated by secretory proteins of ´M. habana´ against experimental Tuberculosis. Scand J Immunol. 2000;51:502-10.
25. Chaturvedi V, Jyoti D, Srivastava S, Gupta HP. Secretory proteins of Mycobacterium habana induce a protective immune response against experimental TB. FEMS Immunol Medic Microbiol. 1999;26:143-51.
26. Chaturvedi V, Srivastava A, Gupta HP, Srivastava BS. Protective antigens of Mycobacterium habana are distributed between peripheral and integral compartments of plasma membrane: a study in tuberculosis of mouse. Vaccine. 1999;17:2882-7.
27. Guevara M, Castellanos R, Robinson RJ, Vázquea L. El sistema inmunológico en los estados de salud y enfermedad. MEDISAN. 2002;6:60-8.
28. Greppi D, Guzmán MA. Vacunas en Tuberculosis. Arch Alerg Inmunol Clin. 2007;38:148-54.
Recibido: 12 de marzo de 2012.
Aprobado: 12 de mayo de 2012.
Iliana Valdés Hernández. Laboratorio Nacional de Referencia en Tuberculosis. Centro Colaborador OPS/OMS. Instituto de Medicina Tropical "Pedro Kourí". Autopista Novia del Mediodía Km 6 ½. AP 601. Lisa. La Habana, Cuba. Correo electrónico: iliana@ipk.sld.cu