Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop vol.70 no.3 Ciudad de la Habana set.-dic. 2018
ARTÍCULO ORIGINAL
Susceptibilidad de diferentes estadios larvarios de Aedes albopictus (S) (Diptera: Culicidae) a la infección por dos especies de nematodos mermítidos en condiciones de laboratorio
Sensitivity of different larval stages of Aedes albopictus (S) (Diptera: Culicidae) to infection by two species of mermithids nematodes in laboratory conditions
Zulema Menéndez Díaz,I Israel García García,I Natividad Hernández Contreras,I Aileen González Rizo,I Ariamys Companioni Ibañez,I Vicente Berovides AlvarezII
I Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
II Facultad de Biología. Universidad de La Habana. Cuba.
RESUMEN
Introducción: La combinación de insecticidas, la reducción de criaderos y el control biológico se proponen como una alternativa para el control de culícidos. Los nematodos entomoparásitos, Romanomermis iyengari y Strelkovimermis spiculatus, han sido empleados con éxito en estudios de laboratorio y campo, pero aún no se han evaluado en Cuba contra larvas de Aedes albopictus, mosquito vector de dengue, chikungunya, zika y otras arbovirosis.
Objetivo: Determinar la susceptibilidad de tres estadios larvales deAe. albopictus a la infección de R. iyengari y S. spiculatus en condiciones de laboratorio.
Métodos: Se aplicó una dosis de 7:1 (preparásitos/larva) a 100 larvas de Ae. albopictus en diferentes estadios de desarrollo (I, II y III). Después de 96 h de la posinfección, se tomaron al azar 30 larvas y se disectaron para determinar la intensidad y frecuencia de la infección. Cada estadio larval de Ae. albopictus por especie de nematodo, constó de 12 réplicas y se colocaron controles.
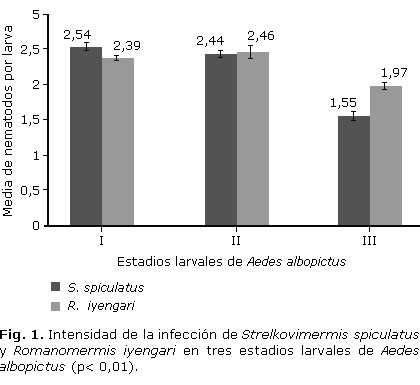
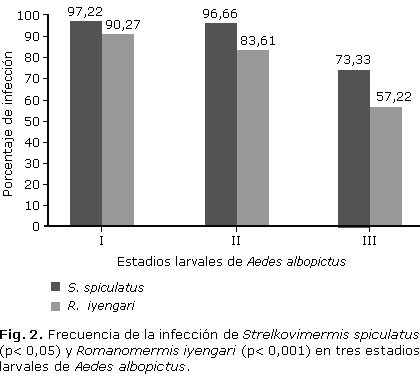
Resultados: S. spiculatus mostró mayor frecuencia de la infección en los estadios larvales estudiados (97,22 %; 96,66 % y 73,33 %) que R. iyengari (90,27 %; 83,61 % y 57,22 %), mientras que la intensidad de la infección por estadios fue de 2,54; 2,44 y 1,55 para S. spiculatus y 2,39; 2,46 y 1,97 para R. iyengari.
Conclusiones: Aunque S. spiculatus fue superior a R. iyengari, con mayores valores de frecuencia de infección en los tres estadios, ambas especies demostraron ser buenos candidatos como agentes de biocontrol de Ae. Albopictus; se recomiendan estudios posteriores antes de su uso en condiciones naturales.
Palabras clave: Romanomermis iyengari; Strelkovimermis spiculatus; control vectorial; control biológico; Cuba.
ABSTRACT
Introduction: The combination of safe insecticides for the environment, breeding sites´ reduction and biological control is proposed as a promising approach for Culicids control. The enthomoparasites nematodes Romanomermis iyengari and Strelkovimermis spiculatus have been used successfully in laboratory and field studies, but haven't been evaluated yet in Cuba against Aedes albopictus larvae. This mosquito species constitutes a vector of dengue, chikungunya, zika and other arboviruses.
Objective: To determine the sensitivity of three larval stages ofAe. albopictus to the infection of R. iyengari and S. spiculatus in laboratory conditions.
Methods: A dose of 7: 1 (preparasitics / larva) was applied to 100 larvae of Ae. albopictus in different stages of development (I, II and III). 96 hours after the post-infection, 30 larvae were taken at random and dissected to determine the intensity and frequency of the infection. Each Ae. Albopictus larval stage had twelve replicas by stages and controls were made to them.
Results: S. spiculatus showed higher frequency of infection in the larval stages studied (97.22 %, 96.66 % and 73.33 %) than R. iyengari (90.27 %, 83.61 % and 57.22 %), while the intensity of infection by stages was 2.54; 2.44 and 1.55 for S.spiculatus and 2.39; 2.46 and 1.97 for R.iyengari.
Conclusions: Although S. spiculatus was superior to R. iyengari, with higher values of infection frequency in the three stages, both species proved to be good candidates as bio-control agents of Ae. albopictus and subsequent studies are recommended before use in natural conditions.
Keywords: Romanomermis iyengari; Strelkovimermis spiculatus; vector control; biological control; Cuba.
INTRODUCCIÓN
Existen siete géneros reconocidos de mermítidos endoparásitos de mosquitos, de los cuales Romanomermis se destaca como el más estudiado, mientras que Strelkovimermis se encuentra entre los de más reciente descubrimiento y desarrollo en el control biológico.1,2 Romanomermis iyengari (Welch, 1964) se encontró originalmente parasitando larvas de Anopheles y Culex en Bengal, India3 y Strelkovimermis spiculatus (Poinar y Camino, 1986) fue colectado en el hemisferio occidental específicamente en Buenos Aires, Argentina, en larvas de Aedes albifasciatus (Macquart, 1838).4
Las potencialidades de estos nematodos como agentes de biocontrol contra un amplio rango de especies de mosquitos se han demostrado en varias partes del mundo.5,6 En Cuba la eficacia de R. iyengari y S. spiculatus también se ha evaluado contra larvas de Culex quinquefasciatus Say, 1823, Culex nigripalpus Theobald, 1901, Aedes aegypti (Linnaeus, 1762), Anopheles albimanus Wiedeman, 1821 y Uranotaenia sapphirina (Oster Sacken, 1868) tanto en condiciones de laboratorio como en criaderos naturales.7-9
Aedes albopictus (Skuse, 1895) es un importante vector de dengue en Asia y el sudeste asiático,10 así como en las islas Seychelles y La Reunión en el suroeste del Océano Índico.11,12 Recientemente se informó infectado con DENV-2 en Medellín, Colombia.13 Además ha sido responsable de brotes de chikungunya.14 En Cuba esta especie fue registrada en 199515 en La Habana y se ha dispersado hacia otras localidades en la isla.16,17
La emergencia y diseminación de enfermedades transmitidas por culícidos en las Américas hacen imprescindible perfeccionar los programas y actividades de control de vectores de importancia médico-epidemiológica. Por tal motivo y ante la posibilidad de emplear alternativas biológicas en el control vectorial, nos propusimos determinar la susceptibilidad de tres estadios larvales de Ae. albopictus a la infección de Romanomermis iyengari y Strelkovimermis spiculatus en condiciones de laboratorio.
MÉTODOS
Cría y mantenimiento de Ae. albopictus
Para iniciar la cría de Ae. albopictus se colectaron larvas de distintos estadios, en criaderos naturales como: huecos de árboles y depósitos artificiales localizados en el Reparto "René Fraga" (coordenadas: 23°04′56″N, 82°48′43″O) perteneciente al municipio La Lisa, provincia La Habana. Las larvas se trasladaron hacia las instalaciones del Instituto de Medicina Tropical "Pedro Kourí" (IPK) donde la cepa fue establecida en el insectario según la metodología descrita18 y se mantuvo a 27°C de temperatura, 76 % de humedad relativa y fotoperiodo de luz:oscuridad (13:11 h).
Cría de las especies de nematodos: S. spiculatus y R. iyengari
Los cultivos de S. spiculatus y R. iyengari empleados en este estudio provienen de Buenos Aires, Argentina y Oaxaca, México, respectivamente, y se mantienen en el Laboratorio Control Biológico del Departamento Control de Vectores en el IPK, siguiendo el procedimiento para la cría masiva de nematodos.19
Bioensayos
Los experimentos de infección de Ae. albopictus se realizaron con una proporción de nematodos por larva de (7:1), establecida previamente como dosis de infección óptima.20 Las larvas de Ae. albopictus fueron separadas en diferentes etapas de desarrollo: primer (I), segundo (II) y tercer estadio (III). Cada unidad experimental por cada estadio larval contuvo 100 larvas infectadas con el parásito en bandejas (28,8 x 18,8 x 5 cm) con 1 L de agua destilada, a temperatura de 26 °C. Cada estadio larval de Ae. albopictus por especie de nematodo, constó de 12 réplicas. Adicionalmente se colocaron tres bandejas consideradas como control, con igual cantidad de larvas por estadio, que no fueron infectadas con el parásito. Transcurridas 96 h de la infección, se tomaron al azar 30 larvas de cada bandeja, y fueron disectadas con agujas entomológicas bajo un microscopio estereoscópico. Se determinaron las variables intensidad de la infección (número de nematodos parásitos por larva examinada) y frecuencia de la infección (porcentaje de larvas parasitadas del total de larvas examinadas).
Análisis estadístico
Las variables de interés para el estudio (variables dependientes) fueron la intensidad y frecuencia de la infección. Los efectos a considerar sobre ambas variables (variables independientes) fueron: la especie de nematodo, el estadio larval del mosquito y su interacción.
Para la variable intensidad de la infección se demostró su distribución normal por la prueba de Shapiro-Wilkis, pero las varianzas entre efectos no fueron homogéneas por la prueba de Levene. Sobre esta base, se compararon las diferencias entre valores medios de dicha variable, por un análisis de varianza factorial, para los efectos especie de nematodo, estadio larval y su interacción. Se aplicó como prueba post hoc, la prueba de Dunnett, para varianzas heterogéneas.
Para la variable frecuencia de la infección se utilizaron tablas de contingencia y prueba de chi cuadrado (χ2) de 2 x n, con dos categorías (no infectados/infectados), n= 2 para cada especie de nematodo y n= 3 para los estadios (dentro de cada especie de nematodo).
Los datos se analizaron estadísticamente con el programa SPSS Statistics. Versión. 21.0.
RESULTADOS
Las réplicas en cada estadio larval por especie de nematodo fueron altamente homogéneas dentro de cada estadio y especie (diferencias estadísticamente no significativas).
Intensidad de la infección
Los resultados de la variable intensidad de la infección ocasionados por la aplicación de la dosis 7:1 muestran una tendencia a la disminución en las dos especies de nematodos del estadio I al III (Fig. 1). El estadio III con valores inferiores a los estadios I y II mostró diferencias estadísticamente significativas (F=12.7; p< 0,01). En la figura 1 se observan las medias totales de la variable estudiada, las cuales no registraron diferencias estadísticamente significativas entre estadios (F= 1,05; p> 0,05), pero sí se aprecia una ligera tendencia al aumento del valor promedio en el estadio III para R. iyengari.
Al comparar los valores promedios de esta variable (Fig. 1), considerando las especies, los estadios y su interacción en conjunto, se observa que las diferencias entre especies no fueron significativas (F= 0,32; p> 0,05), pero si entre estadios (F= 7,26; p< 0,01), así como tampoco hubo diferencias en la interacción especie por estadio (F= 1,00; p> 0,05), destacándose los bajos valores en ambas especies para el estadio III. Independientemente de la especie de nematodo que parasita, las diferencias en el nivel de infestación por estadio (ligeramente mayor en el estadio I para S. spiculatus y en el estadio II para R. iyengari), si son estadísticamente significativas y, por tanto, de interés biológico.
Frecuencia de la infección
El análisis de la variable frecuencia de infección total (Fig. 2), nos revela que para S. spiculatus se da una diferencia estadísticamente significativa (χ2= 14,01; p<0,01), provocada por la marcada reducción de la frecuencia de infección en el estadio III; resultado similar al encontrado para la anterior variable. En R. iyengari, también se da dicha reducción en el estadio III, pero no llega a ser estadísticamente significativa (χ2= 0,39; p> 0,05).
Al comparar el comportamiento de esta variable entre las especies de nematodos, se observa una clara tendencia para ambas a la disminución del estadio I al III con diferencia estadística significativa para ambas (S. spiculatus: χ2= 12,44; p< 0,05; R. iyengari: χ2= 21,22; p< 0,001) siempre con mayores valores para S. spiculatus en los tres estadios. Tomando ambas especies en total, ignorando las diferencias entre estadios, la especie S. spiculatus tuvo un 89,07 % de frecuencia de infección comparado con 76,85 % para R.iyengari, diferencia altamente significativa (χ2= 12,01; p< 0,001).
DISCUSIÓN
Los resultados demuestran que Ae. albopictus fue susceptible al parasitismo de ambas especies de nematodos, aunque S. spiculatus resultó ser más efectivo al mostrar valores superiores en la intensidad y frecuencia de la infección. Los estadios larvarios I y II fueron los que presentaron mayor susceptibilidad al parasitismo, lo cual es esperado pues se ha descrito que la susceptibilidad al parasitismo del nematodo es superior en los estadios larvales primarios (I y II) debido a la escasa formación de quitina, lo que facilita la invasión del hemocele de las larvas.21
Sanad y otros22 exponen la existencia de diferentes patrones o conductas de penetración de la etapa infectiva o preparásita de cada especie de nematodos. En sus resultados mostraron que R. iyengari (66,7 %) perfora la zona posterior del abdomen larval y el 33,3 % se introduce por el tórax. Mientras queS. spiculatus (83,3 %) prefirió el tórax y solo un 10 % perforaron el abdomen para introducirse en la larva. Dicha preferencia por zonas diferentes del cuerpo del hospedero pudiera ser la razón de la ligera superioridad mostrada por R. iyengari en el parasitismo del segundo y tercer estadio larval, pues es conocido que la deposición de quitina en el tórax es superior a la encontrada en los segmentos abdominales de la larva23 lo que podría desfavorecer la entrada de los juveniles de S. spiculatus.
La susceptibilidad de Ae. albopictus a S. spiculatus en los ensayos realizados se mostró muy similar a lo descrito en estudios anteriores.6,24 La actividad parasitaria de S. spiculatus fue demostrada en larvas de segundo estadio de Ae. albopictus, en experimentos en que se informó parasitismo elevado (92,2 %) para dosis de 7 nematodos/larva.24 Es conocido además que infestaciones de S. spiculatus superiores al 80 %, son consideradas exitosas en larvas de I y II estadio, comparado con 52 % y 38 % en tercer y cuarto estadio, respectivamente.6,25 Achinelly y Micieli26 plantean que larvas de estadio II de culícidos hospederos en una relación entre 4 y 7:1 (nematodo/larva) aseguran entre 81 % y 87,5 % de parasitismo, por lo que recomiendan dichas dosis en ensayos de campo con poblaciones de mosquitos salvajes.
Las especies de mermitidos estudiadas son reconocidas porque ofrecen una mejor oportunidad de control biológico al ser organismos que poseen la capacidad de tolerar aguas ligeramente poluidas y salobres, así como infectar con éxito varias especies de culícidos.1,21,27,28 En la India se ha informado que la aplicación de R. iyengari en huecos de árboles causa infestación en larvas de Ae. albopictus, suficiente para reducir su densidad, con un nivel de infección superior al 80 %.29 También confirman su eficacia y posibilidad de controlar la emergencia de adultos de Ae. albopictus en huecos de árboles de caucho presentes en plantaciones del área de Kerala.30
Este trabajo compara la capacidad de infección de S. spiculatus y R. iyengari contra tres estadios larvales de Ae. albopictus en condiciones de laboratorio. Aunque S. spiculatus fue superior a R. iyengari con mayores valores de frecuencia de infección en los tres estadios, ambas especies demostraron ser buenos candidatos como agentes de biocontrol de Ae. albopictus. Estudios posteriores acerca de la influencia de factores abióticos en la efectividad de estos nematodos y como afectan parámetros poblacionales de larvas de culícidos deben ser realizados en laboratorio, antes de ser utilizados en sitios de cría de mosquitos como una alternativa en el control vectorial.
Conflicto de intereses
No existe conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Platzer EG. Mermithid Nematodes. J Am Mosq Control Assoc. 2007;23(Supl 2):58-64.
2. Cruz AS. Caracterización morfológica de cuatro especies de nematodos parásitos de larvas de mosquitos. [Tesis para optar por el grado de Máster en Conservación y Aprovechamiento de Recursos Naturales]. Oaxaca: Instituto Politécnico Nacional, Centro Interdisciplinario de Investigación para el Desarrollo Regional Integral de Oaxaca, México; 2011.
3. Iyengar MOT. Parasitic nematodes of Anopheles in Bengal. Far Eastern Assoc Trop Med Trans. 1927;(3):128-35.
4. Poinar GO Jr, Camino NB. Strelkovimermis spiculatus n.sp. (Mermithidae: Nematoda) parasitizing Aedes albifasciatus Macquart (Culicidae: Diptera) in Argentina. J Nematol. 1986;18:317-9.
5. Pérez R, Rodriguez C, Lara J, Montes B, Ruíz J. Parasitism of Romanomermis iyengari in larvae of three species of mosquito in the laboratory and in Anopheles pseudopunctipennis in the field. Agrociencia. 2004;38(4):413-21.
6. Achinelly MF, Micieli MV, Marti GM, García JJ. Susceptibility of neotropical mosquito larvae (Diptera: Culicidae) and non-target acuatic organisms to the entomoparasitic nematode Strelkovimermis spiculatus Poinar and Camino, 1986 (Nematoda: Mermithidae). Nematology. 2004;6:299-302.
7. Rodríguez J, García I, Menéndez Z, García Ávila I, Sánchez J, Pérez R. Efecto patogénico de 3 nematodos parásitos en larvas de Aedes aegypti en condiciones de laboratorio, en Cuba. Rev Cubana Med Trop. 2005;57(3):219-22.
8. Santamarina A, García I, Rivera J, Solís A. Release ofRomanomermis iyengari (Nematoda:Mermithidae) to control Aedes taeniorhynchus (Diptera:Culicidae) in Punta del Este, Isla de la Juventud, Cuba. J Med Entomol. 1996;33(4):680-2.
9. Santamarina AM. Actividad parasitaria de Romanomermis iyengari (Nematoda, Mermithidae) en criaderos naturales de larvas de mosquitos. Misc Zool. 1993-1994;17:59-65.
10. Gratz N. Critical review of the vector status of Aedes albopictus. Medical and Veterinary Entomology. 2004;18:215-27.
11. Metselaar D, Grainger CR, Oei KG, Reynolds DG, Pudney M, Leake CJ, et al. An outbreak of type 2 dengue in the Seychelles, probably transmitted by Aedes albopictus (Skuse). Bull WHO.1980;58(6):937-43.
12. Paupy C, Girod R, Salvan M, Rodhain F, Failloux AB. Population structure of Aedes albopictus from La Reunion Island (Indian Ocean) with respect to susceptibility to a dengue virus. Heredity. 2001;87:273-83.
13. Gómez A, Suaza J, Castaño S, Triana O, Uribe S. Aedes albopictus (Skuse, 1894) infected with the American-Asian genotype of dengue type 2 virus in Medellín suggests its possible role as vector of dengue fever in Colombia. Biomédica. 2017;37(Supl. 2):135-42.
14. Reiter P, Fontenille D, Paupy C. Aedes albopictus as an epidemic vector of chikungunya virus: another emerging problem? The Lancet. 2006;6:463-64.
15. González R, Marro E. Aedes albopictus in Cuba. J Am Mosq Control Assoc. 1999;15(4):569-70.
16. Fuster CA. Distribución espacial y temporal de Aedes aegypti y Aedes albopictus en Pinar del Rio 2003-2010 [Tesis para optar por el grado de Máster en Entomología y Control de Vectores]. La Habana: Instituto de Medicina Tropical "Pedro Kourí"; 2012.
17. Castillo RM, Pérez M, Mesa A, Silva I, Alfonso Y, Marquetti MC. Presencia y sitios de cría de Aedes albopictus (Diptera: Culicidae) en la región oriental de Cuba. Rev Cubana Med Trop. 2014;66(1):143-7.
18. Pérez O, Rodríguez J, Bisset JA, Leyva M, Díaz M, Fuentes O. Manual de indicaciones técnicas para insectarios. La Habana: Editorial Ciencias Médicas; 2004.
19. Santamarina A. Cría masiva de Romanomermis culicivorax (Nematoda: Mermithidae) en las condiciones tropicales de Cuba. Rev Cubana Med Trop. 1996;48(1):26-33.
20. Rodríguez J, García I, Díaz M, García Ávila I, Sánchez J. Pathogenic effect of the parasitic nematodeStrelkovimermis spiculatus on larvae of the mosquito Culex quinquefasciatus under laboratory conditions in Cuba. Rev Cubana Med Trop. 2003;55(2):124-5.
21. Petersen JJ. Nematodes as biological control agents: Part I. Mermithidae. Advances in Parasitology. 1985;24:307-44.
22. Sanad M, Shamseldean M, Elgindi A, Gaugler R. Host penetration and emergence patterns of the mosquito-parasitic mermithids Romanomermis iyengari and Strelkovimermis spiculatus (Nematoda: Mermithidae). J Nematol. 2013;45(1):30-8.
23. Clements AN. The physiology of mosquitoes. Oxford: Pergamon Press; 1963.
24. García I, Menéndez Z, Hernández N, García GI, Anaya J, Companioni A, et al. Susceptibilidad de larvas deAedes albopictus (Diptera:Culicidae) a Strelkovimermis spiculatus (Nematoda: Mermithidae) en condiciones de laboratorio. Rev Cubana Med Trop. 2014;66(3):453-7.
25. Achinelly MF, Micieli MV. Host range of the parasite Strelkovimermis spiculatus (Nematoda: Mermithidae) in Argentina mosquitoes. J Vector Ecology. 2013;38(1):69-73.
26. Achinelly MF, Micieli MV. Optimizing laboratory production of Strelkovimermis spiculatus (Nematoda: Mermithidae) with a discussion of potential release strategies for mosquito biological control. Biol Control. 2011;57:31-6.
27. Santamarina A, Pérez R. Efecto patogénico del nematodo parásito Romanomermis iyengari (Nematoda: Mermithidae) en larvas del mosquito Aedes aegypti (Diptera: Culicidae) en condiciones de laboratorio en el Estado de Oaxaca, México. Rev Cubana Med Trop. 1998;50(1):8-11.
28. Di Battista C, Fischer S, Campos R. Prevalence of parasitism and adult survival time of Aedes albifasciatus (Diptera: Culicidae) parasitized by Strelkovimermis spiculatus (Nematoda: Mermithidae). J Vector Ecology. 2015;40(2):393-7.
29. Paily KP, Balaraman K. Susceptibility of ten species of mosquito larvae to the parasitic nematode Romanomermis iyengari and its development. Med Vet Entomol. 2000;14:426-9.
30. Paily K, Chandhiran K, Vanamail P, Pradeep Kumar N, Jambulingam, P. Efficacy of a mermithid nematode Romanomermis iyengari (Welch) (Nematoda: Mermithidae) in controlling tree hole-breeding mosquito Aedes albopictus (Skuse) (Diptera: Culicidae) in a rubber plantation area of Kerala, India. Parasitol Res. 2013;112:1299-304.
Recibido: 30 de agosto de 2018.
Aprobado: 13 de septiembre de 2018.
Zulema Menéndez Díaz. Instituto de Medicina Tropical "Pedro Kourí". Autopista Novia del Mediodía km 6½. La Habana, Cuba. Correo electrónico: zulema@ipk.sld.cu