Introducción
El virus del papiloma humano (VPH) es la causa principal de cáncer cervicouterino (CaCU) y, en general, de las neoplasias del tracto anogenital.1 El CaCU se ubica en el tercer lugar entre aquellos de mayor incidencia a escala mundial.2 Se han descrito hasta la fecha, cerca de 200 genotipos del VPH3 y aproximadamente entre 15 y 19 son considerados de “alto riesgo” de acuerdo con su potencial oncogénico y su asociación causal con el CaCU.4 Estos genotipos del VPH pertenecen al género Alphapapillomavirus, especies 7 y 9.2,4 Los VPH de una misma especie taxonómica se relacionan genéticamente y causan lesiones clínicamente similares.2,4 El VPH 16 es el genotipo de alto riesgo oncogénico perteneciente a la especie 9, más frecuentemente asociado a lesiones precancerosas y al CaCU. Sin embargo, el VPH 18 perteneciente a la especie 7, es menos frecuente que el VPH 16, pero es el segundo con respecto a su relación causal con el CaCU.4
De acuerdo con una revisión sistemática realizada por Picconi y Villa, hasta 2016 los pocos estudios realizados en América Latina destacan una frecuencia alta de los genotipos 16 y 18 en muestras de CaCU.5 En los últimos años esta panorámica ha variado, ya que en investigaciones efectuadas en el noreste de Brasil y el sur de México, se reportan prevalencias elevadas de otros tipos de VPH diferentes al 16 y 18, en particular los genotipos de la especie 9 como los VPH 33 y 58.6,7 Actualmente en América del Sur, el VPH 58 es uno de los genotipos de alto riesgo con mayor prevalencia en la región.2 Este tipo de VPH fue detectado en el centro y norte de Brasil, Argentina, Colombia y Ecuador.8,9,10
Con el fin de mejorar el diagnóstico y tamizaje del VPH, especialmente para los genotipos de alto riesgo oncogénico, se han desarrollado varios métodos de detección, entre ellos, los basados en la reacción en cadena de la polimerasa en tiempo real (PCR-TR), que además permiten la cuantificación del agente infeccioso.11Young-Jo Lee y otros desarrollaron un método de PCR-TR que detecta múltiples dianas en un solo canal de fluorescencia.12 Esto permite la detección de varios genotipos de VPH, especialmente de VPH-AR, en muestras de cepillados cervicales, mediante el sistema comercial denominado ANYPLEX II VPH28.13
En Ecuador no existen datos oficiales sobre la morbilidad y mortalidad por CaCU. Cada año se diagnostican 2094 nuevos casos de CaCU y se reportan 1026 decesos.14 Esta neoplasia constituye el tipo de cáncer más común en mujeres ecuatorianas con edades comprendidas entre 15 y 44 años, por lo que también ocupa el primer lugar dentro de las causas de mortalidad femenina, en el grupo de edad fértil.14
El perfil epidemiológico del VPH en el Ecuador y su asociación con el CaCU en mujeres ecuatorianas, permanece aún sin dilucidar. Frente a la escasa información epidemiológica del VPH en el Ecuador, el incremento de genotipos diferentes al VPH 1615,16 en la región, y tomando en cuenta la reciente introducción en el país de vacunas comerciales contra este agente viral, se propone un estudio epidemiológico y molecular para la tipificación del VPH. El objetivo es proporcionar información sobre la circulación de genotipos de VPH de alto riesgo oncogénico, fundamentalmente del género Alphapapillomavirus, especie 9, e infecciones múltiples, en mujeres con lesiones cervicouterinas y CaCU.
Métodos
Se realizó un estudio observacional de corte transversal entre agosto de 2013 y enero de 2015. El universo estuvo constituido por todas las pacientes atendidas en centros de salud ginecológicos del Ministerio de Salud Pública (MSP) y de la Sociedad de Lucha Contra el Cáncer (SOLCA), de las Provincias Costeras del Ecuador (Esmeraldas, Manabí, Guayas, Los Ríos, Santa Elena y El Oro).
Se incluyó a todas las mujeres con edades entre 30 y 60 años, sexualmente activas, con diagnóstico de lesiones intraepiteliales cervicales o CaCU, mediante citología vaginal, según el sistema de clasificación de Bethesda 2014.17. Se excluyó a las mujeres embarazadas, con antecedentes de tratamientos ginecológicos 3 meses antes de la toma de muestras y que tuvieron relaciones sexuales 48 h antes de la prueba o tacto genital previo.
Se estudiaron 300 mujeres entre 30 y 60 años, de las cuales se colectaron los cepillados cervicouterinos con el sistema Cobas®PCR Cell Collection Media (Roche Molecular Systems, Branchburg, NJ 08876, EE.UU.), siguiendo estrictamente las recomendaciones de los fabricantes. Las muestras se almacenaron a -20 °C por un tiempo máximo de 3 meses, hasta la extracción del ADN. Todas las personas incluidas en la investigación confirmaron su participación, a través de la firma del consentimiento informado, antes de la toma de muestra.
Detección y genotipaje del VPH: La extracción del ADN total se realizó a través del estuche comercial QIAamp DNA Mini Kit (QIAGEN, Alemania), siguiendo las recomendaciones del fabricante. La calidad del ADN se evaluó con el espectrofotómetro 54 NanoDrop 2000 (Thermo Scientific™, Madison WI, EE.UU.). Como control interno, para evaluar la calidad del ADN purificado, se amplificó un fragmento del gen de la betaglobina humana mediante PCR, con cebadores descritos previamente.18
Para la identificación genérica del VPH se normalizó una PCR convencional anidada empleando los cebadores universales MY09/1118 y los cebadores internos GP5/GP6.19 Como control negativo se utilizó agua destilada estéril, y como control positivo se empleó un plásmido recombinante de VPH 16 (VR 3240SDTM ATCC).
La tipificación de las muestras positivas a VPH, se realizó con el estuche comercial ANYPLEX II HPV28 (SEEGENE, Corea del Sur), siguiendo las instrucciones del fabricante. Este estuche comercial detecta 28 genotipos de VPH del género Alphapapillomavirus, entre ellos 19 genotipos de alto riesgo oncogénico (16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 69, 73, 82)a y 8 de bajo riesgo (6,11, 40, 42, 43, 44, 54, 61, 70).2,4
Los datos sociodemográficos y clínicoepidemiológicas fueron colectados y almacenados en una base de datos de Microsoft Excel versión 15.0. El análisis estadístico se realizó a dos niveles: descriptivo y analítico (bivariado). Para efectuarlo se empleó el paquete estadístico SPSS versión 21.0 (IBM, EE.UU.). La estadística descriptiva se basó en el cálculo de frecuencias absolutas y relativas. Para el análisis bivariado se utilizaron tablas de contingencia donde se evaluó el nivel de asociación mediante la prueba de X2 de Pearson. También se estimó la probabilidad de riesgo mediante la prueba de razón de prevalencias (RP) corregida con el estadígrafo de Mantel-Haenszel. Se consideraron significativos valores de RP > 1, p < 0,01, con un intervalo de confianza del 95 %.
El estudio se realizó de acuerdo con los principios de la Declaración de Helsinki20 sobre lo establecido por las normas éticas, institucionales y regionales de la medicina actual, la investigación clínica en humanos y las Normas de la Organización Mundial de la Salud establecidas por el Consejo de Organizaciones Internacionales de las Ciencias Médicas (OMS-CIOMS).21 La investigación contó con el aval del Comité de Bioética del Hospital Francisco Icaza Bustamante de la ciudad de Guayaquil, reconocido por la Autoridad Sanitaria Nacional del Ecuador.
Resultados
Frecuencia de infección y genotipos del virus del papiloma humano
De las 300 mujeres investigadas, se detectó el VPH en el 92,00 % (276/300). Se hallaron frecuencias altas de infección por genotipos individuales, principalmente los de alto riesgo oncogénico (VPH-AR), en comparación con los de bajo riesgo (VPH-BR). Los VPH-AR más frecuentes fueron los tipos 58 (18,17 %), 70 (8,64 %), 53 (8,34 %), 35 (7,45 %), 16 (7,37 %), 33 (6,55 %), 31 (5,58 %) y 18 (4,24 %). Entre los VPH-BR se encontraron más comúnmente los tipos 69 (4,84 %), 61 (4,17 %), 6 (2,61 %), 11 (2,16 %) y 42 (2,31 %) (Fig. 1).

Fig. 1 Frecuencia relativa de genotipos de VPH en mujeres de la región litoral del Ecuador en el periodo de agosto de 2013 a enero de 2015. Se destacan las elevadas frecuencias individuales de los genotipos de alto riesgo oncogénico (VPH-AR en azul claro), en comparación con los de bajo riesgo (VPH-BR en azul oscuro).
Infecciones múltiples por virus del papiloma humano
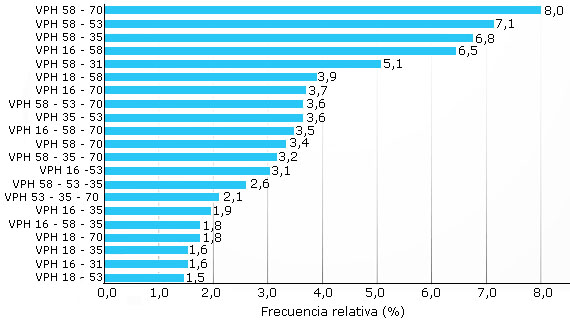
En el 91,66 % (253/276) de las muestras infectadas se detectaron infecciones múltiples. En una misma muestra, pudieron detectarse hasta 13 genotipos diferentes de VPH. La infección con tres genotipos en una misma muestra fue la forma más frecuente de infección múltiple (21,01 %; 58/276).
Las frecuencias altas del VPH 58 y VPH 16 se reflejaron en las combinaciones siguientes: VPH 58/VPH 70 (8,0 %); VPH 58/VPH 53 (7,1 %); VPH 58/VPH 35 (6,8 %); VPH 16/VPH 58 (6,5 %); VPH 58/VPH 31 (5,1 %); VPH 18/VPH 58 (3,9 %); VPH 16/VPH 70 (3,7 %); VPH 58/VPH 53/VPH 70 (3,6 %); VPH 35/VPH 53 (3,6 %); y VPH 16/VPH 58/VPH 70 (3,5 %) (Fig. 2).
Asociación entre la infección por virus del papiloma humano y las lesiones citológicas
En la tabla se detallan los resultados del análisis estadístico bivariado. El genotipo de bajo riesgo VPH 61 presentó asociación con las lesiones citológicas de bajo grado (LSIL) (RP = 3,5; p = 0,000). Así mismo, los genotipos de alto riesgo, VPH 33 (RP = 3,3; p = 0,000), VPH 56 (RP = 2,9; p = 0,001), VPH 59 (RP = 3,3; p = 0,007) y VPH 69 (RP = 2,4; p = 0,003) tuvieron una mayor probabilidad de ser detectados en este tipo de lesiones.
El VPH 16 tuvo una probabilidad mayor para identificarse en las lesiones de alto grado (HSIL) (RP = 2,5; p = 0,000) y también fue significativamente más frecuente en los casos con CaCU (RP = 5,9; p = 0,000). El genotipo 70 fue casi dos veces más frecuente (RP = 1,95; p = 0,005) en las HSIL.
Las combinaciones entre genotipos de VPH-AR se asociaron tanto con las HSIL como con los casos de CaCU. Las principales combinaciones asociadas estadísticamente con HSIL fueron VPH 16/VPH 58 (RP = 2,9; p = 0,000); VPH 16/VPH 70 (RP = 2,7; p = 0,002); VPH 58/VPH 70 (RP = 1,8; p = 0,017); y VPH 16/VPH 58/VPH 70 (RP = 2,6; p = 0,003). Las combinaciones VPH 16/VPH 31 se asociaron con el CaCU, con una probabilidad hasta cinco veces superior (RP = 5,2; p = 0,004); mientras que la combinación VPH 16/VPH 58/VPH 70 fue aproximadamente tres veces más frecuente en las mujeres con CaCU (RP = 3,5; p = 0,007).
Tabla Análisis bivariado de las combinaciones de VPH más frecuentes en mujeres de la región litoral del Ecuador en el periodo de agosto de 2013 a enero de 2015
| Variable | Tipo | LSIL | HSIL | CaCU | ||||
|---|---|---|---|---|---|---|---|---|
| RP | Valor de p | RP | Valor de p | RP | Valor de p | |||
| Genotipos de VPH | VPH 6 | 0,857 | 0,705 | 1,176 | 0,655 | 4,203 | 0,040 | |
| VPH 11 | 2,219 | 0,044 | 0,794 | 0,572 | 0,000 | 0,116 | ||
| VPH 16 | 1,181 | 0,566 | 2,483 | 0,000 | 5,893 | 0,000 | ||
| VPH 18 | 1,085 | 0,798 | 0,878 | 0,666 | 1,309 | 0,61 | ||
| VPH 31 | 1,181 | 0,566 | 0,732 | 0,263 | 2,295 | 0,065 | ||
| VPH 33 | 3,319 | 0,000 | 0,433 | 0,002 | 0,368 | 0,114 | ||
| VPH 35 | 1,376 | 0,223 | 0,864 | 0,558 | 0,309 | 0,063 | ||
| VPH 39 | 1,844 | 0,307 | 0,762 | 0,663 | 1,182 | 0,876 | ||
| VPH 40 | 0,000 | 0,273 | 0,768 | 0,83 | 6,705 | 0,126 | ||
| VPH 42 | 1,679 | 0,186 | 1,125 | 0,759 | 1,441 | 0,574 | ||
| VPH 43 | 1,48 | 0,396 | 0,702 | 0,454 | 0,597 | 0,623 | ||
| VPH 44 | 2,161 | 0,213 | 1,295 | 0,675 | 0,000 | 0,348 | ||
| VPH 45 | 2,551 | 0,353 | 0,509 | 0,561 | 0,000 | 0,575 | ||
| VPH 51 | 2,175 | 0,097 | 0,365 | 0,077 | 1,476 | 0,617 | ||
| VPH 52 | 1,29 | 0,533 | 1,613 | 0,214 | 0,915 | 0,908 | ||
| VPH 53 | 1,502 | 0,111 | 0,743 | 0,222 | 1,471 | 0,379 | ||
| VPH 54 | 0,747 | 0,663 | 0,674 | 0,519 | 1,08 | 0,943 | ||
| VPH 56 | 2,856 | 0,001 | 0,582 | 0,124 | 0,911 | 0,884 | ||
| VPH 58 | 0,82 | 0,487 | 1,441 | 0,187 | 3,484 | 0,097 | ||
| VPH 59 | 3,327 | 0,007 | 0,225 | 0,018 | 1,319 | 0,721 | ||
| VPH 61 | 3,499 | 0,000 | 0,504 | 0,036 | 0,2 | 0,119 | ||
| VPH 63 | 0,000 | 0,112 | 0,000 | 0,42 | 0,000 | 0,78 | ||
| VPH 66 | 0,272 | 0,219 | 1,027 | 0,967 | 1,455 | 0,728 | ||
| VPH 68 | 1,173 | 0,755 | 1,128 | 0,802 | 1,569 | 0,564 | ||
| VPH 69 | 2,383 | 0,003 | 0,488 | 0,021 | 0,361 | 0,176 | ||
| VPH 70 | 0,564 | 0,034 | 1,952 | 0,005 | 1,995 | 0,112 | ||
| VPH 73 | 2,111 | 0,129 | 0,179 | 0,024 | 1,673 | 0,36 | ||
| VPH 82 | 0,498 | 0,527 | 3,148 | 0,189 | 2,655 | 0,382 | ||
| Infecciones múltiples y combinaciones de infecciones por VPH | VPH 58/VPH 70 | 0,679 | 0,155 | 1,776 | 0,017 | 1,919 | 0,134 | |
| VPH 16/VPH 70 | 0,297 | 0,008 | 2,719 | 0,002 | 4,014 | 0,002 | ||
| VPH 16/VPH 58 | 0,249 | 0,000 | 2,887 | 0,000 | 4,861 | 0,000 | ||
| VPH 16/VPH 31 | 0,425 | 0,181 | 1,586 | 0,319 | 5,222 | 0,004 | ||
| VPH 16/VPH 58/VPH 70 | 0,324 | 0,013 | 2,632 | 0,003 | 3,528 | 0,007 | ||
| Infección simple | 1,309 | 0,934 | 0,612 | 0,291 | 0,000 | 0,156 | ||
| Infección múltiple | 1,412 | 0,368 | 2,143 | 0,039 | 0,000 | 0,047 | ||
| Infección doble | 1,42 | 0,327 | 1,16 | 0,666 | 0,301 | 0,246 | ||
| Infección triple | 0,612 | 0,149 | 2,019 | 0,014 | 1,17 | 0,766 | ||
| Infección cuádruple | 1,326 | 0,262 | 0,831 | 0,42 | 2,527 | 0,058 | ||
Leyenda: VPH: virus del papiloma humano; RP: razón de prevalencia; ASC-US: células escamosas atípicas de significado indeterminado (del inglés, atypical squamous cells of undetermined significance); LSIL: lesión escamosa intraepitelial de bajo grado (del inglés, low grade squamous intraepithelial lesion); HSIL: lesión escamosa intraepitelial de alto grado (HSIL del inglés, high grade squamous intraepithelial lesion); CaCU: cáncer cervicouterino.
Fuente: Resultados de investigación.
Discusión
La infección persistente por VPH-AR se considera como la condición fundamental para el desarrollo de las lesiones precursoras y el CaCU.4 El largo intervalo entre la infección persistente por VPH-AR y el desarrollo de la carcinogénesis cervical explicaría el por qué las lesiones de alto grado y el CaCU son más frecuentes en mujeres mayores de 30 años.22 La prevalencia de la infección por el VPH en el sexo femenino es diversa según las características de la población estudiada y la técnica empleada. En los resultados obtenidos existe un predominio de lesiones HSIL, y la frecuencia de infección por VPH se incrementa con el grado de la lesión. Estos resultados coinciden con la literatura revisada, donde se reporta que en más del 90 % de las mujeres mayores de 30 años, con lesiones cervicales de alto grado y CaCU, se detecta VPH-AR.23,24
En los primeros estudios de epidemiología molecular del VPH, la detección de pocos genotipos o de infecciones simples era el resultado más común.25 Con el desarrollo de nuevos métodos de detección molecular para el genotipado de amplio espectro, es muy frecuente la presencia de infecciones múltiples, especialmente en las mujeres más jóvenes, en el pico de su actividad sexual.26 Sin embargo, el significado biológico y clínico de las coinfecciones con varios VPH-AR en mujeres mayores de 30 años, con lesiones de alto grado y CaCU es actualmente un tema en estudio. En los resultados presentados, la combinación de genotipos en las infecciones múltiples fluctuó desde dos hasta 13 tipos, aunque la coinfección con tres genotipos fue la más frecuente. Los más detectados fueron VPH 58, 53, 70, 16 y 35, tanto en infecciones simples como múltiples. A nivel mundial los genotipos 16 y 18 son los más frecuentemente asociados a la presencia de lesiones precursoras y CaCU.2,4 Sin embargo, en un metaanálisis publicado en 2014, sobre la prevalencia global del VPH, el tipo 18 tuvo una frecuencia relativamente baja, y predominaron otros genotipos como el VPH 52 y VPH 58 (especie 9), fundamentalmente en Asia, mientras que en América Latina, se reporta la presencia significativa del VPH 58.27
En Ecuador, los hallazgos se muestran contradictorios. En una investigación previa realizada recientemente por nuestro grupo de trabajo, se identificó una alta prevalencia del VPH 16 y VPH 58 en mujeres de la región costera del Ecuador.15 Estos hallazgos concuerdan con los obtenidos en estudios independientes realizados tanto en mujeres de la ciudad de Quito (región sierra norte del Ecuador)10 como de la ciudad de Cuenca (región sierra sur del Ecuador).28 Sin embargo, no concuerdan con estudios anteriores al año 2010.29
Los métodos de genotipado amplio pueden detectar varios genotipos en una muestra clínica, lo cual dificulta conocer la contribución de los genotipos individuales a los diferentes estadios de las lesiones precursoras del CaCU. Algunos investigadores han abordado esta dificultad, atribuyendo la contribución de cada genotipo o combinaciones de genotipos específicos al desarrollo de las lesiones de forma jerárquica. Wentzensen y otros establecieron una nomenclatura para determinadas combinaciones de genotipos que se presentan coinfectando y que pueden contribuir de manera jerárquica, aunque no sinérgica, al desarrollo del CaCU.30 Por ejemplo, definieron que en coinfecciones donde están presentes los VPH 16 y 18, existe un riesgo superior para desarrollar CaCU: esta combinación ocuparía el primer nivel jerárquico. De la misma forma, coinfecciones con VPH 31; 33; 35 y 39 ocuparían el segundo nivel jerárquico con respecto al riesgo para desarrollar CaCU.30
Por su parte, de Brot y otros, en el 2017 plantearon, según un metaanálisis realizado a partir de una investigación mundial en 15 áreas geográficas diferentes, que la prevalencia de infecciones múltiples por VPH pudo alcanzar hasta un 46 %. También describen la asociación entre dichas infecciones múltiples y la presencia de lesiones intraepiteliales cervicales de alto grado y CaCU. Esas coinfecciones se pudieron relacionar con una probabilidad cinco veces mayor para desarrollar fallo a las radioterapias, en mujeres con CaCU. El riesgo incrementado para desarrollar CaCU y lesiones precursoras en mujeres con infecciones múltiples por VPH, según estos autores, pudiera compararse con la suma de los riesgos individuales adjudicados a cada VPH-AR. Sin embargo, no existieron evidencias de interacciones sinérgicas entre estos.31
En cuanto a combinaciones de genotipos identificadas en la presente investigación, la más común fue la mezcla de los VPH 16/VPH 58/VPH 70, en lesiones de alto grado y CaCU. Como se mencionó, en Asia, la presencia del VPH 58 es frecuente, por lo que es común encontrarlo coinfectando con el VPH 16.27 En el caso de América del Sur y Ecuador, al no existir información concluyente sobre esta asociación, este reporte sería uno de los primeros en comunicar sobre la presencia de esta combinación en lesiones cervicales precancerosas y cancerosas en mujeres de la región. Los datos muestran que la combinación de los genotipos de VPH de alto riesgo de la especie 9 de la familia Alphapapillomavirus (VPH 16 y VPH 58) presenta un nivel de asociación significativa con la aparición de lesiones cervicales precancerosas y cancerosas.
El mecanismo, desde el punto de vista biológico, que desempeñan las infecciones múltiples en el desarrollo del CaCU, se explica desde diferentes aristas. Según Salazar y otros, algunas investigaciones concluyen que las infecciones múltiples con VPH-AR actúan sinérgicamente en la evolución de la carcinogénesis cervical, pero otras muestran que las coinfecciones no tienen ningún efecto sinérgico o aditivo en el desarrollo del CaCU o en el incremento del riesgo de padecer lesiones cervicales de alto grado, cuando se comparan con infecciones simples.32 Los hallazgos descritos por Sobota y otros, publicados en 2018, son los más concluyentes hasta el momento, al demostrar mediante diferentes estudios de cohorte, que pueden existir interacciones competitivas o cooperativas entre diferentes genotipos de VPH-AR en las coinfecciones. Particularmente, se plantea que las coinfecciones con genotipos de VPH-AR de la misma especie taxonómica pueden reducir la progresión de las lesiones cervicales de alto grado, mientras que la coinfección con genotipos de diferentes especies, no confiere protección a la progresión tumoral, en lesiones de alto grado. Según los autores, el curso de estos eventos está dado por una respuesta inmunitaria diferente en cada caso.33 De acuerdo con esta última hipótesis, las combinaciones de genotipos donde aparecen virus de las especies 7 y 9, encontradas en el presente estudio, pudieran constituir un factor de riesgo para el desarrollo del CaCU.
Existen investigaciones básicas que demuestran, desde el punto vista de la biología molecular y celular, que las implicaciones biológicas de las infecciones múltiples están dadas por varios factores. La integración de los genomas de VPH-AR y no así los de bajo riesgo, en el genoma del hospedero, la interacción de las oncoproteínas E6 y E7 de los VPH-AR con las proteínas supresoras de tumores, la respuesta inmunitaria y los mecanismos de evasión de estos virus son los elementos cruciales en el mecanismo de la carcinogénesis cervical.31 Por lo tanto, las coinfecciones con varios VPH-AR pudieran potenciar o amplificar fenómenos como la integración del ADN viral, la expresión de oncoproteínas y los diferentes mecanismos de evasión de los VPH-AR a la respuesta inmunitaria.
Conclusiones
A pesar de que la repercusión de las infecciones múltiples con varios VPH-AR en la carcinogénesis cervical aún está en discusión. Los resultados demuestran que la combinación VPH 16/VPH 58 del género Alphapapillomavirus, especie 9, podría ser un factor clave en la aparición de lesiones premalignas y su progresión hacia el CaCU. Esta información aporta elementos para evaluar el posible impacto de las vacunas contra VPH en la población femenina del Ecuador.