Introducción
La pandemia por el coronavirus tipo 2 causante del síndrome respiratorio agudo severo (SARS-CoV-2) ha ocasionado más de 220 millones de casos y 4.5 millones de muertes, representando un desafío para los sistemas e instituciones de salud a nivel mundial.1) El desarrollo de vacunas y la oportuna distribución masiva permite el control de la enfermedad por coronavirus 2019 (COVID-19).2) Las vacunas contra la infección del SARS-CoV-2 utilizan tecnología de ARNm, vectores de adenovirus y virus inactivos, entre otros.3) Los efectos adversos de las vacunas son leves y de corta duración, entre ellos la fiebre, astenia, adinamia, cefalea y mialgias.3,4) Sin embargo, se reportan casos de una respuesta inflamatoria sistémica y miocarditis secundario a la exposición de vacunas independiente de la plataforma.4) Entre las vacunas disponibles, la COVID-19 de adenovirus de serotipo 26 (Ad26.COV2.S) que codifica una proteína espiga de SARS-CoV-2, presenta 96 % de títulos de anticuerpos neutralizantes al día 57 posterior a la dosis de la vacuna, cuyos efectos adversos más comunes fueron la fatiga, cefalea, mialgia, dolor en el lugar de la inyección y fiebre.5
El síndrome inflamatorio multisistémico (MIS) comprende un estado febril, hiperinflamatorio y falla orgánica múltiple potencialmente mortal asociado a la infección por SARS-CoV-2 o después de la inmunización, en el cual se debe descartar otras causas infecciosas, inmunológica o neoplásica compatibles con el estado proinflamatorio.6 La seguridad e inmunogenicidad de las vacunas contra la COVID-19 se han estudiado por medio de ensayos clínicos en humanos.6,7,8) El MIS genera un compromiso multiorgánico posterior a las 2 a 6 semanas de la vacunación contra la infección por SARS-COV-2, cuyos síntomas pueden ser el dolor abdominal, vómitos, diarrea, manifestaciones cutáneas o mucocutáneas y/o hipotensión, con requerimiento de vigilancia clínica e incluso soporte vasopresor o ventilatorio.6,7,8 El tratamiento de la enfermedad se enfoca en dosis altas corticosteroides parenterales, representando un reto médico para el personal de salud, y siendo necesaria la descripción de la enfermedad, comprender la etiopatogenia y generar nuevos enfoques terapéuticos.6,7,8 Sin embargo, es limitada la evidencia que asocie la inmunización contra este coronavirus con el desarrollo de un estado inflamatorio sistémico.7 El objetivo del artículo es describir los datos clínicos y de laboratorio de una mujer de 20 años de edad con diagnóstico de MIS posterior a la inmunización con la vacuna Ad26.COV2.S.
Caso clínico
Paciente femenina de 20 años, estudiante y sin antecedentes patológicos, quien refiere cuadro clínico de aproximadamente 20 días de evolución consistente en dolor lumbar bilateral sin mejoría con el manejo analgésico, el cual empeora 10 días después debido al inicio de mialgias, artralgias, diarrea sin moco ni sangre y fiebre cuantificada, motivo por el cual consulta al servicio de urgencias. La paciente niega síntomas respiratorios y urinarios sugestivos de infección. El único dato de importancia o nexo epidemiológico que relaciono con el inicio de los síntomas fue la administración de la primera dosis de la vacuna Janssen (Ad26.CoV2.S) para SARS-CoV-2 un mes antes del inicio del dolor lumbar. Al examen clínico de ingreso se encuentra fiebre cuantificada en 39 °C, lengua en frambuesa, puño percusión bilateral negativa y dolor articular en las cuatro extremidades a la movilización pasiva y activa con evidencia rash color salmón evanescente a la digitopresión (Fig - 1).
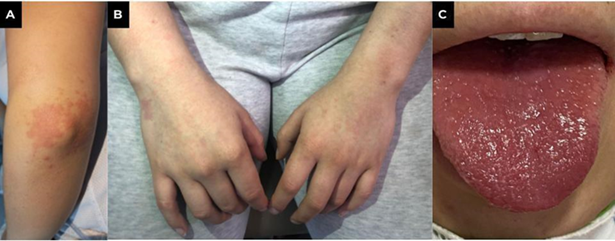
Fig. 1 A,B; Rash color salmón evanescente a la digitopresión en codo, antebrazos y manos ipsilateral. C, lengua en frambuesa.
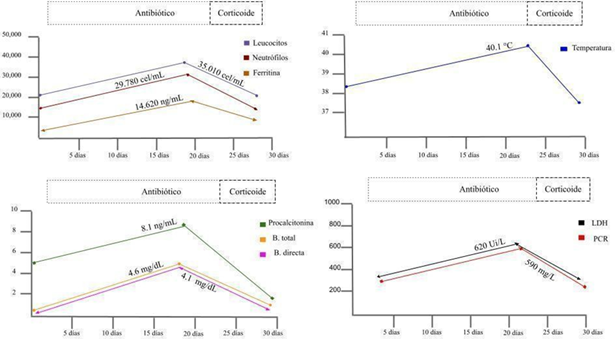
Los exámenes de laboratorio de ingreso presentan elevación de leucocitos, neutrófilos y plaquetas, junto a reactantes de fase aguda elevados (tabla 1). Se inicia tratamiento antibiótico con cefepime a 1 gramo cada 8 horas por sospecha de pielonefritis aguda, sin embargo, la ecografía renal no muestra signos de pielonefritis y el urocultivo fue negativo a las 72 horas de incubación. La paciente presenta deterioro clínico dado por disnea, dolor abdominal difuso y edema de miembros inferiores con persistencia de respuesta inflamatoria sistémica.
Tabla 1 Exámenes de laboratorio durante hospitalización
| Leucocitos: 24.810 cel/Ml (7.000-11.000 cel/Ml) | Proteína c reactiva 560 mg/L (negativa) |
| Neutrófilos: 21.900 cel/Ml (2.000-7.500 cel/Ml ) | Deshidrogenasa láctica: 576 Ui/L (105 a 333 Ui/L) |
| Linfocitos: 870 cel/Ml (1.500-4.000 cel/Ml ) | Dímero D: 4.950 µ/L (< 0.5 µ/L) |
| Hemoglobina: 11.5 g/dL (12-16 gr/dL) | Ferritina: 9.029 ng/ml (12 a 150 ng/mL) |
| Plaquetas: 540.000 cel/Ml (150.000-400.000 cel/Ml ) | Coombs directo: positivo (negativo) |
| Creatinina: 0.7 mg/dL (0.7 a 1.3 mg/dL) | Complemento 3: 30.1 mg/dL (88 a 201 mg/dL) |
| Nitrógeno ureico 11.4 mg/dL (6 a 20 mg/dL) | Complemento 4: 5.9 mg/dL (15 a 45 mg/dL) |
| Bilirrubina total: 0.9 mg/dL (0.1 a 1.2 mg/dL) | ANAs, FR, ANCA y ENAs: negativo (negativo) |
| Alanino aminotransferasa: 31 Ui/L (4 a 36 U/L) | Elisa VIH: negativo (negativo) |
| Aspartato aminotransferasa: 62 Ui/L (8 a 33 U/L) | VDRL: negativo (negativo) |
* ANA, Anticuerpo antinuclear; FR, Factor reumatoideo; ANCA, anticuerpo anticitoplasma del neutrófilo; ENAS, anticuerpos nucleares extraíbles; VIH, virus de la inmunodeficiencia adquirida; VDRL, Venereal Disease Research Laboratory.
Al tratamiento antibiótico instaurado al ingreso se agregó vancomicina 500 mg cada 12 horas dada la sospecha de un proceso infeccioso compatible con fiebre escarlatina, endocarditis infecciosa o infección piógena diseminada asociado a una infección faríngea. Pese a ello, los hemocultivos son negativos a las 72 horas y el ecocardiograma transtorácico negativo para vegetaciones, se suspendiendo el tratamiento antibiótico. La presencia de hiperferritinemia, prueba de coombs directa positiva, dímero D elevado y complementos consumidos (Tabla 1), hacen sospechar un proceso de origen autoinflamatorio y/o hematolinfoide. Se realiza aspirado de médula ósea el cual fue normal y tomografía por emisión de positrones negativa para hipercaptación metabólica compatible con proceso neoplásico.
El deterioro clínico persiste al tercer día desde el ingreso dado por signos de dificultad respiratoria y edema generalizado, se traslada a la unidad de cuidados intensivos e inicia tratamiento con dosis de un gramo de metilprednisolona al día durante 3 días. Se realiza una prueba de reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) positiva para infección por SARS, por lo cual se realiza un diagnóstico de MIS. Al finalizar el manejo inmunomodulador la paciente presenta franca mejoría del cuadro clínico con modulación de la leucocitosis y reactantes de fase aguda (Fig. 2). Se da egreso de la unidad de cuidados intensivos dada la resolución total de los signos y síntomas clínicos asociados, y una semana después la paciente sale del hospital con tratamiento con corticosteroides vía oral a dosis baja y seguimiento por reumatología.
La paciente acepta el uso de la información clínica de manera confidencial por medio de la firma del consentimiento informado a los investigadores.
Discusión
Las definiciones de casos originales de síndrome inflamatorio multisistémico asociada a la infección por SARS-CoV-2 están ampliamente descritas en población pediátrica como en adultos.7) La definición de caso de MIS del Centro para el Control y la Prevención de Enfermedades (CDC, por sus siglas en inglés) incluye diversos criterios clínicos y paraclínicos (tabla 2).8) En el caso descrito se muestran manifestaciones clínicas concordantes con los criterios establecidos por la CDC: fiebre >38 C°, elevación de reactantes de fase aguda, hospitalización con requerimiento de vigilancia clínica estricta y ausencia de un diagnóstico infeccioso, inmunológico u oncológica asociado a la infección por SARS-CoV-2, la cual se diagnosticó con pruebas moleculares.
El desarrollo de varios tipos de vacunas contra la COVID-19 genero la posibilidad de una respuesta inflamatoria descontrolada en pacientes con o sin exposición previa a la infección por SARS-CoV-2, mediada por complejo del inflamasoma, mimetismo molecular y sobreproducción de citocinas proinflamatorias como el TNF-alfa, IL-1, IL-6, IL-18 e interferón-gamma.7,9,10) Se ha reconocido también como vías fisiopatológicas de la MIS el aumento en la oxidación de ácidos grasos, producción mitocondrial y especies reactivas de oxígeno con actividad bactericida de los macrófagos a través de receptores tipo Toll-like 3, 7, 8 y 9.10,11) Cabe resaltar la fisiopatología del MIS puede verse potenciada o atenuada por la edad, gravedad de la infección previa, comorbilidades, entre otras condiciones previo a la administración de la vacuna.7,9,10
Chai y colaboradores, describieron el caso clínico de una mujer de 17 años con MIS posterior a la vacunación con Pfizer-BioNTech, los sintomas que presento fue fiebre, vómito, mialgias y dolor torácico 5 días posterior a la segunda dosis de la vacuna, síntomas que la hicieron consultar al servicio de urgencias.12 Durante la hospitalización presentó un compromiso multiorgánico con órgano blanco el corazón, mostró una fracción de eyección del ventrículo izquierdo reducida y miocarditis. Requirió soporte vasopresor, oxigenoterapia e inmunoglobulina intravenosa. En el descrito en este artículo, se evidencia un cuadro clínico inicial similar al descrito por Chai, con síntomas compatibles con una infección viral aguda, cuyo curso empeoró requiriendo manejo hospitalario y soporte médico avanzado. La inmunoglobulina no se planteó como tratamiento en el caso presentado debido a la mejora clínica con el corticosteroide intravenoso.
Tabla 2 Definición de caso para MIS según el Centro para el Control y la Prevención de Enfermedades.8
| Individuo menor de 21 años que presente: Fiebre > 38,0 °C durante ≥24 hrs o informe de fiebre subjetiva que dura ≥24 horas Exámenes de laboratorio de inflamación sistémica PCR, VSG , fibrinógeno, procalcitonina, dímero D, ferritina, LDH y neutrófilos elevados Linfocitos y albúmina disminuida |
| Enfermedad clínicamente grave que requiere hospitalización, con compromiso multisistémico (>2) de órganos (cardiaco, renal, respiratorio, hematológico, gastrointestinal, dermatológico o neurológico). |
| Y |
| Ausencia de diagnósticos plausibles alternativos. |
| Y |
| Positivo para infección actual o reciente por SARS-CoV-2 por RT-PCR, serología o prueba de antígeno; o exposición a un caso sospechoso o confirmado de COVID-19 dentro de las 4 semanas anteriores al inicio de los síntomas. |
* PCR, proteína c reactiva, VSG, volumen de sedimentación globular; LDH, lactato deshidrogenasa; RT-PCR, reacción en cadena de la polimerasa con transcriptasa inversa.
Datos de un estudio de farmacovigilancia basados en información del Sistema de Notificación de Eventos Adversos de Vacunas, mostraron un total 21 casos de MIS-C después de la vacunación con una o dos dosis contra la COVID-19, incluyendo Pfizer-BioNTech (BNT162b2), moderna (mRNA-1273) y Janssen (Ad26.COV2.S).13) Se estima una tasa general de notificación de MIS-C después de la vacunación de un caso por millón de personas que reciben una o más dosis. Salzman y otros, describen dos casos de MIS en población pediátrica y un caso de MIS en adultos posterior a recibir la vacuna Pfizer-BioNTech (BNT162b2). Los pacientes pediátricos tenían antecedente de asma, los síntomas comunes incluyen fiebre, diarrea y emesis , presentan elevación de la ferritina y el tiempo transcurrido desde la vacunación hasta el inicio de los síntomas fueron 12 y 19 días.14) Los autores mencionan que la infección reciente por SARS-CoV-2 es frecuente en pacientes con una respuesta inflamatoria descontrolada posterior a la vacunación; si bien, la causa exacta del MIS relacionada a la vacunación aún no es clara, la etiopatogenia podría estar relacionada con la COVID-19 y un aumento de la viscosidad de la sangre, potenciada por la vacuna COVID-19.15
Alfayadh y otros, evalúan el riesgo de episodios repetitivos de artritis posterior a la vacunación contra la COVID-19 en 138 pacientes con diagnóstico de artritis idiopática juvenil. La mediana de edad fue de 3,2 años (RIC: 1,1-6,0) y el 60 % de la población estaba en tratamiento con terapia inmunosupresora. Tres meses posteriores a la inmunización, el riesgo relativo de que se produjeran brotes de artritis fue de 0,59 (IC del 95 %: 0,39-0,89).16) Si bien, Alfayadh no reportan un aumento en el riesgo de desarrollar artralgias y/o artritis, puede existir una fuerte asociación entre la vacunación y una respuesta inflamatoria descontrolada debido a la predisposición genética como mutaciones sin sentido homoalélica en el gen Laccase Domain Containing 1 (LACC1, por sus siglas en inglés), mimetismo molecular y proceso inflamatorio crónico en población con enfermedades inflamatorias.10,17,18,19
El síndrome autoinmune/inflamatorio inducido por adyuvante (ASIA, por sus siglas en inglés) comprende un grupo de enfermedades inmunomediadas desencadenadas por un estímulo adyuvante externo al organismo como fármacos, infecciones, prótesis de silicona o metales.20) Esta entidad puede caracterizarse por la presencia de manifestaciones clínicas poco específicas como artralgias, artritis y fiebre, además de asociarse a distintas entidades como la sarcoidosis, el síndrome de Sjögren e incluso el fenómeno posterior a la vacunación. Los criterios propuestos para el diagnóstico del ASIA requieren el antecedente de la aplicación del agente adyuvante, manifestaciones clínicas como artritis, factor reumatoide y anticuerpos anti-péptido cíclico citrulinado positivos y la demostración histológica de inflamación granulomatosa como reacción a cuerpo extraño.20) La presentación clínica descrita en el caso que se describe cumplía parcialmente con los criterios para el diagnóstico del síndrome de ASIA, sin embargo, los valores negativos de autoanticuerpos y la ausencia de disponibilidad para realizar una biopsia del tejido afectado, termina por excluir a esta enfermedad dentro de las posibilidades diagnósticas.10,11,20
La terapia con dosis altas de corticosteroides vía oral y/o pulsos son el tratamiento de primera línea, otros medicamentos inmunomoduladores incluyen colchicina, antiinflamatorios no esteroideos, hidroxicloroquina, plasmaféresis e inmunoglobulina.9,10,12,21) En pacientes con enfermedad grave refractaria, la terapia incluye alternativas como inhibidores del TNF, anticuerpo anti-receptor de IL-6 o antagonistas de la interleucina IL-1.9,22 Pese a ello, se requieren un mayor número de estudios clínicos que evalúen la respuesta de la terapia convencional y biológica en pacientes con un síndrome inflamatorio multisistémico posterior a la vacuna contra la COVID-19.17
Se concluye que el síndrome inflamatorio multisistémico en niños posterior a la vacunación es poco frecuente pero altamente mortal sin un tratamiento temprano y adecuado, sin embargo, se necesita comprender mejor la fisiopatología y diagnosticar tempranamente para un tratamiento oportuno. Las mialgias, artralgias, fiebre y rash son síntomas presentes en el síndrome inflamatorio multisistémico posterior a la vacunación. El tratamiento inmunomodulador con corticosteroides intravenosos, al descartar un proceso infeccioso activo, mejora el curso clínico de la enfermedad.