Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter vol.32 no.4 Ciudad de la Habana oct.-dic. 2016
ARTÍCULO ORIGINAL
Evaluación ecocardiográfica longitudinal en pacientes con leucemia linfoide aguda que recibieron antraciclinas durante la edad pediátrica
Longitudinal ecocardiographic assesment in patients with acute lymphoid leukemia that received anthracyclines during childhood
Dr. Alejandro González Otero I, Dr. Sergio Machín García I, Dr. Alberto Arencibia Núñez I, Dra. Janette Collazo Acosta I, Dr. Carlos Rivera Keeling I, Dr. Luis Bravo Perez de Ordaz II, Dra. Andrea Menéndez Veitía I, Dr. Jesús Serrano Mirabal I, Dra. Mildrey Gil Agramonte I, Dra. Rosa María Lam Díaz I, Dra. Eva Svarch I
I Instituto de Hematología e Inmunología. La Habana, Cuba.
II Cardiocentro Pediátrico "William Soler". La Habana, Cuba.
RESUMEN
Introducción: La cardiotoxicidad tardía causada por el tratamiento del cáncer puede ser un problema frecuente en los sobrevivientes por lo que se decidió realizar un estudio ecocardiográfico longitudinal de la función cardiovascular con el objetivo de detectar las alteraciones causadas por la administración de antraciclinas en pacientes que tuvieron una leucemia linfoide aguda en la edad pediátrica.
Métodos: se incluyeron todos los pacientes atendidos por esta leucemia en el Servicio de Pediatría del Instituto de Hematología e Inmunología ,desde abril de 2002 hasta febrero de 2015, que además debían tener al menos 2 evaluaciones ecocardiográficas posteriores a la conclusión del tratamiento. A todos se les realizó examen físico, se tomaron datos generales de las historias clínicas, se les calculó la dosis acumulativa de antraciclinas y el tiempo transcurrido hasta la realización de la evaluación. De los ecocardiogramas realizados se tomaron las medidas de aurícula izquierda, ventrículo derecho, fracción de eyección y fracción de acortamiento.
Resultados : predominaron los signos de cardiotoxicidad tardía subclínica con una media de 9 años después de suspendido el tratamiento y estuvieron afectados ambos sexos por igual. En el primer ecocardiograma realizado, tres años después de la suspensión, la mayor frecuencia de alteraciones estuvieron en las medidas de aurícula izquierda y ventrículo derecho. Los estudios se repitieron cada tres años y en el tercer estudio fue más frecuente la afectación de las fracciones de eyección y de acortamiento. Se encontró que había relación estadísticamente significativa entre el uso de mayores dosis de antraciclinas y las alteraciones ecocardiográficas.
Conclusiones: las afectaciones de la función cardiovascular fueron ligeras y aumentaron durante el seguimiento.
Palabras clave: leucemia linfoide aguda; antraciclinas; cardiotoxicidad; hallazgos ecocardigráficos.
ABSTRACT
Introduction Cancer therapy could cause frequent cardiac toxicity, so we decided to perform an echocardiographic longitudinal study of the late effects caused by anthracyclines administration in patients that were treated for acute lymphoid leukemia during childhood.
Methods All the patients admitted in the Pediatric Service of Institute of Hematology and Immunology, with acute lymphoid leukemia since april 2002 until february 2015 and that have at least two echocardiographic studies after finishing therapy. A complete physical exammination was performed to all of them and the cumulative dose of anthracyclines received was calculated and also time until evaluation. From the echocardiograms were taken the measurements of left auricle, right ventricle, ejection fraction and shortening fraction.
Results: the main findings were signs of late subclinical cardiotoxicity with a mean of 9 years after therapy completion and there were no sex predominance. In the first echocardiogram performed three years after stopping therapy there were more alterations in the measures of left auricle and right ventricle. The studies were repeated every three years and in the third one there were more alterations in ejection fraction and shortening fraction and there also were a statiscally significative relation between cumulative anthracyclines doses and echocardiographic findings.
Conclusions: There were found subclinical cardiac dysfunction that increases as time goes by.
Keywords: acute lymphoid leukemia; anthracyclines; cardiotoxicity; echocardiographic findings.
INTRODUCCIÓN
La leucemia linfoide aguda (LLA) es una neoplasia de células hematopoyéticas que se produce por transformación y proliferación clonal de progenitores inmaduros linfoides que desplazan a las células hematopoyéticas normales. Al momento del diagnóstico las células leucémicas pueden haber remplazado total o parcialmente el tejido hematopoyético normal de la médula ósea, incluso pueden haberse diseminado a varios sitios extramedulares1. La LLA representa el 75 % de las leucemias del niño, es la más común de las neoplasias infantiles y constituye el 23 % de los diagnósticos de cáncer en niños menores de 15 años 2.
En general, el pronóstico de los niños con hemopatías malignas ha mejorado considerablemente durante las últimas décadas; por tanto cada vez es mayor el número de sobrevivientes de cáncer que pueden tener los efectos tardíos de la quimioterapia antineoplásica. Dentro de las drogas más utilizadas en el tratamiento del cáncer infantil están las antraciclinas pero su empleo está limitado por su potencial cardiotóxico 3,4.
Las antraciclinas se comportan como agentes intercalantes que se insertan y unen a la doble hélice del ácido desoxirribonucleico (ADN), alterando su estructura, interfiriendo con la replicación, transcripción y reparación del ADN, por inhibición de la enzima topoisomerasa II. Pueden generar radicales libres hidroxilo que ocasionan la ruptura del ADN y peroxidación de los lípidos celulares. Las antraciclinas alteran las membranas celulares al unirse a fosfolípidos e interactuar con las vías de señalización intracelular, lo que contribuye al efecto antitumoral 5. La toxicidad cardiovascular mediada por antraciclinas es causada por diferentes mecanismos que no actúan de forma aislada, sino que están relacionados entre sí por diferentes vías. Entre ellos tenemos la acción del estrés oxidativo, la acumulación de metabolitos tóxicos, la alteración de la función mitocondrial y el depósito de hierro en los cardiomiocitos, entre otros.
Las antraciclinas son capaces de alterar la homeostasis del hierro, creando los complejos hierro-antraciclina, con la consecuente producción de radicales libres de oxígeno, que producen estrés oxidativo y dañan el miocardio. Al mismo tiempo el hierro es capaz de catalizar diversas reacciones moleculares que generan radicales hidroxilo, que van a contribuir al daño celular 6.
El metabolismo de las antraciclinas genera moléculas tóxicas a nivel del miocardio capaces de inhibir la bomba de intercambio de iones de calcio y sodio. De este modo también produce alteraciones en las mitocondrias, dadas por ruptura de su potencial de membrana y alteraciones en la cadena respiratoria, lo cual conduce a la pérdida de la integridad de la arquitectura mitocondrial, disminución en la capacidad de producir energía y dificultad para mantener las demandas metabólicas ya que casi todo el trifosfato de adenosina (ATP) utilizado por las células cardiacas se produce por la cadena transportadora de electrones 7.
Además, se invocan otros mecanismos como la peroxidación de lípidos de la membrana celular y la ocurrencia de una reacción inmunológica facilitada por el estrés oxidativo 6,7. Incluso, con el auge de la llamada medicina genómica se estudian polimorfismos genéticos que pueden estar relacionados con la cardiotoxicidad inducida por antraciclinas 8,9.
Los reportes de insuficiencia cardiaca congestiva en estos pacientes son poco frecuentes; sin embargo, la prevalencia de cardiotoxicidad tardía subclínica puede alcanzar hasta el 57 %. Una vez establecido, el daño miocárdico puede tener un curso progresivo y fatal 8,9. El daño que se produce se puede manifestar como taquicardia transitoria, arritmias y cambios electrocardiográficos inespecíficos 10,11. Hay reportes contradictorios sobre la susceptibilidad de los individuos que presentan trastornos agudos a padecer cardiotoxicidad crónica 12,13.
La cardiotoxicidad tardía puede ocurrir después de un año de finalizado el tratamiento y se correlaciona con la dosis acumulativa de antraciclinas. Las manifestaciones clínicas predominantes son las de la insuficiencia cardiaca congestiva, pero se puede acompañar además de arritmias y derrame pericárdico 14-16.
La cardiotoxicidad se puede medir en grados que van desde 0 que corresponde a un nivel subclínico, solamente detectado por estudios específicos, hasta el grado 5 que corresponde al nivel letal 16,17. Para la determinación del daño cardiovascular se utiliza un estudio imagenológico eficaz que es el ecocardiograma, el cual permite evaluar la función ventricular y diagnosticar cualquier anomalía previo a que se produzcan síntomas. Se han utilizado otras técnicas como la biopsia subendocárdica que es muy invasiva y no aporta mucha más información.
A partir de los 6 meses de vida, la capacidad proliferativa de los cardiomiocitos es muy pobre; por tanto la pérdida de fibras miocárdicas se compensa con la hipertrofia de las células restantes. Sin embargo, las demandas que debe satisfacer el músculo cardiaco a medida que el niño se desarrolla, pueden llegar a ser superiores a su capacidad funcional. Mientras los adultos que reciben antraciclinas desarrollan una miocardiopatía dilatada; los niños tienden a presentar una combinación de enfermedad dilatada y restrictiva8,17. El envejecimiento de los sobrevivientes aumenta la prevalencia y la gravedad de estas alteraciones.
Los estudios efectuados en nuestro país sobre la cardiotoxicidad por antraciclinas se han realizado de forma transversal; lo cual puede subestimar el verdadero impacto del problema. En este trabajo se realizó una evaluación longitudinal de los enfermos que recibieron estos medicamentos para determinar las dosis acumulativas, la importancia de la edad y de otras condiciones asociadas y el período de latencia en la aparición de las alteraciones
MÉTODOS
Se realizó un estudio longitudinal descriptivo, que incluyó los pacientes con LLA atendidos en el servicio de Pediatría del Instituto de Hematología e Inmunología (IHI), en el período comprendido entre abril de 2002 y febrero de 2015, que habían recibido tratamiento con antraciclinas durante la edad pediátrica. De un total de 170 pacientes, 100 fueron excluidos por tener realizado solamente un ecocardiograma. Quedaron 70 que tenían al menos dos estudios, 33 con tres o más realizados cada tres años, de acuerdo al tiempo de seguimiento Además se pidió la aceptación por el paciente o el padre/tutor de las condiciones de la investigación, mediante consentimiento informado para realizar los estudios evolutivos y usar los datos generados del seguimiento.
A cada paciente incluido se le realizó un interrogatorio y examen físico, orientado a determinar la presencia de síntomas o signos de disfunción cardiovascular. Se revisó la historia clínica para obtener la información referente a las características del paciente al comienzo de la enfermedad hematológica, los estudios ecocardiográficos previos al tratamiento, si los hubiese, la dosis de antraciclina administrada de acuerdo a la superficie corporal y la presencia de cardiotoxicidad aguda inducida por estos medicamentos.
Para el cálculo de la dosis acumulativa de antraciclinas se sumaron las dosis recibidas en mg/m2y, se expresaron en base a la daunorrubicina. Para convertir las dosis de doxorrubicina se utilizó el factor de conversión (x 0.83) propuesto en estudios previos 18.
La ecocardiografía con doppler se realizó en el Cardiocentro Pediátrico "William Soler", siempre por el mismo examinador. A todos los pacientes se les realizó un estudio al suspender el tratamiento, alrededor de los dos años después del diagnóstico y después se indicaron cada tres años. El seguimiento más prolongado fue de 12 años en tres pacientes. Se utilizó un equipo SIEMENS con transductores apropiados para la edad. Después de un período de reposo de 10 min se visualizaron las estructuras cardiacas en modo M, a través de la ventana paraesternal y se realizaron las mediciones correspondientes mediante los programas incorporados en el equipo, de acuerdo a las recomendaciones de la Sociedad Americana de Ecocardiografía 19-21.
Se determinó la fracción de eyección (FEVI) y de acortamiento (FAVI) del ventrículo izquierdo, así como las mediciones de aurícula izquierda (AI) y ventrículo derecho (VD).Para la interpretación de los resultados de las mediciones de las cavidades los pacientes debían tener una edad superior a los 15 años pues no tuvimos posibilidades de emplear los z scores en los de menor edad
Los grupos de riesgo de toxicidad por antraciclinas se establecieron de acuerdo a las normas de seguimiento a largo plazo de sobrevivientes de cáncer, del Children Oncology Group (COG) 22-24. Esta escala utiliza tres variables de reconocida importancia: edad, administración de radioterapia torácica y dosis acumulativa de antraciclinas para dividir a los individuos en tres grupos de riesgo. La evaluación ecocardiográfica se debe realizar con una periodicidad anual en los pacientes de riesgo alto; cada dos años en los de riesgo intermedio y cada cinco años en los de riesgo bajo. La clasificación de la cardiotoxicidad se realizó según las definiciones de eventos adversos del Instituto Nacional de Cáncer de los EE UU 24.
Los datos obtenidos, fueron almacenados en una base de datos confeccionada con el programa SPSS v.12.0.0, a partir de la cual se procesaron. Las variables cuantitativas se procesaron utilizando como medida de resumen la media y desviación estándar; para su validación estadística se aplicó la t de Student. Las variables cualitativas se resumieron a partir de sus frecuencias absolutas y relativas. El análisis se realizó mediante la prueba de Chi cuadrado, así como la regresión logística incondicional. El nivel de confianza se estableció en 95 %, para una significación estadística p ≤ 0,05. Se trazaron curvas de probabilidad de afectación de la FEVI y la FAVI.
RESULTADOS
De los 70 pacientes con LLA incluidos, 28 fueron del sexo femenino y 42 del masculino. El rango de edades, en el momento del diagnóstico, osciló entre 2 y 17 años. En cuanto a la distribución por edad y sexo, en el momento del diagnóstico, 48 pacientes tenían menos de 10 años; de ellos, 22 eran del sexo femenino. En los mayores de 10 años hubo 22 enfermos, 16 del sexo masculino.
Ningún paciente tuvo alteraciones en el examen físico cardiovascular. Del total de pacientes, 58 tenía menos de 15 años al realizarse el primer ecocardiograma, por lo que el comportamiento de las medidas de AI y VD no fueron valoradas.
La distribución en grupos de riesgo de acuerdo a la dosis de antraciclinas recibida se muestra en la tabla 1. Todos los pacientes de riesgo alto fueron mayores de 5 años y ninguno recibió irradiación sobre tórax. Las antraciclinas utilizadas fueron daunorubicina y doxorubicina y en ningún paciente se superaron los 400 mg/m2.
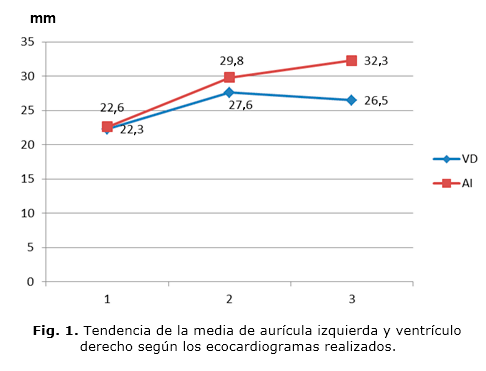
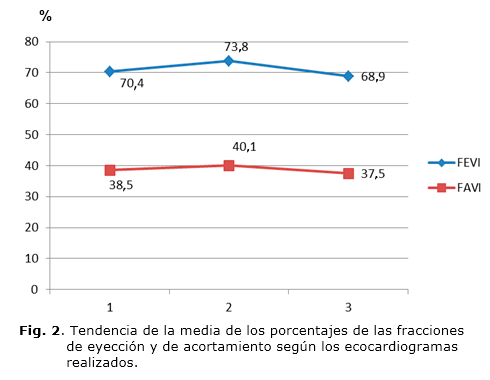
En la tabla 2 se muestra la frecuencia de las alteraciones que pudieran representar cardiotoxicidad en las mediciones de AI y VD, al menos en los dos primeros estudios. Durante el primer ecocardiograma hubo 5 casos con modificación de las medidas de AI (42,2 %) y 6 con modificación del VD (50 %); aunque la muestra evaluable era limitada, no hubo modificación significativa de la FEVI ni la FAVI. En el segundo ecocardiograma hubo 11,7 % de casos con cambios en las medidas de AI; 21,3 % con cambios en el VD y, se observó poca repercusión sobre la FEVI y FAVI. Mientras que en el tercer ecocardiograma se obtuvo una mayor modificación de la FEVI (6,3 %) y de la FAVI (9,4 %). El período de latencia entre la administración de antraciclinas y la aparición de las alteraciones funcionales de la FEVI y la FAVI estuvo entre 6 y 12 años, con una media de 9 años. No se observó predominio de un sexo sobre otro, según la frecuencia de cardiotoxicidad.
En la comparación entre las medidas de AI del primer y tercer ecocardiograma se encontraron diferencias estadísticamente significativas (p=0.00). La mayor parte de los cambios en la FEVI ocurrieron entre el segundo y tercer ecocardiograma (p=0.03). Sin embargo, en cuanto al VD y a la FAVI los cambios que se encontraron no fueron estadísticamente significativos.
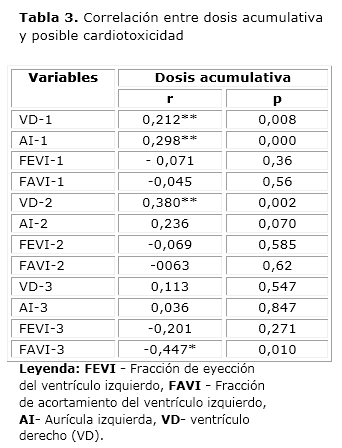
Se encontró correlación inversa entre la dosis acumulativa de antraciclinas y los valores del ecocardiograma, o sea, que a mayor dosis de antraciclinas se ve una disminución, sobre todo de la FAVI. Se encontraron correlaciones directas entre la dosis acumulativa y el VD y AI del primer ecocardiograma, además con el VD del segundo ecocardiograma, las cuales resultaron estadísticamente significativas al nivel 0,01; sin embargo, resultaron débiles pues los coeficientes de correlación lineal de Pearson fueron menores de 0,5. Entre la dosis acumulativa y la FAVI del tercer ecocardiograma se encontró correlación inversa, estadísticamente significativa al nivel 0,05 que también resultó débil pues el coeficiente de correlación lineal de Pearson fue menor de 0,5 (tabla 3).
En cuanto a la media, se apreció que de forma general las mediciones de la FEVI y FAVI se mantuvieron estables (Fig. 1); sin embargo hubo una ligera disminución entre el primer y el tercer ecocardiograma realizado. Además existió tendencia al aumento de las medidas de AI y VD entre el primer y tercer estudio (Fig. 2).
A pesar de todo esto, del total de casos estudiados ninguno presentó síntomas cardiovasculares y los hallazgos fueron solamente de toxicidad subclínica o grado 1.
DISCUSIÓN
El uso de antraciclinas en las leucemias agudas pediátricas tiene riesgo de producir cardiotoxicidad como se ha descrito en muchos estudios sin embargo no es frecuente la aparición de síntomas relacionados con ella, 17,22,24,26 sino que aparece de forma subclínica en la mayoría de los casos, como pudimos apreciar en este estudio.
En relación a las mediciones de AI y VD, que se refieren a la funcionalidad de las cavidades, no podemos ser concluyentes en el valor de los resultados porque la mayoría de los pacientes incluidos tenían menos de 15 años en el momento del primer estudio. Sin embargo en el tercer estudio, donde ya la totalidad de los pacientes eran mayores de 15 años, se mantuvieron estos hallazgos pero la muestra era pequeña. Hay que señalar que precisamente la dispersión de la muestra en relación al número de pacientes nos impidió utilizar los z scores con resultados confiables. Hubo disminución de FEVI y FAVI entre el primer y tercer ecocardiograma. Los resultados de esta investigación se corresponden con los de un estudio realizado y publicado en nuestro país por Cedré y colaboradores 26 en 2013 que obtuvo signos de cardiotoxicidad en un 9,7 % de los casos. Sin embargo, no encontraron relación entre la dosis acumulativa de antraciclinas y los signos de cardiotoxicidad. Es de señalar que dicho estudio no fue longitudinal como el nuestro y tuvo un periodo de seguimiento mucho más largo. En el presente estudio el tiempo de latencia para la aparición de las alteraciones ecocardiográficas funcionales estuvo entre 6 y 12 años después de suspendido la quimioterapia y pudieran haber sido mayor las alteraciones si se hubiese prolongado el período de seguimiento.
Cardinale y colaboradores realizaron una investigación donde encontraron signos de cardiotoxicidad inducida por antraciclinas en un 9 % de los pacientes y hubo relación entre esta y la dosis acumulativa del fármaco. Este estudio fue realizado en pacientes adultos pero los resultados fueron semejantes a los obtenidos en la presente investigación. 27
La mayoría de los pacientes incluidos en este estudio se consideraron como de riesgo bajo o intermedio pero eso no los exime de padecer algún tipo de secuelas, ya que se ha descrito cardiotoxicidad por antraciclinas, sobre todo disfunción ventricular, en un 40% de las personas que recibieron estos medicamentos hasta 10 a 15 años posteriores al tratamiento 28. Aun cuando ha señalado que la toxicidad es mayor en el sexo femenino 7,28, no encontramos diferencias significativas en relación al género.
En un estudio realizado por Ramjun y colaboradores en pacientes oncológicos que recibieron tratamiento con antraciclinas durante la edad pediátrica con dosis acumulativas mayores de 250 mg/m2, se encontró un 14.7 % de pacientes con alteraciones en al menos un ecocardiograma, sin manifestaciones clínicas. 29
Hubo una tendencia no significativa a una disminución de la FEVI y la FAVI durante el seguimiento sin embargo el periodo de estudio no fue prolongado para poder dar conclusiones válidas.
En el tratamiento de la LLA hay grupos que no emplean antraciclinas en la inducción de la remisión en todos los enfermos El CCSG por sus siglas en inglés 30 hizo una evaluación de más de 500 niños con LLA de riesgo estándar tratados con protocolos de la década de los 90 e inicios de la primera década del presente siglo, que no utilizaban antraciclinas y describieron muy poca toxicidad con supervivencias similares a la población de su misma edad.
En las leucemias mieloides se ha demostrado que este grupo de medicamentos son prácticamente imprescindibles para la terapia para lograr la remisión y eventualmente la curación, por lo que es primordial evitar la toxicidad si es posible. Se plantea que el desraxozane, que es un quelante de hierro en los cardiomiocitos, podría ser efectivo pero tiene un costo elevado y parece ser imprescindible solo cuando las dosis de antraciclinas son muy elevadas 31. Hay algunos reportes que describen la utilidad de la melatonina para prevenir el daño mitocondrial causado por las antraciclinas pero se requieren confirmación 32.
En un estudio de metanálisis de 18 revisiones sobre los efectos cardiotóxicos de las antraciclinas y su prevención, utilizando el método Cochrane realizado por Conway y colaboradores, se determinó que las variables que podían prevenir la cardiotoxicidad eran: primero la no utilización de estas drogas, segundo el uso de desraxozane sin una certeza absoluta y por último el tiempo de infusión siempre mayor de 6 horas.33
En todos los pacientes incluídos en este estudio las antraciclinas se emplearon en infusión pero no de más de 1 hora de duración y nunca se administró por vía endovenosa directa. No existe disponibilidad de desraxozane en nuestro medio pero se considera que con dosis acumulativas inferiores a 300 mg/m2 su empleo no es absolutamente imprescindible.
Una de las interrogantes sería si es posible erradicar el uso de este grupo de medicamentos para evitar la cardiotoxicidad .En la actualidad Cuba pertenece al grupo Acute Lymphoblastic Leukemia Intercontnental (ALL- IC) por sus siglas en inglés que emplea esquemas de tipo BFM ( Berlín-Frankfurt-Munster) que aún en los pacientes considerados de bajo riesgo utiliza al menos dos dosis de daunorubicina en la inducción y cuatro dosis de doxorubicina en el protocolo II o de consolidación tardía Es difícil decidir no emplear un medicamento que es potencialmente efectivo y sin dudas son necesarios más estudios para poder tomar una decisión definitiva.
Aun cuando en el grupo estudiado la toxicidad detectada fue inferior a 10 % en lo referente a la FEVI y a la FAVI hay que señalar algunos hechos: el tiempo de seguimiento no fue prolongado y las alteraciones se detectaron sobre todo en el tercer estudio. Es imprescindible aumentar el número de pacientes y el tiempo de seguimiento para poder llegar a conclusiones definitivas que permitan mejorar la calidad de vida de los sobrevivients y evitar complicaciones.También hay que incluir un número apreciable de pacientes con leucemias agudas no linfoides donde las antraciclinas se emplean a dosis más elevadas
REFERENCIAS BIBLIOGRÁFICAS
1. Kaushansky K, Lichtman MA, Beutler E, Kipps TJ, Seligsohn U, Prchal JT. Williams Hematology. 8 ed. New York: Mc Graw-Hill; 2010.
2. Hoffman R, Benz EJ, Silberstein LE, Heslop HE, Weitz JI, Anastasi J. Hematology. Basic Principles and Practice. 6 ed. Philadelphia: Elsevier; 2013. p.935-51.
3. Whitlock JA, Gaynon PS. Acute Lymphoblastic Leukemia in Children. En: Greer JP, et al, editors. Wintrobe's clinical hematology. 12 ed. Philadelphia:Lippincott Williams & Wilkins; 2009. p.1890-911.
4. Khakoo AY, Liu PP, Force T, Lopez-Berestein G, Jones LW, Schneider J, et al. Cardiotoxicity due to cancer therapy. Tex Heart Inst J. 2011;38(3):253-6.
5. Comité de Medicamentos de la Asociación Española de Pediatría. Pediamécum. Antraciclinas. Edición 2015. (Citado en 14/07/2015). Disponible en: http://www.pediamecum.es .
6. Salazar-Mendiguchía J, González-Costello J, Roca J, Ariza-Solé A, Manito N, Cequier Á. Miocardiopatía inducida por antraciclinas: conocimientos moleculares básicos para el cardiólogo. Arch Cardiol Mex. 2014;84(3):21-32.
7. Pérez C, Agustí MA, Tornos P. Cardiotoxicidad tardía inducida por antraciclinas. Med Clin. 2009;133(8):311-3.
8. Cuns DI, Lagrotta PI. Toxicidad a largo plazo del tratamiento de LLA pediátrica. Hematolología. 2013;17(3):223-30.
9. Ruggiero A, Ridola V, Puma N, Molinari F, Coccia P, De Rosa G, et al. Anthracycline cardiotoxicity in childhood. Pediatr Hematol Oncol. 2008;25(4):261-81.
10. Lipshultz SE, Alvarez JA, Scully RE. Anthracycline associated cardiotoxicity in survivors of childhood cancer. Heart. 2008;94(4):525-33.
11. Hurtado SN, Mejía AMC, Sanabria AC. Cardiotoxicidad por quimioterapia. Un enfoque práctico para el clínico. Insuf Card. 2011;6(3):131-41.
12. Parma G, Lluberas N, Castillo C, Ormaechea G. Quimioterápicos y Cardiotoxicidad: un enfoque actual y práctico para el clínico de una disciplina en pleno desarrollo. Arch Med Interna. 2013;35(2):37-44.
13. Creutzig U, Diekamp S, Zimmermann M, Reinhardt D. Longitudinal evaluation of early and late anthracycline cardiotoxicity in children with AML. Pediatr Blood Cancer. 2007;48(7):651-62.
14. Fulbright JM. Review of cardiotoxicity in pediatric cancer patients: during and after therapy. Cardiol Res Pract. 2011; 2011:942-90. doi: 10.4061/2011/942090.
15. Rathe M, Carlsen NL, Oxhoj H. Late cardiac effects of anthracycline containing therapy for childhood acute lymphoblastic leukemia. Pediatr Blood Cancer. 2007;48(7):663-7.
16. Rathe M, Carlsen NL, Oxhoj H, Nielsen G. Long-term cardiac follow-up of children treated with anthracycline doses of 300 mg/m2 or less for acute lymphoblastic leukemia. Pediatr Blood Cancer. 2010;54(3):444-8.
17. Uchikoba Y, Fukazawa R, Ohkubo T, Maeda M, Ogawa S. Early detection of subclinical anthracyclinecardiotoxicity on the basis of QT dispersion. J Nihon Med Sch. 2010;77(5):234-43.
18. Adams MJ, Lipshultz SE. Pathophysiology of anthracycline- and radiation-associated cardiomyopathies: implications for screening and prevention. Pediatr Blood Cancer. 2005;44(7):600-6.
19. Tolba KA, Deliargyris EN. Cardiotoxicity of cancer therapy. Cancer Invest. 1999;17(6):408-22.
20. Lai WW, Geva T, Shirali GS, Frommelt PC, Humes RA, Brook MM, et al. Guidelines and standards for performance of a pediatric echocardiogram: a report from the Task Force of the Pediatric Council of the American Society of Echocardiography. J Am Soc Echocardiogr. 2006 Dec; 19(12):1413-30.
21. Lopez L, Colan SD, Frommelt PC, Ensing GJ, Kendall K, Younoszai AK, et al. Recommendations for quantification methods during the performance of a pediatric echocardiogram: a report from the Pediatric Measurements Writing Group of the American Society of Echocardiography Pediatric and Congenital Heart Disease Council. J Am Soc Echocardiogr. 2010 May;23(5):465-95; 576-7.
22. Abosoudah I, Greenberg ML, Ness KK, Benson L, Nathan PC. Echocardiographic surveillance for asymptomatic late-onset anthracycline cardiomyopathy in childhood cancer survivors. Pediatr Blood Cancer. 2011 Sep;57(3):467-72.
23. Kaski JP, Daubeney PE. Normalization of echocardiographically derived pediatric cardiac dimensions to body surface area: time for a standardized approach. Eur J Echocardiogr. 2009 Jan;10(1):44-5.
24. Landier W, Bhatia S, Eshelman DA, Forte KJ, Sweeney T, Hester AL, et al. Development of risk-based guidelines for pediatric cancer survivors: the Children's Oncology Group Long-Term Follow-Up Guidelines from the Children's Oncology Group Late Effects Committee and Nursing Discipline. J Clin Oncol. 2004 Dec; 22(24):4979-90.
25. Common Terminology Criteria for Adverse Events (CTCAE) and Common Toxicity Criteria (CTC). National Cancer Institute; 2010 Jun 14. (Citado en 2012 Feb 18). Disponible en: http://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14.xls.
26. Cedré Hernández T, Martínez Cárdenas L, García Caraballoso MB, González Díaz A, González Ojeda G, Castillo Villocht A. Cardiotoxicidad tardía por antraciclinas en pacientes tratados por leucemia linfoblástica aguda infantil. Acta Méd Centro. 2013;7(3):1-4.
27. Cardinale D, Colombo A, Bacchiani G, Tedeschi I, Meroni CA, Veglia F, et al. Early Detection of Anthracycline Cardiotoxicity and Improvement With Heart Failure Therapy. Circulation. 2015;131:1981-8.
28. Consenso de diagnóstico, prevención y tratamiento de la cardiotoxicidad por tratamiento médico del cáncer. Rev Argentina Cardiol. 2013;81(5):28-34.
29. Ramjaun A, AlDuhaiby E, Ahmed S, Wang L, Yu E, Nathan PC, et al. Echocardiographic Detection of Cardiac Dysfunction in Childhood Cancer Survivors: How Long Is Screening Required? Pediatr Blood Cancer. 2015;62:2197-203.
30. Essig S, Li O C, Hitzler J; Leissening W, Greenberg M, et al. Risk of late effects of treatment in children newly diagnosed with standard risk acute lymphoblastic leukaemia. A report of the childhood cancer study group lancet. Oncol. 2014 Jul;(8):841-51.
31. Lipshultz SE, Sdsatakos P, Maguire M, Kamir R, Ross SW, Franco VI, et al. Cardiotoxicity and cardioprotection in childhood cancer. Acta Haematol 2014;132(3-4):391-9.
32. Govendor J, Loos B, Marais F, Englerechra M. Mitochondrial catastrophe during doxorubicin induced cardiotoxicity. A revision of the protective role of melatonin. J Clin Oncol. 2014;57(4):367-80.
33. Conway L, Mccarthy AI, Landimer P, Closk RA. The prevention, detection and management of cardiac treatment induced cardiac toxicity. A meta review. BMC Cancer. 2015;15:366.
Recibido: marzo 3, 2016.
Aceptado: julio 27, 2016.
Dr. Alejandro González Otero . Instituto de Hematología e Inmunología. Apartado 8070, La Habana, CP 10800, CUBA. Tel (537) 643 8695, 8268. Email: rchematologia@infomed.sld.cu