Introducción
La piel es la principal barrera de defensa de los seres humanos. Cuando se produce una discontinuidad anatómica y fisiológica (herida) por traumatismos, quemaduras u otras causas, se afectan sus funciones. En proporción a la extensión dañada y a otros factores intrínsecos y extrínsecos, aumentará el riesgo de infecciones locales o sistémicas; existirá pérdida de proteínas, líquidos y electrolitos, lo que puede conducir a complicaciones que ponen en peligro la vida del paciente. La cicatrización rápida y eficaz es el objetivo terapéutico fundamental luego de la reanimación si esta fue necesaria.1
La cicatrización es un proceso metabólico reparativo y dinámico que se activa en respuesta a una lesión. Consta de cuatro fases que se superponen en el tiempo y en las que actúan diferentes tipos celulares y numerosas moléculas bioactivas secretadas a la matriz extracelular.2
Durante la fase de hemostasis se detiene la hemorragia por la respuesta vasoconstrictora ante la liberación de sustancias vasoactivas por las células dañadas y, por la aglomeración de plaquetas para formar un tapón que oblitera el vaso. La fase inflamatoria está caracterizada por la acción de los neutrófilos (inflamación temprana) y posteriormente por los monocitos, macrófagos y linfocitos (inflamación tardía). Durante la fase proliferativa ocurren varios procesos: formación del tejido de granulación (proliferación de fibroblastos y de células endoteliales); de la matriz extracelular (fibroplasia) y la repitelización (migración y proliferación de los queratinocitos). La última, fase de remodelación se caracteriza por la degradación de la matriz extracelular y reordenamiento del tejido conectivo.2,3
Para cada fase del proceso de cicatrización resulta imprescindible la acción de múltiples células y la actividad de factores bioactivos, dentro de los que se encuentran los factores de crecimiento derivados de las plaquetas (FCDP), con potencialidad para la reparación de diferentes tejidos.4
Las plaquetas son protagónicas en el proceso de reparación tisular. Son células que liberan mediadores bioquímicos como las citoquinas y quimioquinas, además, constituyen un reservorio de factores de crecimiento (FC) contenidos en altas concentraciones en los gránulos alfa.5,6
Los FC tienen efectos pleiotrópicos con acción intracrina, autocrina, paracrina, yuxtacrina y endocrina. Actúan propiciando la expresión y síntesis de los productos codificados por diferentes genes, influenciando el tipo de matriz que las células forman en la reparación celular.7) Estos factores aumentan y estimulan los procesos de división, migración y diferenciación de las células epiteliales, aumentan la proliferación celular de queratinocitos, células endoteliales, fibroblastos, monocitos y macrófagos. Así como también, estimulan la síntesis de colágeno, elastina y proteoglicanos.8
La capacidad multifuncional de las plaquetas se evidencia por su participación en las tres primeras fases de la cicatrización. Unos segundos después de ocurrida la lesión inicia su función como activadora de la coagulación seguida de la liberación de sustancias inflamatorias.2,9) La gran cantidad de FC contenidos en los gránulos plaquetarios, la capacidad de síntesis de novo de proteínas, su intervención en la síntesis de matriz extracelular y en la revascularización, promueven la reparación de las heridas y otras lesiones tisulares. Por estas propiedades es que se propone la utilización del plasma rico en plaquetas (PRP) para la reparación y regeneración de tejidos.4,6,10,11
La obtención del PRP es una de las técnicas de bioestimulación para la regeneración de tejido por medio de la proliferación, diferenciación celular y la angiogénesis que utiliza las propiedades de las plaquetas. El beneficio que ofrecen las plaquetas en el crecimiento de los tejidos fue descrito a inicios de este siglo con reportes satisfactorios, ya sea como PRP o lisado plaquetario, facilitando su cicatrización.4
Los datos clínicos revelan que el uso de PRP actúa como una matriz favorable para el desarrollo de la curación sin exagerar procesos inflamatorios, en tanto estudios histológicos revelan que favorece la proliferación defibroblastos, la síntesis de colágeno tipo I, estimula la angiogénesis, mitogénesis, la permeabilidad e induce el crecimiento del tejido epitelial.12
El primer trabajo que demostró la efectividad del uso de las plaquetas en úlceras cutáneas crónicas fue publicado en el año 1986; posteriormente su empleo se extendió a Ortopedia y Cirugía Maxilo-Facial.13) En la actualidad su uso ganó en popularidad en las diferentes áreas de la cirugía plástica; en la estética, fundamentalmente con fines de rejuvenecimiento (tópica e infiltrativa)y en la reconstrucción para acelerar la cicatrización.
Todas las heridas no logran cicatrizar en el tiempo estipulado; las que primero deben eliminar el tejido dañado requieren un tiempo mayor y pueden convertirse en heridas crónicas, incluso muchas veces los mecanismos fisiológicos no son capaces de lograr la cicatrización por lo que es necesario acudir a técnicas quirúrgicas para cerrar la zona cruenta.14
La extensión de las zonas desprovistas de piel en los enfermos quemados y politraumatizados, luego de necrectomizado el tejido desvitalizado, constituye un elemento importante en la evolución de los pacientes.15) En ellos la posibilidad de concluir la cicatrización puede ser nula si además de extensa están afectadas todas las capas de la piel; igualmente concomitan factores como desnutrición y desequilibrios del medio interno, los cuales limitan el proceso de cicatrización.7,8) En estas condiciones las lesiones necesitan de la realización de injertos autólogos de piel, lo que implica crear nuevas heridas (zonas donantes). El tiempo de cicatrización de las zona donante variará en dependencia del grosor de la piel extraída,7,15) pero cuando se trata de pacientes con quemaduras extensas, la cicatrización rápida de la zona donante ofrece la posibilidad de disminuir las pérdidas de proteínas, disminuir el riesgo de infección y facilita su reutilización como zona dadora de piel, por tanto, es importante la búsqueda de alternativas para que esta evolucione de la mejor manera posible.16
Utilizar un vehículo, que funcione como portador y proveedor de FC, fibronectina y otras proteínas adhesivas, es una estrategia terapéutica eficaz en la cicatrización; las plaquetas pueden lograr este propósito.15) Se obtienen a partir de la centrifugación de la sangre con lo que se obtiene el plasma, que al centrifugarse nuevamente resultará en un concentrado plaquetario rico en FC, el cual puede aplicarse de forma autóloga u homóloga, una vez activadas las plaquetas.12
La utilización de FC obtenido a partir del plasma resulta conveniente al aplicarlo en las lesiones por quemaduras para su cicatrización; sin embargo, la obtención de plasma autólogo con este fin pudiera no ser aconsejado en los quemados con lesiones extensas pues su homeostasis y condiciones generales lo desaconsejan. Existe, en cambio la opción de utilizar lisado plaquetario obtenido a partir de las donaciones sanguíneas ya procesadas cuyo concentrado de plaquetas no fue utilizado, conservándolo a -30 oC. En el momento de la descongelación las plaquetas se lisan quedando liberados los FC por lo que se obtiene un concentrado de factores de crecimiento plaquetarios.
Basado en lo anterior se decide determinar las ventajas del uso del lisado plaquetario homólogo sobre la cicatrización de zonas donantes de piel.
Métodos
Se realizó estudio longitudinal prospectivo, entre agosto de 2016 y mayo de 2019, en pacientes tratados en el servicio de Cirugía Plástica y Caumatología del Hospital Clínico Quirúrgico “Hermanos Ameijeiras”, por trauma histionecrótico profundo en los que, luego del desbridamiento, se lograron las condiciones para realizar el injerto autólogo de piel.
Se incluyeron pacientes de ambos sexos, mayores de 19 años, con exámenes de laboratorios aceptables para la intervención, que expresaron voluntariedad para participar en la investigación. Se excluyeron los pacientes con antecedentes de enfermedades cutáneas o sistémicas que afectaran la cicatrización. La selección de la muestra se realizó de manera intencional, cumpliendo los principios éticos para las investigaciones médicas en humanos.17
Se realizó la determinación del grupo sanguíneo del sistema ABO para garantizar la compatibilidad donante-receptor.
El plasma rico en plaquetas se obtuvo a partir de sangre total por centrifugación ligera (2 750 rpm x 4 a 5 min) y posteriormente se sometió a centrifugación rápida (3 750 rpm x 10 min) para obtener el lisado plaquetario. Todo el procedimiento, desde la recolección de la sangre hasta la preparación del lisado plaquetario, se realizó a temperatura de 22 ºC, evitando el enfriamiento para evitar pérdidas. La separación se realizó dentro de las 4 a 6 horas después de la flebotomía. En el concentrado se dejaron entre 50 y 70 mL de plasma para mantener el pH entre 6,4 y 7,4. De esta forma a partir de una unidad de sangre entera se produce un concentrado con entre 5,5 x 1010/L y 7,5 x 1010/L plaquetas.
Las plaquetas se conservaron en fase líquida a 4 ºC, durante tres días. Después del tercer día, a las que no mostraron cambios de coloración, se le realizó un recuento plaquetario en cámara de Neubauer y se anotó en el registro del banco de sangre, antes de ser congeladas a -30 ºC durante una hora y posteriormente se descongelaron en baño termostatado durante 6 min. Este procedimiento se realizó tres veces para obtener un lisado homogéneo, rico en factores de crecimiento que se conservó a -30 ºC. Se realizó recuento de plaquetas y estudio microbiológico a todas las bolsas, tomando 1 mL del tramo, después de su descongelación de forma rápida, antes de aplicar el lisado plaquetario al paciente. Se recogieron los datos de la bolsa entregada en el registro del banco de sangre.
A cada paciente se le se calculó la cantidad de milímetros de piel necesaria para injertar. Sobre esta base se realizaron dos tomas de piel de espesor parcial (0,3 mm de grosor) en la misma zona corporal con el electro-demátomo Aesculap. Se definieron dos zonas: la primera (zona 1) de control y la segunda (zona 2) de intervención. En esta última se aplicó el lisado plaquetario de forma tópica una vez descongelado a temperatura ambiente. La cantidad aplicada se calculó a razón de 1-1,5 mL/4 cm2 de área a tratar. Ambas zonas se cubrieron con pomada antibiótica (neobatín) y se ocluyeron con vendajes hasta el 5to día, cuando fueron revisadas. Se continuó con cura semiexpuesta hasta su epitelización. La revisión clínica se efectuó los días 5, 9, 14 y 21 postinjerto, momentos en los que se aplicó nuevamente lisado plaquetario en la zona 2.
La evaluación de la cicatrización de las zonas se realizó por un grupo de expertos en quemados ajenos a la investigación que describieron y anotaron previo consenso, los indicadores: coloración de la piel, porcentaje de epitelización, intensidad de dolor (de 0 al 10) según Wong Baker,18) presencia de signos inflamatorios en la zona donante, días necesarios para epitelizar totalmente y complicaciones. Además, se controlaron las variables edad, sexo y la causa de la zona cruenta.
Procesamiento de la información
Los datos fueron trasladados a una base de datos y procesados en el paquete estadístico SPSS versión 20.0. Se utilizó la estadística descriptiva. Los datos fueron resumidos según las características de las variables; en las cualitativas se utilizaron números absolutos y proporciones, expresadas en porcentajes y en las cuantitativas, medidas de tendencia central como promedio o media aritmética y medidas de dispersión absoluta como la desviación típica. Se calcularon los límites de confianza para la media con varianza desconocida para conocer entre qué valores se movieron los parámetros involucrados. Se aplicó la prueba de Friedman, al ser el caso de más de dos muestras relacionadas y pequeño tamaño muestral. Para evaluar si existían diferencias significativas se prefijó un nivel de significación de 0,05.
Resultados
Fueron estudiados 20 pacientes con edad promedio de 52,85±13,79 años. El grupo más representado fue entre 50 y 89 años. El sexo masculino ocupó 55 % del total. La quemadura estuvo presente como causa de lesión en el 75 %.
La zona tratada con lisado plaquetario presentó un porcentaje mayor de epitelización que la zona control los días 5 y 9. Al día 14 todos los pacientes presentaron ambas zonas con 75 a 100 % de epitelización, con diferencias significativas en el porcentaje de epitelización entre las zonas (p < 0,01) (Tabla 1).
Tabla 1 Distribución de los pacientes según porcentaje de epitelización de la zona donante

n=20 para cada zona (zona 1: sin lisado. zona 2: con lisado plaquetario) Prueba de Friedman (p < 0,01)
Fuente: Base de datos.
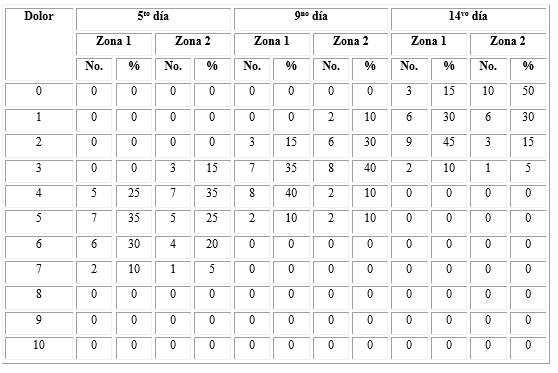
Los días para epitelización de la zona donante tratada con el lisado plaquetario fueron menos en comparación con la zona control (teniendo en cuenta la disminución de extensión en porciento de la lesión); el 95 % de los pacientes con lisado plaquetario epitelizaron entre los 10 y 14 días, mientras que 5 % lo hizo entre los 15 y 21 días. En cambio, en el grupo control, el 60 % de los pacientes epitelizó entre los 10 y 14 días y el 40 % entre 15 y 21 días. Al comparar las proporciones de cada zona donante según los días en que epitelizaron, los resultados no fueron significativos para la zona no tratada con lisado; sin embargo, para la zona donde se aplicó el lisado plaquetario la diferencia entre las proporciones fue significativa (p < 0,01). Del mismo modo, fueron significativas las diferencias del grado de dolor entre las zonas donantes en los tres momentos de su medición (p < 0,01). Tabla 2).
Tabla 2 Distribución de los pacientes según los días en los que epitelizó la zona donante

Fuente: Base de datos. n=20 para cada zona (Zona 1: sin lisado de plaquetas, Zona 2: con lisado de plaquetas)
La mayoría de los pacientes refirieron menos dolor en la zona tratada con lisado plaquetario en las tres evaluaciones (Tabla 3). Ninguna zona donante presentó signos inflamatorios ni complicaciones durante las evaluaciones.
Discusión
Durante la ruta crítica de la evolución, el paciente quemado adquiere morbilidades, propias de los mecanismos de respuesta a la agresión y por complicaciones que afectan el proceso de cicatrización; ya sea de las lesiones o de las zonas donante.
El uso del lisado plaquetario homólogo en la zona donante de injerto autólogo de piel constituye una herramienta prometedora para acelerar los procesos de cicatrización en los pacientes quemados.
El uso de FCDP es un avance de la medicina contemporánea y uno de los pilares de la medicina regenerativa.19) En Cuba se han realizado investigaciones sobre el tema,20,21) pero en quemaduras poco se ha publicado, aunque se ha utilizado lisado plaquetario sobre injertos, con beneficios en la velocidad de cicatrización.16
Las lesiones de la piel que afectan hasta la dermis profunda, tienen como promedio un tiempo de cicatrización de 21 días,22,23) ya que este proceso ocurre a partir de los anexos (glándulas sudoríparas, sebáceas y folículos pilosos) implantados en la dermis profunda, que quedan indemnes al ocurrir la lesión. Los cambios metabólicos, la atrofia de la piel, junto con la pérdida de los anejos con la edad en relación al proceso de envejecimiento puede traer consigo una menor cantidad de células basales germinativas como sustrato para la cicatrización; situación que puede relacionarse con un tiempo más prolongado para la curación completa y la necesidad de cierre por tercera intención.24
El empleo de plaquetas activadas (o mejor, plasma rico en FC) resulta muy efectivo como adyuvante y estimulante del proceso de cicatrización. Los avances científicos en biología molecular y genética han permitido investigar factores plaquetarios de crecimiento angiogénico,25) y otras proteínas que ejercen acciones sobre diferentes aspectos de la reparación tisular, que aceleran la cicatrización en pacientes adultos con quemaduras y disminuyen el dolor en ausencia de complicaciones,26lo que mejora el pronóstico de vida. Maghsoudi y otros, también compararon la eficacia de la aplicación de plaquetas en la cicatrización de las quemaduras en relación a la sulfadiazina de plata, obteniendo mayores y más aceleradas tasas de cicatrización en el primer grupo.27) Todo lo anterior reafirma la importante función de los FC en la aceleración del proceso de cicatrización de heridas, y su efectividad como alternativa terapéutica.26,28
Lo anterior coincide con los resultados de este estudio, ya que la zona tratada con el lisado plaquetario tuvo una tendencia a más altos porcentajes de epitelización en menor tiempo, en comparación de la zona control acelerando la cicatrización de la zona donante. El acortamiento en los tiempos de cicatrización o epitelización no solo disminuye la estadía hospitalaria y los costos, sino que también permite una incorporación más precoz del individuo a la sociedad y reduce los días de baja laboral por enfermedad.29
Un síntoma muy frecuente en los quemados que son tratados con injerto de piel, es el dolor en la zona donante. El hecho de encontrar menor dolor en la zona que recibió lisado plaquetario pudo estar relacionado con la analgésica secundaria a la liberación de péptidos del receptor 4 activado por proteasas (PAR-4).30) La sumatoria de factores de crecimiento que modulan la inflamación provenientes de las plaquetas, disminuye el proceso inflamatorio local, proporciona alivio y mejoría del dolor, lo que se ve reflejado en este estudio en concordancia con otras investigaciones.29
La exacerbación de la fase inflamatoria que ocasiona el PRP sobre las quemaduras, y la liberación de FC, aumenta los leucocitos polimorfonucleares y macrófagos en el sitio de la lesión, lo cual aumenta la defensa contra la infección en el área afectada.26,31
Este mecanismo lento y progresivo consigue que las lesiones sanen, minimizando el tejido cicatrizal y sustituye la lesión por tejido sano. Con la aplicación del lisado plaquetario esta respuesta es más rápida y segura.4
Tzen y otros evaluaron el efecto de la aplicación de plaquetas en úlceras en miembros inferiores en pacientes diabéticos y reportaron una tasa de complicaciones de 0 % en 8 pacientes que fueron tratados con aplicación de plaquetas y aplicación de injertos.32 El seguimiento hasta nueve meses no mostró recurrencia de las lesiones ulcerosas, ese estudio, aunque fue realizado en pacientes con úlceras por arteriopatía diabética demuestra la capacidad de angiogénesis y cicatrizal de los componentes plaquetarios.32
Es conocido que la capacidad para la reparación tisular de los pacientes quemados se encuentra disminuida pues presentan una menor capacidad de proliferación celular;22) sin embargo con la aplicación tópica del lisado plaquetario la evolución fue satisfactoria con un número insignificante de complicaciones, lo que permite asumir que el uso de FC aportados por el lisado plaquetario homólogo resulta efectivo en el tratamiento tópico de las quemaduras. El PRP es de fácil preparación y, aunque, el lisado plaquetario lleva un paso más de centrifugación, su uso evita desechar en los bancos de sangre de este hemocomponente que cumplió su vida media útil como heomostático. Además, en el caso de los quemados, la aplicación de esa técnica evita extraer sangre al paciente que en la fase aguda constituye una agresión más.29
La zona intervenida con el lisado plaquetario mostró mejor evolución clínica (menor tiempo de cicatrización y mayor porciento de epitelización) en comparación con la zona control.
La utilización del lisado plaquetario es una buena opción de terapia regenerativa para acelerar procesos de cicatrización, sobretodo en pacientes graves en quienes se prefiere evitar nuevas agresiones para obtener un producto autólogo y en los que el cierre precoz de las zonas cruentas es vital en su recuperación integral.