Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.30 n.2 Ciudad de la Habana abr.-jun. 2011
TRABAJO ORIGINAL
Efectos del tratamiento con Compvit B, ácido orótico o la combinación de ambos sobre la recuperación de la memoria espacial en ratas con lesión de fimbria-fornix
Effects of treatment with Compvit B, orotic acid or their combination on the recovery of spatial memory in rats with fimbria-fornix lesion
Olivia Teresa González GayI, William Almaguer MeliánII, Magalys Ramírez FigueredoIII, Araceli Vallejo MoralesIV, Jorge Alberto Bergado RosadoV
ILicenciada en Biología. Empresa de Producción de Biológicos "Carlos J. Finlay". La Habana, Cuba.
IIDoctor en Ciencias Biológicas, Profesor e Investigador Auxiliar. Centro Internacional de Restauración Neurológica. La Habana, Cuba.
IIITécnico Auxiliar de la Investigación. Centro Internacional de Restauración Neurológica. La Habana, Cuba.
IVDoctora en Medicina Veterinaria. Centro Internacional de Restauración Neurológica. La Habana, Cuba.
VDoctor en Ciencias Biológicas. Profesor e Investigador Titular. Centro Internacional de Restauración Neurológica. La Habana, Cuba.
RESUMEN
Las vitaminoterapias han sido ampliamente utilizadas en neurología para el tratamiento de neuritis o la correción de déficit metabólicos. En Cuba, se produce desde hace algunos años el preparado vitamínico Compvit®, que contiene vitaminas B1, B6 y B12. El ácido orótico, también llamado vitamina B13, es un producto natural que ha mostrado acciones como nootrópico en estudios con animales jóvenes y viejos que acusan deterioro cognitivo. En el presente trabajo se reportan los resultados de un estudio realizado para evaluar las potencialidades terapéuticas del Compvit® y del ácido orótico, empleando la lesión del sistema fimbria-fornix, que afecta severamente las capacidades de aprendizaje de los animales. Los resultados confirman un efecto positivo de cada uno de los tratamientos vitamínicos mejorando las capacidades cognitivas afectadas por la lesión. Aunque ninguno de los productos empleados o su combinación fue capaz de elevar el rendimiento cognitivo al nivel de los animales sanos, todos logran mejorías signficativas en comparación con el placebo. Este trabajo constituye una evidencia adicional en favor del uso terapéutico de compuestos vitamínicos como parte del tratamiento neurorrestaurativo.
Palabras clave: Vitaminas, Compvit B, ácido orótico, lesión de fimbria-fornix, aprendizaje, restauración neurológica.
ABSTRACT
Vitamin therapies have been widely used in Neurology for the treatment of neuritis or the correction of metabolic deficits. In Cuba, Compvit® (B1, B6 and B12 vitamins) have been produced since several years. Orotic acid, also called vitamin B13 is a natural product showing nootropic actions in studies with young and old cognitively impaired animals. The present paper reports the results of a study conducted to assess the therapeutic potentials of Compvit® and orotic acid, in the recovery of cognitive abilities in fimbria-fornix lesioned animals, a lesion known to severely impair learning abilities. The results confirm positive effects of each vitamin treatment to improve the cognitive abilities affected by lesion. Although none of the products used, neither their combination, was able to raise the cognitive performance to the level of non-lesioned animals, both of them achieve significant improvement compared to placebo. The present paper constitutes additional evidence favoring the therapeutic use of vitamin compounds as part of neurorestorative treatments.
Key words: Vitamins, Compvit B, orotic acid, fimbria-fornix lesion, learning, neurologic restoration.
INTRODUCCIÓN
La neuroplasticidad es una propiedad fundamental del sistema nervioso que se expresa durante toda la vida y guía el desarrollo neural y la memoria en todas sus formas.1 Los procesos neuroplásticos son un componente esencial en la recuperación de funciones nerviosas perdidas o alteradas por lesión o degeneración.2-5
La neuroplasticidad puede ser estimulada por técnicas de rehabilitación física6-8 pero puede beneficiarse también del tratamiento con farmacéuticos. Si bien algunos estudios han promovido el uso de anfetaminas en el tratamiento de secuelas de infarto cerebral9,10 se trata de drogas con fuertes efectos colaterales y periféricos. De la misma forma, y por razones similares, los llamados factores neurotróficos, como el factor de crecimiento nervioso y otros,11-14 no han logrado aún una inserción efectiva en el tratamiento de ninguna enfermedad neural.
Una estrategia menos agresiva contempla el posible uso de factores nutricionales, bien sea en forma de alimentos o de preparados nutracéuticos, que puedan apoyar los procesos neuroplásticos, o espontáneos o activados por tratamientos neurorrestaurativos.15-17
Las vitaminoterapias han sido ampliamente utilizadas en neurología, sobre todo para el tratamiento de neuritis, o la correción de déficit metabólicos, pero adquiren nuevas potencialidades a la luz de estas concepciones.18 Dentro de este concepto, las vitaminas del complejo B, y en especial preparados con altas dosis de vitaminas B1, B6 y B12 ocupan un lugar importante. Ejemplo de esta búsqueda fue el ensayo multicéntrico VITATOPS (Vitamins To Prevent Stroke) que empleó folato, B6 y B12 en un intento por prevenir el riesgo de infarto por incremento de la homocisteína.19
En Cuba, la industria farmacéutica produce desde hace algunos años el preparado vitamínico Compvit®, que contiene vitaminas B1, B6 y B12 en dosis de 100 mg, 100 mg y 5 000 µg respectivamente, y que se emplea en el tratamiento de múltiples enfermedades, como terapia directa o de apoyo.
Por otra parte, el ácido orótico, también llamado vitamina B13, es un producto natural20,21 que ha mostrado acciones como nootrópico en estudios con animales jóvenes 22-25 y también con animales viejos que acusan deterioro cognitivo.26
En el presente trabajo se reportan los resultados de un estudio realizado para evaluar las potencialidades terapéuticas del Compvit® y del ácido orótico, solos o en combinación, empleando la lesión del sistema de la fimbria-fornix, un modelo de lesión del sistema nervioso central (SNC) que afecta severamente las capacidades de aprendizaje de los animales.27
MÉTODOS
Animales
En este estudio se emplearon ratas macho de 8 sem de edad (al comienzo de los experimentos) obtenidas del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB, Habana). Los animales fueron mantenidos en cajas translúcidas de Plexiglas, 5 animales por caja, en régimen de 12:12 horas de luz y oscuridad, bajo condiciones controladas de temperatura y humedad y con libre acceso al agua y la comida durante todo el experimento. En todos los pasos del experimento se trató de reducir al mínimo el dolor, siguiendo las regulaciones cubanas para el uso de animales de laboratorio.
Cirugía
La lesión de fimbria-fornix fue realizada bajo anestesia general con hidrato de cloral (420 mg/kg) por vía intraperitoneal. Los detalles de la operación se describen en un trabajo anterior.27 En breve, después de ser colocados en un marco estereotáctico (David Kopf, Tujunga, USA) se hizo una incisión de la piel y se abrió una ventana en el cráneo para permitir el descenso bilateral, en ángulo de 15°, de un bisturí no. 11 rebajado en las coordenadas estereotácticas anteroposterior: 1,4 mm; medial-lateral: 0,8 mm; dorsoventral: 5,0 mm, que se movió después lentamente en dirección lateral hasta la coordenada 3,1 mm. Después de la operación los animales fueron tratados durante 5 días con antibióticos (tetraciclina en el agua de beber).
Tratamiento
Los animales lesionados, 21 días después de la operación, fueron asignados aleatoriamente a los siguientes grupos tratamiento:
Compvit (n= 18): se aplicó una dosis de 1 mL/kg de peso corporal del fármaco Compvit® (QUIMEFA, La Habana, Cuba) por vía intraperitoneal disuelta en solución salina fisiológica en días alternos durante 15 días.
Orótico (n= 9): se aplicó una dosis de 100 mg/kg de peso corporal de metil éster de ácido orótico (Sigma, Saint Louis, USA) suspendido en solución salina por vía intraperitoneal en días alternos durante 15 días.
Compvit-Oro (n= 23): se administró una dosis combinada de Compvit y ácido orótico en las mismas dosis y por la misma vía y forma de administración descrita para los dos grupos anteriores.
Salina (n= 23): a los que se aplicó un volumen de solución salina equivalente al empleado en los grupos anteriores y que sirvieron como controles de lesión.
Control sano (n= 15). Grupo de animales sin lesión ni tratamiento, que sirvió como referencia.
Todos los tratamientos se comenzaron una semana antes de las pruebas conductuales y se mantuvieron durante la semana de evaluación conductual. La administración de las sustancias se hizo por vía intraperitoneal en todos los casos.
Entrenamiento
En esta prueba los animales deben encontrar una plataforma invisible, sumergida bajo la superficie del agua, que se mantiene a una temperatura aproximada de 21 °C, en un tanque circular de 1,5 m de diámetro y 40 cm de profundidad.
En cada uno de los 3 primeros días de entrenamiento se realizan 8 ensayos consecutivos con cada uno, en los que se introduce al animal en el tanque por 1 de 4 puntos seleccionados aleatoriamente. Utilizando un sistema computarizado de seguimiento y registro (SMART Panlab, Barcelona, España) se midieron, en cada uno de los intentos: el tiempo que tardaba el animal en encontrar la plataforma sumergida y escapar del agua (latencia de escape, en s), la distancia recorrida por el animal en cada intento (cm), la velocidad de nado promedio (cm/s) y el tiempo total dedicado a nadar a lo largo de las paredes (tigmotaxia, s). En cada intento se permitió un tiempo máximo de búsqueda de 60 s. Si transcurrido ese tiempo, los animales no habían llegado a la plataforma, el observador les conducía hasta ella. Se permitió el reposo de los animales sobre la plataforma durante 30 s entre cada prueba. El 4to. y último día de entrenamiento se realizaron 4 ensayos como los descritos.
Se desarrolló además un 5to. día de evaluación con 8 ensayos, en los cuales la plataforma se hizo visible y se colocó en un lugar diferente, con el objetivo de comprobar la presencia o no de defectos sensoriales o motores entre los animales lesionados.
Los resultados obtenidos en los ensayos individuales, tanto con la plataforma visible como no visible, se agruparon en bloques de 4 intentos, a los que se asignó el valor promedio de las cuatro observaciones. Así, cada día de entrenamiento se representa por dos bloques, excepto el 4to., que consta de solo 1.
Histología
Al final de los experimentos conductuales los animales fueron perfundidos por vía intracardiaca bajo anestesia con hidrato de cloral, con una solución de paraformaldehído al 4 %, glutaraldehído al 0,1% y ácido pícrico al 15 % en buffer fosfato 0,1M (pH=7,4). Tras 1 h de posfijación los cerebros se lavaron con buffer y se incubaron en soluciones crecientes de sacarosa (7, 15 y 30 %) a 4 °C y congelados en nitrógeno líquido. Se hicieron cortes histológicos de 20 µm con un criostato en toda la región del hipocampo que fueron procesados para acetil colino-esterasa según el método descrito por Hedreen y otros.28
Estadística
El análisis estadístico de los resultados conductuales se realizó mediante un análisis de varianza (ANOVA) con diseño entre-dentro (mediciones repetidas). Se consideraron los siguientes factores:
1. Tratamiento, con 5 niveles, correspondientes a los grupos de tratamiento arriba descritos.
2. Bloque, con 7 niveles, correspondientes a los bloques de ensayos antes descritos (mediciones repetidas).
Para las pruebas con plataforma visible se empleó el mismo diseño.
En todos los casos en que se obtuvieron diferencias significativas con el ANOVA, se hicieron comparaciones post hoc entre grupos mediante el test de Tukey. Se consideraron significativas las diferencias en las que el valor de p fue inferior a 0,05.
RESULTADOS
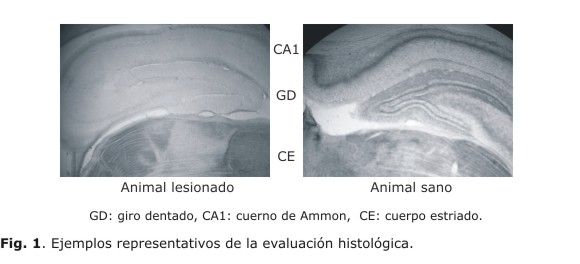
El estudio histológico realizado mostró que el hipocampo de los animales lesionados presenta una ausencia casi total de inervación colinérgica, en contraste con los animales sanos en los cuales la inervación colinérgica aparece bien marcada en todos los campos del cuerno de Ammon (hippocampus proper) y el giro dentado. En la figura 1 se muestran cortes obtenidos de un animal lesionado (izquierda) y no lesionado o sano (derecha). Obsérvese que en el corte obtenido del animal sano la formación del hipocampo, que comprende el giro dentado (GD) y el cuerno de Ammon (CA1) aparece una marcada tinción para la enzima acetilcolinesterasa en las zonas por encima y por debajo de los cuerpos celulares de las neuronas principales, mientras que la tinción está totalmente ausente en el hipocampo del animal lesionado. Nótese que en ambos casos el cuerpo estriado (CE) que se localiza de inmediato debajo del hipocampo muestra una tinción para la enzima, lo cual demuestra que la denervación colinérgica es específica y exclusiva del hipocampo y puede ser considerada como resultado de la lesión de fimbria-fornix.
Uno de los cambios más evidentes en los animales lesionados fue su mayor velocidad de nado con respecto a los controles sanos. En la figura 2 se muestran las velocidades promedio (media ± error estándar de la media) de nado de las ratas en los diferentes grupos de tratamiento). Puede notarse el aumento en la velocidad de nado en todos los grupos lesionados, con tratamiento o sin este.
El análisis estadístico utilizando un ANOVA unifactorial evidenció que el factor GRUPO tuvo una influencia significativa sobre esta variable (F4,83= 66,994). El análisis post hoc con el test de Tukey mostró que todos los grupos lesionados nadan significativamente más rápido que los controles sanos, pero no existen diferencias entre ellos.
Otra de las consecuencias que se describen en la literatura para esta lesión es una mayor tendencia a desplazarse a lo largo de las paredes, en este caso, de la piscina (tigmotaxia). Esta variable muestra un comportamiento similar entre los grupos lesionados, y obviamente diferente en los sanos, entre los que se reduce a valores muy bajos ya desde el primer día de entrenamiento (bloque 1.2) como muestra la figura 3. En esta figura se muestra el tiempo (media ± error estándar de la media) invertido por los animales de los diferentes grupos en nadar a lo largo de las paredes de la piscina circular (tigmotaxia). Puede notarse la permanencia de esta conducta en los animales lesionados en contraste con los controles sanos que rápidamente la abandonan.
El análisis estadístico de los grupos lesionados (ANOVA dos vías, mediciones repetidas) no mostró influencias significativas para el factor GRUPO (F3,68= 0,9349) aunque sí para el factor BLOQUE (mediciones repetidas, F3,68= 24,7932). Es decir todos los lesionados reducen la tigmotaxia en el curso de las sesiones de entrenamiento, pero ninguno de los tratamientos aplicados modificó sustancialmente esta conducta.
Para analizar el aprendizaje en el laberinto acuático de Morris se emplean comúnmente dos variables: la latencia de escape y la distancia recorrida hasta alcanzar la plataforma.
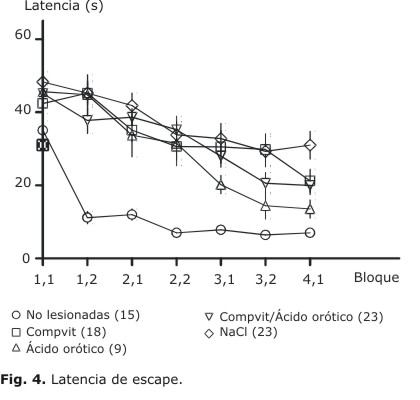
La figura 4 muestra el comportamiento de la latencia en los diferentes grupos experimentales (media± error estándar de la media). Es evidente que los animales sanos aprenden rápidamente a localizar la plataforma y resulta también obvio que ninguno de los tratamientos aplicados a las ratas lesionadas alcanza esos niveles de aprendizaje. Sin embargo, al compararlos entre sí, aparecen evidencias de un efecto positivo de algunos tratamientos. La comparación estadística de los grupos lesionados mostró efectos significativos para el factor BLOQUE (mediciones repetidas, F6,414= 39,475). No lo fue para el factor GRUPO (F3,69= 1,5469) pero sí se demostró una interacción significativa BLOQUE-GRUPO (F18,414= 1,7285). El análisis post hoc de esa interacción evidenció que el grupo tratado con solución salina no mostró ningún progreso significativo en el curso del entrenamiento, pero sí los grupos tratados. El grupo tratado con Compvit tuvo una reducción significativa de la latencia en el último bloque (4.1) con respecto al valor inicial (bloque 1.1). Por otra parte, los grupos tratados con ácido orótico y con la combinación de este con Compvit mostraron reducciones significativas desde el bloque 3.2 en adelante.
Algo semejante ocurre al analizar la distancia recorrida. En la figura 5 se muestra la distancia recorrida por los animales (media ± error estándar de la media) para encontrar (o no) la plataforma sumergida y escapar del agua. Nótese que los animales no lesionados aprenden rápidamente a localizar la plataforma y escapar del agua, lo que se evidencia en una reducción de la distancia, en contraste con los animales lesionados y tratados con salina que no muestran cambios significativos en esa variable, esto indica una deficiencia en su capacidad de aprendizaje. Los tratamientos con Compvit y su combinación con orótico mejoraron esta capacidad y los animales logran una reducción significativa de la latencia en el último bloque de ensayos (4.1). El tratamiento con orótico también lo hace, ya desde el bloque 3.1.También en este caso es evidente que los animales sanos aprenden rápidamente a localizar la plataforma y la alcanzan recorriendo una trayectoria más corta. De igual forma, ninguno de los grupos lesionados se acerca a los valores mostrados por esos controles sanos, que incluimos en las gráficas solo como referencia. La comparación de los grupos lesionados entre sí (ANOVA de dos vías, mediciones repetidas) evidenció efectos significativos del factor BLOQUE (mediciones repetidas, F6,414= 33,6631), no para el factor GRUPO (F3,69= 0,3045) pero sí para la interacción entre ambos (F18,414= 1,7421). El análisis post hoc con el test de Tukey demostró que los animales tratados con solución salina no mejoran en nada la distancia para encontrar la plataforma a lo largo del entrenamiento. Los animales tratados con orótico muestran una reducción significativa de esta variable ya desde el inicio del 3er. día de entrenamiento (bloque 3.1) mientras que los tratados con Compvit o con la combinación de ambos lo hacen el 4to. día (bloque 4.1).
La prueba con plataforma visible no evidenció diferencias significativas entre los grupos en ninguna de las variables que evalúan el aprendizaje (latencia y distancia). Todos pueden localizar y alcanzar la plataforma con igual eficacia (datos no mostrados).
DISCUSIÓN
El estudio histológico permitió confirmar la efectividad de la lesión de fimbria-fornix por transección realizada en este estudio. La región septal es la principal fuente de inervación colinérgica a toda la formación del hipocampo (cuerno de Ammon y giro dentado)29-31 y la casi total ausencia de marcadores colinérgicos (la actividad de la enzima acetilcolino esterasa en este caso) confirma que la lesión de fimbria-fornix realizada ha sido efectiva.
La mayor velocidad de nado mostrada por los animales lesionados es una consecuencia de la hiperlocomoción que caracteriza a esta lesión.30,32-34 De la misma forma, la lesión de esta estructura acentúa la natural tendencia tigmotáctica de los roedores35,36 algo que también resulta evidente en nuestros resultados. Estos datos confirman, además de la histología, la efectividad de la lesión realizada y constituyen una evidencia fuerte de que cualquier cambio en las capacidades de aprendizaje son debidas al tratamiento aplicado y no a una recuperación espontánea de la lesión.
El laberinto acuático de Morris es una prueba de memoria espacial en la cual los animales deben aprender a localizar la plataforma oculta bajo el agua empleando marcadores externos en el entorno inmediato, es decir en la habitación donde se realiza la prueba.37,38 La deprivación colinérgica al hipocampo producida por la lesión de fimbria-fornix o como consecuencia del envejecimiento tienen un fuerte impacto negativo sobre la capacidad de aprendizaje espacial de los animales.39-43
Los resultados obtenidos por evaluación de la latencia de escape sugieren un efecto beneficioso de los tratamientos con ácido orótico, Compvit o la combinación de ambos, cuando se comparan sus resultados con animales tratados con placebo (solución salina fisiológica). Pudiera objetarse que esta variable depende de la velocidad de nado y que esta resultó ser mayor en los animales lesionados. En contra de este argumento, está el hecho de que a pesar de nadar más rápido, ninguno de los grupos lesionados exhibió latencias de escape siquiera comparables con las mostradas por los controles sanos. Los animales lesionados invierten más tiempo que los sanos nadando en la periferia de la piscina (tigmotaxia), una característica que ninguno de los tratamientos fue capaz de modificar. Tomados en conjunto, estos argumentos favorecen la interpretación de que la reducción de la latencia de escape entre los animales tratados con vitaminas, es consecuencia de una mejoría en sus capacidades de aprendizaje, y no de una mayor velocidad de nado.
La distancia recorrida hasta la plataforma es preferida por algunos, como una variable más adecuada para evaluar el aprendizaje en el laberinto acuático de Morris.44 Nuestros resultados confirman un efecto positivo de los tratamientos vitamínicos también considerando esta variable.
Los mecanismos por los cuales se producen estos efectos benéficos sobre el aprendizaje son complicados, teniendo en cuenta las múltiples acciones centrales y periféricas de sustancias como las vitaminas incluidas en el Compvit® y el ácido orótico. Las 3 vitaminas del complejo incluidas en Compvit® intervienen en procesos metabólicos esenciales y su déficit puede causar alteraciones neurológicas, lo que indica su enorme importancia funcional. El ácido orótico es un precursor de nucleótidos de pirimidina y, por tanto esencial para la síntesis de ARN y glicoproteínas.23,45 Los procesos neuroplásticos que ocurren durante la formación de la memoria y la recuperación poslesión dependen de un eficiente metabolismo celular y de un aporte de precursores en cantidad suficiente para sustentar esos procesos.1
La acción benéfica de los nutrientes sobre los procesos neuroplásticos en el cerebro cobra cada día mayor atención y reconocimiento15,46 y ya se han realizado ensayos en humanos con B6 y B1218 con resultados favorables.
El presente trabajo constituye una evidencia adicional en favor del uso terapéutico en neurología de compuestos vitamínicos como parte del tratamiento neurorrestaurativo.
REFERENCIAS BIBLIOGRÁFICAS
1. Bergado Rosado JA, Almaguer Melian W. Mecanismos celulares de la neuroplasticidad. Rev Neurol. 2000;31:1074-95.
2. Kleim JA, Barbay S, Nudo RJ. Functional reorganization of the rat motor cortex following motor skill learning. J Neurophysiol. 1998;80:3321-5.
3. Nudo RJ. Adaptive plasticity in motor cortex: implications for rehabilitation after brain injury. J Rehabil Med. 2003:7-10.
4. Celnik PA, Cohen LG. Modulation of motor function and cortical plasticity in health and disease. Restor Neurol Neurosci. 2004;22:261-8.
5. Cohen LG, Chen R, Celnik P. Functional relevance of cortical plasticity. In: Grafman J, Christen Y, editors. Neuronal plasticity: Building a bridge from the laboratory to the clinic. Berlin: Springer-Verlag; 1999; p. 64-77.
6. Cauraugh JH. Coupled rehabilitation protocols and neural plasticity: upper extremity improvements in chronic hemiparesis. Restor Neurol Neurosci. 2004;22:337-47.
7. Komitova M, Johansson BB, Eriksson PS. On neural plasticity, new neurons and the postischemic milieu: An integrated view on experimental rehabilitation. Exp Neurol. 2006;199:42-55.
8. Lippert-Gruner M, Maegele M, Pokorny J, Angelov D, Svestkova O, Wittner M, et al. Early rehabilitation model shows positive effects on neural degeneration and recovery from neuromotor deficits following traumatic brain injury. Physiol Res. 2007;56:359-68.
9. Borlongan CV, Cahill DW, Sanberg PR. Locomotor and passive avoidance deficits following occlusion of the middle cerebral artery. Physiol Behav. 1995;58:909-17.
10. Ramic M, Emerick AJ, Bollnow MR, O'brien TE, Tsai SY, Kartje GL. Axonal plasticity is associated with motor recovery following amphetamine treatment combined with rehabilitation after brain injury in the adult rat. Brain Res. 2006;1111:176-86.
11. Apfel SC, Kessler JA. Neurotrophic factors in the treatment of peripheral neuropathy. Ciba Found Symp. 1996;196:98-108.
12. Bergado JA, Fernández CI, Gómez-Soria A, González O. Chronic intraventricular infusion with NGF improves LTP in old cognitively-impaired rats. Brain Res. 1997;770:1-9.
13. Fernández CI, Soto J, González O, González ME, Quijano Z. Neurorestorative techniques as experimental approach to Alzheimer's disease treatment. Mol Chem Neuropathol. 1995;24:241-4.
14. Lang UE, Muhlbacher M, Hesselink MB, Zajaczkowski W, Danysz W, Nker-Hopfe H, et al. No nerve growth factor response to treatment with memantine in adult rats. J Neural Transm. 2004;111:181-90.
15. Gomez-Pinilla F. Brain foods: the effects of nutrients on brain function. Nat Rev Neurosci. 2008;9:568-78.
16. Spencer JP. Food for thought: the role of dietary flavonoids in enhancing human memory, learning and neuro-cognitive performance. Proc Nutr Soc. 2008;67:238-52.
17. van der Beek EM, Kamphuis PJ. The potential role of nutritional components in the management of Alzheimer's Disease. Eur J Pharmacol. 2008;585:197-207.
18. Bryan J, Calvaresi E, Hughes D. Short-term folate, vitamin B@12 or vitamin B@6 supplementation slightly affects memory performance but not mood in women of various ages. J Nutr 2002;132:1345-56.
19. VITATOPS Trial Study Group. The VITATOPS (Vitamins to Prevent Stroke) Trial: rationale and design of an international, large, simple, randomised trial of homocysteine-lowering multivitamin therapy in patients with recent transient ischaemic attack or stroke. Cerebrovasc Dis. 2002;13:120-6.
20. Anastasi G, Antonelli ML, Biondi A, Vinci G. Orotic acid: a milk constituent Enzymatic determination by means of a new microcalorimetric method. Talanta. 2000;52:947-52.
21. Hallanger Le, Laakso Jw, Schultze Mo. Orotic acid in milk. J Biol Chem. 1953;202:83-9.
22. Bergado JA, Krug M, Ruthrich H, Matthies H. Orotate improves memory and enhances synaptic long-term potentiation in active avoidance behaviour in rats with perforant path stimulation as the conditioned stimulus. Eur J Pharmacol. 1988;157:155-63.
23. Bergado Rosado JA, Rüethrich H, Matthies H. La estimulación eléctrica de la vía perforante como estímulo condicionado en shuttle box. Efecto del orotato de metilglucamina sobre la retención. Rev Cubana Invest Biomed. 1987;6:347-59.
24. Ott T, Matthies H. Effect of orotic acid on the retrograde amnesia induced by electroconvulsive shock. Psychopharmacologia. 1971;20:16-21.
25. Matthies H, Fahse C, Lietz W. Effect of RNA-precursors on the maintenance of long-term memory. Psychopharmacologia. 1971;20:10-5.
26. Ruthrich HL, Wetzel W, Matthies H. Postnatal orotate treatment: effects on learning and memory in adult rats. Psychopharmacology (Berl). 1979;63:25-8.
27. Almaguer-Melian W, Vallejo A, Ramírez M, Capdevila V, Rosillo JC, Bergado-Rosado JA. Estudio comparativo de la lesión bilateral de corteza entorrinal y de la fimbria-fórnix. Rev Neurol. 2003;37:619-22.
28. Hedreen JC, Bacon SJ, Price DL. Modified Histochemical Technique to Visualize Acetylcholiesterase-containing Axons. J Histochem Cytochem. 1985;33:134-40.
29. Adelmann G, Deller T, Frotscher M. Organization of identified fiber tracts in the rat fimbria-fornix:an anterograde tracing and electron microscopic study. Anat Embryol (Berl). 1996;193:481-93.
30. Cassel J-C, Duconseille E, Jeltsch H, Will B. The fimbria-fornix/ cingular bundle pathways: a review of neurochemical and behavioural approaches using lesions and transplantation techniques. Prog Neurobiol. 1997;51:663-716.
31. Jackisch R, Neufang B, Hertting G, Jeltsch H, Kelche C, Will B, et al. Sympathetic sprouting: Time course of changes of noradrenergic, cholinergic, and serotonergic markers in the denervated rat hippocampus. J Neurochem. 1995;65:329-37.
32. Balse E, Suhr R, Haaf A, Kelche C, Jackisch R, Cassel JC. The potentiation of amphetamine-induced hyperlocomotion by fimbria-fornix lesions in rats is abolished by intrahippocampal grafts rich in serotonergic neurons. Neurosci Lett. 1999;265:79-82.
33. Cassel J-C, Cassel S, Galani R, Kelche C, Will B, Jarrard L. Fimbria-fornix vs selective hippocampal lesions in rats: Effects on locomotor activity and spatial learning and memory. Neurobiol Learn Mem. 1998;69:22-45.
34. Coutureau E, Galani R, Jarrard LE, Cassel JC. Selective lesions of the entorhinal cortex, the hippocampus, or the fimbria-fornix in rats: a comparison of effects on spontaneous and amphetamine-induced locomotion. Exp Brain Res. 2000;131:381-92.
35. Oddie SD, Kirk IJ, Gorny BP, Whishaw IQ, Bland BH. Impaired dodging in food-conflict following fimbria-fornix transection in rats: a novel hippocampal formation deficit. Brain Res Bull. 2002;57:565-73.
36. Devan BD, White NM. Parallel information processing in the dorsal striatum: relation to hippocampal function. J Neurosci 1999;19:2789-98.
37. Anglade F, Christin D, Marchaland C, Troullier G, Baudoin C, Chapouthier G. Analysis of the behaviour of rats in the Morris water-maze: new methodology and pharmacological application. C R Acad Sci Paris. 1993;316:603-6.
38. D'Hooge R, De Deyn PP. Applications of the Morris water maze in the study of learning and memory. Brain Res Rev. 2001;36:60-90.
39. Gallagher M, Nicolle MM. Animal models of normal aging: Relationship between cognitive decline and markers in hippocampal circuitry. Behav Brain Res. 1993;57:155-62.
40. Granholm AC, Sanders LA, Crnic LS. Loss of cholinergic phenotype in basal forebrain coincides with cognitive decline in a mouse model of Down's syndrome. Exp Neurol 2000;161:647-63.
41. Ikegami S, Shumiya S, Kawamura H. Age-related changes in radial-arm maze learning and basal forebrain cholinergic systems in senescence accelerated mice (SAM). Behav Brain Res. 1992;51:15-22.
42. Ikegami S. Behavioral impairment in radial-arm maze learning and acetylcholine content of the hippocampus and cerebral cortex in aged mice. Behav Brain Res. 1994;65:103-11.
43. Van der Zee CE, Lourensen S, Stanisz J, Diamond J. NGF deprivation of adult rat brain results in cholinergic hypofunction and selective impairmentes in spatial learning. Eur J Neurosci. 1995;7:160-8.
44. Carrillo-Mora P, Giordano M, Santamaría A. Spatial memory: Theoretical basis and comparative review on experimental methods in rodents. Behav Brain Res. 2009;203:151-64.
45. Rosenfeldt FL. Metabolic supplementation with orotic acid and magnesium orotate. Cardiovasc Drugs Ther. 1998;12 Suppl 2:147-52:147-52.
46. van Praag H. Exercise and the brain: something to chew on. Trends Neurosci. 2009;32:283-90.
Recibido: 5 de enero de 2011.
Aprobado: 20 de enero de 2011.
Lic. Olivia Teresa González Gay. Empresa de Producción de Biológicos "Carlos J. Finlay". Infanta No. 1162 esquina a Manglar, Centro Habana. La Habana, Cuba. Correo electrónico: tereggay@infomed.sld.cu.