Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd vol.36 no.1 Ciudad de la Habana ene.-mar. 2017
ARTÍCULO ORIGINAL
Fibras de quitosana-BSA bioinspiradas para aplicaciones en ingeniería de tejido del anillo fibroso de los discos intervertebrales
Bioinspired chitosan-BSA fibres for applications in intervertebral disc annulus fibrosus tissue engineering
Hazel Peniche Agüero,I,II Laurent David,III Carlos Peniche Covas,I,IV Anayancy Osorio-MadrazoII,V
I Centro de Biomateriales. Universidad de La Habana. La Habana, Cuba.
II Institute of Microsystems Engineering IMTEK-Sensors, "Albert Ludwig" University of Freiburg. Alemania.
III Polytech Lyon, UMR CNRS 5627 Ingénierie des Matériaux Polyméres IMP, Claude Bernard University of lyon 1. Francia.
IV Facultad de Química. Universidad de La Habana. La Habana, Cuba.
V Freiburg Materials Research Center FMF, "Albert Ludwig" University of Freiburg, D-79104 Freiburg. Alemania.
RESUMEN
Introducción: Recientemente, las fibras de quitosana están siendo utilizadas para fabricar o reforzar andamios o soportes para la ingeniería de tejidos, mejorando así sus propiedades biomecánicas. El hilado en disolución de la quitosana en interacción con proteínas no ha sido experimentado antes y puede ser utilizado para obtener fibras bioinspiradas del complejo quitosana-albúmina que tengan propiedades adecuadas y morfología similar a la del tejido fibroso presente en los discos intervertebrales y sirvan para su potencial reparación.
Objetivos: preparar y caracterizar fibras bioinspiradas del complejo de la quitosana con la albúmina de suero bovino por una técnica de hilado en húmedo para su uso potencial en la ingeniería de tejido del anillo fibroso de los discos intervertebrales.
Métodos: se estudiaron las condiciones experimentales para obtener complejos quitosana-proteína con propiedades en disolución apropiadas para el hilado. Se obtuvieron fibras de quitosana con albúmina de suero bovino por hilado en húmedo, se caracterizaron y se determinaron sus propiedades mecánicas.
Resultados: se obtuvieron fibras con una estructura microfibrilar similar a la quitina natural. Los espectros infrarrojos transformada de Fourier obtenidos por reflexión total atenuada evidencian la incorporación de albúmina de suero bovino en las fibras de quitosana. Las fibras de quitosana-albúmina poseen altos valores de módulo Young y resistencia a la fractura según revelan los ensayos micromecánicos.
Conclusiones: las fibras de quitosana-albúmina pueden ser obtenidas por el hilado en disolución de complejos de quitosana-albúmina sin el uso de ningún agente entrecruzante o postratamiento. Las fibras poseen propiedades mecánicas apropiadas para su uso como refuerzo de hidrogeles para aplicaciones como biomateriales para ingeniería de tejido de los discos intervertebrales. La albúmina de suero bovino fue usada como modelo de proteína globular, el próximo paso de este trabajo será el uso del colágeno para aplicación requerida.
Palabras clave: fibras de quitosana; complejo quitosana-BSA; hilado en húmedo; ingeniería de tejidos; discos intervertebrales.
ABSTRACT
Introduction: Recently, chitosan fibers are being used to fabricate or reinforce scaffolds or supports for tissue engineering, thus improving their biomechanical properties. Wet spinning of chitosan and protein in solution has not been assessed before and can be used to obtain bioinspired fibers of chitosan-albumin complex having suitable properties and morphology similar to fibrous tissue present in the intervertebral discs and support their potential repair.
Objective: The aim of this work is the preparation and characterization of bioinspired fibers of the complex of chitosan with bovine serum albumin (BSA) by a wet-spinning technique as a potential biomaterial for tissue engineering the annulus fibrous of intervertebral discs (IVD).
Methods: The experimental conditions to obtain chitosan-protein complexes suitable for spinning were studied. The Chitosan-BSA fibers obtained by wet-spinning were characterized and their mechanical properties were determined.
Results: Fibres with a microfibrilar structure similar to native chitin fibres were obtained. ATR-FTIR spectra evidence the BSA incorporation into chitosan fibres. Chitosan-BSA fibres have high Young modulus and stress at break values as revealed by microtensile tests.
Conclusions: Chitosan-BSA fibers can be obtained by wet- spinning of chitosan-BSA complexes without any use of cross-linking agents or post-treatments. The fibres exhibited suitable mechanical properties for their use in fiber-reinforced hydrogel biomaterials for IVD tissue engineering applications. BSA was chosen here as a model globular protein. For the claimed application, collagen should be the next step.
Key words: Chitosan fibers, chitosan-BSA complex, wet-spinning, tissue engineering, intervertebral disc.
INTRODUCCIÓN
La degeneración de los discos intervertebrales (DIV) puede ocurrir por diversas causas, como son: la realización de cargas o esfuerzos excesivos, cambios bioquímicos, una nutrición reducida, y la predisposición genética, esto trae como consecuencia un fallo estructural del anillo fibroso (AF) que provoca una herniación del núcleo pulposo (NP). Estas hernias pueden afectar a los nervios espinales adyacentes y causan dolores que pueden llegar a ser crónicos.1
El dolor lumbar es una causa importante de discapacidad y puede tener consecuencias socioeconómicas significativas. Los tratamientos comunes actuales para las hernias discales implican la discectomía, la escisión y la fusión de los cuerpos vertebrales adyacentes. Sin embargo, estos tratamientos comprometen la función biomecánica normal de la columna y pueden conducir a la degeneración de los segmentos adyacentes.2,3 Existen también estrategias de reemplazo de disco artificial con biomateriales, pero la cirugía es invasiva y la prótesis se desgasta con el tiempo. Debido a la incapacidad de los métodos actuales para revertir el daño y regenerar los tejidos de los DIV, se ha propuesto una estrategia curativa en la resección de la hernia discal que consiste en la eliminación del NP y parte o la totalidad del AF y la implantación de un cierre bioactivo/sutura adecuado basado en biomateriales compuestos.4 El AF rodea el NP y es el principal responsable de atenuar las fuerzas de tracción generadas en el NP.5 EL AF externo está compuesto de laminillas concéntricas de fibras de colágeno tipo I principalmente.6,7
Los biomateriales empleados deben asegurar y sustituir las funcionalidades biológicas y mecánicas del tejido resecado no sólo a corto plazo, sino también en el tiempo necesario para la regeneración de los tejidos del AF. Para cumplir con estos requisitos se han utilizado diferentes polímeros para desarrollar materiales reforzados con fibras para aplicaciones en la reparación de los DIV. Estos incluyen poliuretanos, caucho de silicona, policaprolactona, poli(lactida-co-glicolida) (PLGA), poli(L-lactida) (PLA), polietileno, ácido hialurónico y quitosana, entre otros.4,8,9 Otro polímero de forma potencial adecuado para esta aplicación es la quitina.
La quitina es un polisacárido lineal compuesto casi de manera exclusiva de unidades de N-acetil-2-amino-2-deoxi-D-glucosa unidas entre sí por enlaces glicósidicos β (1 → 4). La quitina se combina con proteínas para formar materiales compuestos que constituyen el soporte estructural en la cutícula de los artrópodos (crustáceos, insectos, arácnidos) entre otras especies. En la naturaleza, las macromoléculas de quitina se ensamblan de forma espontánea en microfibrillas.10,11
Simulándose la estructura y la alta resistencia de la cutícula de los artrópodos, se podrían obtener fibras quitina-proteína para refuerzo de biomateriales del tipo hidrogeles para la regeneración tisular del AF de los DIV. Sin embargo, la insolubilidad de la quitina en un sistema acuoso se opone a la preparación de estas fibras por hilado. En contraste, la quitosana (QUIT), polisacárido obtenido por la desacetilación extensiva de la quitina, es soluble en disoluciones acuosas diluidas de ácidos.
La quitosana, por ser un polisacárido catiónico puede formar complejos por medio de interacciones electrostáticas con proteínas cargadas de forma negativa. La interacción de la quitosana con proteínas se ha estudiado de manera principal con el objetivo de utilizar la quitosana como un vehículo farmacéutico para mejorar la absorción de agentes terapéuticos macromoleculares (péptidos, proteínas y antígenos y ADN).12 La magnitud de tales interacciones depende de numerosos factores: el grado de acetilación y el peso molecular de la quitosana, el pH, el punto isoeléctrico de la proteína y la naturaleza de la propia proteína, entre otros.13
El hilado en disolución de la quitosana en interacción con proteínas no ha sido experimentado antes. Inspirándonos en la forma en que producen las fibras de quitina los insectos y crustáceos, nos proponemos llevar a cabo el hilado de disoluciones de quitosana-proteína para obtener fibras bioinspiradas del complejo QUIT con la albúmina de suero bovino (BSA).
MÉTODOS
FORMACIÓN DEL COMPLEJO QUITOSANA-BSA
Se utilizó quitosana producida a partir de pluma de calamar (G.A= 2,7 ± 0,5, PM= 5,4 x 105 Da). Se prepararon disoluciones de quitosana al 0,5; 1,0; 1,5 y 2,0 % (m/v) en ácido acético al 1 % (v/v). El pH de las disoluciones fue ajustado a 5. Las disoluciones permanecieron bajo agitación magnética durante toda la noche para garantizar la completa disolución del polímero. Estas disoluciones se gotearon sobre disoluciones acuosas de BSA al 1 % (m/v) libre de proteasa (pH = 7) con agitación constante en un homogeneizador a 3400 rpm. Las partículas formadas por interacción de la quitosana con la BSA de caracterizaron en cuanto a tamaño promedio y potencial ζ, empleándose un Zetasizer.
PREPARACIÓN DE LAS FIBRAS POR HILADO EN DISOLUCIÓN
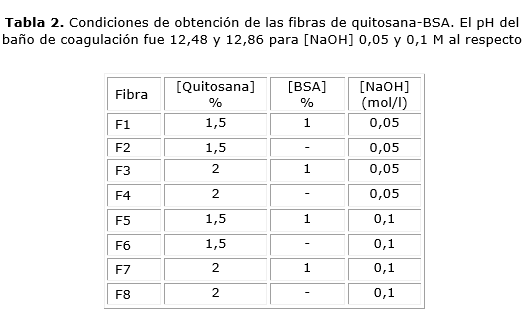
Se adicionaron 0,1g de BSA en 100ml de disolución de quitosana 1,5 % y al 2 % (m/v) en ácido acético en concentraciones estequiométricas (pH= 6) manteniéndose una agitación constante. Para obtener las fibras, la disolución de quitosana-BSA se inyectó en el baño de coagulación alcalino (NaOH 0,05 y 0,1 M), pH= 12,48-12,86, usándose un equipo de extrusión con la boquilla sumergida en el baño de coagulación. La presión durante la extrusión varió desde 0,30 bar para las disoluciones de quitosana al 1,5 %, hasta 0,45 bar para las disoluciones de quitosana al 2 %, manteniéndose todo el tiempo una agitación suave. Después de 1 h, las fibras fueron lavadas con agua destilada hasta la neutralidad. Detrás se secaron al aire a temperatura ambiente (25 ºC).
Se obtuvieron también fibras de quitosana por el mismo procedimiento, pero en ausencia de BSA.
COMPOSICIÓN Y MORFOLOGÍA DE LAS FIBRAS
Los espectros infrarrojos se obtuvieron mediante espectroscopía infrarroja transformada de Fourier con reflexión total atenuada (FTIR-ATR).
Mediante la microscopía electrónica de barrido ambiental (MEBA) se determinó la morfología de las fibras obtenidas. El análisis se realizó con una resolución de hasta 10 nm, profundidad de hasta > 10 μm y rango de imagen de hasta 300 μm.
ENSAYOS MICROMECÁNICOS
Las pruebas mecánicas se realizaron en un equipo 'home-made' para ensayos de microtracción. Se utilizaron muestras de fibras con un aproximado de 1 mm de diámetro y 7 mm de longitud. Las muestras se pegaron con pegamento de cianoacrilato a una lámina de ensayo tomándose una distancia de prueba de 7 mm. La lámina con la muestra se montó en el equipo de microanálisis. La fibra fue estirada uniaxialmente a una velocidad constante de 0,2 μm/s. La fuerza aplicada F se midió con una celda de carga de capacidad máxima de 50 N. Los valores de tensión nominal σ = F/(A) y deformación fueron determinados teniéndose en cuenta las dimensiones originales de la muestra. Se midieron al menos tres muestras diferentes de la fibra bajo las mismas condiciones experimentales. Las propiedades mecánicas (Módulo de Young y resistencia a la fractura) fueron determinadas a partir de la curva tensión-deformación. El módulo de Young corresponde al valor de la pendiente en la parte inicial de la curva donde ocurren las deformaciones elásticas. La resistencia a la fractura es el punto máximo de la curva o punto de máxima tensión.
RESULTADOS
La formación del complejo quitosana-BSA quedó evidenciada por la aparición de turbidez al adicionar las disoluciones de quitosana a la disolución de BSA a pH 7, debido a la formación de nanopartículas del complejo quitosana-proteína en las condiciones experimentales empleadas. Como se aprecia en la tabla 1, en todos los caso se obtienen nanopartículas con carga positiva, con valores que varían según la concentración de la disolución de quitosana empleada. Como era esperado, teniéndose en cuenta las concentraciones de quitosana y BSA utilizadas, valores positivos del potencial zeta ζ quedaron determinados por la quitosana. Luego, ζ disminuyó a medida que aumentó la concentración de BSA. Un aumento del tamaño promedio de partícula al aumentar la concentración de quitosana confirma la alta viscosidad y propiedades gelificantes aportadas al sistema por el polímero de alto peso molecular quitosana. La adición de la BSA a las disoluciones de quitosana en ácido acético en concentraciones estequiométricas y pH = 6 produjo soluciones homogéneas a partir de las cuales se obtuvieron las fibras de quitosana-BSA. En la figura 1 se muestran para comparación los espectros ATR-FTIR de una fibra de quitosana y una fibra del complejo quitosana-BSA. El espectro de las fibras de quitosana-BSA muestra las bandas de absorción características de la quitosana (1580,1154 y 1044-1024 cm -1) y la BSA (1653 y 1586 cm-1). Otras bandas señaladas en el espectro son comunes a ambos.
Las muestras de las fibras de quitosana y QUIT-BSA tienen un diámetro de ~ 1mm y una longitud de ~ 7mm.
Las micrografías de microscopía electrónica de barrido (Fig. 2) muestran que la fibra del complejo quitosana-BSA presenta una superficie más lisa que la fibra de quitosana y una estructura microfibrilar compacta.
En la figura 3 se muestra la curva esfuerzo-deformación obtenida para una fibra de quitosana 2 % - BSA 1 %. Los valores de módulo de Young y resistencia a la tracción obtenidos para las fibras de quitosana-BSA fueron de 1,08 ± 0,02 GPa y 83,06 MPa respectivamente. Estos valores están en correspondencia con las propiedades de tracción de fibras de colágeno tipo I, que constituyen las fibras de refuerzo del tejido anillo fibroso de los discos intervertebrales.
DISCUSIÓN
Es conocido que debido a su comportamiento como polímero policatiónico en disolución, la quitosana forma complejos con polianiones. En dependencia de las condiciones experimentales se puede obtener disoluciones homogéneas, coacervados o complejos insolubles. Los resultados reportados en la tabla 2 muestran que a los valores de pH y concentración de quitosana y proteína empleados, se obtuvieron complejos insolubles de tamaño nanométrico y carga superficial positiva. Esta carga superficial resultó suficiente para mantener el sistema como una dispersión coloidal estable.
No obstante, para formar las fibras de complejo quitosana-BSA mediante la técnica de hilado húmedo es necesario partir de una disolución homogénea. Esto se logra disolviéndose la quitosana en ácido acético en cantidades estequiométricas y empleándose las condiciones experimentales descritas y listadas en la tabla 2. El pH de la disolución de quitosana no debe ser demasiado bajo y el del baño de coagulación no debe ser muy alto para evitar la desnaturalización de la BSA.
La espectroscopía de FTIR permitió evidenciar la incorporación de la BSA en las fibras de quitosana por la presencia de las banda Amida I a 1653 cm-1 y Amida II, a 1580 cm-1 . En las fibras de quitosana sola, no se observa la banda amida debido a que la quitosana usada en este trabajo tiene un grado de acetilación muy bajo (DA = 2,7 ± 0,5) y los grupos amida de las unidades de N-acetilglucosamida están en muy baja proporción. Por otro lado, en el espectro de las fibras de QUIT-BSA aparecen las bandas de vibración del esqueleto polisacárido de la quitosana que no están presentes en el espectro de la albúmina (no se muestra).
Las fibras de quitosana-BSA obtenidas presentan una microestructura fibrilar (Fig. 2) similar a la de la quitina en estado natural y que a su vez tiene similitud estructural con las fibras de colágeno presentes en los discos intervertebrales.
El hilado de disoluciones de quitosana suele producir fibras con propiedades mecánicas moderadas. Por ejemplo, N. Dresvyanina y colaboradores 14 emplearon una técnica de hilado en disolución para obtener fibras de quitosana, usándose un baño de coagulación con NaOH 10 % y Etanol 1:1, con concentraciones de quitosana 4 % (m/v) y obtuvieron fibras con Módulo de Young de 1,61±0,9- hasta 7,93±1,0 GPa y resistencia a la fractura entre 58±14 y 225±18 MPa para su uso como suturas reabsorbibles y como matrices para reparación de cartílago y músculo.14 Para obtener fibras de quitosana con propiedades mecánicas superiores (módulos elásticos de 3 a 8 GPa), L. Notin y colaboradores 15 emplearon una técnica de hilado semi-seco con el objetivo de con aplicación potencial en herniaplastias y suturas.15
En la figura 3 se muestra la curva tensión-deformación obtenida para una fibra de quitosana 2 %-BSA 1 %. El módulo de Young obtenido para la fibra fue de 1,08 ± 0,02 GPa y la resistencia a la fractura de 83,06 Mpa. Un DIV humano sano soportando una carga de 490 N tiene un módulo elástico de 16,37 Mpa.16 Es válido destacar que en el DIV la presión hidrostática del núcleo pulposo se encarga de soportar la carga de comprensión aplicada. El anillo fibroso es quien presenta un alto porcentaje de fibras de refuerzo de colágeno y actúa como un vaso de presión de paredes espesas para contener la presión interna del núcleo pulposo. Así, el anillo fibroso con sus fibras de refuerzo juega un rol fundamental en los movimientos de flexión y extensión de la columna vertebral.17
Las propiedades mecánicas de las fibras de quitosana-BSA obtenidas comparan de manera satisfactoria con fibras similares reportadas por otros autores para su uso como refuerzo de matrices de hidrogeles para la regeneración en ingeniería de tejidos. Por ejemplo, V. Beachley y X. Wen obtuvieron por la técnica de electrospinning una matriz de gelatina reforzada con nanofibras de policaprolactona para ser empleada como implante en ingeniería de tejido de AF, con módulo elástico de 20 a 120 Mpa y resistencia a la fractura de 5 a 25 Mpa.18 Pavel Dutov y colaboradores midieron el módulo elástico de fibras de colágeno de tendón de cola de rata de 162 nm de diámetro y obtuvieron valores entre 100 y 360 MPa.19
Estos resultados muestran que es posible obtener fibras de complejos de quitosana con proteínas con una morfología similar a la de los complejos quitina-proteína de origen animal, con propiedades mecánicas adecuadas para su potencial empleo como refuerzo de matrices de hidrogeles para la reparación del DIV mediante ingeniería de tejidos.
AGRADECIMIENTO
Al Dr. M. Ruggeberg y al Prof. I. Burgert, Institute for Building Materials, ETH - Swiss Federal Institute of Technology Zurich, CH-8093 Zurich, Switzerland por su ayuda en la realización de los ensayos micromecánicos. También agradecen al Servicio Alemán de Intercambio Académico, Deutscher Akademischer Austauschdienst (DAAD) por el apoyo financiero que hizo posible la realización de este trabajo.
APOYO FINANCIERO
Centro de Biomateriales de la Universidad de La Habana.
DECLARACIÓN DE CONFLICTOS DE INTERESES
Los autores declaran que no existen conflictos de intereses entre las partes o instituciones.
REFERENCIAS BIBLIOGRÁFICAS
1. Iatridis JC, Nicoll SB, Michalek AJ, Walter BA, Gupta MS. Role of biomechanics on intervertebral disc degeneration and regenerative therapies: What needs repairing in the disc andwhat are promising biomaterials for its repair? Spine J. 2013;13(3):243-62.
2. Bailey A, Araghi A, Blumenthal S, Huffmon GV. Prospective Multicenter, Randomized, Controlled Study of Anular Repair in Lumbar Discectomy. Spine. 2013;38(14):1161-9.
3. O'Connell GD, Malhotra NR, Vresilovic EJ, Elliott DM. The Effect of Discectomy and the Dependence on Degeneration of Human Intervertebral Disc Strain in Axial Compression. Spine. 2011;36(21):1765-71.
4. Pei BQ, Li H, Zhu G, Li DY, Fan YB, Wu SQ. The Application of Fiber-Reinforced Materials in Disc Repair BioMed Research International. 2013;2013:10. ID 714103.
5. Smith LJ, Nerurkar NL, Choi KS, Harfe BD, Elliott DM. Degeneration and regeneration of the intervertebral disc: lessons from development. Dis Model Mech. 2011;4(1):31-41.
6. O'Halloran DM, Pandit AS. Tissue-engineering approach to regenerating the intervertebral disc. Tissue Eng. 2007;13(8):1927-54.
7. Schollmeier G, Lahr-Eigen R, Lewandrowski KU. Observations on fiber-forming collagens in the anulus fibrosus. Spine J. 2000;25:2736-41.
8. Osorio-Madrazo A, Fratzl P, Davi L, Urban G, Montembault A, Crepet A, et al. Hydrogel nanocomposite biomaterials for intervertebral disc tissue engineering. Preparation, characterization and application. Bionanomaterials. 2015;16:236-55.
9. Visser J, Melchels FPW, Jeo E, vanBussel EM, Kimpton LS, Byrne HM, et al. Reinforcement of hydrogels using three-dimensionally printed microfibers. Nature Communications 2015;6:1-10.
10. Chanzy H. Chitin crystals. In: Domard A, Varum KM, Muzzarelli RAA, editors. Advances in Chitin Science Proceedings of the 7th International Conference on Chitin and Chitosan. Lyon: Jacques André Publisher; 1998. p. 11.
11. Muzzarelli RAA. Chitin New York: Pergamon Press; 1977.
12. Amidi M, Mastrobattista E, Jiskoot W, Hennink WE. Chitosan-based delivery systems for protein therapeutics and antigens. Adv Drug Deliv Rev. 2010;62:59-82.
13. Yuan Y, Wan ZL, Yang XQ, Yin SW. Associative interactions between chitosan and soy protein fractions: Effects of pH, mixing ratio, heat treatment and ionic strength. Food Research International. 2014;55:207-14.
14. Dresvyanina EN, Dobrovolskaya IP, Popryadukhin PV, Yudin VE, Ivankova EM, Elokhovskii VY, et al. Influence of spinning conditions on properties of chitosan fibers. Fibre Chemistry. 2013;44(5):280-3
15. Notin L, Viton C, David L, Alcouffe P, Rochas C, Domard A, et al. Morphology and mechanical properties of chitosan fibers obtained by gel-spinning: Influence of the dry-jet-stretching step and ageing. Acta Biomaterialia. 2006;2:387-402.
16. Bomshtein KG, Danilov VI, Pravetskii VN. Statics and dynamics of intervertebral discs. Mechanics of Composite Materials. 1980;15(4):419-23.
17. Sato K, Kikuchi S, Yonezawa T. In vivo intradiscal pressure measurement in healthy individuals and in patients with ongoing back problems. Spine J. 1999;24:2468-74.
18. Beachley V, Wen X. Fabrication of nanofiber reinforced protein structures for tissue engineering. Materials Science and Engineering C. 2009;29(8):2448-53.
19. Dutov P, Antipova O, Varma S, Orgel JPRO, JD. Schieber Djp. Measurement of Elastic Modulus of Collagen Type I Single Fiber. PLOS ONE. 2016. DOI:101371/journalpone0145711.
Recibido: 17 de noviembre de 2016.
Aprobado: 12 de diciembre de 2016.
Hazel Peniche Agüero. Centro de Biomateriales. Universidad de La Habana. La Habana, Cuba.
Correo electrónico: hazel@biomat.uh.cu