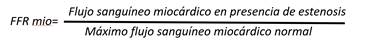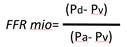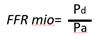Introducción
A lo largo de la historia, el estudio de la circulación coronaria se ha relacionado con la comprensión de sus principios fisiológicos y las consecuencias de sus trastornos en el corazón. Las pruebas invasivas y no invasivas permiten conocer el estado funcional. En los últimos años ha aumentado el uso de las técnicas de fisiología intracoronaria porque contribuyen a un diagnóstico más preciso en cardiopatía isquémica,1 y un tratamiento personalizado; además de mejorar la planificación de los procedimientos, evaluar los resultados funcionales posteriores a la intervención coronaria percutánea (ICP) y guiar su optimización.2
El empleo de un enfoque práctico sobre la evaluación fisiológica de lesiones epicárdicas, a partir de índices invasivos y pruebas de vasorreactividad coronaria, merece una revisión actualizada y detallada. La fisiología en la planificación de procedimientos constituye un área de creciente interés; por tanto, se requiere conocer la evidencia actualizada, las técnicas disponibles y su interpretación adecuada.
Esta revisión ofrece un enfoque, con implicación clínica, sobre la fisiología coronaria epicárdica. Asimismo, muestra una perspectiva novedosa sobre la efectividad de una intervención guiada por estrategias que garantizan una ganancia fisiológica y brindan una medicina personalizada de precisión. El objetivo de este artículo fue describir las recomendaciones de la literatura médica con respecto a la fisiología coronaria en la cardiopatía isquémica.
Principios básicos de la circulación coronaria
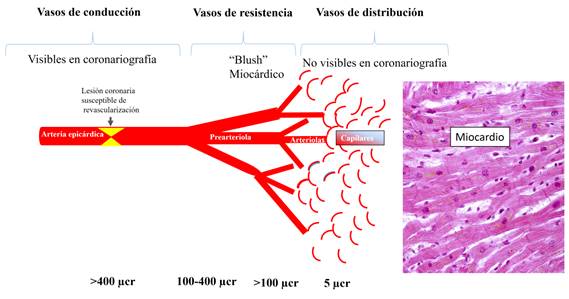
Para la valoración funcional de la circulación coronaria epicárdica se deben recordar algunos aspectos anatómicos y fisiológicos, esenciales en la adecuada interpretación de sus resultados. Desde el punto de vista anatómico, la circulación coronaria se separa en tres compartimientos:
Compartimiento de conducción: corresponde a las arterias coronarias epicárdicas visibles en la angiografía, con un diámetro mayor a 400μm. Estas presentan una distribución en árbol con ramas bifurcadas. En condiciones fisiológicas normales, sin estenosis, su contribución a la resistencia al flujo sanguíneo resulta prácticamente nula.
Compartimento de resistencia: se constituye por las prearteriolas (vasos entre 400 y 100μm de diámetro) y las arteriolas (< 100μm), las cuales son responsables de la autorregulación del flujo coronario. Se visualizan en la coronariografía invasiva como blush miocárdico. La circulación a través de este compartimiento se controla mediante variaciones en el tomo vascular que limitan su diámetro. En las primeras, mediado por el sistema nervioso autónomo, la función endotelial en respuesta a la tensión de cizallamiento de la pared, el propio flujo coronario, la presión intravascular y el tono del músculo cardíaco. En las segundas, por la presión de perfusión al inicio del compartimento y el metabolismo miocárdico. Constituyen el compartimento diana de los estímulos vasodilatadores en los distintos test funcionales.
Compartimento de distribución: se compone por los capilares que, sin variar su tono vascular, varían su diámetro (5μm aproximadamente) en función de la presión intravascular y, externamente, por la contractilidad miocárdica.3) Este compartimiento se considera una red independiente de las regiones irrigadas por las arterias epicárdicas (fig. 1).
Determinantes del flujo coronario
El gradiente de presión entre la arteria aorta y el sistema venoso genera los flujos de irrigación sistémica. La resistencia del sistema microvascular y capilar de estos órganos resulta constante, y garantiza que la mayoría de ellos reciba un flujo continuo a los cambios de presión aórtica.
No obstante, el flujo coronario no se comporta como el resto de los circuitos sistémicos por varios motivos. Primero, la mayor parte de la perfusión cardíaca se realiza en diástole. Durante la sístole ventricular los capilares intramiocárdicos colapsan y modifican la resistencia al flujo sanguíneo con incrementos rápidos y severos al inicio de la sístole (denominada ola de compresión) y, posteriormente, al inicio de la diástole, se abren rápidamente y provocan caídas marcadas de la resistencia (denominada ola de descompresión). Segundo, en reposo, se eleva la demanda de oxígeno del miocardio, casi 200 veces más que la del músculo esquelético, y la extracción tisular de oxígeno se acerca al 80 %, a diferencia del músculo esquelético que ronda el 30 %.
Este mecanismo provoca que, ante una mayor demanda de oxígeno por parte del miocardio, por ejemplo, durante el ejercicio, se incremente el flujo coronario; además, contrasta con el de otros órganos que al aumentar el flujo de irrigación también amplían considerablemente la extracción tisular de oxígeno.
Autorregulación del flujo coronario
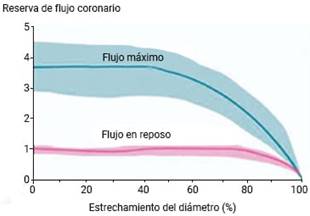
La autorregulación coronaria constituye la capacidad de la circulación para mantener el flujo constante, a pesar de los cambios en la presión de perfusión, y adaptarse a las necesidades de oxígeno del miocardio. En ausencia de estenosis, entre 130 y 70 mmHg, el flujo coronario permanece continuo por los cambios en el nivel de vasodilatación arteriolar. Por debajo de 40-45 mmHg, se alcanza el máximo de vasodilatación, no se mantiene el flujo coronario y aparece isquemia subendocárdica. Esta regulación es mayoritariamente endotelio dependiente, mediante la generación de óxido nítrico en respuesta a la tensión de cizallamiento de la pared.
El flujo coronario también se adapta a las necesidades de oxígeno del miocardio de forma endotelio-independiente; lo cual se regula mediante el consumo de adenosina trifosfato por el músculo cardíaco que la libera al espacio extracelular. En este medio la adenosina resulta un potente vasodilatador de microcirculación e incrementa el flujo coronario. La diferencia entre el flujo en reposo y el flujo máximo, que llega a un determinado territorio, se denomina reserva coronaria y depende, en ausencia de estenosis, de la capacidad de vasodilatación de la circulación coronaria en esa zona del corazón.4
Ante una lesión coronaria epicárdica, según su grado de estenosis, el lecho arteriolar distal compensará mediante vasodilatación la caída de presión ocasionada por la estenosis. En consecuencia, la capacidad de respuesta al requerimiento máximo de flujo en ese territorio estará parcialmente comprometida en situación basal y obtendrá una menor reserva coronaria. En pacientes con una buena función microvascular, no se detectan caídas de la reserva de flujo coronario en reposo hasta que la obstrucción epicárdica no supera el 90 % de estenosis. En situación de hiperemia máxima, puede caer la reserva de flujo coronario con lesiones de un diámetro de estenosis mayor al 70 % (fig. 2).4
Evaluación fisiológica, planificación y estrategia de revascularización
En la enfermedad arterial coronaria, la isquemia miocárdica se considera un predictor de riesgo importante para el desenlace de eventos clínicos adversos.5,6,7 Su extensión y severidad resultan útiles para la estratificación de riesgo.8
Mientras más inducible es la isquemia miocárdica, aumenta el riesgo de muerte o infarto de miocardio. El tratamiento farmacológico puede aliviar los síntomas del paciente al reducir la isquemia, inhibir la progresión de la enfermedad o evitar las complicaciones de las placas existentes; sin embargo, si prevalece una cantidad sustancial de miocardio isquémico, la restauración del flujo sanguíneo, mediante la revascularización de la arteria coronaria, se considera más eficaz para reducir la isquemia.7,8,9 Varios estudios han mostrado mejores resultados clínicos para la revascularización en comparación con la terapia médica.10,11,12,13
En cambio, para las arterias coronarias estenóticas, que no inducen isquemia miocárdica, el beneficio de la revascularización es menos claro. Incluso, después de 15 años de seguimiento a pacientes con estenosis única y reserva fraccional de flujo (FFR) negativa, la revascularización mediante ICP no ofrece ninguna ventaja sobre el tratamiento médico.14) Tal como recomiendan las guías actuales para el tratamiento de la enfermedad arterial coronaria, la presencia de isquemia miocárdica debería desempeñar un papel fundamental en el proceso de toma de decisiones sobre la revascularización coronaria.15
La coronariografía invasiva resulta fundamental en el estudio de las arterias coronarias. No obstante, tiene un valor limitado para definir el significado fisiológico de una estenosis. En este sentido, “fisiológicamente significativo” significa “funcionalmente significativo”, “hemodinámicamente significativo” o “asociado a isquemia inducible en caso de estrés”. Actualmente la coronariografía invasiva sigue siendo la técnica estándar.
En muchos pacientes las decisiones de revascularización se basan en la evaluación angiográfica visual de las estenosis de las arterias coronarias, junto con los datos clínicos y los estudios de imágenes no invasivos. Sin embargo, posee limitaciones bien reconocidas.16,17,18) Se ha demostrado que la estimación visual de la gravedad de la estenosis varía entre diferentes operadores e, incluso, la variabilidad intraobservador se incrementa.19,20 Cuando se utiliza la coronariografía invasiva para esta evaluación se predice mal la importancia funcional de la estenosis.18 Por tanto, un enfoque fisiológico inducible, que señale isquemia miocárdica relacionada con dicha estenosis, debería ser la indicación de la revascularización.
El estudio FAME comparó la medición rutinaria de la importancia fisiológica de una lesión mediante la FFR con la coronariografía invasiva para guiar la ICP en pacientes con enfermedad arterial coronaria multivaso. El análisis de las lesiones mostró las imprecisiones de la coronariografía invasiva para evaluar la importancia funcional de una estenosis coronaria, en comparación con FFR, no solo en el rango del 50 al 70 %, sino también en las lesiones del 71 al 90 % de estenosis angiográfica. La figura 3 presenta un diagrama de cajas y bigotes que muestra los valores de FFR de las lesiones en las categorías de estenosis de diámetro entre el 50-70 %, el 71-90 % y el 91-99 %, según la estimación visual basada en la coronariografía invasiva.21
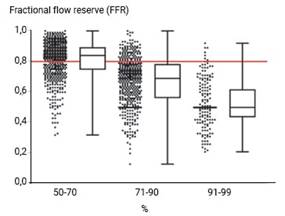
Fig. 3 Severidad angiográfica frente a severidad funcional de la estenosis arterial coronaria en el estudio FAME.
Durante la última década, las críticas sobre el uso de la angiografía sola para guiar la revascularización se han extendido a la decisión de cuándo se ha logrado un resultado funcional óptimo de la intervención.22 Tal crítica se apoya por los resultados funcionales subóptimos identificados en vasos a pesar de un resultado angiográfico satisfactorio de la ICP.22,23 Se considera que estos hallazgos funcionalmente subóptimos tienen relevancia pronóstica.24,25,26,27,28,29,30 Por tanto, el estudio fisiológico garantiza un diagnóstico más preciso, y ofrece una estrategia personalizada. Su orientación mejora la planificación del procedimiento y optimiza el resultado de la ICP.23
Evaluación de lesiones fisiológicas mediante reserva de flujo fraccional
La FFR constituye un índice muy preciso y específico de la lesión coronaria para indicar si una estenosis puede provocar isquemia. Esto facilita la revascularización en el laboratorio de cateterismo cardíaco.30,31,32,33,34 En pacientes con síndrome coronario crónico, diferir la colocación de stent en una estenosis FFR negativa se considera seguro y se asocia con un excelente resultado a largo plazo. También se ha indicado que la revascularización de una estenosis FFR positiva se relaciona con una disminución significativa de la isquemia y un mejor efecto.13,35
La FFR consiste en un índice meramente epicárdico y solo revela la severidad funcional; no aporta información sobre la microcirculación ni la aterotrombogenicidad de la lesión o sus características histológicas. Cuando se sospecha un síndrome coronario agudo por componente aterotrombótico se considera mejor guiar la decisión por imagen intravascular y no por fisiología.
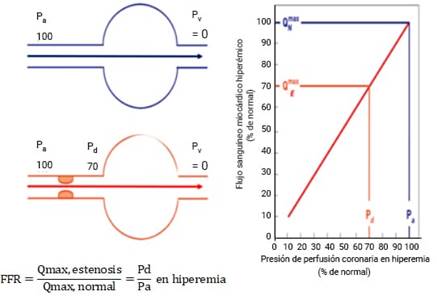
La FFR constituye el flujo sanguíneo máximo alcanzable a un territorio miocárdico ante una estenosis, como una relación con el flujo sanguíneo máximo en la situación en que el vaso de suministro sería completamente normal.30) En otras palabras, la FFR expresa el porcentaje de flujo sanguíneo máximo en presencia de una estenosis con respecto al teórico de esa arteria si no tuviera la estenosis. Este índice no depende del flujo en reposo ni de las condiciones hemodinámicas cambiantes, tiene un valor normal de 1,0 para cada paciente y arteria, e incluye la extensión del área de perfusión y la presencia de colaterales.
El concepto de FFR se desarrolló para investigar el significado funcional de una estenosis de la arteria coronaria4 y se considera el estándar de oro para la detección de isquemia miocárdica relacionada con esta afección. Actualmente constituye una herramienta diagnóstica utilizada para la toma de decisiones clínicas en muchos laboratorios de cateterismo cardíaco. Establece una relación de flujos, fácilmente medible, mediante la presión coronaria distal y la presión aórtica en hiperemia máxima (fig. 4).
Medición de FFR
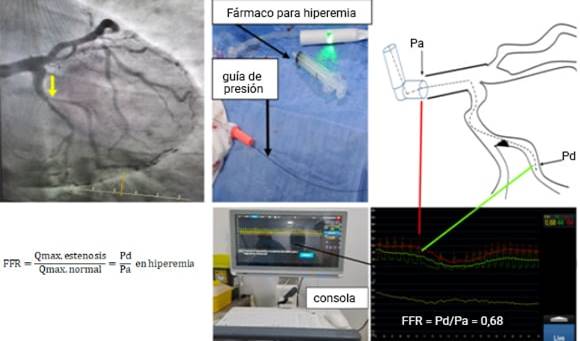
Mediante una guía de presión en hiperemia máxima, se calcula la relación entre la presión distal a la lesión (Pd) y la presión aórtica (obtenida por la presión del catéter guía). En hiperemia máxima, la presión de perfusión miocárdica y el flujo miocárdico son linealmente proporcionales; por tanto, si cambia la presión de perfusión miocárdica también se modifica el flujo miocárdico.
En una arteria coronaria normal, la arteria epicárdica no tiene resistencia apreciable al flujo y la presión en la arteria coronaria distal iguala la presión aórtica. Por consiguiente, la presión de perfusión miocárdica, definida como la presión coronaria distal (Pd) menos la presión venosa (Pv) llega a 100 mmHg. Sin embargo, en caso de estenosis se crea una resistencia adicional al flujo sanguíneo, y la presión coronaria distal resulta menor que la presión aórtica: existe un gradiente de presión a través de la estenosis en el ejemplo Pa-Pd = 30 mmHg. En la perfusión miocárdica, la presión disminuye a 70 mmHg, pero en un caso normal equivale a 100 mmHg.
Debido a que, durante la hiperemia máxima, la presión de perfusión es directamente proporcional al flujo miocárdico, la relación entre el flujo máximo estenótico y el máximo normal se expresa como la relación entre la presión coronaria distal y la presión aórtica en hiperemia, por tanto:
se puede expresar de la siguiente manera:
Como, en general, la presión venosa central resulta más pequeña que Pd y Pa, y cercana a cero, la ecuación se simplifica más:
La Pa se mide de forma regular con el catéter guía o coronario, y la Pd se obtiene, simultáneamente, cuando se cruza la estenosis con una guía con un sensor en la punta. La FFR se calcula de forma sencilla, durante los procedimientos de diagnóstico e intervención, a partir de la medición de las respectivas presiones en hiperemia máxima.
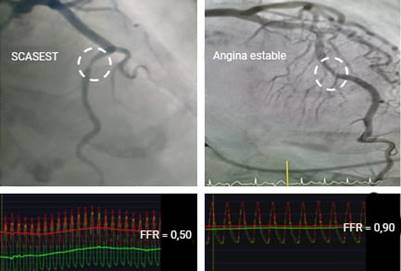
La figura 5 muestra como durante la hiperemia coronaria máxima, el flujo sanguíneo miocárdico resulta proporcional a la presión de perfusión coronaria. Con una guía con sensor de presión y un estímulo hiperémico adecuado, la FFR se calcula como la relación Pd/Pa. La parte inferior de la figura muestra los trazados de presión vistos en un analizador, derivados de una guía, con el sensor situado distalmente de la estenosis (Pd, señal verde) en la rama primera obtusa marginal (1raOM) de la arteria circunfleja y la punta del catéter guía (Pa, señal roja). Aunque el estrechamiento (flecha amarilla) de una estenosis ostial genera dudas en la coronariografía invasiva, su repercusión fisiológica o hemodinámica se considera importante. El valor de FFR de 0,68 indica que, como consecuencia de la estenosis, el flujo sanguíneo máximo a la pared lateral de este paciente ha disminuido al 62 % de su valor normal.
La FFR tiene un equivalente clínico directo: una FFR de 0,60 significa que el flujo sanguíneo máximo (y la provisión de oxígeno) a la distribución miocárdica de la arteria respectiva solo alcanza el 60 % de lo que sería si esa arteria fuera completamente normal. Un aumento a 0,90 después de la colocación del stent indica que el suministro máximo de sangre ahora ha aumentado en un 50 %.
Validación de FFR y valor de corte para isquemia miocárdica
La FFR < 0,75 posee especificidad del 100 % para indicar isquemia inducible; pero si la FFR > 0,80 tiene una sensibilidad > 90 % para excluirla. Actualmente no existe otra prueba en cardiología con esta precisión para documentar la isquemia miocárdica. Una investigación en 45 pacientes con estenosis angiográficamente dudosa demostró que la precisión de la FFR para distinguir estenosis hemodinámicamente significativas resulta mejor que la prueba ergométrica, la gammagrafía de perfusión miocárdica y la ecocardiografía de esfuerzo.35 Para ello se utilizó el llamado enfoque bayesiano secuencial, que demuestra la importancia del FFR como estándar de oro.
Con el transcurso de los años, múltiples estudios clínicos han modificado los valores de corte en varias poblaciones heterogéneas y comparan la medición de FFR con pruebas no invasivas para la isquemia miocárdica inducible.24,37,38,39) El implante de un stent sobre una estenosis coronaria en pacientes con una FFR por debajo de 0,75-0,80 mejora la clase funcional y el pronóstico; en cambio, si se encuentra por encima de ese umbral no lo hace y, por tanto, no se recomienda.11,19,31,33,34,38
Estímulos hiperémicos
Se debe inducir la máxima vasodilatación de los dos compartimentos de la circulación coronaria (arterias epicárdicas o de conductancia y la microvasculatura o arterias de resistencia) para obtener un índice de flujo sanguíneo máximo, porque sin esta condición fisiológica no se adquiere la FFR (tabla).39
Tabla Opciones farmacológicas para inducir la hiperemia
| Vasodilatación coronaria | |
|---|---|
| Nitroglicerina IC: | Un bolo de al menos 200 mcg como mínimo 30 segundos |
|
Vasodilatación microvascular Adenosina o ATP EV: |
ACD: al menos 100 mcg en bolo ACI: al menos 100 mcg en bolo |
| Adenosina o ATP EV: | 140 mcg/kg/min |
| Papaverina IC: |
ACD: al menos 10 mcg bolo ACI: al menos 15 mcg bolo |
| Regadenoson EV: | Un simple bolo de 400 mcg |
Leyenda: ACD: arteria coronaria derecha; ACI: arteria coronaria izquierda; ATP: adenosín trifosfato; IC: intracoronaria; IV: intravenoso.
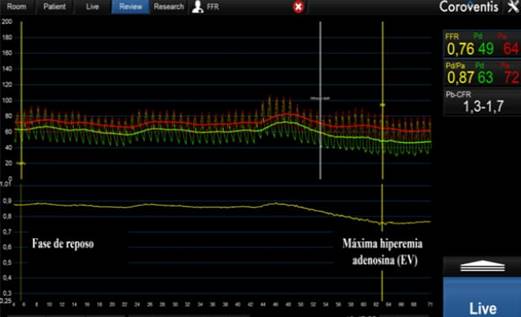
La vasodilatación microvascular resulta básica para calcular la FFR. Medir las diferencias de presión en reposo no ofrece una medida definitiva. Incluso, cuando el gradiente de presión de reposo se incrementa, se sugiere inducir la hiperemia porque permite evaluar la reserva de resistencia residual. Cuando la hiperemia se mantiene en estado estacionario, se administra adenosina por una vena central o periférica grande, y se consigue una hiperemia óptima en estado estacionario de 30 a 120 segundos después de iniciada la infusión. A veces, ocurren fluctuaciones periódicas en el nivel de hiperemia debido al rápido metabolismo de la adenosina, por ello se recomienda tomar la FFR en el punto más bajo al estabilizar el valor (fig. 6).
Recientemente, se ha aprobado un nuevo fármaco para inducir la hiperemia coronaria: el regadenosón, un antagonista selectivo del receptor de adenosina-A2, que se suministra como un bolo único independiente del peso corporal; también se puede inyectar en una vena central o periférica para inducir una hiperemia máxima similar a la adenosina. Una duración de meseta hiperémica de 30 a 120 segundos con regadenosón asegura tiempo suficiente para registrar el retroceso de la presión.
La infusión intravenosa de adenosina se acompaña de sensación de disconfort bastante similar a la angina en la mayoría de los pacientes. La adenosina estimula las fibras nerviosas libres del corazón y constituye el transmisor intrínseco de la angina (durante la isquemia de la vida real, el adenosín monofosfato cíclico no se metaboliza a ATP y se degrada a adenosina). Ese dolor de pecho puede considerarse una señal de que el fármaco funciona.
La adenosina es un nucleósido constituido por adenina y ribosa. Activa receptores purínicos (receptores adenosina A1, A2 de superficie celular), y relaja la musculatura lisa por la inhibición del flujo lento de entrada de Ca y la activación de adenilciclasa mediada por receptores A2 en células de musculatura lisa. Tiene un tiempo de vida media muy corto, menos de 10 segundos. Su único efecto secundario es que, en pacientes (< 1:1000) con asma grave, puede provocar broncoconstricción, debido a la degranulación de los mastocitos y la liberación de histamina. Si eso sucede, se recurre a la teofilina como antídoto.40) Por razones logísticas y para evitar la adenosina, se han introducido las denominadas relaciones de presión no hiperémicas (NHPR, siglas de Non-hyperaemic coronary pressure measurements).
El FFR posee una serie de características para la evaluación funcional de las estenosis coronarias y la toma de decisiones clínicas en el laboratorio de cateterismo:
Valor normal teórico de 1 para cada paciente, cada arteria y cada lecho miocárdico. Es fácil referenciar un valor inequívoco, pero resulta raro en la medicina clínica; por ello, se considera una ventaja única de la FFR. Dado que en una arteria coronaria epicárdica normal prácticamente no disminuye la presión (ni siquiera durante la hiperemia máxima), la Pd/Pa se acercará a la unidad.41) Por regla general, las arterias epicárdicas no contribuyen a la resistencia al flujo sanguíneo coronario; sin embargo, pueden hacerlo aunque no haya una estenosis discreta visible en la coronariografía invasiva. En el 50 % de estas arterias la FFR es menor que el valor más bajo encontrado en individuos sanos, y en el 10 % de las arterias ateroscleróticas será incluso inferior al umbral isquémico.41 En términos prácticos, este hallazgo implica que la isquemia miocárdica, por enfermedad difusa, podría afectar pacientes ateroscleróticos sin estenosis discretas.
Valor de corte bien definido con una estrecha zona gris entre 0,75 y 0,80. Los valores de corte o umbral distinguen los niveles isquémicos de los no isquémicos en una medición. Para una adecuada toma de decisiones clínicas resulta fundamental reducir al mínimo el nivel de incertidumbre. Las estenosis con una FFR < 0,75 invariablemente inducen isquemia miocárdica; mientras que las estenosis con FFR > 0,80 casi nunca se asocian con la isquemia provocada por el ejercicio.
Es el único índice de isquemia validado como estándar de oro.31) Muchos estudios examinan la zona gris y han encontrado un mejor valor de corte entre 0,75 y 0,80 en varios subgrupos de pacientes. Por tanto, en una estenosis con FFR ≤ 0,75, la revascularización estará justificada; mientras que en una estenosis con FFR > 0,80, se puede diferir y un tratamiento médico correcto será suficiente. En cambio, si se halla en una zona ambigua, entre 0,76 y 0,80, el juicio clínico (teniendo en cuenta el carácter de las molestias, los resultados de las pruebas no invasivas, si están disponibles, y el gradiente de presión) debe equilibrar la decisión final.
No está influenciado por la hemodinámica sistémica. La presión arterial sistémica, la frecuencia cardíaca y la contractilidad del ventrículo izquierdo tienen propensión a cambiar.42
Contribución de las colaterales. Si el flujo miocárdico lo proporciona anterógradamente la arteria epicárdica o retrógradamente a través de colaterales, no importa para el miocardio en condiciones de reposo. La presión coronaria distal durante la hiperemia máxima refleja tanto el flujo anterógrado como el retrógrado, según su contribución respectiva.41,42 Esto se considera válido para las estenosis irrigadas por colaterales, pero también para las arterias estenosadas que proporcionan colaterales a otro vaso más gravemente enfermo.
No solo se relaciona con el flujo miocárdico. Este permite evaluar por separado la contribución del flujo de la arteria coronaria (FFRcor) y el flujo colateral (FFRcoll) al flujo sanguíneo total del miocardio, siempre que la oclusión coronaria mida la presión.35
Relaciona la gravedad de la estenosis con la masa de tejido a perfundir: normalización por área de perfusión. Cuanto mayor sea la masa miocárdica irrigada por un vaso, mayor será el flujo hiperémico y el gradiente, y menor la FFR para la estenosis. Esto explica por qué una estenosis con un área transversal mínima de 4 mm tiene un significado hemodinámico diferente en la descendente anterior proximal frente a la segunda rama marginal. La importancia hemodinámica de una estenosis se modifica si cambia el territorio de perfusión; por ejemplo, después de un infarto de miocardio.38,43
Resolución espacial inigualable. La posición exacta del sensor en el árbol coronario se controla mediante fluoroscopia y se documenta angiográficamente. Retirar el sensor bajo hiperemia máxima le da al operador una evaluación instantánea de la resistencia anormal del segmento arterial ubicado entre el catéter guía y el sensor. Mientras que otras pruebas funcionales alcanzan una precisión por paciente (ECG de esfuerzo) o vaso (imágenes de perfusión miocárdica o eco estrés), la FFR lo hace por segmento con una resolución espacial de unos pocos milímetros. Los gradientes dentro de una arteria coronaria en hiperemia son generalmente dos o tres veces más altos que en reposo; en consecuencia, la resolución del registro pullback hiperémico es dos o tres veces mayor que la del registro en reposo.44
Altamente reproducible. Al igual que otros estudios, VERIFY encontró una alta reproducibilidad.11,20,45 Esto se debe a la capacidad de la microvasculatura para vasodilatar repetidamente exactamente en la misma medida. Estas características contribuyen a la precisión del método y la confianza en su valor para la toma de decisiones clínicas.33
Aplicación de FFR en diferentes subconjuntos de lesiones coronarias epicárdicas
FFR en estenosis angiográficamente intermedia
En cardiología se dificulta estandarizar las estenosis coronarias epicárdicas con consecuencias funcionales inciertas: estenosis leves a moderadas, lesiones dudosas, estenosis intermedias, estenosis no limitantes del flujo, estenosis no significativas. La multiplicidad de estas denominaciones delata la inexactitud de los métodos para estimar esas lesiones. Una de las indicaciones para la FFR es la evaluación de las consecuencias funcionales de una estenosis coronaria con un significado hemodinámico poco claro. En un estudio de 45 pacientes con estenosis angiográficamente equívocas, se demostró que la FFR resulta más precisa para distinguir estenosis hemodinámicamente significativas que el ECG de ejercicio, la gammagrafía de perfusión miocárdica y la ecocardiografía de esfuerzo.31
El resultado clínico de los pacientes en los que se difirió la ICP, porque la FFR no fue hemodinámicamente relevante, se consideró muy favorable. En dicha población el riesgo de muerte cardíaca o infarto de miocardio se calcula 1 % por año y no disminuye con la ICP.11) Estos resultados respaldan la indicación de la FFR como guía para la toma de decisiones sobre la necesidad de revascularización en lesiones intermedias.
En la figura 7 se ilustra cómo dos estenosis angiográficamente similares pueden tener gravedad hemodinámica completamente diferente. Un caso debe ser revascularizado, el otro no. Basado únicamente en la coronariografía, la indicación sería intervenir la estrategia en ambos casos, lo que llevaría a un tratamiento inadecuado.
Enfermedad coronaria multivaso
En la cardiopatía isquémica las pruebas de estrés no invasivas y la coronariografía no siempre proporcionan la información sobre la importancia funcional de las estenosis de las arterias coronarias. Particularmente en pacientes con enfermedad multivaso, puede ser difícil determinar cuál de varias lesiones provoca la isquemia miocárdica.
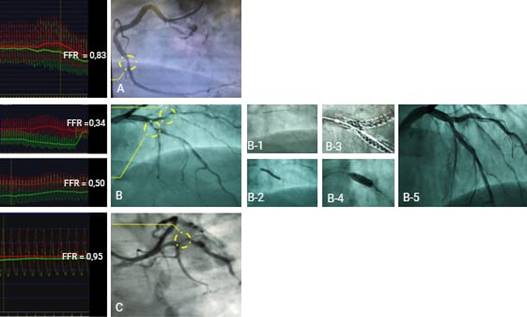
La figura 8 muestra un paciente con enfermedad multivaso que involucraba la descendente anterior proximal. Desde el punto de vista terapéutico, se beneficiaría de una estrategia de revascularización (percutánea o quirúrgica); pero, dado su cuadro clínico y el resultado de la coronariografía invasiva, se decidió una estrategia guiada por FFR. Se descartó severidad funcional de la estenosis de la coronaria derecha, con FFR de 0,83 (panel A). Sin embargo, las estenosis del segmento proximal de la descendente anterior y la primera diagonal resultaron funcionalmente significativas para valores de FFR 0,50 y FFR 0,34, respectivamente (panel B). La estenosis del 70 % en el ostium de la arteria circunfleja no tenía una significación útil por el umbral isquémico superior a 0,80 (panel C). Por tanto, cambió el escenario isquémico y se decidió realizar una revascularización percutánea, se implantó un stent en la primera diagonal (panel B-1), otro en la descendente anterior proximal, que englobó la primera diagonal (panel B-2). Bajo visión de la herramienta Stentboost, se ajustó con precisión de optimización proximal (panel B-3). Luego, con balón no complaciente se aplicó la técnica de optimización proximal (panel B-4). Finalmente, en la proyección de control se objetivó el adecuado resultado angiográfico (panel B-5).
En un estudio retrospectivo en pacientes con enfermedad multivaso, que se sometieron a ICP en lesiones isquémicas de acuerdo con la FFR y aplazaron la ICP en otras lesiones porque la FFR indicó ausencia de isquemia, la tasa de eventos a los tres años, relacionada con la lesión diferida, fue baja.46 Otro análisis retrospectivo comparó un grupo de pacientes revascularizados mediante ICP, sobre la base de la coronariografía, con un grupo de pacientes sometidos a ICP guiada por FFR. Esta última trató menos vasos, con costos menores y un resultado superior después de 30 meses.47
El ensayo clínico multicéntrico aleatorizado FAME proporcionó una prueba incontrovertible del beneficio de la ICP en la enfermedad multivaso guiada por FFR en comparación con la coronariografía estándar.21) Los eventos adversos se redujeron en un 30-35 % en el primer año, hubo un costo menor, sin prolongar el procedimiento intervencionista, y la angina se alivió con la misma eficacia.48
FFR en las lesiones del tronco coronario izquierdo
La estenosis en el tronco coronario izquierdo compromete la supervivencia del paciente.49 En cambio, la revascularización de una estenosis no significativa en esta zona puede provocar fallo de los conductos, especialmente cuando se utilizan arterias mamarias internas.50 El tronco coronario izquierdo se encuentra entre los segmentos más difíciles de apreciar mediante angiografía;51 por ello debe evaluarse con imagen intravascular, especialmente con ecografía intracoronaria, para obtener el área luminal mínima de la lesión. Si esta excede los 6 mm2 indica un buen pronóstico y no requiere revascularización ni más intervención;52) pero, si no supera los 4,5 mm2, se correlaciona con valores de FFR patológicos y se recomienda su revascularización. Cuando las lesiones presentan un área luminal mínima entre 4,5 y 6 mm2, se sugiere el uso de fisiología.
La FFR podría usarse en la estenosis del tronco coronario izquierdo y la decisión de no revascularizarla con una FFR por encima del umbral isquémico se considera segura.53,54,55,56 En este sentido, los pacientes con una estenosis intermedia del tronco coronario izquierdo precisan una evaluación fisiológica antes de la revascularización. De acuerdo con las guías actuales de buena práctica clínica de la Sociedad Europea de Cardiología, la revascularización en estos casos posee una indicación clase I nivel A, si se ha documentado isquemia miocárdica de forma no invasiva o por un valor de FFR ( 0,80 con 50-90 % de diámetro.13) La FFR proporciona al cardiólogo intervencionista información crucial para tomar decisiones adecuadas sobre este procedimiento.
La enfermedad del tronco coronario izquierdo rara vez se aísla. Cuando hay estenosis estrechas en la descendente anterior o en la circunfleja, estas lesiones aumentan la FFR. La influencia de una lesión de la descendente anterior/circunfleja en el valor de FFR dependerá de la gravedad de la estenosis distal, pero, más aún, del territorio vascular irrigado por ella. No afecta igual la estenosis distal en la descendente anterior proximal, que en una rama marginal pequeña.55 Las lesiones del tronco coronario izquierdo se localizan en la bifurcación y dañan de forma distinta los ostiums de la descendente anterior y la circunfleja. Por este motivo, se recomienda observar el FFR en ambas arterias, pues un valor normal en una de las ellas no significa que sea normal en la otra.
FFR en estenosis de rama lateral
La superposición de los segmentos de los vasos y los artefactos radiográficos dificultan la evaluación en la angiografía de las estenosis en bifurcación, mientras que la ICP de las bifurcaciones resulta más compleja. Dos estudios sobre la colocación de stent en bifurcación56,57 demuestran que, después de colocarlo en la rama principal, el ostium de la rama lateral parece pellizcado; sin embargo, dichas estenosis se sobrestiman mediante la angiografía: ninguna de estas lesiones ostiales, con una estenosis de diámetro < 75 %, tuvo una FFR inferior a 0,75 y el flujo TIMI 3 en la rama lateral se asoció con FFR > 0,75.
Por regla general, las bifurcaciones plantean dificultades técnicas para la ICP. Por tanto, el operador debe decidir si intervenir o no en las lesiones del ramo secundario, con o sin implante de stent. Para superar esta complejidad, se sugiere una mejor comprensión del subconjunto de lesiones; y por tanto, la FFR en este escenario esclarece sobre la estrategia a decidir.
FFR en estenosis secuenciales
Cuando hay varias estenosis en la misma arteria, el concepto y el valor clínico de la FFR se considera válido para evaluar el efecto de todas las estenosis juntas. Cada una de ellas interviene en el flujo sanguíneo hiperémico y en la FFR de la otra. La lesión distal sobre la proximal, generalmente, influye más que la inversa. En la práctica, una maniobra de retroceso bajo hiperemia máxima permite apreciar la ubicación exacta y el significado fisiológico de las estenosis secuenciales, y guiar, paso a paso, el procedimiento intervencionista. Los registros en retirada (pullback) en reposo tienen menos precisión que las retiradas en hiperemia, ya que los gradientes dentro de una arteria coronaria aumentan dos o tres veces en este estado.58
FFR en enfermedad difusa
El concepto de lesión focal constituye una descripción angiográfica y no refleja obligatoriamente patología. Cuando no se observaba un estrechamiento focal de > 50 % en la coronariografía, se asumía que la resistencia de la arteria epicárdica se hallaba alterada, la presión distal se encontraba normal, y la enfermedad leve difusa sin estenosis focal no causaba isquemia miocárdica. Este paradigma ha cambiado: actualmente, la enfermedad difusa se asocia con una disminución progresiva de la presión y el flujo coronarios, lo cual no puede evaluarse claramente a partir de la coronariografía invasiva.29,58,59
La disminución de la presión se correlaciona con la carga aterosclerótica total.59) En el 10 % de los pacientes, la resistencia epicárdica anormal provoca la isquemia miocárdica reversible. En estos casos el dolor torácico se estima no coronario porque no se encuentra una estenosis focal única y la imagen de perfusión miocárdica se considera erróneamente como falso positivo.60) La enfermedad difusa y su impacto hemodinámico siempre deben tenerse en cuenta para las mediciones funcionales.
En un gran registro multicéntrico de 750 pacientes, la FFR se obtuvo después de una colocación de stent técnicamente satisfactoria. Un valor de FFR post-ICP de < 0,9 estaba presente en casi un tercio de los pacientes (a pesar de la ausencia de un gradiente a través del stent), lo cual refleja cierto grado de enfermedad difusa; además, el FFR post-stent más bajo, se asoció con peores resultados clínicos.61
La maniobra de retroceso del sensor de presión constituye la forma clásica de demostrar el impacto hemodinámico de la enfermedad difusa. Similar a la situación de las lesiones en tándem, un registro pullback en reposo tiene una resolución más baja para detectar la gravedad de este padecimiento.
Recientemente, se está empleando un nuevo índice para analizar la presión de la enfermedad difusa frente a la focal de manera sofisticada. El índice de gradiente de presión de retroceso (Pullback Pressure Gradient: PPG) incorpora la magnitud y la extensión de las pérdidas de presión, proporciona una métrica continua de 0 a 1; los valores cercanos a 0 representan afección coronaria difusa y los cercanos a 1 representan afección coronaria focal.62 Esto sintetiza la enfermedad aterosclerótica a lo largo de la arteria coronaria y facilita la toma de decisiones sobre la gravedad.
FFR e infarto de miocardio
Después de un infarto de miocardio, el tejido previamente viable se reemplaza parcialmente por tejido cicatricial. La masa de miocardio viable, suministrada por una estenosis en una arteria relacionada con un infarto, tiende a disminuir.40) Aunque la morfología de la estenosis permanezca idéntica, la FFR debe aumentar, lo cual no significa que subestime la gravedad de la lesión después del infarto; solo ilustra la relación entre el flujo, el gradiente de presión y la masa miocárdica.
La morfología de un segmento estenótico no refleja su importancia funcional (fig. 9). Datos recientes confirman que la resistencia hiperémica, en el miocardio viable dentro del área infartada, permanece normal.58) Esto respalda la aplicación del valor de corte de FFR, establecido en el entorno de territorios parcialmente infartados; aunque no resulta fiable ni útil para evaluar las lesiones culpables en la fase aguda del infarto de miocardio. El ECG prevalece sobre cualquier otra investigación. A partir de los cinco días posteriores al infarto, la FFR se utiliza para detectar isquemia residual de la arteria ocluida.
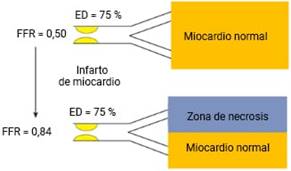
Fig. 9 Relación de la FFR con el miocardio subperfundido por una estenosis angiográfica antes y después de un infarto de miocardio.
La utilidad de la FFR para la valoración de las lesiones no culpables de infarto agudo de miocardio con elevación del ST (IAMCEST) se ha corroborado en 3 grandes ensayos clínicos aleatorizados: COMPARE-ACUTE, DANAMI-PRIMULTI y FLOWER-MI.61,62,63) En el COMPARE-ACUTE, después de la ICP de la lesión culpable, los pacientes con IAMCEST se aleatorizaron a tratamiento conservador o revascularización inmediata, basada en la FFR de las otras arterias. En el ensayo DANAMI, la revascularización basada en FFR se hizo durante el ingreso hospitalario. Ambos ensayos demostraron el beneficio del abordaje guiado por FFR para la revascularización de las otras lesiones.
Los datos favorables del ensayo DANAMI y COMPARE-ACUTE respaldaron el empleo del FFR. El estudio FLOWER-MI informó un aumento no significativo en el riesgo de infarto en el brazo guiado por FFR. Un subestudio del grupo FFR demostró que los pacientes sin revascularización (por tener un FFR negativo) tuvieron más eventos que los que presentaron un FFR positivo (y se trataron con stent).64
Esta estimación del efecto se consideró baja y no significativa. La FFR solo se midió en el 4 % de los pacientes durante el cateterismo índice, lo cual pudo sesgar el resultado. Estudios previos habían sugerido que la función microvascular sería anormal en regiones alejadas de un infarto de miocardio reciente.65,66 Sin embargo, trabajos más actualizados muestran la confiabilidad de la FFR en estenosis no causantes, obtenida después de la ICP de la estenosis causante.67,68 Estos datos respaldan el uso de FFR durante la fase aguda de los infartos del miocardio para la evaluación de la estenosis de la arteria coronaria no culpable y facilitan la toma de decisiones sobre la necesidad de revascularización adicional.64
FFR en las guías de revascularización coronaria
La Sociedad Europea de Cardiología, el Colegio Americano de Cardiología (ACC) y la Asociación Americana del Corazón (AHA) publicaron nuevas pautas sobre revascularización coronaria. La FFR se indica para la evaluación de las consecuencias funcionales de las estenosis coronarias moderadas (50-90 % por estimación angiográfica visual) cuando falta la información funcional con nivel de evidencia: Clase I Nivel A.13) Recientemente, la preferencia de usar FFR (hiperémica) en lugar de índices de reposo, se reconoció específicamente en las correcciones del Colegio Americano de Cardiología.64,69
ICP guiada por FFR versus tratamiento médico óptimo en la enfermedad arterial coronaria estable
El estudio ORBITA, realizado en pacientes con enfermedad arterial coronaria estable, comparó el tratamiento médico óptimo con la ICP guiada por angiografía. Aunque, inicialmente, el tratamiento médico óptimo se presentó no inferior a la ICP, después de dos años el 40 % de los pacientes se sometió a revascularización, lo que significa un fracaso del tratamiento médico óptimo.62) Si se asume que la ICP en esos pacientes constituyó una buena razón clínica, podría afirmarse que, sin la ICP, la tasa de evento adversos habría aumentado considerablemente. En conclusión, el estudio ORBITA comparó la ICP directa con la ICP diferida.
Por otra parte, FAME 265 constituyó el primer ensayo aleatorizado que cotejó la ICP guiada por FFR con el tratamiento médico óptimo en pacientes elegibles para ICP y con enfermedad arterial coronaria estable evaluada angiográficamente. Los pacientes con al menos una estenosis funcionalmente significativa (o sea, FFR ≤ 0,80) se asignaron al azar para recibir revascularización mediante ICP guiada por FFR más el tratamiento médico óptimo o solamente tratamiento médico óptimo. El punto final primario consistió en un compuesto de muerte por cualquier causa, infarto de miocardio no fatal u hospitalización que condujo a una revascularización urgente.
Se realizó seguimiento por cinco años y actualmente aumentó a 10 años. En total se aleatorizaron 888 pacientes entre ICP y tratamiento médico óptimo. El estudio se detuvo debido a una diferencia significativa entre los grupos en un seguimiento medio de 213 días. Hubo una tasa más baja de revascularización urgente en el grupo de ICP en comparación con el grupo de tratamiento médico óptimo (1,6 % vs 11,1 %; IC del 95 %: 0,06-0,30). Por otra parte, la tasa de muerte por cualquier causa y la de infarto del miocardio no difirieron entre el grupo de ICP y el grupo tratamiento médico óptimo. El porcentaje de pacientes con angina de grado II-IV de la Sociedad Canadiense del Corazón se redujo más en el grupo de ICP que en el grupo de tratamiento médico óptimo; en consecuencia, el beneficio de la ICP guiada por FFR se incrementó con un seguimiento más prolongado.65
Para concluir este punto, un reciente metanálisis de datos de pacientes individuales proporcionó pruebas sólidas de que la ICP guiada por FFR no solo mejora la calidad de vida de manera efectiva, sino que también disminuye el criterio de valoración compuesto de muerte e infarto de miocardio.70
Problemas técnicos y limitaciones de la reserva fraccional de flujo
En la práctica diaria, la valoración del FFR no está demostrada en todos los escenarios clínicos y debe realizarse con cautela. Durante el contexto agudo de un infarto de miocardio, decidir la revascularización de una lesión culpable mediante FFR trae consigo ciertos riesgos. La embolización de trombos, el aturdimiento miocárdico, la disfunción microvascular isquémica aguda y otros factores impiden alcanzar una vasodilatación microvascular completa. Sin embargo, el uso de la FFR en la lesión culpable, reperfundida espontáneamente o mediante trombolisis o tromboaspiración, pasados entre tres y cinco días del infarto del miocardio, se considera segura.13,66,67,68
Desde el punto de vista técnico, se tienen en cuenta dos aspectos fundamentales para medir la FFR: la hiperemia submáxima (subestimar la gravedad de la estenosis) y los relacionados con el catéter guía. La amortiguación de los trazados de presión, debido al encaje del catéter guía en el ostium coronario, se resuelve si se retira ligeramente el catéter guía del ostium.71,72
La FFR puede elevarse pese a una estenosis estrecha. A continuación, se enumeran las posibles razones:
Argumento fisiológico.
Relacionadas con la interpretación.
Explicación técnica.
Falsos negativos de FFR.
Índices de reposo
Se ha propuesto un nuevo enfoque para cuantificar la gravedad de la estenosis funcional a partir de los índices de reposo. Se emplean derivados de mediciones combinadas de presión-velocidad (bSVR) o solo de gradientes de presión en reposo (Pd/Pa en reposo, iFR, dPR o RFR). Aunque parece atractivo saltarse la hiperemia por simplicidad, se pierde parte de la información fisiológica.73
El renovado interés en la fisiología del reposo se puso en marcha con la introducción del índice instantáneo libre de ondas Wave-Free Ratio (iwFR), basado en la presión como un índice independiente del vasodilatador de la gravedad de la estenosis coronaria. Este índice se basa en la suposición de que la resistencia miocárdica durante un período sin ondas diastólicas wave-free period equivale a la resistencia promedio durante la hiperemia máxima. Sin embargo, se ha demostrado que ese período no existe y el iwFR depende del grado de hiperemia.74) Detectar el wave-free period no constituye un requisito previo para obtener la misma información fisiológica. Por otra parte, las relaciones de presión diastólica (dPR), definida como Pd/Pa durante la diástole completa o el ciclo completo en reposo (RFR), definida como la Pd/Pa más baja en todo el ciclo, igualan el wave-free period y se utilizan para fines idénticos.75,76
Los índices de presión no hiperémicos (NHPR) tienen una precisión de aproximadamente 80 % en comparación con la FFR. Hasta la actualidad no hay estudios disponibles para ninguno de estos índices y, aunque en las guías europeas se mencionan como una alternativa a la FFR (hiperémica), las guías americanas no comparten el mismo criterio.59
Entre las limitaciones y las dificultades de los índices de presión no hiperémicos se encuentran las siguientes:
Los índices de reposo que incluyen iwFR, dPR y RFR solo se han comparado con FFR y nunca se han realizado estudios independientes para mostrar mejores resultados.
En las estenosis proximales de grandes arterias coronarias, la NHPR falsa negativa está presente en el 30 % de los pacientes.
Es probable que haya NHPR falsos negativos en un gran territorio de perfusión, lesión corta y estrecha, pacientes jóvenes con buena función microvascular, enfermedad del tronco coronario izquierdo o arteria coronaria derecha dominante.
Los gradientes hiperémicos son dos o tres veces mayores que los gradientes de reposo. Por tanto, evitar la hiperemia disminuye la relación señal/ruido del registro de retroceso de la presión y la sensibilidad para desenmascarar la importancia de la enfermedad difusa, y la diafonía entre diferentes lesiones dentro de una arteria coronaria.
La disminución de la relación señal/ruido en reposo también aumenta la confusión por deriva y constituye un fenómeno absoluto (mm Hg/unidad de tiempo), cuya influencia resulta mayor cuando se utilizan índices de reposo.
La evaluación fisiológica por índices de reposo no se considera posible después de la ICP, pues existe un estado variable de hiperemia submáxima durante un tiempo prolongado. Los índices de reposo tampoco permiten cuantificar la tasa de mejora con la colocación de stents.
Angiografía funcional coronaria
La angiografía funcional coronaria anuncia una nueva era de evaluación fisiológica en la enfermedad arterial coronaria, sin necesidad de instrumentación intracoronaria ni administración de fármacos vasodilatadores. Esto la convierte en una técnica rápida y segura. La mayoría de las técnicas de FFR basadas en imágenes utilizan la dinámica de fluidos computacional (DFC). Para hacer factible la evaluación del vaso en el laboratorio de cateterismo, en los sistemas disponibles comercialmente, se utiliza a menudo una versión simplificada de DFC con coeficientes matemáticos más sencillos. Estos enfoques se benefician de la velocidad real del flujo sanguíneo mediante el recuento de fotogramas TIMI (trombolisis en el infarto de miocardio) y los valores de presión aórtica, a los que se puede acceder directamente para el estudio en línea.77
Asimismo, puede extraerse una reconstrucción 3D de la luz del vaso a partir de proyecciones angiográficas invasivas ortogonales. La mayoría de los sistemas se integran en los metadatos incrustados en el formato de imagen DICOM, que contiene información sobre parámetros relevantes, como la altura del intensificador de imagen/tabla y la frecuencia de imagen. El modelo geométrico obtenido puede dividirse en entidades más pequeñas.78
Se han desarrollado varios programas informáticos que estiman la FFR a partir de la angiografía y se han publicado estudios de validación. Sin embargo, sólo QFR, FFR angio, vFFR, caFFR cuentan con pruebas derivadas de estudios multicéntricos prospectivos.77,78,79
QFR (QAngio XA 3D; Medis Medical Imaging Systems y AngioPlus; Pulse Medical Imaging Technology) constituye un método de FFR computacional derivado de 3D-QCA, basado en dos proyecciones angiográficas ortogonales del vaso coronario. Una vez reconstruido el vaso en un modelo 3D, se calculan las caídas de presión hemodinámicas en segmentos consecutivos, según los coeficientes derivados de presión de fricción y turbulencia, y, posteriormente, se integran en todo el segmento analizado.77
FFRangio (FFRangio System; CathWorks Ltd) consiste en crear una representación tridimensional de todo el árbol arterial coronario, mediante tres proyecciones angiográficas de un solo plano, y estima el flujo a través de una estenosis a partir de las ecuaciones de fluidos de resolución simplificada. El flujo hiperémico se estima a partir de la resistencia calculada de la microcirculación, el volumen total y la longitud del sistema arterial coronario reconstruido. El FFRangio se obtiene de la división del flujo hiperémico esperado en la arteria estenótica por el flujo hiperémico calculado para una arteria sana.
La reserva de flujo fraccional virtual vFFR (CAAS vFFR; Pie Medical Imaging) se obtiene mediante 3D-QCA y ecuaciones de fluidos simplificadas. El flujo de entrada se determina mediante la presión de la raíz aórtica en hiperemia, y para la velocidad de flujo se aplica la presión medida a la geometría coronaria reconstruida en 3D.78
caFFR (FlashAngio caFFR System; RainMed Ltd.). La FFR derivada de la dinámica computacional presión-flujo utiliza reconstrucciones angiográficas 3D, basadas en dos vistas ortogonales, que posteriormente se fusionan con la dinámica computacional de fluidos. La presión aórtica específica del paciente, aplicada en el límite de entrada, y las velocidades del flujo en reposo, determinadas por el método TIMI de recuento de fotogramas, se integran en los cálculos para resolver las ecuaciones de Navier-Stokes.80
μQFR (MicroPort, Cardio Pulse) se considera el QFR basado en la Ley de Murray, a partir de una única vista angiográfica. Con el apoyo de algoritmos de inteligencia artificial, se estima la FFR mediante el ajuste tanto del diámetro del vaso de referencia, como el flujo de salida a través de las ramas laterales, según las reglas de la geometría fractal.77
Estudios preliminares han demostrado una buena correlación con la FFR invasiva y una buena reproducibilidad. Los avances en la angiografía funcional coronaria y su adopción clínica podrían convertir esta modalidad del campo de la investigación a la práctica clínica en los próximos años. Sin embargo, aún se necesitan estudios y ensayos para evaluar los principales criterios de valoración clínicos y rentabilidad.
Conclusiones
El estudio fisiológico de la circulación coronaria se considera una herramienta de diagnóstico esencial en los laboratorios de cateterismo. La FFR constituye un medio sólido para el estudio de las estenosis coronarias ambiguas. A pesar de su naturaleza invasiva, tiene una resolución espacial inigualable por territorio vascular; también posee un valor normal inequívoco, tiene en cuenta el flujo sanguíneo colateral y la cantidad de masa miocárdica viable, es independiente de las variaciones hemodinámicas con una alta reproducibilidad.
Por otro lado, el iFR, índice de presión en reposo no hiperémico, ha conducido al desarrollo de índices basados en la presión en reposo. Evalúa la relación entre la presión aórtica y la presión distal durante el período de diástole sin guía ni medicación y, aunque ofrece algunas ventajas, no se ha consolidado mundialmente. El nuevo campo de la angiografía funcional coronaria ha llamado la atención de los cardiólogos intervencionistas porque garantiza una evaluación fisiológica de la enfermedad arterial, sin necesidad de instrumentación ni administración de fármacos vasodilatadores. Sin embargo, se necesitan más ensayos prospectivos aleatorizados, con datos de seguimiento clínico, antes de implementar esta nueva herramienta diagnóstica en la práctica médica diaria.