Introducción
Las infecciones urinarias representan una carga para la salud pública y la sociedad, pues cerca del 40 % de las mujeres y el 12 % de los hombres tienen al menos un evento de este tipo durante su vida adulta; la infección se asocia con altas tasas de recurrencia y, si no se instaura un manejo antibiótico adecuado, puede progresar rápidamente a sepsis severa y muerte.1
La mayoría de las infecciones urinarias se producen por miembros de la familia Enterobacteriaceae, principalmente Escherichia coli (69-90 % de los casos), seguido por Klebsiella spp, Staphylococcus saprophyticus y Proteus. La resistencia de las bacterias aisladas supera el 20 % para trimetoprim/sulfametoxazol y cefalosporinas de primera generación, y el 50 % para amoxicilina. La epidemiología de las bacterias resistentes a los antibióticos varía entre tipos de infección, y algunas condiciones de uso regionales que deben documentarse bien.2,3
En los últimos años ha aumentado la resistencia a los principales agentes bacterianos, lo cual se ha convertido en un problema de difícil manejo, tanto en instituciones nacionales como internacionales; en consecuencia, se deben revisar y ajustar las pautas de tratamiento de estas infecciones en función de la sensibilidad local en el entorno comunitario y el intrahospitalario.3 El uso empírico de los antibióticos facilita la resistencia a los agentes antimicrobianos. Esto constituye un reto para los clínicos y los investigadores, ya que los datos sobre la prevalencia de uropatógenos y la sensibilidad a los antimicrobianos varían, y deben identificarse para cada hospital.4 El presente estudio tuvo como objetivo determinar el perfil de susceptibilidad de las principales especies bacterianas causantes de infecciones urinarias, mediante los reportes de laboratorio e historias clínicas del Hospital General Docente Ambato.
Métodos
Se realizó un estudio no experimental, de tipo descriptivo retrospectivo de corte transversal. La población se conformó por 1000 historias clínicas de pacientes con diagnóstico de infección urinaria. A todos se les había hecho urocultivo en el Servicio de Consulta Externa del Hospital General Docente Ambato durante mayo de 2017 y junio de 2018. La muestra se constituyó por los 245 casos con reportes de urocultivos positivos (con crecimiento microbiano) y procedentes de la comunidad. Se excluyeron los resultados negativos, y los reportados como muestra contaminada o muestra insuficiente.
El procesamiento microbiológico en el hospital se realizó mediante la siembra de la muestra de orina en agar sangre y agar MacConkey. Se utilizó el método del asa calibrada. Las placas sembradas se incubaron a 37° C por 24 horas para luego verificar la presencia de crecimiento bacteriano. Concluida esa fase, se hizo la tinción de Gram a las colonias aisladas y se identificaron las bacterias a través de las pruebas bioquímicas convencionales (-Oxidasa, Kligler, Lisina hierro agar (LIA), motilidad indol ornitina (MIO), citrato, urea).5
Las pruebas de susceptibilidad antimicrobiana se hicieron con el método de difusión del disco en agar (Kirby-Bauer). Se empleó el método de sinergia del doble disco para la detección fenotípica de betalactamasas de espectro extendido (BLEE) en las enterobacterias aisladas.6
Las variables de estudio fueron urocultivo positivo con el aislamiento de un microorganismo uropatógeno con más de 100 000 unidades formadoras de colonias; e infección del tracto urinario, como la respuesta inflamatoria del urotelio, a consecuencia de una invasión bacteriana asociada con bacteriuria y piuria. Se definió BLEE como bacteria productora de betalactamasa de espectro extendido. También se evaluaron los reportes de antibiograma de los pacientes para establecer el patrón de sensibilidad/resistencia en los urocultivos.
Los datos se recopilaron mediante la revisión de las correspondientes historias clínicas, para ello se organizaron las variables en una base de datos de Microsoft Excel. Esto facilitó el procesamiento de la información a través de análisis de frecuencias, cuyos resultados se resumieron a partir de tablas y gráficos.
La dirección del hospital autorizó el acceso a los datos de su archivo siempre que se respetara la privacidad de la información personal de las historias clínicas. Los investigadores solo las utilizaron con fines científicos y académicos.
Resultados
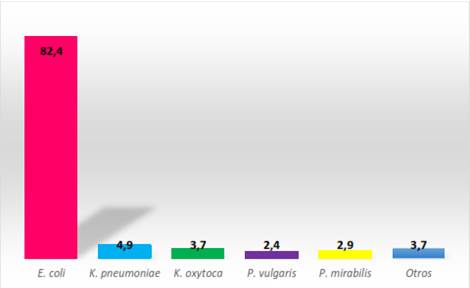
Se revisaron las historias clínicas de 1000 pacientes que se habían hecho urocultivo durante el período de estudio. De los 245 urocultivos positivos, se aisló como agente etiológico más frecuente a E. coli en un 82,4 %, seguido por K. pneumoniae (4,9 %) y K. oxytoca (3,7 %) (fig.).
Las mujeres resultaron las más afectadas (81,2 %). En 182 casos (74,3 %) la infección se produjo por E. coli. En el sexo masculino también predominó la infección por E. coli, seguido por K. pneumoniae (tabla 1).
Tabla 1 - Distribución porcentual de las especies bacterianas aisladas
| Bacterias aisladas | ||||||
|---|---|---|---|---|---|---|
| No. | (%) | No. | (%) | Suma | (%) | |
| 20 | 8,2 | 182 | 74,3 | 202 | 82,4 | |
| 10 | 4,1 | 2 | 0,8 | 12 | 4,9 | |
| 7 | 2,9 | 2 | 0,8 | 9 | 3,7 | |
| 3 | 1,2 | 3 | 1,2 | 6 | 2,4 | |
| 1 | 0,4 | 6 | 2,4 | 7 | 2,9 | |
| Otros | 5 | 2,0 | 4 | 1,6 | 9 | 3,7 |
| Total | 46 | 18,8 | 199 | 81,2 | 245 | 100,0 |
Los principales antibióticos a los que la E. coli se mostró sensible fueron la fosfomicina (95 %), la ceftazidima (80 %), la ceftriaxona (74 %), la amikacina (70 %) y la nitrofurantoína (70 %); mientras que la ciprofloxacina (50 %) y la gentamicina (42 %) se determinaron para la K. pneumoniae (tabla 2).
Tabla 2 - Perfil de sensibilidad de los uropatógenos aislados
| No. | n | (%) | No. | n | (%) | No. | n | (%) | |
|---|---|---|---|---|---|---|---|---|---|
| AMC | 202 | 91 | 45 | 12 | 3 | 25 | 9 | 2 | 22 |
| SAM | 202 | 81 | 40 | - | - | - | - | - | - |
| CZ | 202 | 44 | 22 | - | - | - | - | - | - |
| CRO | 202 | 149 | 74 | - | - | - | - | - | - |
| CAZ | 202 | 162 | 80 | - | - | - | - | - | - |
| CTX | 202 | 139 | 69 | 12 | 3 | 25 | 9 | 4 | 44 |
| CN | 202 | 95 | 47 | 12 | 5 | 42 | 9 | 3 | 33 |
| AK | 202 | 143 | 71 | - | - | - | 9 | 4 | 44 |
| CIP | 202 | 79 | 39 | 12 | 6 | 50 | 9 | 8 | 90 |
| F | 202 | 141 | 70 | 12 | 2 | 17 | 9 | 2 | 22 |
| FF | 202 | 192 | 95 | - | - | - | - | - | - |
| SXT | 202 | 50 | 25 | 12 | 2 | 17 | 9 | 2 | 22 |
Leyenda: No.: casos que emplearon el antibiótico; n: frecuencia; AMC: amoxicilina/ácido clavulánico; SAM: ampicilina/sulbactam; CZ: cefazolina; CAZ: ceftazidima; CXT: cefotaxima; CN: gentamicina; AK: amikacina; CIP: ciprofloxacina; F: nitrofurantoina; FF: fosfomicina; SXT: trimetoprim sulfametoxazol.
La E. coli se resistió a la cefazolina (78 %), el trimetoprim-sulfametoxazol (75 %), la ampicilina/sulbactam (60 %) y la ciprofloxacina (61 %); la K. pneumoniae, a la nitrofurantoina y el trimetoprim-sulfametoxazol, fundamentalmente; y la K. oxytoca, a la amoxicilina/ácido clavulánico (78 %), el trimetoprim/sulfametoxazol (78 %) y la nitrofurantoína (78 %) (tabla 3).
Tabla 3 - Perfil de resistencia de los uropatógenos aislados
| No. | No. | (%) | No. | n | (%) | No. | No. | (%) | |
|---|---|---|---|---|---|---|---|---|---|
| AMC | 202 | 111 | 55 | 12 | 9 | 75 | 9 | 7 | 78 |
| SAM | 202 | 121 | 60 | - | - | - | - | - | - |
| CZ | 202 | 158 | 78 | - | - | - | - | - | - |
| CRO | 202 | 53 | 26 | - | - | - | - | - | - |
| CAZ | 202 | 40 | 20 | - | - | - | - | - | - |
| CTX | 202 | 63 | 31 | 12 | 9 | 75 | 9 | 5 | 56 |
| CN | 202 | 107 | 53 | 12 | 7 | 58 | 9 | 6 | 67 |
| AK | 202 | 59 | 29 | - | - | - | 9 | 5 | 56 |
| CIP | 202 | 123 | 61 | 12 | 6 | 50 | 9 | 1 | 10 |
| F | 202 | 61 | 30 | 12 | 10 | 83 | 9 | 7 | 78 |
| FF | 202 | 10 | 5 | - | - | - | - | - | - |
| SXT | 202 | 152 | 75 | 12 | 10 | 83 | 9 | 7 | 78 |
Leyenda: No.: casos que emplearon el antibiótico; n: frecuencia; AMC: amoxicilina/ácido clavulánico; SAM: ampicilina/sulbactam; CZ: cefazolina; CAZ: ceftazidima; CXT: cefotaxima; CN: gentamicina; AK: amikacina; CIP: ciprofloxacina; F: nitrofurantoina; FF: fosfomicina; SXT: trimetoprim sulfametoxazol.
La incidencia de bacterias con el fenotipo de producción de BLEE resultó baja (6,5 %), de ellas la E. coli representó el 3,3 %, seguido por K. pneumoniae con el 1,2 %, y P. vulgaris y P. mirabilis con un 0,8 % (tabla 4).
Discusión
El presente estudio identificó los principales agentes etiológicos y el perfil de susceptibilidad a los antibióticos de los microorganismos aislados de los urocultivos de pacientes con infección urinaria, a través de la recolección de información de los reportes de resultados de laboratorio e historias clínicas.
E. coli resultó la bacteria más frecuente, lo cual coincide con lo informado por varios estudios nacionales e internacionales.1,3,7,8,9,10,11P. vulgaris y P. mirabilis ocuparon el tercer y el cuarto lugar de frecuencia, y constituyen entre el segundo y el quinto agente causal más común de infecciones urinarias.3,12 Aunque no se hallaron en esta investigación, otros microorganismos patógeno usuales son Corynebacterium urealyticum, encontrado en pacientes con infecciones urinarias asociadas a urolitiasis, manipulación de la vía urinaria o trasplante renal, y S. aureus, relacionado con bacteriemia o absceso renal.3,12
Guamán y otros13 coinciden con que el mayor porcentaje de infección urinaria se observa en mujeres (95 %). Este predominio del género femenino se debe a la predisposición anatómica y los múltiples factores de riesgo que las vuelve más propensas a contraer este tipo de infección, con relación a los hombres, pero también reportan la E. coli como el principal agente etiológico de la infección.14,15
Los mayores porcentajes de sensibilidad de las enterobacterias se determinaron con los siguientes antibióticos: fosfomicina, ceftazidima y ceftriaxona, en correspondencia con lo reportado por otros autores.3,13) Quiroz y Apolaya9) informan que las enterobacterias asociadas a la infección urinaria presentaron 100 % de sensibilidad frente a ceftazidima, cefuroxima, claritromicina, meropenem y nitrofurantoína.
Un trabajo realizado en la ciudad de Quito comunicó que las cepas de E. coli, aisladas de pacientes con infección urinaria, mostraron las tasas más bajas de resistencia a gentamicina y amikacina con un 19,4 y 3,6 %, respectivamente. Sin embargo, el uso de aminoglucósidos en el primer nivel de atención se administra exclusivamente por vía parenteral.10
Los antibióticos indicados con más frecuencia para la infección urinaria no complicada mostraron los mayores porcentajes de resistencia: ampicilina/sulbactam, amoxicilina/ácido clavulánico, cefazolina, nitrofurantoina, trimetoprim/sulfametoxazol y ciprofloxacina. La literatura consultada coincide en que la E. coli presenta una resistencia superior al 50 % para cefazolina, trimetoprim - sulfametoxazol, ampicilina/sulbactam y ciprofloxacina.17,18
Varias publicaciones señalan un aumento en la resistencia a trimetoprim/sulfametoxazol, a pesar de que solo se recomienda después de un antibiograma que demuestre sensibilidad.3,13,17 Una prevalencia de > 20 % contraindica su uso empírico.10,19 En el presente estudio este antibiótico manifestó una resistencia superior al 70 %, mientras que la de la ciprofloxacina y la ampicilina/sulbactam se estableció alrededor de un 60 %. Estos datos superaron los porcentajes reportados por Lozada y otros20 quienes indican la resistencia de E. coli frente a ciprofloxacina y ampicilina/sulbactam en un 26,2 y un 49,2 %, respectivamente.
Otras investigaciones13,21,22 revelan mayores niveles de resistencia para la ciprofloxacina, relacionados con el uso del antibiótico sin prescripción médica o su formulación inadecuada.3 Por este motivo, actualmente, el trimetoprin sulfametoxazol y la ciprofloxacina no se recomiendan como tratamiento empírico.20
Se destacaron las altas tasas de inmunidad de las enterobacterias K. pneumoniae (83 %) y K. oxytoca (78 %) frente a nitrofurantoína, uno de los antibióticos más utilizados en el tratamiento empírico de infecciones urinarias. No obstante, E. coli presentó un porcentaje de resistencia menor (30 %); en cambio, Guamán y otros,13 y Lozada y otros20 publican un 7,5 % y un 2,4 %, respectivamente, en cepas de E. coli asociadas a infecciones urinarias.
De acuerdo con los resultados, el tratamiento empírico de infecciones urinarias en el Hospital General Docente Ambato debería evitar ampicilina/sulbactam, trimetoprim-sulfametoxazol, ciprofloxacina y nitrofurantoína, y recomendar fosfomicina para las infecciones urinarias no complicadas asociadas a E. coli.
En los últimos años ha aumentado la incidencia de enterobacterias productoras de BLEE, principalmente la E. coli. Esto representa un signo de alarma porque las cepas con los genes que codifican estas enzimas portan otros genes de resistencia a aminoglucósidos y fluoroquinolonas, se vuelven multirresistentes y reducen las opciones terapéuticas.23
Son pocas las investigaciones sobre infecciones urinarias adquiridas en la comunidad que reporten el aislamiento de enterobacterias productoras de BLEE. Esta producción en las cepas aisladas de los pacientes que acudieron a la consulta externa del Hospital General Docente Ambato fue relativamente baja 6,5 %, al igual que en otros estudios.20,23,24Guzmán y otros25) refieren un 20,4 % de la E. coli aislada en la consulta externa de urología y urgencias del Hospital de Cumaná-Venezuela. Por su parte, según Grabe y otros,26 el 6,5 % de aislamientos de las cepas de E. coli productoras de BLEE son sensibles a fosfomicina; publicaciones europeas informan un 5,420 y un 10 %;27 y en Perú se reportan porcentajes mayores al 72,2 %.28
Entre 2005 y 2009 en España se incrementaron los aislamientos de E. coli productores de BLEE, resistentes a fosfomicina. Se consumía un 340 % de dosis diarias por 1000 habitantes de este antibiótico en 2008 con respecto a 1997; además, se comprobó la amplia distribución de un clon de E. coli 025b/B2 y la existencia de población susceptible de mujeres residentes en centros sociosanitarios.29 Cuando se compararon los datos de 2011/2012 con los de 2016/2017, las cifras de E. coli no sensibles a fosfomicina se mantuvieron a pesar de su uso.30
En conclusión, la E. coli fue el microorganismo más aislado en pacientes con infección urinaria en la consulta externa del Hospital General Docente Ambato, con una tasa de sensibilidad a la fosfomicina del 95 %, y una resistencia mayor al 50 % frente a ampicilina/sulbactam, amoxicilina/ácido clavulánico, cefazolina, trimetoprim-sulfametoxazol, ciprofloxacina. Las tasas de inmunidad a los antimicrobianos evaluados sugieren una revisión de los esquemas terapéuticos para el tratamiento empírico de la infección del tracto urinario en esta institución para evitar la diseminación de mecanismos de resistencia bacteriana. Se debe limitar el uso de los fármacos disponibles para el tratamiento específico porque la actualización y la socialización periódica de los perfiles locales de resistencia bacteriana son importantes para la adecuada práctica clínica.