Introducción
Los defectos congénitos no sindrómicos tienen un origen multifactorial, relacionado con factores genéticos y ambientales. Entre los factores ambientales se encuentra la deficiencia materna de folato. El término defectos congénitos folato-sensibles se utiliza cuando se ha comprobado una disminución de la frecuencia de esta vitamina, luego de la suplementación materna preconcepcional o la fortificación de alimentos con ácido fólico.1,2,3) La vitamina B9 desempeña un rol crucial en la regulación epigenética del desarrollo embriofetal y resulta esencial para diferentes procesos vitales, como los de división celular y crecimiento.4
Los factores genéticos incluyen polimorfismos en genes vinculados al metabolismo del folato, como el metilentetrahidrofolato reductasa (MTHFR). Se han descrito más de 40 polimorfismos del gen MTHFR: el C677T se considera, clínicamente, el más importante por su influencia en la reducción de la forma biológicamente activa del ácido fólico. La prevalencia del alelo T de esta variante de secuencia oscila entre un 24 y 64 % en la población europea, un 48 % entre los norteamericanos, un 35 % en la población africana, y alrededor de un 2 y 63 % en poblaciones asiáticas.3,4,5,6,7
En Cuba no existen evidencias de estudios previos sobre la asociación entre el polimorfismo C677T del gen MTHFR y los defectos congénitos; por consiguiente, el presente estudio tuvo como objetivo relacionar el polimorfismo materno C677T del gen metilenetetrahodrofolato reductasa y la aparición de defectos congénitos folato-sensibles en la descendencia.
Métodos
Se realizó un estudio observacional analítico de casos y controles poblacionales entre los años 2013 y 2018 en la provincia de Villa Clara. Se incluyeron 90 madres con descendencia afectada por cinco tipos de defectos congénitos folato-sensibles y se les hizo la genotificación del polimorfismo de nucleótido simple C677T del gen MTHFR. Los casos se obtuvieron del Registro Cubano de Malformaciones Congénitas (RECUMAC) y el Registro Cubano Prenatal de Malformaciones Congénitas (RECUPREMAC) del Centro Provincial de Genética Médica de Villa Clara.
La población se constituyó por 22 madres cuyos hijos padecían cardiopatías congénitas conotroncales (Código CIE-10: Q20-Q28), 24 con defectos del tubo neural (Código CIE-10: Q00, Q01, Q05), 18 con hendiduras labio-palatinas (Código CIE-10: Q35-Q37), 16 con síndrome de Down (Código CIE-10: Q90) por trisomía 21 libre y 10 con gastrosquisis (Código CIE-10: Q793).8
Se incluyeron como controles 45 madres con descendencia sin ningún defecto congénito. A toda la población se le genotipó el polimorfismo C677T. Para ello se le tomó a cada madre una muestra de 5 ml de sangre venosa por punción antecubital; la sangre se transfirió a tubos estériles de polipropileno con 200 μL de EDTA y se refrigeró a -20oC hasta la extracción del ADN, que se hizo de manera automatizada mediante el sistema modular QIAsymphony SP en el Laboratorio de Biología Molecular del Centro Nacional de Genética Médica.
El polimorfismo C677T del gen MTHFR se estudió con PCR/RFLP a través de protocolos estandarizados.3,7 Los fragmentos obtenidos de la digestión enzimática se visualizaron mediante electroforesis en gel de agarosa. Se definieron las siguientes variables:
Alelos: cada una de las dos formas alternativas del polimorfismo C677T, según la corrida electroforética. Valores finales: alelo C o alelo T.
Genotipo: combinación dos a dos, de alelos para el polimorfismo C677T, característicos de cada individuo; según la corrida electroforética. Valores finales: homocigótico CC, heterocigótico CT u homocigótico TT.
Dado el limitado número de estudios moleculares en las madres del grupo control, se utilizaron, previa autorización del investigador principal, los resultados de la genotificación de 130 controles provenientes del único estudio poblacional sobre este polimorfismo en Cuba.7 Esta práctica resulta habitual en los estudios internacionales multicéntricos.
Los datos de la genotificación del polimorfismo C677T del gen MTHFR se introdujeron en una base de datos mediante el programa SPSS. Como estadígrafo de frecuencia se usó el porcentaje. Se empleó la dócima de hipótesis de independencia u homogeneidad, a través de la estimación del estadígrafo Chi cuadrado (X2) de Pearson para comparar la frecuencia de los diferentes genotipos entre los casos y controles, y entre los diferentes tipos de defectos congénitos folato-sensibles.
Para verificar si el polimorfismo C677T se hallaba en equilibrio génico de Hardy-Weinberg en el grupo de 173 controles, se calculó el Chi cuadrado de bondad del ajuste. Previo a la incorporación de las muestras al grupo control, se valoró el equilibrio génico de Hardy-Weinberg en los controles de cada provincia por separado.
Obtenidos los genotipos correspondientes al polimorfismo de los casos y los controles, y comprobada la existencia de equilibrio génico de Hardy-Weinberg, se estudiaron modelos de asociación genética de relaciones hipotéticas, bajo siete referencias de dominancia entre los alelos cuatro de codominancia, y los modelos de dominancia, recesividad y aditivo. Para determinar la asociación genética se utilizó el paquete estadístico Microstat; se calculó el valor del Chi cuadrado de Pearson para dos grados de libertad, la p asociada, el Odds Ratio y el intervalo de confianza al 95 %. Se empleó un nivel de significación α = 0,05.
La investigación se aprobó por el Comité de Ética de la Unidad de Investigaciones Biomédicas de la Universidad de Ciencias Médicas de Villa Clara. Las madres incluidas en el estudio consintieron participar en la investigación, y autorizaron la toma de muestras biológicas y la extracción de ADN.
Resultados
La frecuencia del genotipo homocigótico TT fue de 0,14 (13/90) y 0,06 (11/173), respectivamente, en las madres con hijos con defectos congénitos folato-sensibles y las madres del grupo control, diferencias consideradas significativas (p = 0,041). El alelo T tuvo una frecuencia de 0,37 (66/180) en los casos y 0,32 (109/346) en los controles. Las frecuencias alélicas entre casos y controles no resultaron diferentes para ninguno de los dos alelos (tabla 1).
Tabla 1 - Frecuencias genotípicas y alélicas del polimorfismo C677T del gen MTHFR en casos y controles
| CC | CT | TT | n | C | T | n | |
|---|---|---|---|---|---|---|---|
| Casos | 37 (0,41) | 40 (0,44) | 13 (0,14) | 90 | 114 (0,63) | 66 (0,37) | 180 |
| Controles | 75 (0,43) | 87 (0,50) | 11 (0,06) | 173 | 237 (0,68) | 109 (0,32) | 346 |
| 0,793 | 0,435 | 0,041 | 0,242 | 0,242 | |||
Las frecuencias genotípicas más elevadas se observaron para el genotipo mutado TT en las madres de casos con deterioro del tubo neural, seguido por hendiduras labio-palatinas y cardiopatías congénitas conotroncales; mientras que las frecuencias alélicas más altas para el alelo mutado T se constataron en las madres de hijos con deterioro del tubo neural, cardiopatías congénitas conotroncales y síndrome de Down. La distribución de frecuencias de los genotipos y los alelos en la muestra de casos con diferentes defectos congénitos folato-sensibles resultó homogénea (tabla 2).
Tabla 2 - Frecuencias genotípicas y alélicas del polimorfismo C677T del gen MTHFR en los diferentes tipos de defectos congénitos
|
|
X2 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| CC | CT | TT | n | Valor | C | T | n | valor | |||
| CCCT | 8 (0,36) | 11 (0,50) | 3 (0,14) | 22 | 27 (0,61) | 17 (0,39) | 44 | 2,61 | 0,624 | ||
| DTN | 7 (0,29) | 12 (0,50) | 5 (0,21) | 24 | 11,85 | 0,458 | 26 (0,54) | 22 (0,46) | 48 | ||
| HLP | 8 (0,44) | 7 (0,39) | 3 (0,17) | 18 | 23 (0,64) | 13 (0,36) | 36 | ||||
| SD | 6 (0,38) | 8 (0,50) | 2 (0,12) | 16 | 20 (0,62) | 12 (0,38) | 32 | ||||
| GS | 8 (0,80) | 2 (0,20) | 0 (0,00) | 10 | 18 (0,90) | 2 (0,10) | 20 | ||||
Leyenda: DC: defectos congénitos; CCCT: cardiopatías congénitas conotroncales; DTN: deterioro del tubo neural; HLP: hendiduras labio-palatinas; SD: síndrome de Down; GS: gastrosquisis.
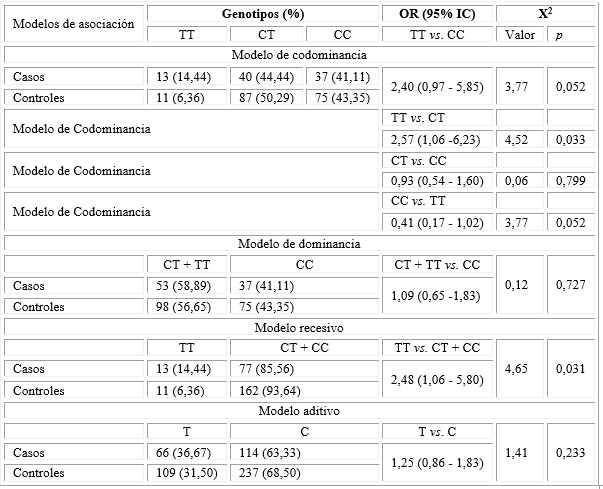
En la tabla 3 se muestran los diferentes modelos de asociación genética en el polimorfismo C677T del gen MTHFR en el grupo de madres de casos con los cinco tipos de defectos congénitos folato-sensibles y los controles. Se observaron diferencias significativas en el modelo de codominancia TT vs. CT [OR 2,57 (IC 95 % 1,06-6,23) (p = 0,033)] y el modelo recesivo TT vs. CT + CC [OR 2,48 (IC) 95 % 1,06 -5,80) (p = 0,031)].
Discusión
Las investigaciones para evaluar equilibrio génico y los análisis para detectar asociación genética, entre polimorfismos y entidades clínicas, se realizan, por regla general, en estudios colaborativos con muestras de varias poblaciones.9,10,11) En el presente estudio, más de la mitad del grupo control eran heterocigotas (CT) y alrededor de un 6 %, homocigotas (TT9). La frecuencia del alelo mutado T se destacó más en el grupo de casos que en los controles, lo cual coincide con Nauman y otros12 quienes observaron que la frecuencia de los genotipos TT y CT era mayor en las mujeres con descendencia con defectos congénitos que en el grupo control; igualmente, el alelo T superó al C en los casos.
La frecuencia de heterocigotos CT del grupo control resultó inferior a la identificada en un estudio poblacional hecho en Colombia (52,6 %); mientras que la frecuencia de individuos homocigóticos para el alelo de riesgo T en la población colombiana duplicó (13,2 %) a la constatada en el presente trabajo.13)
Las madres de los casos con deterioro del tubo neural mostraron las frecuencias genotípicas más elevadas del genotipo homocigoto TT. Esto se corresponde con lo descrito por Cai y otros.14 Para algunos investigadores el polimorfismo MTHFR C677T se asocia con un aumento de la susceptibilidad para el deterioro del tubo neural y para otros no, lo cual puede relacionarse con diferentes ajustes de las variables. Se requieren muestras más grandes para obtener resultados más sólidos.15,16,17 Sin embargo, en el oeste de México al comparar la frecuencia de dos polimorfismos en el gen MTHFR entre 101 recién nacidos con deterioro del tubo neural y 247 controles no hubo evidencias de que el estado de homocigocidad TT estuviera vinculado con este defecto.18
Las frecuencias genotípicas más elevadas del genotipo homocigoto TT, luego del deterioro del tubo neural, resultaron hendiduras labio-palatinas y cardiopatías congénitas conotroncales; debido a que el tubo neural, la cavidad oral y el tracto de salida del corazón se relacionan embriológicamente.11,19) La asociación del polimorfismo materno C677T y la hendidura labio-palatina se ha observado por varios autores. Investigadores italianos encontraron que el genotipo homocigoto TT en las madres incrementó el riesgo en la descendencia de presentar el labio con o sin paladar hendido.20 En cambio, otros estudios no hallaron asociación entre el polimorfismo en las madres y los defectos congénitos en la descendencia.21
En cuanto a las cardiopatías congénitas, existen controversias a la hora de arribar a conclusiones específicas.22 En este trabajo, la frecuencia genotípica para el genotipo homocigótico TT en las madres de los casos con cardiopatías congénitas conotroncales resultó inferior a la constatada por Raina y otros,23 quienes, en un estudio de casos y controles de base hospitalaria, identificaron una frecuencia del genotipo homocigótico TT de 0,40. Asimismo, científicos egipcios demostraron relación significativa entre el polimorfismo C677T y las cardiopatías congénitas conotroncales, con mayor relevancia en el modelo de asociación aditivo entre los alelos T vs. C (OR 1,85, 95 % CI: 1.41-2.43; p < 0,0001).24)
Las frecuencias génicas más altas para el alelo T se observaron en las madres de los casos con deterioro del tubo neural y cardiopatías congénitas conotroncales, seguidos por síndrome de Down y hendiduras labio-palatinas. Li y otros25 señalan el vínculo entre el menor alelo T en las madres y su descendencia con deterioro del tubo neural, cardiopatías congénitas, síndrome de Down y hendiduras labio-palatinas.
La deficiencia de ácido fólico y los polimorfismos del gen MTHFR alteran la metilación del ADN y la segregación cromosómica. Las irregularidades en el patrón de metilación de los centrómeros conllevan a la formación aberrante de los cinetocoros, lo cual provoca una segregación anormal de los cromosomas durante la meiosis.26,27,28) Aunque la literatura científica no indica consenso sobre la relación entre los polimorfismos del gen MTHFR y la aparición del síndrome de Down, en diferentes poblaciones se ha hallado asociación.27
La información obtenida en seres humanos y modelos animales apunta que el origen de la gastrosquisis se encuentra en el cierre defectuoso del anillo umbilical y la ruptura del amnios. Estos dos eventos podrían ocurrir por la activación de una vía patogénica común en la que convergen un factor con potencial inductor y algún tipo de predisposición genética en los embriones afectados.29) Al considerar la dualidad de un posible mecanismo patogénico vascular/trombótico en la génesis de la gastrosquisis, Makhmudi y otros30 estudiaron tres polimorfismos, y solamente el C677T se relacionó con la gastrosquisis.
Este estudio no reconoció el genotipo homocigoto TT en ninguna de las madres con descendencia afectada por gastrosquisis, quizás porque solo se genotiparon 10 casos con este defecto congénito; además de la baja frecuencia del menor alelo del polimorfismo C677T en la población. Las asociaciones alélicas encontradas para la presencia del alelo T, por la deficiencia materna de ácido fólico, se corresponde con lo referido en la literatura. Diferentes publicaciones describen una correlación significativa entre los polimorfismos del gen MTHFR y los defectos congénitos de origen multifactorial.4,14,15,20,22,31,32,33
Un metaanálisis con los mismos tipos de defectos congénitos folato-sensibles del presente estudio, excepto la gastrosquisis, vinculó el genotipo de riesgo TT en las madres con las cardiopatías congénitas y el deterioro del tubo neural en su descendencia, excepto para el modelo de codominancia (TT vs. CC) y el modelo de dominancia (TT + TC vs. CC); en el caso de las madres con síndrome de Down y hendiduras labio-palatinas, el riesgo se evidenció en el modelo de codominancia (TC vs. CC).25) La asociación en los modelos de codominancia (TT vs. CT) y el modelo recesivo (TT vs. CT + CC) resulta la más frecuentemente.23,34
Se concluye que la mayor frecuencia del genotipo homocigótico para el menor alelo T en las madres con descendencia con defectos congénitos folato-sensibles, en particular los del tubo neural, se halla potencialmente relacionada con la disminución de la actividad enzimática de la MTHFR en este genotipo.