Introducción
La cáscara de plátano posee un elevado valor nutricional, principalmente desde el punto de vista energético, lo que le confiere gran potencial para su utilización en la alimentación animal. Entre sus características, se encuentra su elevado contenido de materia seca y alta concentración de carbohidratos no fibrosos (Diniz et al., 2014). Según, Blasco-López et al. (2014), es una fuente potencial de sustancias antioxidantes y antimicrobianas, así como de metabolitos secundarios con actividad, que eliminan a los radicales libres. También contiene otros compuestos, como antocianinas (delfinidina y cianidina) y catecolaminas, carotenoides (β-caroteno, α-caroteno), xantofilas, esteroles y triterpenos (β-sitoesterol, stigmasterol, campesterol, cicloeucalenol, ciclártenos, cicloartanol 24-metileno).
Desde la década del 60 y en la actualidad, los nutricionistas trabajan en los procesos de maduración ruminal, con el propósito de alcanzar sincronización entre los metabolismos energéticos y nitrogenados en el rumen y consecuentemente, aumentar la respuesta productiva de los animales (DiLorenzo et al., 2015; Mercadante et al., 2015). Los subproductos con alto contenido de fibra pueden contribuir a mantener un pH ruminal normal, incrementar la digestión de forrajes fibrosos y pasturas y, por lo tanto, aumentar el consumo de materia seca de los bovinos. El efecto de los metabolitos secundarios de plantas en la digestibilidad de los alimentos es consecuencia de su acción en los microorganismos ruminales o de su interacción con el sustrato y las enzimas microbianas (van Wyngaard et al., 2015).
El método de digestibilidad in vitro de la materia seca consiste en una simulación del ambiente ruminal, en el que se crea una atmósfera reductora, rica en dióxido de carbono y exenta de oxígeno, con los minerales y el pH requerido para albergar los microorganismos del rumen. Se realiza una incubación de los alimentos con líquido ruminal durante 48 h, con 39 °C de temperatura corporal en la vaca y después con una disolución detergente neutro durante una hora a 100 °C (Godoy-Espinoza, 2012).
Por lo general, las mejoras en la producción de rumiantes con la utilizacón de enzimas fibrolíticas suplementarias se atribuyen al incremento de la absorción ruminal de la fibra. Se han propuesto numerosos mecanismos potenciales, que incluyen efectos ruminales y de pre-alimentación, como hidrólisis directa, cambios estructurales en la fibra, aumento de la fijación microbiana ruminal, estimulación de las poblaciones microbianas ruminales y sinergismo con las enzimas microbianas del rumen (Giraldo et al, 2007).
Medir la digestibilidad resulta cada vez más importante, debido al avance que se ha presentado en los actuales sistemas de alimentación, en los que la disponibilidad de nutrientes a nivel ruminal se calcula sobre la base de la competencia entre la tasa de digestión y la tasa de pasaje (Espinoza-Guerra, 2016). La determinación de la producción de gas in vitro es de valor para el nutricionista, ya que proporciona información acerca de la cinética de fermentación del forraje consumido por los rumiantes, que depende de la velocidad de paso y de la tasa de degradación (Mould et al., 2005). La taza y el alcance de la fermentación de MS en el rumen son determinantes en los nutrientes utilizados por los rumiantes (Jancík, et al., 2010).
La relevancia de la evaluación del valor nutricional del forraje contribuye de forma importante a trazar estrategias para mejorar la ingesta de proteínas y la energía de los animales de pastoreo (Cline et al., 2010). La tendencia actual en la alimentación de los bovinos está basada en aprovechar los residuos agrícolas (cascara de plátano) ricos en fibra, como suplementos alimenticios, y en obtener producciones más rentables (Gómez-Urrego et al., 2014).
Recientemente, debido al creciente interés en el cambio climático, y teniendo en cuenta la contribución de la ganadería a las emisiones de gases de efecto invernadero, la producción de gas in vitro se ha utilizado también para estimar el metano (Yáñez-Ruiz et al., 2016).
El objetivo de este estudio fue evaluar la digestibilidad in vitro de la cáscara de Musa paradisiaca L., pre-tratada con enzima exógena xilanasa para la alimentación de rumiantes.
Materiales y Métodos
Localización. Este estudio se realizó en el Laboratorio de Bromatología, de la Facultad de Ciencias Veterinarias, de la Universidad Técnica de Manabí, ubicada en la Parroquia Lodana, cantón Santa Ana, Provincia de Manabí, Ecuador, de agosto de 2018 a mayo de 2019.
Tratamiento y diseño experimental. Se evaluaron la digestibilidad in vitro de la materia seca (DIVMS) y la producción de gas (PGIV) mediante un diseño completamente al azar, con cuatro tratamientos y tres repeticiones, con diferentes dosis de enzimas exógenas (xilanasas). Se determinaron ambas variables a las 24 y 48 h. Los tratamientos fueron los siguientes:
T0-Cáscara de plátano sin enzima (testigo)
T1-Cáscara de plátano + 2 000 UI de enzima/kg de MS
T2-Cáscara de plátano + 4 000 UI de enzima/kg de MS
T3-Cáscara de plátano + 8 000 UI de enzima/kg de MS
Procedimiento experimental
Recolección del material vegetal. La muestra de la cáscara de plátano (CP) verde, (M. paradisiaca variedad barraganete), se obtuvo en una instalación de producción de procesamiento de plátanos. Mediante un análisis sensorial sencillo se revisaron las características organolépticas de olor, color, textura y grado de madurez. Posteriormente, se procedió a pesar 1 kg de la muestra en una balanza analítica de precisión de 0,01 g, y luego se secó. La CP se deshidrató durante 72 h, a 60 ºC, en una deshidratadora artesanal. Después se volvió a pesar para determinar el por ciento de materia seca y se molió a 2 mm de diámetro con un motor de cuchillas de acero (marca Willy IKA MF 10 Basic). La muestra molida se conservó en un frasco plástico, debidamente rotulado con las características de su contenido.
Preparación de las soluciones enzimáticas. Se utilizó fibrolítica exógena xilanasa (EC 3.2.1.4) del laboratorio comercial Dyadic Internacional Inc. (Júpiter, FL-USA). La actividad enzimática de la xilanasa se determinó usando xilano de madera al 1% (Sigma Chemical Co. St. Louis, MO); como sustrato puro, con 10 mg/mL diluido en buffer fosfato-citrato 0,1 M con pH 6,6 a 39 °C (Bailey et al., 1992). La enzima se diluyó 1:100, y se aplicó con una micropipeta en los volúmenes que se describen a continuación, de acuerdo a las dosis evaluadas: Xilanasas, T1-2 000 UI/kg de MS, 0,5 mL de enzima + 1,5 mL de agua destilada en 0,5 g de MS por frasco, T2-4 000 UI/kg de MS, 1 mL de enzima + 1 mL de agua destilada en 0,5 g de MS por frasco, T3-8 000 UI/kg de MS, 2 mL de enzima + 0 mL de agua destilada en 0,5 g de MS por frasco.
Tratamiento de las CP con la enzima. Una vez pesada la muestra (0,5 g) en viales de vidrio transparente rotulado, se aplicó la dosis de xilana, según los tratamientos definidos. Las diferentes dosis de enzimas se diluyeron directamente con la ayuda de una micropipeta una hora antes del proceso de llenado del medio de cultivo para el inicio de la fermentación microbiana anaeróbica. Los viales se colocaron en una incubadora a 39 °C para mantener una temperatura adecuada en el momento del llenado.
Ensayos in vitro. Como inóculo microbiano, se utilizó el líquido ruminal extraído de dos bovinos canulados en el rumen, que se mezcló y filtró a través de lienzo y gaza para eliminar los residuos presentes. Se mezcló con saliva artificial (SA) en proporción de 1/4 (100 mL de licor ruminal con 400 de SA). A esta mezcla se le denominó fluido ruminal. Después se procedió a gasear con C02 de 10 a 20 minutos, a temperatura de 39 °C. Concluido el gaseado, se transfirió el fluido ruminal a los viales de vidrio que ya contenían sustrato (0,5 g de CP), además de la enzima aplicada por tratamientos (xilanasa) en un volumen de 50 mL, con ayuda un dosificador manual. Terminado el llenado, se procedió nuevamente a gasear con CO2 durante 10 segundos y a sellar los viales herméticamente. Se registró el tiempo de inicio del proceso de la fermentación. Con la ayuda de un transductor de presión, se estableció la presión existente como el nivel cero, con el propósto de calcular la producción de gas in vitro a los diferentes tiempos de incubación (3, 6, 12, 24 y 48 h). Para el desarrollo del experimento, se prepararon 24 botellas (6 por tratamiento). Se utilizaron tres botellas por tratamiento para determinar la producción de gas en los tiempos indicados con anterioridad.
La digestibilidad aparente in vitro de la materia seca (DIVMS) se midió a las 24 y 48 h de incubación. Simultáneamente, se determinó la producción de gas a diferentes tiempos 3, 6, 12, 24 y 48 h, con la utlización de un transductor de presión (PSI) adaptado a una aguja número 23 (0,6 mm), modelo T443A (Bailey y Mackey, Birmingham, UK) y conectado a un dispositivo visual.
Los gases acumulados en la parte superior se retiraron con una jeringa hasta el momento en que la presión registrada en el lector llegó a cero. Los valores informados fueron en mL/g de MS del sustrato y se estimaron mediante la ecuación cuadrática propuesta por Mauricio et al. (1999):
Gp = 0,18 + 3,697 Pt + 0,0824 Pt 2
Este proceso se repitió en todos los frascos de cada caja. Después de las lecturas, se agitaron manualmente y se reubicaron en la estufa.
Determinación de la composición química. Se realizaron los análisis bromatológicos de la CP para conocer el contenido de materia seca (MS), proteína bruta (PB), cenizas (Cz) y materia organica (MO), según la metodología de la AOAC (2005). Se determinó el contenido de fibra detergente neutro (FDN) y fibra detergente ácido (FDA), según la técnica de Goering & van Soest (1970).
Análisis estadístico. Los datos se analizaron a partir de un análisis de varianza. Para las comparaciones de las medias, se utilizó la prueba de Tukey (p < 0,05). Se usó el paquete estadístico PROC GLM (SAS Institute, 2011).
Resultados y Discusión
La composición química de M. paradisiaca se muestra en la tabla 1. La materia orgánica fue de 91,6 %. En un trabajo de Ríos-Elizalde (2014), se informa un valor de 88,6 % al estudiar la cascara de otra variedad de plátano. Este autor también encontró contenido de cenizas de 11,4 %, valor superior a los obtenidos en esta investigación.
La cifra de proteína bruta (4,9 %) superó a la informada por Encarnación-Montero y Salinas-Alvarado (2017), al realizar la caracterización proximal y de la fibra dietética de la harina de plátano verde (2,4 %). A su vez, en harinas de plátano papocho y pelipita, Espitia et al. (2013) refireron contenido de proteína de 6,7 y 2,4 %, respectivamente. De ahí que la variación de proteína se relacione directamente con la variedad.
En este estudio, el valor de cenizas fue de 8,4 %, lo que se encuentra directamente asociado al alto contenido de minerales, como el calcio, potasio y magnesio. Según Montoya-López et al. (2015), esto se puede deber a la variedad de plátano que se evalúa. Este valor es inferior al obtenido por Godoy-Espinoza (2016), al analizar la composición química de la harina de plátano con urea en distintas formulaciones. Este autor encontró porcentajes de ceniza que variaron de 9,5 a 11,7 %.
En esta investigación, los contenidos de FDN y FDA fueron de 45,0 y 30,8 %, respectivamente. Valores similares obtuvieron Mosquera-Perea et al. (2013), cuando evaluaron los contenidos de FDN y FDA. Estos autores refireron cifras de 46,5 y 16,5 %, respectivamente.
La digestibilidad in vitro es un indicador del valor nutritivo de los alimentos (Mosquera-Perea et al., 2013). Al determinar la digestibilidad in vitro de la materia seca, a las 24 y 48 h de incubación, se encontraron diferencias entre los tratamientos (tabla 2). A las 24 h, se hallaron los mayores valores de digestibilidad en T1, T2 y T3, sin difierencias significativas entre ellos; sin embargo, difirieron de T0.
Tabla 2 Efecto de enzimas fibrolíticas exógenas en la digestibilidad in vitro (%) de la MS en la cáscara de plátano.
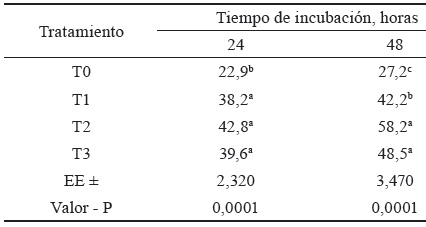
T0-Cáscara de plátano sin enzima (Testigo), T1-Cáscara de plátano + 2 000 UI de enzima/kg de MS, T2-Cáscara de plátano + 4 000 UI de enzima/kg de MS; T3-Cáscara de plátano + 8 000 UI de enzima/kg de MS
abc: Letras distintas en la misma columna difieren significativamente (p < 0,05)
Similar comportamiento informaron Moreno et al. (2007), al evaluar el efecto de enzimas fibrolíticas exógenas en la degradación ruminal in vitro de dietas para vacas lecheras. Estos autores encontraron mayor digestibilidad al aplicar la enzima (51,6 vs 50,3 % sin enzima). En sus resultados refieren que la enzima a 2 g/kg de MS mejoró la DIVMS en 2,5 %, con respecto a T0 (sin enzimas).
Los resultados muestran que a las 48 h, la digestibilidad fue mayor en cada uno de los tratamientos en los que se incluyeron las enzimas fibrolíticas exógenas, con respecto al testigo (T0). Los mayores valores se obtuvieron en T2 y T3, sin diferencias significativas entre ambos, pero sí con respecto al T1. Este último difirió significativamente del testigo.
Son similares estos resultados a los hallados por Win et al. (2015), quienes alimentaron con ensilaje de maíz a bovinos fistulados, y observaron diferencias en los diferentes tiempos que se evaluaron al utilizar enzimas fibrolíticas en la digestibilidad ruminal.
Valencia-Trujillo et al. (2010), al evaluar la digestibilidad in vivo en ovinos, mencionan que el contenido de fibra que contienen los pastos y forrajes influye en el comportamiento de la fermentación ruminal. Estos son indicadores que se deben considerar, al aplicar enzimas fibrolíticas. No obstante, Pedraza et al. (2003) refieren que las variaciones en la digestión se pueden atribuir al efecto de factores como la especie y el cultivar, el manejo de la planta y las condiciones edafoclimáticas.
Moreno et al. (2007) y Giraldo et al. (2007) mencionan que durante las primeras horas las enzimas presentan una mayor actividad sobre el sustrato, y estimulan la fase inicial de la digestibilidad. Estos autores mencionan que la actividad de las enzimas disminuye a medida que avanza el tiempo de fermentación.
Los valores altos de DIVMS se han asociado a la capacidad de los rumiantes para mantener niveles adecuados de producción, ya que este es un indicador de la capacidad de un alimento para aportar nutrientes a la flora ruminal (Lazo-Salas et al., 2018).
En muchos casos, se considera que el contenido de lignificación en la celulosa y hemicelulosa del sustrato es uno de los factores que influyen en el tiempo de digestión del sustrato (Montenegro et al., 2018). Reséndiz (2013) afirma que al aumentar la cantidad de la enzima y la fibra de la dieta se forma una barrera que sirve de protección al ataque de microorganismos, reduciendo así la digestibilidad.
En este estudio, los resultados de la producción de gas in vitro (PGIV), a las 3, 6, 12, 24 y 48 h, muestran que durante las tres primeras horas no se registraron diferencias significativas entre tratamientos (tabla 3), mientras que, a las 6, 12, 24 y 48 h sí hubo diferencias estadísticas entre ellos (p < 0,01).
Tabla 3 Producción de gas in vitro (mL/0,5 g de de la cáscara de plátano).

T0-Cáscara de plátano sin enzima (Testigo), T1-Cáscara de plátano + 2 000 UI de enzima/kg de MS, T2-Cáscara de plátano + 4 000 UI de enzima/kg de MS; T3-Cáscara de plátano + 8 000 UI de enzima/kg de MS
abc: Letras distintas en la columna difieren significativa
La máxima producción de gas (PG), alcanzada hasta las 48 h, se registró en el tratamiento T2, con media de 284,3 mL/g de MS. La más baja se obtuvo en el tratamiento T3 (229,7 mL/g de MS). En este período, la tasa fraccional de PG no fue significativa entre los T0 y T1, lo que se asocia a la cantidad de la enzima añadida en cada uno de estos tratamientos. Sin embargo, en los dos últimos tratamientos (T2 y T3) sí se encontraron diferencias estadísticas (p < 0,05). No obstante, en esta investigación se observó que la concentración más alta de enzimas redujo la PG en comparación con el tratamiento control.
Los resultados de la PG in vitro muestran que durante las primeras seis horas se presentó un comportamiento similar en cada uno de los tratamientos (T0, T1 y T3), pero con diferencias significativas con respecto a T2 (p < 0,001). A las 12 h, se encontraron diferencias significativas entre los tratamientos (p < 0,001). La mayor PG se otuvo en T2 y la menor, en T3. Mientras, a las 48 h no se encontraron diferencias estadísticas en T0, T1 y T2, pero sí con respecto a T4 (p < 0,05).
Estudios realizados por Rubanza et al. (2005) coinciden en que una dosis alta de enzimas produce acumulación de productos finales en la botella. Generalmente, la acumulación de estos productos de reacción disminuye la velocidad de acción de la enzima. En algunos casos, se combinan con el sitio activo de esta y forman un sistema complejo, lo que inhibe la actividad enzimática.
La mayor producción de gas se puede deber al contenido de los carbohidratos solubles, ya que la producción de ácidos grasos volátiles está determinada por la acción de los microorganismos en los metabolitos de los carbohidratos (Silva-Ruilova, 2017). Lo referido por Velázquez et al. (2013) corrobora esta idea, al afirmar que el volumen de gas producido y la degradación de la MS presentan una correlación positiva. Esto implica que al aumentar la degradación de MS, aumenta la producción de gas.















