Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Nucleus
versión impresa ISSN 0864-084X
Nucleus no.49 Ciudad de La Habana ene.-jun. 2011
CIENCIAS NUCLEARES
Nuevas curvas de calibración para la dosimetría biológica en Cuba
New calibration curves for biological dosimetry in Cuba
Ana Ilsa Lamadrid Boada, Tania Mandina Cardoso, Jorge Ernesto González Mesa, Ivonne Romero Aguilera, Omar García Lima
Laboratorio de Radiobiología del Centro de Protección e Higiene de las Radiaciones (CPHR)
Calle 20 No 4113 e/ 41 y 47, Playa. La Habana, Cuba
RESUMEN
Se muestran 11 curvas dosis respuesta in vitro obtenidas por primera vez en el país para tres indicadores biológicos: anillos en cromosomas prematuramente condensados (PCC-R) índice PCC; focos gamma H2AX (![]() -H2AX), todos ellos en linfocitos de sangre periférica humana. Estas curvas en su conjunto cubren un intervalo de dosis desde 0,1 Gy hasta 25 Gy, y varias calidades de radiación, así como varios tiempos post exposición, lo cual fortalece las capacidades para dar respuesta a las emergencias radiológicas y amplía las posibilidades de contribuir al esclarecimiento de cualquier suceso radiológico anormal que pueda ocurrir en la región, donde el indicador predominante en la actualidad continúa siendo la cuantificación de dicéntricos en linfocitos de la sangre periférica.
-H2AX), todos ellos en linfocitos de sangre periférica humana. Estas curvas en su conjunto cubren un intervalo de dosis desde 0,1 Gy hasta 25 Gy, y varias calidades de radiación, así como varios tiempos post exposición, lo cual fortalece las capacidades para dar respuesta a las emergencias radiológicas y amplía las posibilidades de contribuir al esclarecimiento de cualquier suceso radiológico anormal que pueda ocurrir en la región, donde el indicador predominante en la actualidad continúa siendo la cuantificación de dicéntricos en linfocitos de la sangre periférica.
Palabras claves: Cuba, dosimetría, calibración, indicadores biológicos, lesiones producidas por radiaciones, distribución de las dosis de radiación, dosis de radiación.
ABSTRACT
In this paper we show the dose response curves in vitro obtained at first time in Cuba, with several biological indicators for radiation damage: rings in premature chromosome condensation (PCC-R); PCC index and ![]() -H2AX foci, all of these in peripheral human lymphocytes. These curves cover an interval of doses between 0.1 Gy to 25 Gy, several radiation qualities and times post-exposition, strengthening the capabilities of the Cuban laboratory to give answer to the radiological emergencies and in the same way increase its contribution to elucidate any radiological abnormal event take place at the region where the main indicator at the present time is the dicentric assay in lymphocytes of peripheral blood.
-H2AX foci, all of these in peripheral human lymphocytes. These curves cover an interval of doses between 0.1 Gy to 25 Gy, several radiation qualities and times post-exposition, strengthening the capabilities of the Cuban laboratory to give answer to the radiological emergencies and in the same way increase its contribution to elucidate any radiological abnormal event take place at the region where the main indicator at the present time is the dicentric assay in lymphocytes of peripheral blood.
Key words: Cuba, dosimetry, calibration, biological indicators, radiation injuries, radiation dose distributions, radiation doses.
Introducción
Cuando ocurren accidentes radiológicos es importante determinar lo antes posible la magnitud de las dosis que recibieron las personas afectadas. La dosimetría biológica aporta frecuentemente criterios importantes en la investigación del accidente.
Si la dosis recibida está por encima de 1 Gy, ayuda a tomar decisiones sobre la terapia y da información de los probables efectos determinísticos que sobrevendrán. Si las dosis son menores el médico podrá orientar al irradiado sobre los riesgos de los efectos estocásticos a largo plazo, por ej. el riesgo de desarrollar cáncer y por último, cuando la dosimetría arroje una dosis menor de 50 mGy será muy tranquilizador para la persona conocer que no se ha encontrado un daño cromosómico significativo.
La dosimetría biológica consiste en la cuantificación del daño ocasionado por las radiaciones ionizantes sobre las células del propio individuo, la cual se compara con curvas dosis respuestas realizadas in vitro y requiere que el parámetro medido posea una relación dosis efecto conocida que perdure el tiempo suficiente para ser observado, que sea reproducible, de alta especificidad respecto a las radiaciones; que abarque un cierto intervalo de dosis; que la muestra sea de fácil recolección y que los resultados se obtengan de manera rápida. Mientras mayor número de esas características posea el indicador medido, será más útil, confiable y preciso.
La dosimetría citogenética convencional utiliza el dicéntrico para las estimaciones y es hasta el momento la más precisa y confiable [1]. El intervalo de dosis en que muestra mayor precisión es entre 0,1 y 5 Gy, por encima de este, los dicéntricos saturan [2]. En la investigación de accidentes radiológicos es importante disponer de una biodosimetría segura para un espectro de exposición lo más amplio posible, por ello se han comenzado a desarrollar otros indicadores que vencen las limitaciones del ensayo de dicéntricos, el cual ha mostrado algunas limitaciones en las altas dosis y en el tiempo de generación de sus resultados. Para las altas dosis las investigaciones se han enfocado en el ensayo de anillos en cromosomas condensados prematuramente, más conocido por PCC-R, el cual permite estimaciones de 20 y hasta 25 Gy [3, 4], por encima de esa dosis ocurre la saturación de los anillos. Sin embargo, es posible hacer estimaciones a dosis aún mayores utilizando otro indicador, el índice PCC [5, 6], si bien se necesitaría confirmación en casos reales. También ha comenzado a ganar espacio en los últimos años el empleo de un indicador molecular muy sensible ![]() -H2AX, mediante el cual es posible detectar los sitios con rupturas dobles en la molécula de ADN, comúnmente denominados “focos
-H2AX, mediante el cual es posible detectar los sitios con rupturas dobles en la molécula de ADN, comúnmente denominados “focos ![]() -H2AX” a dosis tan bajas como 0,02 Gy [7, 8]. La ventaja de este indicador es la inmediatez, pues para el análisis de este no es necesario el cultivo celular, imprescindible en el ensayo de dicéntricos y PCC-R, su limitante es que su frecuencia disminuye rápidamente con el tiempo, no obstante se ha demostrado que a dosis altas es posible evaluar el indicador varias horas después de ocurrida la exposición, por lo que se ha desarrollado la estrategia de evaluarlo y obtener curvas de calibración a diferentes tiempos post exposición [9,10].
-H2AX” a dosis tan bajas como 0,02 Gy [7, 8]. La ventaja de este indicador es la inmediatez, pues para el análisis de este no es necesario el cultivo celular, imprescindible en el ensayo de dicéntricos y PCC-R, su limitante es que su frecuencia disminuye rápidamente con el tiempo, no obstante se ha demostrado que a dosis altas es posible evaluar el indicador varias horas después de ocurrida la exposición, por lo que se ha desarrollado la estrategia de evaluarlo y obtener curvas de calibración a diferentes tiempos post exposición [9,10].
En el trabajo se muestran los resultados más recientes obtenidos en el Servicio de Dosimetría Biológica del CPHR. Se muestran 11 curvas dosis respuesta in vitro elaboradas para cubrir el intervalo de dosis entre 0,1 a 25 Gy de rayos gamma y hasta 4 Gy de neutrones. Estas incluyen una curva para el ensayo dicéntricos en el intervalo de 0,1 a 5 Gy, una curva de PCC-R y una del índice PCC con radiación gamma para el intervalo de dosis entre 5 y 25 Gy. Una curva de PCC-R y una de índice PCC con neutrones para el intervalo de 1 a 4 Gy, tres curvas de ![]() -H2AX para rayos X en el intervalo de 0,1 a 2 Gy a 30 minutos, 5 horas y 8 horas postexposición y tres de
-H2AX para rayos X en el intervalo de 0,1 a 2 Gy a 30 minutos, 5 horas y 8 horas postexposición y tres de ![]() -H2AX para radiación gamma con 30 minutos, 8 horas y 16 horas post exposición. Las curvas amplían las posibilidades existentes en el país para estimar las dosis en los individuos expuestos durante accidentes o incidentes radiológicos.
-H2AX para radiación gamma con 30 minutos, 8 horas y 16 horas post exposición. Las curvas amplían las posibilidades existentes en el país para estimar las dosis en los individuos expuestos durante accidentes o incidentes radiológicos.
Materiales y Métodos
Preparación de las muestras
Las extracciones de sangre se hicieron con jeringuillas desechables con heparina de litio y dispensada en tubos para su posterior irradiación. Los donantes voluntarios dieron su consentimiento por escrito y fueron informados de los fines de las investigaciones acorde a la Ley No 41 del Ministerio de Salud Pública de Cuba en caso de las irradiaciones hechas en el CPHR. Para las irradiaciones realizadas en el IRSN de Francia, la sangre fue colectada acorde a la Ley de Bioética francesa (L 2004-800).
Irradiación de las muestras
En todas las irradiaciones realizadas se siguieron las recomendaciones del Organismo Internacional de Energía Atómica para la producción de las curvas dosis respuesta in vitro [1]. La dosimetría se expresó en términos de Kerma en aire.
Curva de dicéntricos y rayos gamma: las muestras de sangre se irradiaron en una fuente de ![]() del Laboratorio Secundario de Calibración Dosimétrica del CPHR, trazable al PTB de Alemania, a dosis de 0,1; 0,2; 0,3; 0,5; 0,75; 1,0; 2,0; 3,0; 4;0 y 5,0 Gy a una tasa de dosis de 1 Gy/min.
del Laboratorio Secundario de Calibración Dosimétrica del CPHR, trazable al PTB de Alemania, a dosis de 0,1; 0,2; 0,3; 0,5; 0,75; 1,0; 2,0; 3,0; 4;0 y 5,0 Gy a una tasa de dosis de 1 Gy/min.
Curva de anillos e índice PCC en cromosomas prematuramente condensados con irradiación gamma: las irradiaciones se realizaron en las instalaciones ICO-4000 del IRSN, Francia con 60Co a dosis de 5; 7,5; 10; 20 y 25 Gy a una tasa de dosis de 0,5 Gy/min.
Curva de anillos e índice PCC en cromosomas prematuramente condensados con irradiación con neutrones: los tubos se expusieron a neutrones de fisión en las instalaciones de SILENE (Valduc, Francia) a dosis de 5; 7,5; 10; 20 y 25 Gy, la energía media del espectro de neutrones fue 0,49 MeV.
Curvas de ![]() -H2AX con rayos X: las irradiaciones se realizaron en el CPHR en una fuente de rayos X Pantak 160, 100 kVp, 10 mA, a una tasa de dosis de 0,14 Gy/min. Las dosis suministradas fueron 0,02; 0,05; 0,1; 0,2; 0,5 y 1 Gy para las curvas de 30 min, mientras que para 5 h y 8 h se suministraron dosis de 0,5, 1 y 2 Gy.
-H2AX con rayos X: las irradiaciones se realizaron en el CPHR en una fuente de rayos X Pantak 160, 100 kVp, 10 mA, a una tasa de dosis de 0,14 Gy/min. Las dosis suministradas fueron 0,02; 0,05; 0,1; 0,2; 0,5 y 1 Gy para las curvas de 30 min, mientras que para 5 h y 8 h se suministraron dosis de 0,5, 1 y 2 Gy.
Curvas de ![]() -H2AX con
-H2AX con ![]() : las irradiaciones se realizaron en las instalaciones ICO-4000 del IRSN, Francia a dosis de 0,02; 0,05; 0,1; 0,2; 0,5 y 1 Gy para las curvas de 30 min, mientras que para 8 h y 16 h se suministraron dosis de 0,5, 1 y 2 Gy a una tasa de dosis de 0,5 Gy/min.
: las irradiaciones se realizaron en las instalaciones ICO-4000 del IRSN, Francia a dosis de 0,02; 0,05; 0,1; 0,2; 0,5 y 1 Gy para las curvas de 30 min, mientras que para 8 h y 16 h se suministraron dosis de 0,5, 1 y 2 Gy a una tasa de dosis de 0,5 Gy/min.
Descripción del ensayo de dicéntricos
Después de la irradiación, las muestras de sangre se mantuvieron a 37 °C durante 2 horas, permitiendo actuar los mecanismos de reparación celular.
Los cultivos de linfocitos se hicieron con sangre total en medio RPMI 1640, suplementado con 10% de suero bovino fetal y 1% de fitohemaglutinina, incubándose a 37 °C durante 48 horas. Se añadió colchicina 3 horas antes de terminar el cultivo. Las células cultivadas se trataron con una solución hipotónica de KCl (0,075 M) durante 30 minutos a 37 °C y se fijaron con metanol:ácido acético, 3:1 v/v. Finalmente, las células se extendieron por goteo en láminas portaobjetos y se colorearon con Giemsa. Cuatro operadores participaron en el conteo, y la aparición de cromosomas dicéntricos se comprobó por un segundo operador. Se analizaron 500 metafases con 46 ± 2 centrómeros o 100 dicéntricos por cada dosis de radiación cuando fue posible. Las frecuencias de dicéntricos se calcularon como la relación entre los dicéntricos encontrados entre el total de metafases analizadas. Se utilizaron microscopios Olympus, Japón, con 1000 aumentos. Para el análisis estadístico se usó el test "U" para testar si la dispersión de las aberraciones describía una distribución de Poisson [11]. Las relaciones dosis efecto se ajustaron acorde al modelo lineal cuadrático, usando el método de la máxima verosimilitud descrito por Papworth [12].
Descripción del ensayo de PCC-R y del índice PCC
Después de la irradiación la sangre se mantuvo a 37 °C durante 2 horas, permitiendo actuar los mecanismos de reparación celular.
Los cultivos de linfocitos para las curvas de PCC-R se hicieron con sangre total en un medio de cultivo similar al utilizado para el ensayo de dicéntricos con ligeras variantes: 20% de suero bovino fetal, colcemid (0,05 μg/ml) a las 24 horas de comenzar el cultivo y calyculina A (50 nM), 1 hora antes de finalizar estos. El tratamiento hipotónico, la fijación y la tinción fueron los mismos que para los dicéntricos. Dos operadores participaron en los conteos acorde al criterio de considerar como un anillo aquel con un orificio visible en su centro (con o sin centrómero visible) en cualquier estadio del ciclo celular y las parejas de anillos separados o unidos por su centrómero [4].
La frecuencia de anillos PCC se evaluó en células PCC en G1, G2 y M con más de 46 elementos. Se analizaron como mínimo 100 anillos o 500 células PCC por cada dosis. Las frecuencias de PCC-R en todos los estadios del ciclo celular se calcularon como la relación entre los anillos encontrados y el total de células observadas. Se utilizó un microscopio Nikon SA, Japón, con 1000 aumentos. Para el análisis estadístico se usó el test "U" para testar si la dispersión de las aberraciones describía una distribución de Poisson [10]. Las relaciones dosis efecto se ajustaron acorde al modelo lineal, usando el método de la máxima verosimilitud descrito por Papworth [11]. El índice PCC se calculó como el porcentaje de células con cromosomas prematuramente condensados entre todas las células observadas. Las células PCC en fase S no se incluyeron en el cálculo de este [6].
Descripción del ensayo ![]() -H2AX
-H2AX
Se empleó la técnica de detección de focos ![]() -H2AX mediante inmunofluorescencia para monitorear la formación de roturas de doble cadena en linfocitos humanos aislados de muestras de sangre no tratadas e irradiadas con rayos X y gamma según la metodología descrita por Roch-Lefèvre et. al. [9].
-H2AX mediante inmunofluorescencia para monitorear la formación de roturas de doble cadena en linfocitos humanos aislados de muestras de sangre no tratadas e irradiadas con rayos X y gamma según la metodología descrita por Roch-Lefèvre et. al. [9].
El número de focos ![]() -H2AX/célula se determinó en muestras controles e irradiadas de al menos 3 sujetos sanos para todos los tiempos de cinética ensayados para ambos tipos de irradiación.
-H2AX/célula se determinó en muestras controles e irradiadas de al menos 3 sujetos sanos para todos los tiempos de cinética ensayados para ambos tipos de irradiación.
La sangre irradiada así como los controles se diluyeron con RPMI y se incubaron a 37 °C durante 30 min, 5 h, 8 h y 16 h. Se aislaron las células mononucleares mediante un gradiente de FICOLL, se fijaron con paraformaldehído 2% durante 1 hora a 4 °C y después de varios lavados se extendieron en las láminas mediante centrifugación. Se realizó la inmunotinción y la captura y análisis de las células y focos mediante los softwares Histolab™ y el Cartograph™ (Microvision Instruments, FRANCE).
En el análisis estadístico para la elaboración de las curvas se cuantificó el número de focos por célula. Se calculó el promedio por dosis en cada caso. Se empleó un ajuste mediante regresión lineal para elaborar las curvas dosis-respuesta. Las curvas dosis-respuesta para 30 min y 8 h después de la irradiación se compararon con las obtenidas en el IRSN con rayos gamma, empleando un análisis de regresión y la prueba t de Student (p < 0,05).
Resultados y discusión
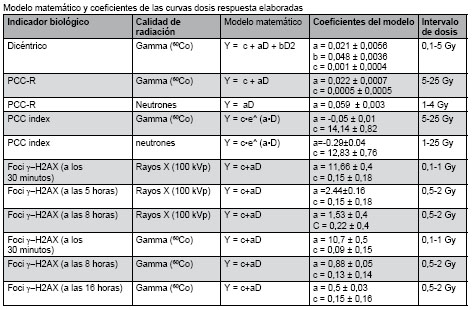
En la siguiente tabla se presentan los resultados de la realización de 11 curvas dosis respuestas elaboradas por los especialistas del Laboratorio de Radiobiología.
Curva dosis respuesta para dicéntricos con irradiación gamma
Se analizaron un total de 11 129 metafases, en un intervalo de dosis desde 0,2 Gy hasta 5 Gy que sin considerarse una dosis tan alta, está en el límite de la sobrevivencia humana. La formación de dicéntricos siguió una distribución de Poisson. La frecuencia base de dicéntricos es la obtenida con donantes sanos analizadas anteriormente en el laboratorio, y similar a las reportadas por laboratorios de referencia en el mundo [13].
Se obtuvo una relación lineal cuadrática como se esperaba, para células expuestas a irradiación con bajo LET, cuyos coeficientes se muestran en la tabla. Esta curva resultó similar a la que existía anteriormente en laboratorio, los coeficientes eran a = 0,028 y b = 0,047, aunque los errores son menores en esta nueva edición de la curva, debido probablemente a un mayor número de células analizadas.
La curva convencional de dicéntricos se aplica en la evaluación dosimétrica inmediata de situaciones de sobreexposición aguda a todo o gran parte del cuerpo, por irradiación externa y/o contaminación interna, con radionúclidos de distribución uniforme en el organismo como cesio y tritio. Mediante la aplicación de métodos estadísticos desarrollados es posible realizar estimaciones en exposiciones inhomogéneas, fraccionadas y prolongadas en el tiempo, donde se tiene en cuenta el decrecimiento en la frecuencia de aberraciones de manera exponencial en función del tiempo [1]. Esta curva es de amplio uso en Cuba, donde la mayoría de los trabajadores expuestos trabajan con fuentes de ![]() y
y ![]() .
.
Curva dosis respuesta para PCC-R con irradiación gamma
Se analizaron 5113 células PCC en estadios G1, G2 y M en el intervalo de dosis de 5 a 25 Gy de radiación gamma ![]() . Las frecuencias de anillos observados mostraron una relación lineal con la dosis de radiación, lo cual concuerda con los modelos planteados para la formación de aberraciones cromosómicas para altas dosis [1] y con la frecuencia de anillos obtenida con el mismo protocolo de cultivo [14], pero inferior a la obtenida por otros autores, probablemente debido a diferencias en los criterios de conteo [3]. Los coeficientes de la curva se muestran en la tabla. El ensayo es de utilidad en casos de sobreexposiciones accidentales, donde la dosis recibida por la víctima esté por encima de 5 Gy, pues este ensayo soluciona las principales dificultades que presenta la técnica convencional de dicéntricos a esas dosis que son la saturación de los dicéntricos y el bajo índice mitótico de los cultivos [15].
. Las frecuencias de anillos observados mostraron una relación lineal con la dosis de radiación, lo cual concuerda con los modelos planteados para la formación de aberraciones cromosómicas para altas dosis [1] y con la frecuencia de anillos obtenida con el mismo protocolo de cultivo [14], pero inferior a la obtenida por otros autores, probablemente debido a diferencias en los criterios de conteo [3]. Los coeficientes de la curva se muestran en la tabla. El ensayo es de utilidad en casos de sobreexposiciones accidentales, donde la dosis recibida por la víctima esté por encima de 5 Gy, pues este ensayo soluciona las principales dificultades que presenta la técnica convencional de dicéntricos a esas dosis que son la saturación de los dicéntricos y el bajo índice mitótico de los cultivos [15].
Curva dosis respuesta para PCC-R con irradiación con neutrones
Se analizaron 11 019 células PCC en estadios G1, G2 y M en el intervalo de dosis de 1-25 Gy de irradiación con neutrones de fisión. El ajuste de las frecuencias de anillos observadas desde 0 a 3,8 Gy fue obtenido con el modelo lineal, como era de esperarse para radiaciones de alto LET [1]. Los coeficientes de la curva se muestran en la tabla. Esta curva se puede utilizar para casos de sobreexposiciones accidentales a neutrones, pudiendo obtenerse estimaciones precisas hasta 4 Gy, aproximadamente. El empleo de un amplio intervalo en las dosis de radiación permitió una caracterizaron más precisa de la respuesta a la dosis y el proceso de saturación.
Curvas dosis respuesta para el índice PCC con irradiación gamma e irradiación con neutrones
Los coeficientes de ambas curvas se dan en la tabla. El valor de este indicador decreció de manera dosis dependiente en el intervalo de 1-25 Gy. En el caso de los neutrones permitió discriminar con facilidad 3 grupos de dosis 0–1 Gy, > 1–10 Gy y> 10 Gy lo cual resulta de utilidad por el proceso de saturación observado en la formación de anillos, que limita las estimaciones de dosis para exposiciones con neutrones extremadamente altas. El valor del índice PCC menor que 1 indicó que la dosis de radiación estuvo por encima de 10 Gy. Estos resultados se obtuvieron en modelaciones in vitro. Los datos obtenidos con este indicador se pueden emplear dentro de la variante multiparamétrica junto a otros indicadores biológicos, en la toma de decisiones sobre el tratamiento médico necesario en cada individuo y fundamentalmente, en la clasificación de las personas irradiadas por niveles de exposición.
Curvas ![]() -H2AX con irradiación X y gamma
-H2AX con irradiación X y gamma
Los valores basales de focos ![]() -H2AX cuantificados para 30 min se encuentran en el intervalo entre 0,03 y 0,16, similar a lo reportado en la literatura para rayos gamma [7-9].
-H2AX cuantificados para 30 min se encuentran en el intervalo entre 0,03 y 0,16, similar a lo reportado en la literatura para rayos gamma [7-9].
Se observó un incremento lineal del número de focos/célula con la dosis de radiación para los diferentes tiempos estudiados. El número de focos/célula/Gy para rayos gamma fue 10,7; mientras que para rayos X fue 11,66 al analizarse 30 minutos postexposición. Estos resultados son similares a los descritos en la literatura para un tiempo de 30 minutos de incubación de la sangre a 37 °C [7,8,10].
Las curvas obtenidas con rayos X y radiación gamma a 30 min no mostraron diferencias significativas (p > 0,05), contrario a lo observado 8 horas post exposición (p < 0,05). El retardo en la cinética de reparación después de la irradiación con rayos X se pudiera atribuir a que la energía y el tamaño de las trazas de partículas secundarias que esta radiación produce es mucho menor que la de la radiación gamma que es más energética, lo que resulta en una elevada densidad electrónica local como sugiere Beels, et. al. para bajas dosis [16] Esto no debe tener implicaciones in vivo según Löbrich, et. al. [7] en estudios de irradiaciones parciales en pacientes.
Como se ha señalado, este indicador tiene la limitante de que su frecuencia disminuye rápidamente con el tiempo postexposición. Las curvas obtenidas avalan la posibilidad de emplear el indicador para detectar daños en el ADN hasta 16 h después de exposiciones corporales uniformes a dosis desde 0,5 hasta 2 Gy. Ello permitiría evaluar en este intervalo de dosis y tiempo personas con sospecha de sobreexposición a las radiaciones ionizantes. Actualmente se evalúa la posibilidad de extender el intervalo de dosis y el tiempo, postexposición al que se realiza el análisis, lo cual permitiría estimar dosis superiores a 2 Gy en intervalos de tiempo mayores.
Conclusiones
Las curvas dosis respuesta de los nuevos indicadores incorporados al servicio de dosimetría biológica permiten estimar dosis en un intervalo entre 0,1 Gy y 25 Gy para radiación gamma y entre 1 Gy y 25 Gy para irradiación neutrónica. Cubrir este amplio intervalo de dosis con la dosimetría biológica fortalece las capacidades del país para dar respuesta a las emergencias radiológicas e igualmente amplía las posibilidades de contribuir al esclarecimiento de cualquier suceso radiológico anormal que pueda ocurrir en la región, donde el indicador predominante en la actualidad sigue siendo la cuantificación de dicéntricos en linfocitos de la sangre periférica.
Agradecimientos
Este trabajo fue financiado por la AENTA/CITMA como parte de dos Proyectos Ramales Nucleares, así como por el Proyecto Regional RLA9061 y el IRSN de Francia.
Referencias Bibliográficas
1. IAEA. Technical Reports Series No. 405 Cytogenetic analysis for radiation dose assessment a manual. Vienna: IAEA, 2001.
2. NORMAN A, SASAKI MS. Chromosome-exchange aberrations in human lymphocytes. Int. J. Radiat. Biol. 1967; 11(4): 321-328.
3. KANDA R, HAYATA J, LLOYD DC. Easy biodosimetry for high-dose radiation exposures using drug-induced, prematurely condensed chromosomes. Int. J. Radiat. Biol. 1999; 75(4): 441-446.
4. LAMADRID AI, GARCIA O, DELBOS M, et. al. PCC-ring induction in human lymphocytes exposed to gamma and neutron irradiation. J. Radiat. Res. 2007; 48(1): 1-6.
5. GOTOH E, TANNO Y, TAKAKURA K. Simple biodosimetry method for use in cases of high dose radiation exposure that scores the chromosome number of giemsa-stained drug-induced prematurely condensed chromosomes (PCC). Int J Radiat Biol. 2005; 81(1): 33-40.
6. LAMADRID AI, GONZALEZ JE, GARCIA O, et. al. Prematurely condensed chromosome rings after neutron irradiation of human lymphocytes. J. Radiat. Res. 2011. In press.
7. LÖBRICH M, RIEF N, KÜHNE M, et al. In vivo formation and repair of DNA double-strand breaks after computed tomography examinations. Proc. Natl. Acad. Sci USA. 2005; 102(25): 8984-8989.
8. ROTHKAMM K, BALROOP SH, SHEKHDAR J, et al. Leukocyte DNA damage after multi-detector row CT: a quantitative biomarker of low-level radiation exposure. Radiology. 2007; 242(1): 244-251.
9. ROCH-LEFÈVRE SH, MANDINA T, VOISIN PA, et. al. Quantification of ![]() -H2AX foci in human lymphocytes: a method for biological dosimetry after ionizing radiation exposure. Rad. Res. 2010; 174(2): 185-194.
-H2AX foci in human lymphocytes: a method for biological dosimetry after ionizing radiation exposure. Rad. Res. 2010; 174(2): 185-194.
10. REDON CHE, DICKEY JS, BONNER W M, SEDELNIKOVA OA. ![]() -H2AX as a biomarker of DNA damage induced by ionizing radiation in human peripheral blood lymphocytes and artifi cial skin. Advances in Space Research. 2009; 43(8): 1171-1178.
-H2AX as a biomarker of DNA damage induced by ionizing radiation in human peripheral blood lymphocytes and artifi cial skin. Advances in Space Research. 2009; 43(8): 1171-1178.
11. PAPWORTH DG. Appendix in: Savage J.R.K. Sites of radiation induced chromosome exchanges. Curr. Top. Radiat. Res. 1970; 6: 129-194.
12. PAPWORTH DG. Curve fitting by maximum likelihood. Radiat. Bot. 1975; 15: 127-131.
13. VAURIJOUX A, GRUEL G, POUZOULET F, et. al. Strategy for population triage based on dicentric analysis. Radiat. Res. 2009; 171(5): 541-548.
14. LINDHOLM C, et. al. Premature chromosome condensation (PCC) assay for dose assesment in mass casualty accidents. Radiat. Res. 2010; 173 (1): 71-78.
15. HAYATA I, KANDA R, MINAMIHISAMATSU M, et. al. Cytogenetical dose estimation for 3 severely exposed patients in the JCO critically accident in Tokaimura. J. Radiat. Res. 2001; 42(Suppl): S-149-S-155.
16. BEELS L, WERBROUCK J, HUBERT TH. Dose response and repair kinetics of c-H2AX foci induced by in vitro irradiation of whole blood and T-lymphocytes with X- and ![]() -radiation. Int. J. Radiat. Biol. 2010; 86(9): 760–768.
-radiation. Int. J. Radiat. Biol. 2010; 86(9): 760–768.
Recibido: 1 de febrero de 2011
Aceptado: 28 de abril de 2011