Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión impresa ISSN 1010-2752
Rev. Protección Veg. vol.28 no.3 La Habana sep.-dic. 2013
ARTÍCULO ORIGINAL
Antagonismo de aislamientos de Trichoderma spp. frente a Didymella bryoniae (Fuckel) Rehm
Antagonism of Trichoderma spp. isolates against Didymella bryoniae (Fuckel) Rehm
Benedicto MartínezI, Jesús PérezII, Danay InfanteI, Yanisia DuarteI, Martha MorenoII
ICentro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, CP 32 700, Mayabeque, Cuba. Correo electrónico: bmcoca@censa.edu.cu.
IIUniversidad Isla de la Juventud, Carretera aeropuerto km 3 ½, Nueva Gerona, Isla de la Juventud, Cuba.
RESUMEN
El presente trabajo tuvo como objetivo determinar los modos de acción de aislamientos de Trichoderma spp. frente a Didymella bryoniae (Fuckel) Rehm, mediante la técnica de cultivo dual. Se evaluaron la competencia por el sustrato, el micoparasitismo y la antibiosis de aislamientos de Trichoderma asperellum Samuels (Ta.), Trichoderma harzianum Rifai (Th.) y Trichoderma sp. (T.). A partir de las 72 horas, todos los aislamientos presentaron efecto inhibitorio del crecimiento del patógeno superior al 50%. Los aislamientos Ta. 12, Ta. 79, Ta. 85 y T. 81 crecieron más del 75% del área de la placa, por lo que se ubicaron en la clase 1 de la escala de Bell. La velocidad de crecimiento de los dos últimos aislamientos aumentó a partir de las 72h, lo que pudiera estar relacionado con compuestos atrayentes, emanados por el patógeno. Los mejores indicadores de parasitismo los presentaron los aislamientos Th. A-34 y Ta. 85 con tres tipos de interacción hifal (enrollamiento, vacuolización y penetración). Los metabolitos volátiles producidos por Th. A-34, Ta. 79 y Ta. 85 y no volátiles emanados de Th. A-34, Ta. 79 y T. 81, inhibieron el crecimiento del patógeno desde las 72h. De acuerdo a los modos de acción exhibidos, los aislamientos Th. A-34 y Ta. 85 se perfilan como posibles candidatos a ingredientes activos de bioplaguicidas, lo que requiere de su evaluación en el control de D. bryoniae en condiciones de campo.
Palabras clave: Trichoderma asperellum, Trichoderma harzianum, modos de acción, gomosis, cucurbitáceas.
ABSTRACT
The aim of this work was to determine the action modes of Trichoderma spp. against Didymella bryoniae (Fuckel) Rehm. The competition by the substrate, antibiosis and mycoparasitism of Trichoderma asperellum Samuels (Ta), Trichoderma harzianum Rifai (Th) and Trichoderma sp. (T.) was assessed by the dual culture method. After 72 hours, all the isolates showed an inhibitory effect over the pathogen growth higher than 50%. The isolates Ta. 12, Ta. 79, Ta. 85 and T. 81 grew more than 75% of the plate area; thus, they were placed in the class 1 of Bell's scale. The growth rate of the two latter isolates increased from the 72 h, which could be related to attractive compounds emitted by the pathogen. Th A-34 and Ta. 85 presented the best indicators of parasitism with three types of hyphal interaction (coiling, vacuolization and penetration). The volatile metabolites produced by Th-34, Ta. 79 and Ta. 85 and those non-volatile emanating from Th A-34, Ta. 79 and T. 81 inhibited the pathogen growth from the 72h. According to the modes of action exhibited by the different isolates, Th A-34 and Ta. 85 were chosen as the best isolates for the control of D. bryoniae. They are emerging as potential candidates for biopesticide active ingredients, although their evaluation in the control of D. bryoniae under field conditions is required.
Key words: Trichoderma asperellum, Trichoderma harzianum, action modes, gummy stem blight, cucurbits.
INTRODUCCIÓN
La gomosis del tallo (Didymella bryoniae (Fuckel)) Rehm (syn. Mycosphaerella melonis (Pass) W.F. Chiu y J.C. Walker) se considera la principal enfermedad fúngica en las cucurbitáceas a nivel mundial (1). Las pérdidas fluctúan entre 15 y 50% en campo, pero se incrementan cuando las frutas se dañan durante la transportación y el almacenaje (2).
El control químico es el más recomendado contra esta enfermedad (3,4), utilizado fundamentalmente en aplicaciones preventivas, a pesar de su alto costo, económico y ecológico. De ahí, la necesidad de disponer de diferentes tácticas que permitan hacer un manejo de la enfermedad.
Entre las tácticas de mayores perspectivas está el control biológico. En este sentido, las especies del género Trichoderma frente a los hongos fitopatógenos han sido las de mejores resultados (5, 6, 7), porque la acción bio-reguladora de Trichoderma está asociada a varios mecanismos de acción como: competencia por espacio y/o nutrientes, micoparasitismo y antibiosis, entre otros (8, 9, 10). Precisamente, para lograr éxito en el control biológico con estos microorganismos, es necesario llevar a cabo la selección de los aislamientos del antagonista basados en estos mecanismos (11).
El objetivo del presente trabajo fue determinar los modos de acción de aislamientos de Trichoderma spp. frente a D. bryoniae.
MATERIALES Y MÉTODOS
Evaluación de la actividad antagónica in vitro de Trichoderma spp. frente a D. bryoniae
Se evaluaron los modos de acción (competencia por espacio, micoparasitismo y antibiosis) de los aislamientos de Trichoderma frente a D. bryoniae, utilizando el método de cultivo dual descrito por Martínez y Solano (12).
Se emplearon tres aislamientos de Trichoderma asperellum Samuels (denominados Ta. 12, Ta. 79 y Ta. 85, respectivamente) (13) y otro de Trichoderma sp. (T.81), pertenecientes todos al cepario del Laboratorio de Micología Vegetal del Centro Nacional de Sanidad Agropecuaria (CENSA) y la cepa A-34 de Trichoderma harzianum (Th. A-34) procedente del laboratorio de Sanidad Vegetal de la Isla de la Juventud. El aislamiento de D. bryoniae se obtuvo de plantas enfermas de sandía [Citrullus lanatus (Thunb.) Matsum and Nakai].
Los hongos se mantuvieron en medio Papa Dextrosa Agar (PDA) (Oxoid) e incubados antes del experimento a una temperatura de 28±2°C por 72 horas (Trichoderma) y 25±2°C por 10 días (patógeno). El ensayo de enfrentamiento dual se realizó en placas Petri de 90 mm de diámetro contentivas de medio PDA (Oxoid). Se incluyó un testigo del patógeno sin el controlador biológico. Todos los hongos en los tratamientos se incubaron (25±2oC), para garantizar que el antagonista muestre su acción en la condición favorable para el desarrollo del patógeno.
- Competencia por espacio
El ensayo se montó y evaluó según lo descrito por Reyes et al. (5). Se emplearon seis tratamientos con cuatro repeticiones (placas), en un diseño completamente aleatorizado. Las evaluaciones se realizaron hasta las 120 horas. La clasificación como antagonista de los aislamientos se realizó según la escala de Bell et al. (14).
- Micoparasitismo
Para evaluar el micoparasitismo (enrollamiento, penetración, vacuolización y lisis), se tomaron tres muestras de la zona de interacción de ambos hongos por cada réplica (placa Petri, cuatro en total) y se colocaron en portaobjetos sobre una gota de lactofenol. La observación se realizó al microscopio óptico binocular modelo Novel a aumentos de 250 y 400x. Se evaluaron 15 muestras por tratamiento (aislados de Trichoderma).
- Antibiosis
— Metabolitos no volátiles
Para evaluar el efecto de metabolitos no volátiles de los aislados de Trichoderma se sembró, sobre papel celofán estéril, que cubría el medio de cultivo (PDA Oxoid) vertido en placas Petri de 90 mm de ø, un disco de cinco mm de cada aislamiento del hongo control biológico. A las 72 horas se retiró el papel celofán con la colonia del antagonista y en su lugar se sembró centralmente un disco de cinco mm del patógeno (15).
— Metabolitos volátiles
Los metabolitos volátiles se evaluaron sembrando centralmente los aislamientos del antagonista y del patógeno en una misma placa Petri de 90 mm de ø, en la tapa de la placa el fitopatógeno y en la base de la misma, el antagonista. Las placas fueron selladas con vitafilm, se incluyó un testigo del patógeno sin el antagonista.
Tanto para los metabolitos volátiles como no volátiles, las placas se incubaron a temperatura de 25±2°C y oscuridad. Se midió el diámetro de las colonias del patógeno con una regla graduada.
Para los ensayos se empleó un diseño completamente aleatorizado con cuatro réplicas. Las evaluaciones se realizaron cada 24 horas hasta las 120 horas.
Los datos se transformaron mediante la expresión arcos Öp+1, y fueron sometidos a un análisis de varianza de clasificación simple y las medias comparadas según la Dócima de Rangos Múltiples de Duncan (16). Para el procesamiento se empleó el paquete estadístico Stat Graph 3.1.
Para la selección de los aislados promisorios in vitro se tomó como criterio el porcentaje de inhibición del crecimiento radial del hongo patógeno, la presencia al menos de dos modos de interacción hifal con el patógeno y su ubicación en las clases 1 ó 2 de la escala de Bell et al. (14).
RESULTADOS Y DISCUSIÓN
Competencia por espacio
Los aislamientos de Trichoderma evaluados (Ta. 12, Ta. 79, Ta. 85 y T. 81) se ubicaron en la clase uno de la escala de Bell et al. (14), con excepción del Th. A-34 (Fig. 1). Todos mostraron un elevado efecto antagónico, con la detención del crecimiento de D. bryoniae al entrar en contacto con el antagonista.
Todos los aislamientos de Trichoderma presentaron efecto inhibitorio superior al 50% a partir de las 72 horas (Tabla 1). Desde las 96h se observó crecimiento de los aislamientos de Trichoderma sobre la colonia del patógeno, aunque esta acción se apreció antes (entre las 72 y 96h) para los aislados T. 81 y Ta. 85. El crecimiento sobre el patógeno se hizo casi total a las 120 horas, excepto para la cepa Th. A-34, que detuvo el crecimiento del patógeno formando un halo alrededor del mismo sin llegar a colonizarlo completamente (Fig. 1). Al parecer, el patógeno excreta metabolitos al medio que pueden detener el avance de esta cepa del antagonista, y no le permite sobrecrecer la colonia de este, aspecto que debe ser objeto de investigaciones futuras.
En la evaluación a las 120h los aislamientos Ta. 85 y T. 81 mostraron los mayores porcentajes de inhibición del patógeno. Los resultados sugieren que estos presentan mayor velocidad de crecimiento a partir de las 72h, por posibles metabolitos desprendidos por el patógeno, que actúan como atrayentes.
Estos resultados coinciden de forma general con los obtenidos por Nofal et al. (17), quienes informaron la inhibición del crecimiento de D. bryoniae provocada por aislamientos de diferentes especies de Trichoderma; no obstante, no llegaron a una evalución completa del antagonismo. A pesar de que existe abundante información acerca de que las especies de Trichoderma se comportan como antagonistas de varios hongos fitopatógenos (8, 14), en la práctica es necesario realizar una selección exhaustiva del agente controlador frente a cada patógeno diana, antes de ser empleado en campo. Establecer in vitro los modos de acción presentes en los aislamientos del biorregulador, constituye la base de la selección de estos, no solo para las pruebas siguientes en condiciones semicontroladas y campo, sino que orientan la forma de producción que debe establecerse para lograr mayor estabilidad y eficacia en los resultados en campo.
Micoparasitismo
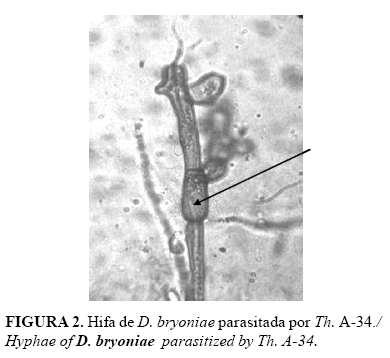
En la Tabla 2 se muestran los resultados de las observaciones microscópicas que reflejan las interacciones de los aislamientos de Trichoderma con D. bryoniae. Como se observa los mejores aislamientos fueron Th. A-34 y Ta.85 con tres tipos de interacción hifal. Por su parte, en la Figura 2 se muestra el parasitismo de Th. A-34 en hifas del patógeno, fenómeno similar a lo observado con los otros aislamientos del antagonista que se evaluaron.
Las enzimas, ß-1,3-glucanasas, ß-1,6-glucanasas, quitinasas y proteasas producidas por aislamientos de Trichoderma son capaces de hidrolizar la pared celular de numerosos hongos (18,19,20), esto podría explicar la causa, por lo que el aislamiento Ta. 85 exhiba estos resultados, ya que se demostró previamente que posee actividades ß-1,3-glucanasas y quitinasas (21).
El uso de microorganismos productores de quitinasas y/o glucanasas para el control de hongos fitopatógenos pertenecientes a la clase Ascomycetes, se considera una acción promisoria, pues su pared celular está constituida principalmente por microfibrillas de quitina y ß-glucanos, sensibles al ataque de estas enzimas (22,23).
Antibiosis
Todos los aislamientos de Trichoderma evaluados inhibieron el crecimiento del patógeno desde las 72h, pero se destacaron en ese momento evaluativo los aislamientos Th. A-34, Ta.79 y Ta.85, no obstante, a las 96h, el aislamiento T. 81 no presentó diferencias con los mencionados (Tabla 3).
Los metabolitos volátiles producidos por estos aislamientos fueron los que produjeron los mayores porcentajes de inhibición del crecimiento radial, con cambios en la coloración de la colonia del patógeno (Fig. 3). Este efecto pudiera deberse, a que los metabolitos liberados por los aislamientos presentaron acción fungistática sobre el patógeno en el interior de la placa Petri, lo que provocó la inhibición del crecimiento del mismo. Esto, en principio, corrobora lo observado por KücüK y Kivan (24), quienes obtuvieron una disminución significativa del crecimiento micelial de Gaeumannomyces graminis (Sacc.) Arx & Olivier var. tritici J. Walker, por efecto de los metabolitos volátiles de T. harzianum.
Los metabolitos no volátiles de todos los aislamientos inhibieron el crecimiento del patógeno en ambos momentos evaluativos. A las 72h, se destacaron los aislamientos Th. A-34, Ta. 79 y T. 81 (Tabla 4); sin embargo, a las 96h, solo Th. A-34 y T. 81 provocaron la mayor inhibición del crecimiento del patógeno, aunque T. 81 no tuvo diferencias significativas con el resto. Al parecer los metabolitos del Ta.79 no fueron tan efectivos o el patógeno logró adaptarse a ellos, por lo que este aspecto se debe seguir investigando.
El efecto inhibitorio de Trichoderma sobre otros hongos antes del contacto hifal se ha explicado con la excreción de metabolitos al medio con efectos fungistáticos, algunos de los cuales inhiben los microorganismos con los que no hacen contacto físico, y estos pudieran ser considerados como sustancias similares a antibióticos (12). Los resultados obtenidos se corresponden con los de Simon y Sivasithamparam (25) y Schirmbock et al. (26), quienes informaron que Trichoderma puede incorporar al medio de cultivo metabolitos con efecto inhibitorio sobre hongos. Estos autores determinaron la presencia de trichodermin, trichodermol, harzianum A y harzianolide, en dichos metabolitos, aspecto que se seguirá investigando como continuación del presente trabajo.
Los hallazgos obtenidos en este estudio corroboran los que informaron Reyes et al. (5) y Martínez et al. (11), quienes demostraron la disminución del crecimiento de hongos fitopatógenos por el efecto de metabolitos no volátiles segregados por Trichoderma al medio de cultivo.
Los resultados obtenidos revelan que se cuenta con dos aislamientos de Trichoderma (Th. A-34 de T. harzianum y Ta. 85 de T. asperellum) con perspectivas como futuros candidatos para constituir ingredientes activos de bioplaguicidas; no obstante, se requiere de estudios en campo donde se determine el momento óptimo de aplicación, la dosificación, la compatibilidad con agroquímicos y otros agentes biológicos, que aseveren la eficacia de estas cepas bajo esas condiciones. Estos constituyen los primeros resultados para Cuba relativos a la búsqueda de agentes de control biológico para el manejo de la gomosis en las cucurbitáceas.
REFERENCIAS
1. Santos GR, Café-Filho AC, Leao FF, Cesar M, Fernadez LE. Progresso do crestamento gomoso e perdas na cultura da melancia. Horticultura Brasileira. 2005;23:230-234.
2. Docampos DM, Gracia O, Nome SF. Enfermedades de Cucurbita moschata (Lam.) Poiret (anco, andaí, calabaza). En Eds: Nome, S.F.; Docampo, D.M.; Conci, L.R. Atlas Fitopatológico argentino. 2010. Córdoba, Argentina. Consultada 25 noviembre 2010. Disponible en http://www.fitopatoatlas.org.ar/default.asp?hospedante=702.
3. Santos GR, Cafe´-Filho AC, Saboya LMF. Controle químico do crestamento gomoso do caule em melancia. Fitopatologia Brasileira. 2005;30:155-163.
4. Keinath AP, DuBose VB. Evaluation of triazoles and other fungicides for control of gummy stem blight on watermelon, 2008. Plant Disease Management Reports. 2009;3:34.
5. Reyes Y, Martínez B, Infante D. Evaluación de la actividad antagónica de trece aislamientos de Trichoderma spp. sobre Rhizoctonia sp. Protección Vegetal. 2008;23(2):112-117.
6. Villegas M. Trichoderma. Características generales y su potencial biológico en la agricultura sostenible. 2008. Consultado 5 de mayo de 2010. Disponible en http://www.oriusbiotecnologia.com/portal/content/view/12/7/.
7. Páez O. Uso agrícola de Trichoderma. Consultada 10 de enero de 2010. Disponible en http://www.soil-fertility.com/trichoderma/espagnol/index.shtml 2008.
8. Harman GE. Overview of mechanisms and uses of Trichoderma spp. Phytopathology. 2006;96(2):190-194.
9. Hoyos-Carvajal L, Chaparro P, Abramsky M, Chet I, Orduz S. Evaluación de aislamientos de Trichoderma spp. contra Rhizoctonia solani y Sclerotium rolfsii bajo condiciones in vitro y de invernadero. Revista Agronomía Colombiana. 2008;26(3):451-458.
10.Infante D, Martínez BC, González N, Reyes Y. Mecanismos de acción de Trichoderma frente a hongos fitopatógenos. Rev Protección Vegetal. 2009;24(1):14-21.
11.Martínez B, Reyes Y, Infante D, González E, Baños H, Cruz A. Selección de aislamientos de Trichoderma spp. candidatos a biofungicidas para el control de Rhizoctonia sp. en arroz. Rev Protección Veg. 2008;23(2):118-125.
12.Martínez B, Solano T. Antagonismo de Trichoderma spp. frente a Alternaria solani (Ellisy Martin) Jones y Grout. Rev Protección Veg. 1995;10(3):221-225.
13.Martínez B, Infante D, Reyes Y. About the identification of some Trichoderma isolates reported in Revista de Protección Vegetal. Rev Protección Veg. 2010;25(2):135.
14.Bell DK, Wells HD, Markam CR. In vitro antagonism of Trichoderma spp. against six fungal pathogens. Phytopathology. 1982;72:379-382.
15.Infante D, Martínez B, Peteira B, Reyes Y, Herrera A. Molecular identification of thirteen isolates of Trichoderma spp. and evaluation of their pathogenicity towards Rhizoctonia solani Kühn. Biotecnología Aplicada. 2013;30:23-28.
16.Lerch G. La experimentación Agrícola en las Ciencias Biológicas y Agrícolas. Editorial Científico- Técnico. La Habana, Cuba. 1977: 452p.
17.Nofal MA, El-Naggar MAA, Ismail BR. Biological control of gummy stem blight (Mycosphaerella melonis L. Passerini) on cantaloupe plants under protected cultivations. ISHS Acta Horticulturae. 1999;(434).
18.Woo L, Scala F, Ruocco M, Lorito M. The molecular biology of the interactions between Trichoderma spp., phytopathogenic fungi, and plants. Phytopathology. 2006;96:181-185.
19.Lorito M, Woo L, Laccarino M, Scala F. Microrganismi antagonisti. En: Laccarino, M. (Ed.) Microrganismi Benefici per le Piante. Idelson-Gnocchi s.r.l. Napoli, Italia. 2006:146-175.
20.Woo L, Lorito M. Exploiting the interactions between fungal antagonists, pathogens and the plant for control. En: Vurro M., Gressel J. (Eds.) Novel Biotechnologies for Control Agent Enhancement and Management. Springer Press, Amsterdam. Netherlands. 2007:107-130.
21.González I, Infante D, Martínez B, Arias Y, González N, et al. Induction of chitinases and glucanases in Trichoderma spp. strains intended for biological control. Biotecnología Aplicada. 2012;29:12-16.
22.Limon MC, Chacón MR, Mejías R, Delgado-Jarana J, et al. Increased antifungal and chitinase specific activities of Trichoderma harzianum CECT 2413 by addition of a cellulose binding domain. Microbiol Biotechnol. 2004;64:675-685.
23.Sahai AS, Manocha MS. Chitinases of fungi and plants: their involvement in morphogenesis and host-parasite interaction. Microbiol. 1993;11(4):317-338.
24.KücüK C, Kivan M. In Vitro antifungal activity of strains of Trichoderma harzianum. Turk J Biol. 2004;28:111-115.
25.Simon C, Sivasithamparam M. Interactions among, Trichoderma koningii and soil bacteria. Can J Microbiol. 1988;34:871-876.
26.Schirmbock M, Lorito M, Wang YL. Parallel formation and synergism of hydrolytic enzymes and peptaibol antibiotics, molecular mechanisms involved in the antagonistic action of Trichoderma harzianum against phytopathogenic fungi. Appl Environ Microbiol. 1994;60:4344-4370.
Recibido: 23-10-2012.
Aceptado: 25-4-2013.