INTRODUCCIÓN
Los fitoquímicos que son bioactivos contra plagas y compatibles con enemigos naturales se consideran fundamentales para el manejo de plagas (1,2,3,4). El jambu, Spilanthes acmella (Asteraceae) es una planta anual amazónica (5), cuyas raíces, botones florales y parte aérea producen diversos compuestos bioactivos (1,6,7). Las propiedades biológicas de S. acmella dependen, principalmente, de N-alcamidas (8). El espilantol es la principal N-alcamida presente en extractos de S. acmella (1,9,10). Estos extractos poseen actividad insecticida (1), fungicida (6) y garrapaticida (10,11,12). Sin embargo, el efecto de extractos de S. acmella contra ácaros fitófagos y su compatibilidad con ácaros depredadores es poco conocido.
El ácaro rojo del cocotero, Raoiella indica Hirst (Acari: Tenuipalpidae), es una plaga polífaga que se alimenta a través de los estomas de las plantas hospederas (13) y pueden interferir en la respiración y fotosíntesis de las plantas afectadas (14). R. indica causa daños económicos a diversas especies de plantas (15); una de ellas es el cocotero (Cocos nucifera L.) (15,16,17), con daños de hasta 70 % en esta especie (18). Actualmente, este ácaro ha invadido prácticamente todas las regiones neotropicales (18,19,20,21,22,23); tanto en el norte, el caribe (21,22) y Sudamérica (19,20). En Brasil, R. indica ha sido una de las principales preocupaciones de los productores de coco, debido a que las condiciones climáticas de estas regiones favorecen la reproducción y el desarrollo del ácaro (24,25,26).
Generalmente, los pesticidas sintéticos se usan para el control de R. indica; sin embargo, su uso continuo acarrea riesgos asociados a la salud, al medio ambiente y a efectos en organismos benéficos, por lo que deben ser elucidadas nuevas formas de control.
Los ácaros fitoseídos son depredadores importantes asociados a R. indica (22,27,28,29) y, en varias regiones, Amblyseius largoensis (Acari: Phytoseiidae) es naturalmente encontrado en asociación con esta plaga (27,28,29). De igual forma, los productos de origen natural también han presentado actividad acaricida y son potenciales candidatos a auxiliar el control de esta plaga en campo. En este contexto, el objetivo del presente trabajo fue evaluar la actividad acaricida del extracto etanólico (EE) de S. acmella a R. indica y su selectividad al ácaro depredador A. largoensis.
MATERIALES Y MÉTODOS
Colección e identificación de la planta
Las partes aéreas de S. acmella se recolectaron en el área rural de la ciudad Parnaíba, Estado de Piauí, Brasil. Se identificaron según lo descrito por Castro et al. (10).
Obtención y caracterización química del extracto de S. acmella
Las partes aéreas de S. acmella (1,2 kg), previamente secadas y trituradas, fueron sometidas a sucesivas extracciones por maceración (5x) con etanol (1:5, m/v) a temperatura ambiente (25-30ºC), resultando en un sólido verde escuro (R= 12,5 %), después de la evaporación del solvente. El contenido de espilantol en el extracto se determinó por cromatografía líquida de alta eficiencia con detector de matriz de diodo (CLAE-DAD), según el método descrito por Bae et al. (30). El patrón analítico de espilantol usado en la cuantificación del extracto se obtuvo por partición líquido- líquido del extracto con diclorometano, seguido por purificación en cartucho de extracción en fase sólida (C18). La estructura del espilantol se confirmó por Espectrometría de Masas de Alta Resolución y por Resonancia Magnética Nuclear, cuyos datos están acorde con la literatura existente (31).
Cría del depredador y obtención de R. indica
La cría de A. largoensis se estableció con individuos colectados de foliolos de plantas de cocotero oriundos de la “Empresa Brasileira de Pesquisa” Agropecuaria (EMBRAPA) Tabuleiros Costeiros, Aracaju - SE (10°57'03,3"S, 37°03'07,4" O). Las colonias de este depredador se mantuvieron en laboratorio a (temperatura de 27,0 ± 3,0°C, humedad relativa de 70 ± 10 % y fotoperiodo natural) en arenas confeccionadas en planchas plásticas de policloruro de vinilo (PVC) de color negro (22 cm de largo x 12 cm de ancho) sobre una espuma de poliuretano (24 cm de largo x 14 cm de ancho x 0,33 cm de espesura), saturada con agua destilada en una bandeja plástica (24 cm de largo x 14,5 cm de ancho x 5,3 cm de altura). Contornando el PVC, se colocó una camada de algodón hidrófilo humedecido con agua destilada para evitar la fuga de los ácaros depredadores. Se colocaron hilos de algodón protegidos con cubreobjetos en forma de arco (18 x 18mm) sobre las arenas para servir de abrigo y local de oviposición, de acuerdo con Oliveira et al. (3). Los ácaros se alimentaron con polen de higuerilla (Ricinus communis L), R. indica y miel al 10 % cada dos días.
Se colectaron teliocrisálidas de R. indica de foliolos de plantas de cocotero (mismo local de colecta de los depredadores) y se mantuvieron durante 48 horas en arenas confeccionadas de acuerdo con lo descrito anteriormente, hasta la emergencia de hembras adultas; de esta manera se estandarizó la edad en los bioensayos.
Toxicidad del Extracto Etanólico (EE) de S. acmella para R. indica
Se realizaron bioensayos de concentración-mortalidad para determinar las concentraciones letales (CL) del EE de S. acmella a R. indica. Las concentraciones utilizadas para R. indica variaron de 0,1 a 2,0 mg del extracto de S. acmella diluido en 10 ml de acetona.
Las unidades experimentales fueron confeccionadas con discos (1,8 cm de diámetro) preparados con foliolos de plantas de cocotero con el envés expuesto hacia arriba. Para delimitar el disco fue necesario cubrir su contorno con una mezcla compuesta por 5 % de agar (agar bacteriológico puro), 0,3 % de metil parabeno (Nipagim®) como fungicida y agua destilada y ionizada de acuerdo con Oliveira et al. (3).
Con ayuda de un pincel, se transfirieron 30 hembras adultas de R. indica (1-2 días de emergidas) a cada arena. Se usaron 20 arenas (repeticiones) para cada concentración del extracto. Se pulverizaron las arenas usadas como control con acetona y el extracto por medio de una torre de Potter (Burkard, Rickmansworth, Reino Unido) a una presión de 5 psi/pulg2 y un volumen de solución de 9,3 ml, lo que corresponde a un depósito de 1,38 mg/cm2 en concordancia con la recomendación de la IOBC/WPRS (International Organization for Biological Control of Noxious Animals and Plants/West Palearctic Regional Section) (32). Para la obtención de la curva de concentración-respuesta para el extracto de S. acmella, se sometieron los datos de mortalidad de R. indica a análisis de Probit utilizando el software SAS (33).
Toxicidad del Extracto Etanólico (EE) de S. acmella a A. largoensis
Para evaluar la toxicidad del EE de S. acmella a A. largoensis, se transfirieron seis hembras del depredador (8-10 días de edad) para cada unidad experimental previamente pulverizada con acetona (control), CL50 y CL80 del EE de S. acmella, estimadas anteriormente para R. indica. De acuerdo con lo descrito por Oliveira et al. (3), se utilizaron ocho arenas confeccionadas para cada concentración del extracto. Las hembras del depredador fueron alimentadas con polen de R. communis, que se colocó sobre piezas de PVC transparente de 0,5 cm2 para evitar así el contacto con el extracto. La mortalidad se evaluó después de 24 horas; se consideraron muertos los ácaros que no consiguieron caminar una distancia superior al tamaño de su cuerpo cuando se tocaron levemente con un pincel (34). La toxicidad de EE de S. acmella al depredador A. largoensis se analizó usando análisis de varianza ANOVA y las medias se compararon a través de la prueba de Tukey a 5 % de probabilidad con el uso del programa estadístico SAS (33).
Repelencia del EE de S. acmella a R. indica y A. largoensis
Se realizaron los bioensayos de repelencia con la CL50 y CL80 del EE de S. acmella, estimadas anteriormente para R. indica, para esta plaga y para el ácaro depredador A. largoensis. Las concentraciones del extracto fueron pulverizadas por medio de una torre de Potter y las unidades experimentales se prepararon conforme con lo descrito anteriormente en los bioensayos de toxicidad; la diferencia radicó en que en estas unidades experimentales se cubrió una mitad tratada con el EE y la otra no (control) (35). El área no tratada se cubrió con dos camadas de cinta adhesiva durante la pulverización del producto (3).
Después de 30 minutos, se retiraron las camadas de cinta adhesiva y se transfirieron individualmente las hembras adultas de R. indica y de A. largoensis para el centro de las unidades experimentales. Las evaluaciones se realizaron después de 1, 24 y 48 horas por medio del registro de la posición de los ácaros en el área tratada y no tratada. Se realizaron 60 repeticiones para cada CL y cada especie de ácaro (plaga y depredador). Los datos obtenidos en cada área se sometieron al análisis de frecuencia mediante prueba de chi-cuadrado utilizando el ProcFreq del software SAS (33).
Efecto del EE de S. acmella en la tasa de crecimiento de R. indica y A. largoensis
Adicionalmente a la repelencia, se usó la tasa instantánea de crecimiento (r i ) para evaluar los efectos subletales del extracto de jambu a R. indica y al ácaro depredador A. largoensis. La r i se basa en datos de reproducción y mortalidad y se calculó usando la ecuación: r i = [ln(Nf/N0)]/∆t, donde N f es el número final de ácaros vivos (incluyendo huevos e inmaduros), N 0 es el número inicial de ácaros y ∆t es el intervalo (10 días) entre el inicio y el final del bioensayo (34).
Para R. indica, las unidades experimentales utilizadas fueron confeccionadas con pedazos de folíolos (2,0 cm de ancho x 4,0 cm de largo), previamente pulverizados con las concentraciones letales de S. acmella (Control, CL50 y CL80), con el envés expuesto hacia arriba y colocados sobre una espuma de poliuretano (3,0 cm de diámetro x 0,5 cm de espesor), saturada con agua destilada en una placa Petri (3,0 cm de diámetro). Al contorno del folíolo se le adicionó una pequeña camada de algodón hidrófilo humedecido con agua para evitar la fuga de R. indica. Para el depredador se usaron las mismas unidades experimentales descritas en los bioensayos de toxicidad. Las hembras del depredador se alimentaron con polen de R. communis que se colocó sobre PVC transparente de 0,5 cm2 para evitar el contacto con el extracto.
Se transfirieron cuatro hembras adultas y un macho de cada especie de ácaro (depredador y plaga) para cada unidad experimental, previamente pulverizada. Las unidades experimentales del tratamiento control fueron pulverizadas con acetona. Se realizaron 20 repeticiones para cada concentración evaluada. La interferencia del extracto en la tasa instantánea de crecimiento (r i ) para R. indica y A. largoensis fue analizada, separadamente, usando un análisis de varianza ANOVA y las medias se compararon usando la prueba de Tukey a 5 % de probabilidad a través del programa estadístico SAS (33).
RESULTADOS Y DISCUSIÓN
El EE de S. acmella (contenido de 56 mg/g) (Fig. 1) fue tóxico a R. indica (χ 2 = 5,062, P=0,167) (Tabla 1). Se ha estudiado la bioactividad del extracto de S. acmella y ha mostrado efectos garrapaticida (10,11), insecticida (1,36), larvicida (9,37), fungicida (6) y actividad neuroprotectora (38). Los extractos etanólico de Chysanthemum cinerariifolium y el hidroalcoolglicolico (HAG) de Myrciaria dubia también han demostrado toxicidad a R. indica (39,40). Sin embargo, el EE de S. acmella fue más eficiente que el extracto HAG de M. dubia, pues la CL50 (0,46 mg/ml) estimada para el EE de S. acmella fue menor más de 50 veces que la CL50 (27,3 mg/ml) estimada para el HAG de M. dubia.
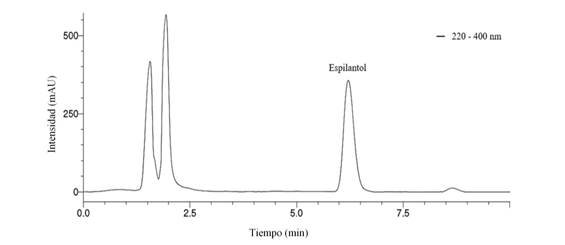
Figura 1 Cromatograma del extracto de Spilanthes acmella obtenido en CLAE-DAD. / Chromatogram of the extract of Spilanthes acmella obtained in CLAE-DAD.
La bioactividad de S. acmella está posiblemente asociada a las N-alcamidas, que forman el principal grupo de moléculas bioactivas encontradas en el género Spilantes (5,41). Las N-alcamidas son compuestos constituidos por ácidos grasos condensados saturados o polinsaturados y una amina (6,42,43). El mayor constituyente de estas alcamidas es el espilantol (7,8,9,10,11). Otros importantes metabolitos secundarios encontrados en esta especie incluyen los alcaloides, flavonoides, saponinas, glicósidos esteroides y taninos (7,8,43).
Adicionalmente a la eficiencia en el control de plagas en agroecosistemas, nuevos compuestos bioactivos pueden ser selectivos a especies no-objetivo, como depredadores (1), además de ser compuestos que rápidamente se degradan (44,45). La CL50 (0,45 mg/ml) y la CL80 (1,34 mg/ml) del extracto de S. acmella, estimadas para R. indica, no causaron mortalidad en el ácaro predador A. largoensis (F= 1,10; g.l= 2,23; P= 0,34). Las alcamidas presentes en el EE de A. oleracea también fueron menos tóxicas a insectos no-objetivo como la hormiga Solenopsis saevessima (Smith) (Hymenoptera: Formicidae) y la abeja Tetragonisca angustula (Latr.) (Hymenoptera: Apidae), en contraste con la polilla del tomate Tuta absoluta (Meyrick) (Lepdoptera: Gelechiidae) (1). Esa susceptibilidad diferencial al extracto puede estar relacionada con características fisiológicas, comportamentales, al mayor tamaño del predador en relación con R. indica (46,47), enzimas (monooxygenasas, glutationas transferasas y carboxilesterasas) responsables por la eliminación de compuestos tóxicos y por las menores tasas de penetración del extracto en el tegumento del depredador en comparación con la plaga (48).
Tabla 1 Concentraciones letales (CL) y sus intervalos de confianza del extracto de Spilanthes acmella a R. indica (χ2 = 5,062, p=0,167). / Lethal Concentrations (LC) (mg/ml and percentage) and confidence intervals of the extract of Spilanthes acmella to R. indica (χ2 = 5.062, P = 0.167).
| Concentración letal | Extracto (mg/mL) | Inte rvalo de confianza (95 %) |
|---|---|---|
| CL10 | 0,0900 | (0,06896-0,11209) |
| CL25 | 0,1948 | (0,16156-0,22909) |
| CL50 | 0,4598 | (0,40145-0,52536) |
| CL80 | 1,3421 | (1,14022-1,62224) |
| CL99 | 8,8805 | (6,42897-13,26019) |
χ2: chi-cuadrado; P: probabilidad
La CL50 y la CL80 del extracto de S. acmella fueron repelentes a R. indica hasta 48 horas (p<0,0001) (Figs. 2, 3). Aquí se observó que, en mayor o menor concentración del extracto, la actividad repelente fue mantenida. Esto indica que las sustancias bioactivas presentes en el extracto de S. acmella interfieren en el comportamiento de R. indica. El efecto repelente intrínseco de algunas plantas, como se ha demostrado para S. acmella a R. indica, han sido indicadas como una forma eficaz para evitar la infestación de plagas en diversas culturas agrícolas, además de ser un atributo deseable para algunos insecticidas de origen botánico en programas de manejo de plagas (49,50).
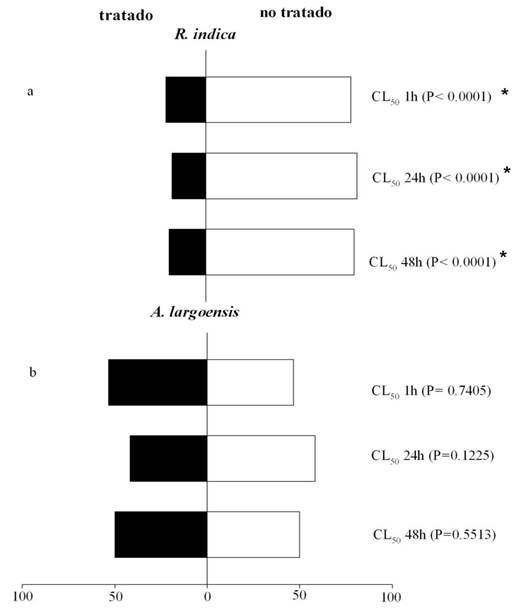
Figura 2 Porcentaje de Raoiella indica (a) y del depredador Amblyseius largoensis (b) en áreas tratadas (barras negras) y no tratadas (barras blancas) con la CL50 del extracto de Spilanthes acmella estimadas para R. indica. El periodo de exposición fue 1, 24 y 48 horas. Cada barra corresponde a la media de tres repeticiones (n= 60 ácaros). El nivel de significancia está dado por la prueba de chi-cuadrado. / Percentage of Raoiella indica (a) and the predatory mite Amblyseius largoensis (b) in treated (black bars) and untreated (white bars) areas with the LC50 of the extract of Spilanthes acmella estimated for R. indica. The period of exposition was 1, 24 and 48 hours. Each bar represents the mean of three replicates (n= 60 mites). Significance level from Chi-Square test.
Otros estudios también demuestran actividad repelente de extractos de plantas a ácaros fitófagos (44,49). Para A. largoensis, el EE fue repelente apenas hasta una hora y en la mayor concentración (P=0,013), perdiendo su efecto después de 24 y 48 horas (Figs. 2,3). La diferencia del efecto repelente de A. largoensis y R. indica al EE de S. acmella puede ser debido al uso de diferentes estrategias de comportamiento por la plaga/depredador, al entrar en contacto con la sustancia o debido a sistemas sensoriales distintos y presentar susceptibilidad diferente a estos compuestos (2,51,52).
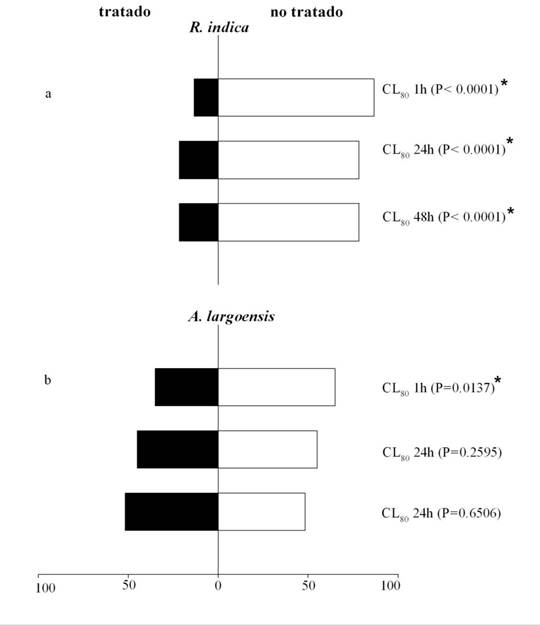
Figura 3 Porcentaje de Raoiella indica (a) y del depredador Amblyseius largoensis (b) en áreas tratadas (barras negras) y no tratadas (barras blancas) con la CL80 del extracto de Spilanthes acmella estimadas para R. indica. El periodo de exposición fue 1, 24 y 48 horas. Cada barra corresponde a la media de tres repeticiones (n= 60 ácaros). El nivel de significancia está dado por la prueba de chi-cuadrado. / Percentage of Raoiella indica (a) and predatory the mite Amblyseius largoensis (b) in treated (black bars) and untreated (white bars) areas with the LC80 of the extract of Spilanthes acmella estimated for R. indica. The period of exposition was 1, 24 and 48 hours. Each bar represents the mean of three replicates (n= 60 mites). Significance level from Chi-Square test.
La tasa de crecimiento de R. indica disminuyó con el aumento de la concentración del extracto de S. acmella (F= 152,33; g.l. = 2,30; P<0,0001; Fig. 4), indicando una tendencia a la extinción de la plaga. En la mayor concentración, fue posible estimar la r i solamente para una repetición de R. indica (Fig. 4). En contraste a la tasa de crecimiento de A. largoensis que no fue afectada por el EE de S. acmella (F= 0,08; g.l.= 2,57; P=0,92), lo que sugiere compatibilidad con este depredador (Fig. 4). La ausencia de posturas en foliolos tratados, tanto en la CL50 como en la CL80 con EE de S. acmella, contribuyó para el decline de la población de R. indica, indicando que el extracto puede afectar la reproducción de la plaga. Similarmente, la oviposición de hembras de la garrapata Rhipicephalus (Boophilus) microplus (Acari: Ixodidae) también se afectó cuando se trataron con extractos hexánicos y metanólicos de S. acmella (10,11).
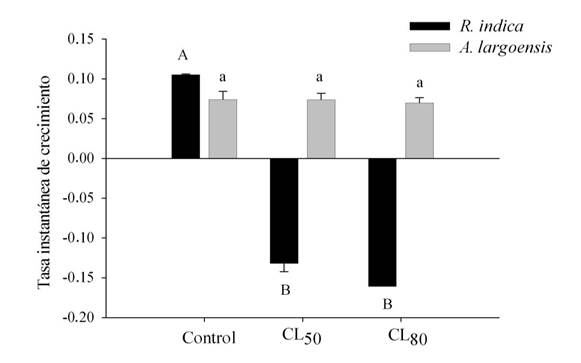
Figura 4 Tasa instantánea de crecimiento (r i ) de Raoiella indica (barras negras) y Amblyseius largoensis (barras grises) expuestos a la CL50 y CL80 del extracto de Spilanthes acmella estimadas para R. indica. Letras diferentes indican diferencias significativas entre los tratamientos por la prueba de Tukey (p<0,05). / Instantaneous rate of increase (r i ) of Raoiella indica (black bars) and Amblyseius largoensis (gray bars) exposed to LC50 and LC80 of the extract of Spilanthes acmella estimated for R. indica. Different letters indicate significant differences between the treatments by Tukey tests (p<0,05).
Aún no se ha informado el mecanismo de acción de alcamidas; sin embargo, el espilantol puede ser capaz de penetrar en el tegumento de algunos insectos y garrapatas, además de actuar en el sistema nervioso y reproductivo (36,53). Saraf y Dixit (37) observaron una rápida mortalidad de pupas de Anopheles culicifacies (Diptera: Culicidae), Culex quinquefasciatous y Aedes aegypti cuando se expusieron al espilantol, lo que sugiere que este podría interferir en los procesos de histólisis e histogénesis (1).
El alto potencial biótico y consecuentemente el elevado número de generaciones por año de R. indica (14,54) puede favorecer más rápidamente el desarrollo de resistencia a algunos productos, por lo tanto, los compuestos bioactivos que presenten varios mecanismos de acción, además de selectividad a los enemigos naturales, son prometedores. Así, el EE de S. acmella fue tóxico, repelente y afectó negativamente la tasa de crecimiento poblacional de R. indica sin afectar a su enemigo natural A. largoensis; demostró así alta actividad acaricida y convirtiéndose en un extracto prometedor en el control de esta plaga.














