Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.20 no.1 Ciudad de la Habana ene.-mar. 2015
ARTÍCULO ORIGINAL
Actividad antioxidante y citotóxica de extractos de Pilea dauciodora Wedd (Urticaceae)
Antioxidant and cytotoxic activity of extracts of Pilea dauciodora Wedd (Urticaceae)
Lic. Alejandro Garro,I DrC. Wilson Cardona,II DrC. Benjamín Rojano,II DraC. Sara M. Robledo,III DrC. Fernando AlzateIV
I Química de Plantas Colombianas, Universidad de Antioquia. Medellín, Colombia.
II Ciencia de los Alimentos, Universidad Nacional de Colombia. Sede Medellín, Medellín, Colombia.
III Programa de Estudio y Control de Enfermedades Tropicales y Centro para el Desarrollo de productos contra Enfermedades Tropicales, Universidad de Antioquia. Medellín, Colombia.
IV Grupo de Estudios Botánicos, Instituto de Biología, Universidad de Antioquia. Medellín, Colombia.
RESUMEN
Introducción: la producción de radicales libres debido al estrés oxidativo, ocasiona la oxidación de lípidos, proteínas, DNA y enzimas que son responsables del daño del tejido celular. Algunas actividades biológicas han sido reportadas para especies del género Pilea Lindl (Urticaceae), lo cual hace llamativo la exploración de las propiedades reductoras en miembros de este género, como una alternativa en la búsqueda de nuevos antioxidantes naturales.
Objetivo: evaluar la actividad citotóxica y antioxidante de extractos alcohólicos y no alcohólicos de Pilea dauciodora Wedd.
Métodos: después de secado el material vegetal, a las hojas se les realizó un proceso de extracción por soxhlet con solventes de diferentes polaridades (diclorometano, acetato de etilo y etanol); de igual manera se procedió para preparar el extracto etanólico de los tallos. Las soluciones obtenidas se concentraron a presión reducida y se evaluó la capacidad antioxidante por diferentes métodos y la citotoxicidad en células U-937.
Resultados: el extracto etanólico de los tallos y el extracto de acetato de etilo de las hojas, arrojaron las más altas capacidades reductoras y menor citotoxicidad, lo cual hace de estos extractos promisorios en la búsqueda de nuevos compuestos antioxidantes.
Conclusión: pilea dauciodora wedd presenta propiedad reductora, por lo cual tiene un alto potencial como fuente natural de antioxidantes de uso potencial en la industria farmacéutica y de alimentos.
Palabras clave: pilea dauciodora Wedd, Urticaceae, citotoxicidad, antioxidantes.
ABSTRACT
Introduction: the free radical production due to oxidative stress, causing the oxidation of lipids, proteins, DNA and enzymes, responsibles for cell tissue damage. Some species of the Urticaceae family exhibit a wide spectrum of biological activities, which makes striking exploring the antioxidant property for members of the genus Pilea Lindl., as an alternative in the search for new natural antioxidants.
Objective: to evaluate the cytotoxic and antioxidant activity of alcoholic and non-alcoholic extracts of Pilea dauciodora Wedd.
Methods: after drying the plant material, leaves were subjected to a process by soxhlet extraction with solvents of different polarities (dichloromethane, ethyl acetate and ethanol); a similar procedure was used to prepare the ethanol extract. The solutions obtained were concentrated under reduced pressure and were assayed for antioxidant capacity by different methods and cytotoxicity in U-937 cells.
Results: the ethanol extract of the stems and the ethyl acetate extract of the leaves showed the best reducing capacity and lower cytotoxicity, which makes promising these extracts in the search of new antioxidant compounds.
Conclusion: Pilea dauciodora Wedd. shows reductive property, which represents high potential as a natural source of antioxidants for using in pharmaceutical and food industry.
Key words: pilea, Urticaceae, cytotoxicity, antioxidants.
INTRODUCCIÓN
Los antioxidantes son compuestos, naturales o sintéticos, que pueden retrasar o inhibir la oxidación de los lípidos u otras moléculas mediante la inhibición de la iniciación o propagación de las reacciones oxidativas en cadena,1 en lo principal a través, de la absorción y la neutralización de radicales libres,2 los cuales son especies nocivas generadas durante el metabolismo oxidativo.
Los radicales libres pueden generar cambios oxidativos sobre las biomoléculas, desencadenando graves patologías entre las que se tienen la aterosclerosis, cáncer, artritis, diabetes, incompetencia inmunológica y desordenes neurodegenerativos entre otros.3 Las acciones nocivas de los radicales libres sobre el organismo han promovido la búsqueda de moléculas con propiedades antioxidantes como potenciales agentes terapéuticos, unido a la creciente preocupación por los efectos secundarios producidos por los antioxidantes sintéticos utilizados en la preservación de alimentos como son el butilhidroxianisol (BHA) y el butilhidroxitolueno (BHT), relacionados con aumento del colesterol, hepatomegalia e inducción de cáncer hepático, entre otros.4
Lo anterior, muestra la importancia de obtener nuevos compuestos de origen natural con alta capacidad antioxidante, que no tengan efectos citotóxicos ni genotóxicos5,6 y que sean de amplia utilidad en la industria alimentaria y farmacéutica.7
Pilea es un género diverso, de aproximadamente 400 especies, perteneciente a la familia Urticaceae, distribuido en las regiones tropicales y subtropicales.8 Varias especies de este género tienen utilidad en medicina popular para tratar quemaduras de la piel, inflamación,9 y alergias,10 entre otras. Algunas de las actividades farmacológicas reportadas incluyen antimicrobiana,11 antioxidante y radioprotectora.12
Pilea dauciodora Wedd, es una especie de la familia Urticaceae que se distribuye desde México hasta Bolivia y prospera en altitudes entre 1800 y 3200 m de zonas riparias o umbrofilas. No se conocen estudios dirigidos a evaluar potenciales actividades farmacológicas para esta especie y basado en las actividades biológicas reportadas para la familia Urticaceae, se pretende en este trabajo, determinar la actividad antioxidante y citotóxica de extractos de Pilea dauciodora.
MÉTODOS
Recolección y secado de la planta
El material vegetal (tallos y hojas) fue recolectado en el corregimiento de Santa Elena, municipio de Medellín, en el departamento de Antioquia (Colombia) a una altitud de 2 400 m. Un espécimen botánico se depositó en el Herbario de la Universidad de Antioquia (HUA), bajo el número de colección Alzate 4 713. El material vegetal se secó en estufa a 35 °C durante 48 horas.
Extracción
Las hojas secas se sometieron a un proceso de extracción por soxhlet con solventes de diferentes polaridades. En lo inicial se utilizó diclorometano, después de varios ciclos al no notarse coloración en el solvente se cambió a acetato de etilo y luego a etanol. Siguiendo la misma metodología por soxhlet, los tallos secos fueron expuestos a una extracción solo con etanol. Por último, todas las soluciones se concentraron a presión reducida.
Evaluación in vitro de la citotoxicidad
La citotoxicidad de los extractos se evaluó sobre la línea celular humana promonocítica U-937.13 Para este ensayo, las células se cultivaron en platos de cultivo celular de 96 pozos, a una concentración de 100 000 células/mL en medio RPMI-1640 suplementado con 10 % de SFB. Para cada extracto se evaluaron 6 concentraciones dobles seriadas a partir de 200 μg/mL. Las células se incubaron a 37 °C con 5 % de CO2 durante 72 horas, en presencia del extracto y detrás el efecto en la viabilidad de las células, se determinó midiendo la actividad de la enzima deshidrogenasa mitocondrial al producir formazan por la adicción de 10 μl/pozo de solución MTT (5 mg/mL) e incubando a 37 °C por 3 horas. La reacción se detuvo con la adición de 100μl de una solución de 50 % isopropanol con 10 % SDS e incubación durante 30 min. La viabilidad celular se determinó según la cantidad de formazan producido mediante la lectura de las densidades ópticas (D.O.) en un lector de ELISA a 570 nm. Como control de viabilidad se usaron células no expuestas a la acción del extracto, pero mantenidas bajo las mismas condiciones. Como control de toxicidad se usaron celulas expuestas a anfotericina B y mantenidas bajo las mismas condiciones. Los ensayos fueron realizados tres veces con tres réplicas para cada concentración evaluada. Los datos obtenidos se usaron para calcular la Concentración Letal 50 (CL50) por el método Probit.14
Determinación de fenoles totales
La determinación de fenoles se realizó por el método colorimétrico de Follin-Ciocalteu15 mediante la construcción de una curva patrón, usando como estándar ácido gálico. Los resultados se expresaron como mg de ácido gálico/L de bebida, con lecturas realizadas a 760 nm.
Determinación de la capacidad antioxidante
Ensayo FRAP (ferric reducing/antioxidant power): este método evaluó la capacidad antioxidante de una muestra de acuerdo con su capacidad para reducir el hierro férrico (Fe+3) presente en un complejo con la 2,4,6-tri(2-piridil)-s-triazina (TPTZ) hasta la forma ferrosa (Fe+2), el cual presenta un máximo de absorbancia a una longitud de onda entre 590-595 nm.16 Este ensayo se llevó a cabo en un buffer ácido acético-acetato de sodio (pH 3,4), que contenía TPTZ y FeCl3. Se utilizó 900 μL de esta solución, 50 μL de muestra y 50 μL de agua destilada y luego de 60 min de reacción se determinó la absorbancia a una longitud de onda de 593 nm. Para cada muestra se tuvo en cuenta la lectura de la absorbancia del blanco sin cromóforo, de la misma manera que en las pruebas anteriores. La curva de referencia se construyó usando ácido ascórbico como patrón primario. Las actividades de las muestras se expresaron como mg de ácido ascórbico/100 g extracto.
Ensayo de decoloración con el radical catiónico ABTS•+: se fundamenta en la cuantificación de la decoloración del radical catiónico ABTS•+, debido a la interacción con especies donantes de hidrógeno o de electrones.17 El radical catiónico ABTS•+ es un cromóforo que absorbe a una longitud de onda de 734 nm y se genera por una reacción de oxidación del ABTS (2,2’-azinobis-(3-etil benzotiazolin-6-sulfonato de amonio) con persulfato de potasio. En la evaluación se utilizaron 10 μL de extracto y 990 μL de la solución del radical ABTS•+. A los 30 min de reacción, a temperatura ambiente y en la oscuridad, se leyó el cambio en la absorbancia respecto a la referencia del reactivo, a una longitud de onda de 734 nm. La referencia del reactivo consistió en una solución del radical ABTS•+ con el solvente de la muestra. Los resultados se expresaron como valores TEAC (trolox equivalent antioxidant capacity) mediante la construcción de una curva patrón usando como antioxidante TROLOX®.
Ensayo de decoloración del radical α-α-difenil-ß-picrilhidrazilo (DPPH): para cuantificar la capacidad captadora de radicales libres de los extractos se determina el grado de decoloración que provocan sus componentes a una solución metanólica de DPPH mediante el método de Brand-Williams, con algunas modificaciones.18 Se preparó una solución madre de DPPH, aproximadamente 20 mg/L del radical en metanol, 990 μL de esta solución se mezcló con 10 μL de solución de extracto a diferentes concentraciones. Se preparó un blanco de muestra que contenía 990 μL MeOH con 10 μL de muestra y un blanco de referencia con 990 μL DPPH y 10 μL de solvente. Se incubó a temperatura ambiente durante 30 min en la oscuridad y se midió la absorbancia a 517 nm. Los resultados se expresaron como valores TEAC (trolox equivalent antioxidant capacity) mediante la construcción de una curva patrón usando como antioxidante TROLOX®.
Análisis estadístico
La evaluación de la citotoxicidad y la capacidad antioxidante fueron realizadas y medidas por triplicado para los extractos, utilizando el método Probit para los dos primeros ensayos, y un análisis de varianza de dos vías (ANOVA) con un nivel de confianza de p< 0,05 empleando el programa Graph-Pad Prism 4 para el último ensayo.
RESULTADOS
Actividad citotóxica
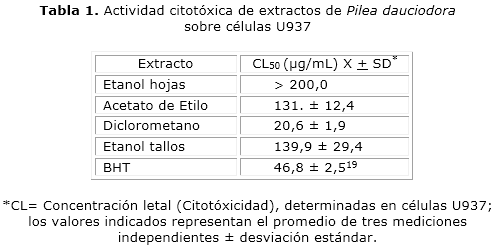
Los resultados obtenidos para la citotoxicidad se presentan en la tabla 1, donde se observa que el extracto etanólico de hojas no fue tóxico contra las células U937 (> 200 µg/mL). Los extractos de acetato de etilo y el etanólico de los tallos presentaron moderada toxicidad, con valores de 131 ± 12,4 y 139,9 ± 29,4 µg/mL, al respecto. El extracto de diclorometano fue el más citotóxico, con un valor de 20,6 ± 1,9 µg/mL.
Capacidad antioxidante y fenoles totales
La tabla 2 muestra los resultados de la capacidad antioxidante y los fenoles totales obtenidos para P. dauciodora. La muestra que presentó mayor contenido de fenoles fue el extracto diclorometano (3 685 mg/100 g). El extracto de acetato de etilo y el etanólico de los tallos, exhibieron un contenido de fenoles de 2 320 y 1305 mg/100 g al respecto, mientras que el extracto etanólico de las hojas mostró muy poca cantidad de fenoles (525 mg/100 g).
El extracto etanólico de los tallos mostró la mayor capacidad antioxidante mediante los métodos DPPH y FRAP con valores de 12 108 µmol trolox/100 g y 18 070 mg/100 g, seguida del extracto de acetato de etilo con valores de 4 090 µmol trolox/100 g y 10 167 mg/100 g; el extracto de diclorometano presentó bajo estos dos métodos valores de 1 897 µmol trolox/100 g y 8 369 mg/100 g. El extracto etanólico de las hojas exhibió la menor capacidad antioxidante, evidenciado en los métodos DPPH y FRAP, con 1 154 µmol trolox/100 g y 2 579 mg/100 g, al respecto.
Al utilizar el método ABTS; el extracto etanólico de las hojas y el de acetato de etilo fueron los que mayor capacidad antioxidante mostraron con valores de 12 747 y 13 323 µmol trolox/100g, seguido del extracto etanólico de los tallos con un valor de 7 263 µmol trolox/100 g. El extracto de diclorometano fue el que menor actividad presento con un valor de 3 009 µmol trolox/100 g.
DISCUSIÓN
Actividad citotóxica
La actividad observada en células U937 para los extractos etanólicos, tanto de las hojas como de los tallos, y el extracto de acetato de etilo de las hojas muestran que estos son menos citotóxicos que el BHT, lo cual sugiere que estos extractos pueden ser promisorios (CL50 ≥130 µg/mL) en la búsqueda de nuevos compuestos con actividad antioxidante. Un estudio de plantas medicinales mostró que P. arborescens (Urticaceae) exhibía una significante letalidad contra artemia salina (CL50= 57.5)20 lo cual indica la presencia de compuestos altamente citotóxicos. Estos resultados nos indican que la Pilea dauciodora a pesar de estar dentro de la misma familia que la P. arborescens tal vez no presentan similares metabolitos secundarios. Hay que tener en cuenta que el ensayo de citotoxicidad se realizó en diferentes modelos, por lo cual, no es comparable el valor reportado con el obtenido, sin embargo; se evidencia la menor citotoxicidad para la planta estudio. La alta citotoxicidad presentada por la fracción de diclorometano hace que ésta no sea una interesante alternativa de exploración.
Capacidad antioxidante y fenoles totales
Actividad captadora de radicales libres (DPPH): la capacidad para eliminar el radical DPPH está relacionada con la inhibición de la peroxidación de lípidos.21 Los radicales libres son un factor importante en daños biológicos y DPPH se ha utilizado para evaluar la actividad captadora de radicales libres de antioxidantes naturales.22 DPPH, es un radical que se transforma en un compuesto estable cuando reacciona con un antioxidante y la extensión de la reacción depende de la capacidad de donación de hidrógeno del antioxidante.23 Los resultados muestran que el extracto etanólico de los tallos es el que mayor actividad captadora de radicales libres posee, seguido del extracto de acetato de etilo. El extracto etanólico de las hojas y el extracto de diclorometano mostraron similar capacidad bajo este método, pero muy baja actividad inhibitoria contra el radical DPPH. Los valores obtenidos para Pilea dauciodora, son inferiores a los reportados para otras especies de la familia Urticaceae tales como P. Microphylla (L.) Liebm., U. dioica y E. umbellatum.24
Actividad reductora del hierro férrico, ensayo FRAP: el ensayo FRAP mide la capacidad de un antioxidante para reducir el complejo de tripiridiltriazina férrica a su forma ferrosa.25 En general, las propiedades reductoras se asocian con la presencia de compuestos que ejercen su acción mediante la ruptura de la cadena de los radicales libres a través de la donación de un átomo de hidrógeno.26 Todos los extractos, con excepción del etanólico de las hojas, mostraron una alta capacidad reductora, lo cual hace que éstos, máxime el extracto etanólico de los tallos, sean considerados como potenciales fuentes de sustancias antioxidantes. Los valores obtenidos son superiores a los reportados en otras familias de plantas, entre las que se destaca Piperaceae, con especies evaluadas como Piper peltatum L27 y P. daniel-gonzalezii Trel.28
Ensayo de decoloración con el radical catiónico ABTS•+: la generación del catión radical ABTS29 constituye la base de uno de los métodos que se han aplicado a la medición de la actividad antioxidante total de soluciones de sustancias puras,30 mezclas acuosas y bebidas.31 La adición de un antioxidante dador de electrones al catión-radical preformado lo reduce ABTS, en una medida y en una escala de tiempo dependiendo de la actividad antioxidante, la concentración del antioxidante y la duración de la reacción. La mayor capacidad reductora fue observada para los extractos etanólicos de las hojas y el de acetato de etilo. El resultado observado para el extracto etanólico de las hojas, es muy alto comparado a los obtenidos por los métodos DPPH y FRAP y contrario a la tendencia que ha sido observada para todos los extractos. Esta diferencia puede atribuirse, en parte, a desplazamientos de equilibrio en la reacción, debido a la presencia de la forma reducida de ABTS que está siempre presente en los sistemas, lo cual no se presenta en las reacciones de DPPH y FRAP. Además, ABTS tiene la habilidad para reaccionar con otros grupos diferentes a fenoles que tengan la capacidad de experimentar oxidación.32
Fenoles totales: los polifenoles son los principales compuestos producidos por las plantas con actividad antioxidante, aunque no son los únicos. La actividad antioxidante de los compuestos fenólicos se debe principalmente a sus propiedades redox,33 la cual puede desempeñar un papel importante en la absorción y la neutralización de los radicales libres, atrapamiento de oxígeno singlete y triplete, o descomposición de peróxidos.
Con la excepción del extracto etanólico de las hojas, todos los extractos muestran un alto contenido de fenoles, presentándose la mayor concentración en el extracto de diclorometano. La capacidad antioxidante está relacionada con la cantidad de fenoles que presente una muestra. Esto no se ve reflejado en el caso del extracto de diclorometano, lo cual puede deberse a diferentes interacciones con otros constituyentes del tejido de la planta o también por el grado de polimerización de los compuestos fenólicos, que disminuye la solubilidad en agua.34
En conclusión, el extracto etanólico de los tallos y el extracto de acetato de etilo de las hojas resultaron tener las mejores capacidades antioxidantes y menor citotoxicidad. Estos resultados validan la recomendación de realizar un posterior fraccionamiento bio-dirigido de estos extractos, así como separar los metabolitos secundarios mayoritarios y determinar sus estructuras, con el fin de evaluar su potencial reductor in vivo y explorar el desarrollo de nuevos compuestos antioxidantes de utilidad en la industria farmacéutica y de alimentos.
AGRADECIMIENTOS
Los autores agradecen el apoyo financiero brindado por la Universidad de Antioquia (Programas de Sostenibilidad 2013-2014 y CIDEPRO) y a la Universidad Nacional sede Medellín.
REFERENCIAS BIBLIOGRÁFICAS
1. Rojano B, Saez J, Schinella G, Quijano J, Vélez E, Gil A, et al. Experimental and theoretical determination of the antioxidant properties of isoespintanol (2-isopropyl-3,6-dimethoxy-5-methylphenol). J Mol Struc. 2008;(877):1-6.
2. Buenger J, Ackermann H, Jentzsch A, Mehling A, et al. An interlaboratory comparison of methods used to assess antioxidant potentials. Int J Cosmetic Sci. 2006;(28):135-45.
3. Atawodi S.E. Antioxidant potential of African medicinal plants. Afr J Biotechnol. 2005;(4):128-33.
4. Botterweck AAM, Verhagen H, Goldbohm RA, Kleinjans J, Van den brandt PA. Intake of Butylated Hydroxyanisole and Butylated Hydroxytoluene and Stomach Cancer Risk: Results from Analyses in the Netherlands Cohort Study. Food Chem Toxicol. 2000;(38):599-605.
5. Gaviria C, Ochoa C, Sánchez N, Medina C, Lobo M, et al. Actividad antioxidante e inhibición de la peroxidación lipídica de extractos de frutos de mortiño (Vaccinium meridionale SW). Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas. 2009;(6):519-28.
6. Rojano B, Gaviria C, Gil M, Saez J, Schinella G, Tournier H. Actividad antioxidante del isoespintanol en diferentes medios. Vitae. 2008;(15):173-81.
7. Pokorny J. Natural antioxidants for food use. Trends Food Sci Technol. 1991;(9):223-7.
8. Chen JR, Monro AK. In Flora of China; Science Press: Beijing. 2003;(5):92-120.
9. Chinese Medicinal Material Company Resource Compendium for Chinese Traditional Medicine; Science Press: Beijing, 1994. pp. 201-5.
10. Facey PC, Pascoe KO, Porter RB, Jones AD. Investigation of plants used in Jamaican folk medicine for anti-bacterial activity. J Pharm Pharmacol. 1999;(51):1455-60.
11. Modarresi CA, Ibrahim D, Fariza S. Antioxidant, antimicrobial activity and toxicity test of Pilea microphylla. Int J Microbiol. 2010;(2010):1-6.
12. Prabhakar KR, Veerapur VP, Bansa lP, Parihar VK, Reddy KM, Bhagath KP, et al. Antioxidant and radioprotective effect of the active fraction of Pilea microphylla (L.) Liebm. ethanolic extract. Chem Biol Interact. 2007;(165):22-32.
13. Taylor VM, Cedeño DL, Muñoz DL, Jones MA, Lash TD, Young AM, et al. In vitro and vivo studies of the utility of dimethyl and diethyl carbaporphyrin ketals in treatment of cutaneous leishmaniasis. Antimicrob Agents Chemother. 2011;55:4755-64.
14. Finney JD. Probit Analysis. 3rd ed. United Kingdom: Cambridge University Press, Cambridge; 1971.
15. Dewanto V, Wu X, Adom KK, Liu RI. Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity. J Agric Food Chem. 2002;(50):3010-14.
16. Benzie IF, Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of antioxidant power: the FRAP assay. Anal Biochem. 1996;(239):70-6.
17. Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Bio Med. 1999;(26):1231-7.
18. Peyrat-Maillard MN, Bonnely S, Berset C. Determination of the antioxidant activity of phenolic compounds by coulometric detection. Talanta. 2000;(51):709-16.
19. Jimenez N, Londoño J, Arango G. Actividad captadora de radicales libres y citotoxicidad de plantas colombianas de la familia Annonaceae. Acta Farm Bonaerense. 2005;(24):337-42.
20. Peteros N, Uy M. Antioxidant and cytotoxic activities and phytochemical screening of four Philippine medicinal plants. J Med Plants Res. 2010;(4):407-14.
21. Rekka E, Kourounakis PN. Effect of hydroxyethylrutenosides and related compounds on lipid peroxidation and free radical scavenging activity. Some structural aspects. J Pharm Pharmacol. 1991;(43):486-91.
22. Zhu N, Wang M, Wei G-J, Lin J-K, Yang CS, Ho CT. Identification of reaction products of (-)-epigallocatechin, (-)-epigallocatechingallate and pyrogallol with 2,2-diphenyl-1-picrylhydrazyl radical. Food Chem. 2001;(73):345-49.
23. Bondent V, Brand-Williams W, Bereset C. Kinetics and mechanism of antioxidant activity using the DPPH free radical methods. LWT – Food Sci Technol. 1997;(30):609-15.
24. Chahardehi AM, Ibrahim D, Sulaiman SF. Antioxidant activity and total phenolic content of some medicinal plants in Urticaceae family. J Appl Biol Scien. 2009;(3):27-31.
25. Benzie IF, Strain JJ. Ferric reducing antioxidant power assay; direct measure of total antioxidant activity of biological fluids and modified version for simultaneous measurement of total antioxidant power and ascorbic acid concentration methods. Enzymol. 1999;(299):15-27.
26. Gordon MH. The mechanism of antioxidant action in-vitro. In: Hudson BJF. Editors. Food antioxidants. London: Elsevier Applied Science; 1990. p. 1-18.
27. Puertas M, Chabala L, Rojano B, Sáez J. Capacidad antioxidante in vitro de fracciones de hojas de Piper peltatum L. Rev Cubana Plant Med. 2009;(14):1-11.
28. Cardona W, Robledo S, Rojano B, Alzate F, Muñoz D, Saez J. Actividad leishmanicida y antioxidante de extractos de Piper daniel-gonzalezii Trel. (Piperaceae). Rev Cubana Plant Med. 2013;(18):268-77.
29. Wolfenden BS, Willson RL. Radical-cations as reference chromogens in kinetic studies of one-electron transfer reactions: pulse radiolysis studies of 2,2 9-azinobis-(3-ethylbenzthiazoline-6-sulphonate). J Chem Soc Perkin Trans. 1982;(2):805-12.
30. Rice-Evans CA, Miller NJ, Paganga G. Structure-antioxidant activity relationships of flavonoids and phenolic acids. Free Radic Biol Med. 1996;(20):933-56.
31. Salah N, Miller NJ, Paganga G, Tijburg L, Rice-Evans CA. Polyphenolic flavonols as scavengers of aqueous phase radicals and as chain-breaking antioxidants. Arch Biochem Biophys. 1995;(322):339-46.
32. Roberta RE, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Bio Med. 1999;(26):1231-37.
33. Galato D, Ckless K, Susin MF, Giacomelli C, Ribeiro do Valle RM, Spinelli A. Antioxidant capacity of phenolic and related compounds: correlation among electrochemical, visible spectroscopy methods and structure-antioxidant activity. Redox Report. 2001;(6):243-50.
34. Naczk M, Shaidi F. Phenolics in cereals, fruits and vegetables: Occurrence, extraction and analysis. J Pharm Biomed Anal. 2006;(41):1523-42.
Recibido: 31 de enero de 2014.
Aprobado: 12 de enero de 2015.
Dr. Wilson Cardona Galeano. Instituto de Química, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia, A. A. 1226, Medellín, Colombia.
Correo electrónico: wilson.cardona1@udea.edu.co