Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.20 no.1 Ciudad de la Habana ene.-mar. 2015
ARTÍCULO ORIGINAL
Evaluación fitoquímica de hojas de Excoecaria lucida Sw. (Aité) (Euphorbiaceae) y Aislamiento e Identificación de un hemiterpenoide
Fitochemistry evaluation of leaves of Excoecaria lucida Sw. (Aité) (Euphorbiaceae) and isolation e identification of a hemiterpenoid
MSc. Ania Ochoa Pacheco,I DrC. Julio César Escalona Arranz,I DrC. Josean Fechine Tavares,II DrC. Marcelo Sobral Da SilvaII
I Facultad de Ciencias Naturales. Universidad de Oriente, Santiago de Cuba, Cuba.
II Instituto de Ciencias de la Salud. Universidad Federal De Paraíba, João Pessoa, Paraíba, Brasil.
RESUMEN
Introducción: excoecaria lucida Sw. (Aité), es una especie que crece en Cuba y en la región del Caribe. La misma ha sido poco estudiada por científicos a pesar de que la población la utiliza con fines medicinales, en lo principal como antiasmático, antimicrobiano y para el dolor dental.
Objetivos: determinar la composición química de las hojas, así como aislar e identificar estructuralmente metabolitos secundarios.
Métodos: las hojas secas y molidas, se maceraron 72 horas con etanol al 95 % y se repitió el procedimiento en 4 ocasiones. Al extracto total se le determinó su composición química cualitativa y posterior se fraccionó con solventes. La fase de mayor rendimiento fue estudiada por Cromatografía Líquida de Alta Resolución y aislada la sustancia mayoritaria, la cual fue caracterizada por espectroscopía infrarroja y de Resonancia Magnética Nuclear 1H y 13C a 500 MHz (HMQC, HMBC, COSY y NOESY).
Resultados: se determinó la presencia cualitativa de alcaloides, triterpenos y esteroides, quinonas, flavonoides, cumarinas, lactonas sesquiterpénicas, fenoles y taninos. De la fase de mayor rendimiento (butanólica= 23,48 g) se logró aislar e identificar el compuesto mayoritario perteneciente a un hemiterpenoide.
Conclusiones: los metabolitos secundarios detectados coinciden con los reportes para otras especies del género. Se informa por primera vez para el género y la especie el aislamiento e identificación del hemiterpenoide (2E)-2-metil-2-buten-1,4-diol-1-O-β-D-glucopiranósido.
Palabras clave: excoecaria lucida, hemiterpenoide, Resonancia Magnética Nuclear, HPLC.
ABSTRACT
Introduction: excoecaria lucida Sw. (Aité), it is a species that grow in Cuba and at the Caribbean region. It has been scientifically quite a little studied, in spite of the fact that the population utilizes it due to their medicinal properties as antiasthmatic, antimicrobial, and for the toothache treatment.
Objectives: to determine the chemical composition of leaves, as well as the isolation and identification of their secondary metabolites.
Methods: dried and milled leaves were macerated 72 hours with ethanol 95 %, repeating the procedure in 4 occasions. Total extract was determined in his chemical qualitative composition and afterwards it was fragmented with solvents. The phase with greater yield was studied by High Performance Liquid Chromatography and isolated the main substance, which was characterized by infrared and Nuclear Magnetic Resonance spectroscopy: uni-dimensional 1H and 13C at 500 MHz and bi-dimensional HMQC, HMBC, COSY and NOESY.
Results: the identification of Alkaloids, triterpenes and steroids, quinone, flavonoids, coumarins, sesqiterpenic lactones, tannins and phenols were accomplished. From the greater yield phase (butanol= 23.48 g) was isolated and identified the main compound, a hemiterpenoid.
Conclusions: the identified secondary metabolites are in coincidence with other reports related to the genera. For first time the hemiterpene (2E)-2-methyl-2- buten-1,4-di-hydroxyl-1-O-β-D-glucopyranoside is informed in this genera and specie.
Key words: excoecaria lucida, hemiterpene, Nuclear Magnetic Resonance, HPLC.
INTRODUCCIÓN
Existen variadas especies botánicas de las cuales se desconoce su composición química, sin embargo, la población las utiliza para el tratamiento de innumerables enfermedades. Es por esto, que la investigación fitoquímica constituye una herramienta importante y prioritaria en este sentido.
Euphorbiaceae , es una de las más grandes familias a nivel mundial y ocupa el sexto lugar en diversidad.1 Está constituida por 300 géneros y alrededor de 7 500 especies;2 distribuidos máxime en los trópicos, fundamental en la región indo-malaya y en la América tropical.3 La familia es sumamente importante, ya que muchos de sus miembros se cultivan para uso medicinal, industrial, alimenticio y ornamental.1 La química de esta familia, está entre la más diversa e interesante de las plantas con flores, posee metabolitos secundarios que sirven de precursores químicos.4 Además, se reporta un total de 30 especies activas como antitumorales, de acuerdo a estudio desarrollado por el Instituto de Cáncer de los Estados Unidos.5
Dentro de los géneros con que cuenta esta familia, se encuentra Excoecaria, que comprende cerca de 40 especies y muestra una gran diversidad fitoquímica, como monoterpenos; diterpenos (labdanos, kauranos, isopimaranos, beyeranos, daphnanos, tiglianos, atisanos); triterpenos; taninos; flavonoides, ácidos orgánicos, ésteres de ácidos orgánicos; esteroides, alcanos, alcoholes, alcaloides. Adicional a esta diversidad fitoquímica, se le añade una gran diversidad de actividades farmacológicas como antimicrobiana, citotóxica, antitumoral, antiviral especialmente como anti VIH, antioxidante y antinflamatorio.6
Excoecaria lucida Sw. (Gymnanthes lucida Sw. "sin".) (Yaití, Aité), es una de las especies que crece en Cuba (Macizo Sierra Maestra, Macizo Nipe-Sagua-Baracoa, Ciénaga de Zapata: Cayo Las Vacas y Cayo Venado), también se puede encontrar en Belice, Guatemala, Honduras, México, Estados Unidos y el Caribe.7-9 Ha sido muy poco estudiada, sin embargo, la población la utiliza con fines medicinales principalmente como antiasmático, antimicrobiano, para el dolor de dientes y para la destrucción de callos.9,10
Desde el punto de vista científico, existe poca información en revistas nacionales e internacionales consultadas desde el 2010 a la fecha. Sólo se reportan dos artículos de interés: uno relacionado con la actividad antimicrobiana de extractos de la corteza9,11 y otro relacionado con la composición química del aceite esencial de las hojas con 99 compuestos identificados, dentro de ellos espatulenol (16,6 %), metilfarnesoato (11,4 %) y α-pineno (9,7 %) como los componentes mayoritarios.12 La insuficiente información científica disponible, permite suponer que se trata de una especie poco estudiada, por lo que se precisa de un estudio más profundo. Es por ello, que en el presente trabajo se realizó la evaluación fitoquímica de las hojas de Excoecaria lucida Sw.; a través de la determinación cualitativa, aislamiento e identificación estructural de sus metabolitos secundarios por técnicas de Resonancia Magnética Nuclear.
MÉTODOS
Recolección y procesamiento del material vegetal
Las hojas de la especie fueron recolectadas en el mes de noviembre, en la reserva ecológica Siboney-Juticí de la provincia Santiago de Cuba, en horas tempranas de la mañana. Los ejemplares colectados se encontraban en estado vegetativo. Después de la identificación botánica por el Ing. Félix Acosta Cantillo, una muestra de la especie fue depositada en el Herbario del Centro Oriental de Ecosistemas y Biodiversidad de la ciudad de Santiago de Cuba, registrada como 154 HAC-SC No. 7384 local: Siboney-Juticí.
Las hojas fueron sometidas a una selección visual, excluyéndose la materia orgánica e inorgánica extraña. Las mismas fueron sometidas a un proceso de secado a la sombra. Detrás se redujo el tamaño de partícula en un molino de martillo de procedencia cubana, perteneciente al laboratorio territorial de Plantas Medicinales “San Luis de Jagua” del municipio Songo-La Maya, Santiago de Cuba, y acondicionadas en recipientes apropiados, para protegerlas de la luz y la humedad.
Preparación del extracto total
Las hojas secas y molidas (850 g), se maceraron con etanol 95 % por 72 horas en recipiente color ámbar, agitando manualmente tres veces al día. Al cabo de las 72 horas, se procedió a la extracción de la muestra por decantación auxiliándose de un embudo de filtración a gravedad cubierto con gasa y algodón. Este procedimiento fue repetido 4 veces sucesivas hasta agotamiento total de la droga, se reunió los extractos correspondientes y concentrándolos a sequedad (temperatura de 40 °C) en un rotoevaporador IKA-Werke de procedencia alemana, hasta la obtención del extracto total seco.
Determinación de la composición química cualitativa al extracto total
La caracterización fitoquímica del extracto total fue realizada, a través de reacciones químicas cualitativas13-18 para las siguientes clases de sustancias naturales:
Alcaloides (Dragendorff, Mayer, Wagner, Marquis, Erdman), Triterpenos y esteroides (Liebermann-Burchard, Solkowski, Rosemheim y Ácido Tricloroacético), Quinonas (Borntrager y las variantes con álcalis concentrado y Ácido Sulfúrico concentrado), Cumarinas (Baljet, Legal, variación de pH, fluorescencia), Lactonas sesquiterpénicas (Tollens), Glicósidos cardíacos (Kedde), Simaroubólidos (Ácido Sulfúrico concentrado), Limonoides y Meliacinas (Erlich), Saponinas (Espuma, Woller, Pseudosapogeninas), Azúcares reductores (Fehling y Benedict), Fenoles y taninos (Gelatina), Carbohidratos (Molish y Seliwanoff),Aminoácidos y aminas libres (Ninhidrina), Glicósidos cianogénicos (Picrato de sodio), Poliurónidos (Etanol), Flavonoides (Shinoda, Ácido Sulfúrico concentrado, Álcalis, Rosemheim, Dimroth, Leucoantocianidinas y Catequinas, Nitrato de Plata).
Fraccionamiento del extracto total
Para el fraccionamiento del extracto total seco se procedió según se representa en el diagrama de flujo (Fig. 1).
Separación y aislamiento por Cromatografía Líquida de Alta Resolución (HPLC) de la fase butanólica
Se desarrollaron varias metodologías hasta conseguir la adecuada, para la separación de uno de los compuestos mayoritarios en esta fase. Se empleó para ello un sistema HPLC analítico VP Shimadzu (Japón) con detección por arreglo de diodo, un loop de 20 µL y una columna ACE5 C18 (250 × 4,6 mm, y 3 µm de tamaño de partícula). Como fase móvil fue empleado un sistema isotérmico a temperatura de 40 °C consistente en agua des-ionizada (preparada por un sistema de purificación de agua Milli-Q, solvente A) y acetonitrilo (grado HPLC, Tedia Company INC., USA, solvente B) con una variación de gradiente de 0,01-35 % de acetonitrilo por 60 minutos y una velocidad de flujo de 1 mL/minuto. El detector fue monitoreado con inicio de absorbancia en 196 hasta 360 nm.
Una vez definidas las condiciones experimentales se procedió al desarrollo de un HPLC semipreparativo en el mismo equipo pero se modificó las condiciones de la columna: ACE 5 C18 (250 × 10 mm, 5 µm de tamaño de partícula) y un loop de 200 µL. La velocidad de flujo de la fase móvil fue de 3 mL/minutos. Todas las soluciones fueron filtradas a través, de una membrana de 0,45 µm antes de ser inyectadas en HPLC (PVDF Schleicher & Schuell, Alemania) y al igual que la fase móvil fueron desgasificadas en un baño ultrasónico (Ultracleaner 1600, Tramontina, Brasil, EN631, 1/3-100 mm) antes de ser usadas. Para desarrollar la metodología analítica fue preparada una solución de 100 µg/mL y para la preparativa de 10 mg/mL.
Elucidación estructural de los compuestos separados
El compuesto mayoritario que se separó fue sometido a elucidación estructural a través de la espectroscopia infrarroja (IR) y de Resonancia Magnética Nuclear (RMN) H1 y C13uni y bidimensional (HMQC, HMBC, COSY, NOESY).
Los espectros IR fueron obtenidos en espectrómetro Modelo PRESTIGIU-21, FTIR-8400S, Shimadzu, Japón en bromuro de potasio (KBr) a la proporción de 0,5 mg de la muestra: 100 mg de KBr. Los espectros de RMN fueron obtenidos en espectrómetro VARIAN modelo System, se operó a 500 MHz (1H), 125 MHz (13C). El solvente que se empleó fue Dimetilsulfóxido deuterado (DMSO-D6,CIL, Cambridge Isotope Laboratories, Inc.). Las deslocalizaciones químicas (δ) fueron expresados en partes por millón (ppm) y las constantes de acoplamiento (J) en Hz. Las multiplicidades de las señales en RMN 1H fueron indicadas según la convención: s (singlete), d (doblete), t (triplete), dd (doble doblete) y m (multiplete).
RESULTADOS
Determinación de la composición química cualitativa al extracto total
Los resultados obtenidos se muestran en la tabla 1.
Tabla 1. Resultados de la determinación de la composición química cualitativa
| Ensayos cualitativos | Resultados | Observaciones |
| Metabolitos secundarios | ||
| Alcaloides | ||
| Dragendorff | (++) Turbidez | Para los ensayos de Dragendorff, Mayer y Wagner se obtuvieron evidencias débiles, pues no se logró en ningún caso un precipitado copioso, sin embargo el ensayo de Marquis sí se considera positivo. |
| Mayer | (+) Opalescencia | |
| Wagner | (++) Turbidez | |
| Marquis | (+) Color rojo | |
| Erdman | (-) | |
| Triterpenos y esteroides | ||
| Liebermann-Burchard | (+) Coloración rojiza | El color rojo en el ensayo de Liebermann-Burchard sugiere la presencia de estructuras triterpénicas, mientras que el cambio de coloración en el ensayo con Ácido Tricloroacético sugiere la presencia de triterpenos pentacíclicos. El resultado negativo del ensayo de Rosemheim sugiere la ausencia de dienos |
| Solkowski | (+) Coloración amarilla-rojiza | |
| Rosemheim | (-) | |
| Ácido tricloroacético | (+) Cambio a amarillo-rojizo | |
| Quinonas | ||
| Borntrager | (+++) | La coloración roja intensa en el ensayo de Borntrager sugiere la presencia de antraquinonas libres y naftoquinonas con prevalencia de las primeras, ya que la variante con benceno resultó negativa. |
| Variante con benceno | (-) | |
| Álcalis concentrado | (+) Coloración | |
| Ácido sulfúrico concentrado | (+) Coloración | |
| Cumarinas | ||
| Baljet | (+++) Precipitado rojo | El precipitado rojo obtenido para el ensayo de Baljet y la fluorescencia verde mostrada en el ensayo que lleva este mismo nombre indica la presencia de furanocumarinas. |
| Legal | (+/-) | |
| Variación de pH | (+/-) | |
| Fluorescencia | (+) Aparición de fluorescencia | |
| Lactonas sesquiterpénicas | ||
| Tollens | (+) Formación | Sugiere la presencia de lactonas α, β- y β, γ-insaturadas. |
| Glicósidos cardíacos | ||
| Kedde | (-) | |
| Simaroubólidos | ||
| Ácido Sulfúrico Concentrado | (-) | |
| Limonoides y meliacinas | ||
| Erlich | (-) | |
| SAPONINAS | ||
| Espuma | (+) | Espuma poco copiosa y de corta permanencia |
| Woller | (-) | |
| Pseudo-sapogeninas | (-) | |
| Azúcares reductores | ||
| Fehling | (+) Precipitado | Los precipitados rojos obtenidos en estos dos ensayos sugieren la presencia de azúcares con presencia de un grupo carbonilo libre |
| Benedict | (+) Precipitado | |
| Fenoles y taninos | ||
| Gelatina | (+) Precipitado | El precipitado blanco en el ensayo de Gelatina sugiere la presencia de taninos con elevado peso molecular. |
| Carbohidratos | ||
| Molish | (+) Anillo | El ensayo de Seliwanoff sugiere la presencia de hexosas del tipo cetosas, pues la reacción ocurre al instante |
| Seliwanoff | (+) Coloración rosa-rojiza/instantánea | |
| Aminoácidos y aminas libres | ||
| Ninhidrina | (+) Coloración azul violácea | La coloración azul violácea sugiere la presencia de aminoácidos y/o aminas primarias |
| Glicósidos cianogénicos | ||
| Picrato de Sodio | (-) | |
| Poliurónidos | ||
| Etanol | (+) Aparición de | La aparición del precipitado sugiere presencia de hemicelulosa, pectina, gomas y mucílagos. |
| Flavonoides | ||
| Shinoda | (+) Color amarillo tenue | El color amarillo tenue del ensayo de Shinoda sugiere la presencia de flavonas, lo cual es confirmado por los ensayos con Ácido Sulfúrico Concentrado y Álcalis; mientras que el ensayo de Rosemheim y el de leucoantocianidinas señalan la presencia de leucoantocianidinas y antocianidinas. Por su parte el ensayo de Nitrato de Plata indica presencia de grupo catecol en las estructuras determinadas. |
| Ácido Sulfúrico Concentrado | (+) Color amarillo intenso | |
| Álcalis | (+) Color amarillo tenue | |
| Rosemheim | (+) Color rojo a marrón | |
| Dimroth | (-) | |
| Leucoantocianidinas y Catequinas | (+) Coloración | |
| Nitrato de Plata | (+) Espejo de | |
Fraccionamiento del extracto total
Como resultado del fraccionamiento que se realizó al extracto total se obtuvieron cuatro fracciones con rendimientos de 18,34 g (hexánica), 10,37 g (diclorometano), 6 g (acetato de etilo), 23,48 g (butanólica). Dado que la fase butanólica resultó ser la de mayor cantidad de sustancia extraída y que la naturaleza de los metabolitos identificados cualitativamente es en lo principal de naturaleza polar, se decide seleccionar a esta fase para realizar el proceso de separación y aislamiento por HPLC.
Separación y aislamiento por HPLC
El cromatograma de una fracción procedente de una planta medicinal se caracteriza por la presencia de múltiples picos. El proceder separativo estuvo enfocado en la resolución de los cuatro compuestos mayoritarios observados. Cada uno de ellos fue colectado y sometido a análisis por IR,RMN-1H y RMN 13C.
Elucidación estructural de los compuestos separados
A pesar de que se logró una separación aceptable para los cuatro componentes mayoritarios, sólo el compuesto 1 (Fig. 2) resultó un compuesto puro y en cantidades suficientes para el desarrollo de las técnicas espectroscópicas. La misma consistió en una sustancia viscosa de color amarillo.
El espectro infrarrojo obtenido en KBr mostró absorción en 3402, 1635, 1076 y 1037 cm-1. En la tabla 2 se muestran los datos espectrales de RMN 13C-APT y RMN 1H para la sustancia aislada.
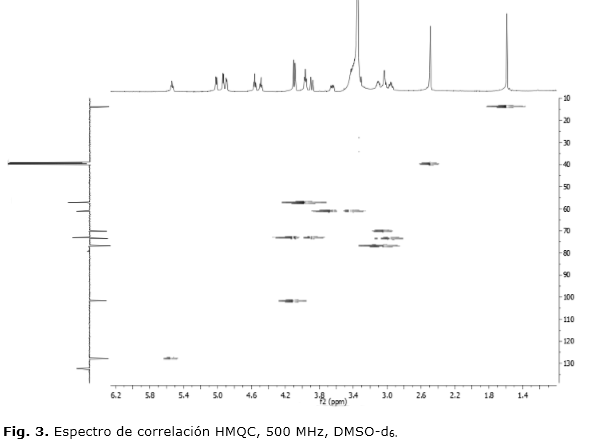
En el espectro RMN 13C-APT se reveló la presencia de 11 señales correspondientes a igual cantidad de átomos de carbono, mientras que el espectro RMN 1H revela un conjunto de señales en las regiones desde δH 1,58 hasta 5,53 ppm. El singlete en 1,58 ppm corresponde a un metilo unido a un carbono con hibridación sp2, lo que sugiere que uno de los dos carbonos implicados en el doble enlace no presenta hidrógenos asociados, se confirmó también por HMQC. Las señales en las regiones de 4,89 a 5 ppm y 4,4 a 4,6 ppm, aparecen en forma de tres dobletes y dos tripletes al respecto; con deslocamientos químicos en δH 4,89, 4,93 y 5,01 ppm para los primeros; así como δH 4,48 y 4,56 ppm para los segundos. De acuerdo al espectro bidimensional heteronuclear HMQC, ninguna de estas señales aparecen asociadas a carbonos, por lo que se tratan de hidrógenos hidroxílicos (Fig. 3). Dado que la molécula de glucosa en forma glicosilada, exhibe sólo 4 grupos OH, se infiere que en el núcleo carbonado de la aglicona, existe también una función hidroxilada (OH).
En el espectro HMQC, también se pueden verificar correlaciones directas entre los carbonos C-2´, C-4´, C-5´, C-3´, C-6´ y C-1´ con los protones H2´, H4´, H5´, H3´, H6´ y H1´; así como las correlaciones entre los carbonos C-5, C-1, C-4 y C-3 con los hidrógenos H-5, H-1, H-4 y H-3. De particular importancia resulta el hecho de que la señal correspondiente a C-1, tiene dos señales protónicas. Algo similar ocurre con el C-6´. Estas observaciones confirman que se tratan de hidrógenos geminales no equivalentes o diastereotópicos.
En el espectro de correlación HMBC, se confirman las posiciones asignadas a C-5, C-1, C-3´, C-3 y C-2 al mostrar el hidrógeno H-1´ de δH 4,09 ppm, correlaciones con 13,88, 73,05, 76,80, 127,71 y 132,32 ppm, correspondientes respecto a cada uno de éstos cinco átomos de carbono. Esto se reafirma ante la correlación entre H-5 de δH 1,58 ppm con δC 73,05, 127,71, 132,32 ppm correspondientes C-1, C-3 y C-2. Bajo este análisis, también es confirmada la naturaleza glucosídica de la sustancia.
En el espectro bidimensional homonuclear NOESY se muestran correlaciones entre la señal δH 3,96 ppm (H-4) con la señal en δ H 1,58 ppm (H-5), al igual que δH 3,88 ppm (H-1) con δH 5,53 ppm (H-3).
DISCUSIÓN
La determinación cualitativa de los metabolitos presentes en las hojas de E. lucida no permite su comparación con los de la literatura, se debe a la casi nula información química reportada para la especie. No obstante, otras especies del género Excoecaria sí han sido más estudiadas. La presencia de diterpenos, flavonoides, cumarinas, fenoles, catequinas, triterpenos, taninos hidrolizables y esteroides han sido determinada en Excoecaria acerifolia;21 Excoecaria cochinchinensis Lour;22 Excoecaria parvifolia;23 y Excoecaria agallocha.24-26 Esta coincidencia casi exacta entre los metabolitos secundarios para E. lucida con respecto a otras especies del género, resulta de gran importancia dado que muestra consistencia quimiotaxonómica. Se adiciona, la determinación química cualitativa de estos metabolitos en E. lucida, podría justificar las numerosas propiedades medicinales atribuidas a la especie.
Un análisis de los reportes bibliográficos19,20 muestra la presencia de dos compuestos con señales en regiones similares a la presentada por la sustancia aislada como se muestra en la tabla 2. Los dos compuestos reportados coinciden en ser hemiterpenos monoglucosilados y difieren en lo relativo a la configuración alrededor del doble enlace entre los carbonos 2 y 3 de la aglicona.
A pesar de que Kitajima y colaboradores19 no reportan los valores referentes a los protones asociados al fragmento glucosídico. La sustancia aislada resulta coincidente con ambos trabajos en lo referente a la presencia de una unidad de glucosa en la estructura, la cual se ve representada en las señales en δC 101,70, 73,43, 76,80, 70,10 y 76,85 ppm pertenecientes a carbonos metínicos y la de δC 61,09 ppm a un carbono metilénico; así como la correspondiente correlación directa de los mismos con sus respectivos hidrógenos, como se ejemplifica en la figura 3. El espectro IR con las señales en 3402, 1076 y 1037 cm-1 son muestra de la presencia de grupos hidroxilos en este fragmento. Se adiciona, los aspectos estereoquímicos de la molécula relacionados a la naturaleza del enlace glucosídico son resueltos por la constante de acoplamiento de H-1´, el cual al ser de (J) 7,5 Hz indica que la estereoquímica de la misma es β.
En lo referente a la aglicona, en el compuesto aislado las señales en δC 127,71 y 132,32 ppm confirman la presencia de una insaturación tipo doble enlace, coincide con el espectro IR (señal en 1635 cm-1). La precisión de la configuración del doble enlace se define de manera inequívoca a través, del espectro de correlación NOESY, el cual muestra una correlación intensa entre el H-4 con el H-5, al igual que la señal del H-1 con el H-3, se evidencia la naturaleza trans de este acoplamiento alílico. Ello corroboró que en definitivo se trataba del isómero Trans (E) de la sustancia, o sea el (2E)-2-metil-2-buteno-1,4-diol 1-O-β-D-glucopiranósido, una sustancia que por primera vez se reporta para la especie y género en estudio.
En el reino Plantae se reportó la presencia tanto del isómero cis (Z)19 como el trans (E).20 La biosíntesis de los hemiterpenos puede ocurrir a partir de dos vías: la vía del ácido mevalónico (procedente del acetato) y la vía del 1-deoxy-D-xylulosa 5-fosfato, genera en ambos casos una unidad de isopreno de configuración trans (E). La inversión de la configuración natural biosintética trans (E) a cis (Z), ocurre por ionización del catión alílico, y resulta indispensable para que ocurra la biosíntesis de terpenos cíclicos como los del sistema Mentano (monoterpenoide), y otros más complejos como diterpenoides cíclicos.27 Resultan precisos, estos últimos compuestos los que más han caracterizado a las especies de Excoecaria, por lo que el aislamiento de esta sustancia en E. lucida es coincidente con los patrones biosintéticos y quimiotaxonómicos de las especies pertenecientes a este género, máxime cuando se trata de una sustancia poco común en el reino vegetal.
La presencia de flavonoides, cumarinas, fenoles, catequinas, triterpenos, taninos hidrolizables y esteroides coincide con los reportes para otras especies del género, se puede justificar las numerosas propiedades medicinales atribuidas a la especie. El aislamiento por primera vez en el género y especie del hemiterpenoide (2E)-2-metil-2-buten-1,4-diol-1-O-β-D-glucopiranósido, podría ser una clave en el entendimiento de los patrones biosintéticos y quimiotaxonómicos de las especies pertenecientes a este género.
AGRADECIMIENTOS
El fraccionamiento del extracto total de las hojas, la separación de la fase butanólica por HPLC y la elucidación estructural de los componentes separados fueron llevados a cabo en los laboratorios correspondientes al Programa de Post-graduación en Productos Naturales y Sintéticos Bioactivos del Instituto de Ciencias de la Salud de la Universidad Federal de Paraíba, Brasil, a través, de estancia de investigación por concepto del proyecto No. 144/11, y se aprobó en la Convocatoria 2011 CAPES/MES/CUBA.
Apoyo financiero o de otra naturaleza que sustenta el trabajo propuesto
Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), Brasil.
REFERENCIAS BIBLIOGRÁFICAS
1. Steinmann VW. Diversidad y endemismo de la familia Euphorbiaceae en México. Acta Botánica Mexicana. 2002;(61):61-96.
2. Singh B, Dutt N, Kumar D, Singh S, Mahajan A. Taxonomy, Ethnobotany and Antimicrobial Activity of Croton bonplandianum, Euphorbia hirta and Phyllanthus fraternus. J Adv Dev Res. 2011;2(1):21-9.
3. Martínez GM, Steinmann V, Jiménez J, Cervantes A, Ramírez AR. Catálogo de Autoridades Taxonómicas da família Euphorbiaceae de México. 1ra ed. D.F: México; 2005.
4. Seigler DS. Phytochemistry and Systematics of the Euphorbiaceae. Annals of the Missouri Botanical Garden. 1994;81:380-401.
5. Cragg GM, Newman DJ, Yang SS. Natural Product Extracts of Plant and Marine Origin Having Antileukemia Potential. The NCI Experience. J Nat Prod. 2006;69(3):488-98.
6. Yin B, Li-Ru Shen, Zhang M, Zhao L, Wang Y, Huo C, et al. Chemical Constituents of Plants from the Genus Excoecaria. Chemistry and Biodiversity. 2008;5(11):2356-71.
7. Borroto RP, Labrada MP, Mancina CA, Oviedo R. Valoración rápida de la biodiversidad en cayos al sureste de la Ciénaga de Zapata (Cuba). Orsis. 2007;(22):9-33.
8. León H, Alaín H. Flora de Cuba. Contribuciones ocasionales del museo de Historia Natural del Colegio de La Salle La Habana Cuba. Tomo III. La Habana: Cuba; 1953.
9. Roig JT. Plantas Medicinales, Aromáticas o Venenosas de Cuba. Ciencia y Técnica, Editorial. La Habana: Cuba; 1974.
10. Hernández CJ, Temó VD, Acosta CF. Uso de las plantas: Proyecto Diversidad Biológica del Macizo Montañoso Sierra Maestra. BIOECO, Editorial. Santiago de Cuba, Cuba; 2004.
11. Pérez GS, Zavala SMA, Arias GL, Pérez GC, Pérez GRM. Antimicrobial study of bark from five tree species. Phytotherapy Research. 2001;15(4):356-9.
12. Pino JA, Marbot R, Payo A, Chao D, Herrera P, Marti MP. Aromatic plants from Western Cuba. I. Composition of leaf oil of Gymnanthes lucida Sw. and Eugenia rhombea (Berg) Krug et Urban. Journal of Essential Oil Research. 2005;17(3):278-80.
13. Domínguez JA. Métodos de Investigación Fitoquímica. Limusa, editorial. DF: (México); 1979.
14. Miranda M, Cuéllar AC. Farmacognosia y Química de los productos naturales. 1ra ed. Félix Varela, editorial. Habana, Cuba; 2001.
15. Ochoa AP, López TG, Colombat MR. Farmacognosia y Química de los Productos Naturales [CD-ROM]. Santiago de Cuba: Cuba; 2002.
16. Ministerio de Salud Pública; Centro para el Desarrollo de la Farmacoepidemiología; Dirección de Ciencia y Técnica; Área de docencia e investigación. Guías Metodológicas para la investigación en Plantas Medicinales. La Habana: Cuba; 1997.
17. Farnsworth NR. Biological and Phytochemical Screening of Plants. Journal of Pharmaceutical Sciences. 1966;55(3):262.
18. Lock OU. Métodos en el estudio de Productos Naturales. Lima: Perú; 1988.
19. Kitajima J, Suzuki N, Ishikawa T, Tanaka Y. New hemiterpenoid Pentol and monoterpenoid glycoside of Torillis japonica fruit, and consideration of the origin of apiose. Chem. Pharm. Bull. 1998;46(10):1583-86.
20. Nanqun Zhu, Nikolai Sharapin, Jinsheng Zhang. Three glucosides from Maytenus ilicifolia. Phytochemistry. 1998;47(2):265-8.
21. Zhao YL, Qiu-Xia He, Yang Li, Si-Feng Wang, Ke-Chun Liu, Yong-Ping Yang, et al. Chemical Constituents of Excoecaria acerifolia and their Bioactivities. Molecules. 2010;15(4):2178-86.
22. Kazuaki Y, Kensuke N, Masahiro Y, Ken K, Hideyuki M. Isolation of antibabesial compounds from Brucea javanica, Curcuma xanthorrhiza, and Excoecaria cochinchinensis. Biosci. Biotechnol. Biochem. 2009;73(3):776-80.
23. Grace MH, Faraldos JA, Lila MA, Coates RM. Ent-Beyerane diterpenoids from the heartwood of Excoecaria parvifolia. Phytochemistry. 2007;68(4):546–53.
24. Tian MQ, Bao GM, Ji NY, Li XM, Wang BG. Triterpenoids and steroids from Excoecaria agallocha. Zhongguo Zhong Yao ZaZhi. 2008;33(4):405-8.
25. Wang ZC, Lin YM, Feng DQ, Ke CH, Lin P, Yan CL, et al. A new atisane-type diterpene from the bark of the mangrove plant Excoecaria agallocha. Molecules. 2009;16-14(1):414-22.
26. Li Y, Liu J, Yu S, Proksch P, Gu J, Lin W. TNF-alpha inhibitory diterpenoids from the Chinese mangrove plant Excoecaria agallocha L. Phytochemistry. 2010;71(17-18):2124-31.
27. Dewick PM. Medicinal Natural Products. A Biosynthetic Approach. 2da ed. John Wiley & Sons Ltd, editorial. West Sussex: Inglaterra; 2002.
Recibido: 29 de mayo de 2014.
Aprobado: 12 de enero de 2015.
MSc. Ania Ochoa Pacheco. Pizarro No. 24, entre Trocha y primera. Reparto Flores, CP 90300. Santiago de Cuba, Cuba.
Correo electrónico: aochoa@cnt.uo.edu.cu