Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.20 no.4 Ciudad de la Habana oct.-dic. 2015
ARTÍCULO ORIGINAL
Actividad antimicrobiana y análisis de la composición química de una fracción de las flores de Acmella ciliata (Kunth) Cass
Antimicrobial activity and chemical composition analysis of an fraction isolated from Acmella ciliata (Kunth) Cass flowers
MSc. Carlos Andrés Rincón Mejía,I PhD. Jhon Carlos Castaño Osorio,I MSc. Milton Gómez Barrera, II PhD. Jan Rezek,III PhD. Tomáš Vaněk IV
I Grupo de Inmunología Molecular. Universidad del Quindío. Armenia, Colombia.
II Grupo de búsqueda de principios bioactivos. Universidad del Quindío. Armenia, Colombia.
III Laboratorio de biotecnología vegetal del instituto de botánica experimental. Academia de ciencias de la República Checa. Praga, República Checa.
IV Instituto de botánica experimental. Academia de ciencias de la República Checa. Praga, Republica Checa.
RESUMEN
Introducción: Acmella ciliata (Kunth) Cass, es una arvense conocida por ser un famoso remedio popular contra el dolor de muelas y garganta. Las sustancias químicas a los que se le atribuyen la actividad biológica son las alcamidas alifáticas.
Objetivo: analizar la composición química y actividad biológica de una fracción rica en alcamidas, proviene del extracto apolar de la flores de Acmella ciliata (Kunth) Cass.
Métodos: el análisis cualitativo de los metabolitos fue llevado a cabo, se usó cromatografía de gases en dos dimensiones, acoplado a un espectrómetro de masas con analizador de tiempo de vuelo (CGxCG/TOFMS). La actividad biológica se determinó por el ensayo de concentración mínima inhibitoria; se empleó el método de microdilución en placa con resazurin.
Resultados: la fracción clorofórmica del extracto etéreo de las flores de A. ciliata, presentó en su composición una variedad de compuestos nitrogenados, predominó alcamidas alifáticas. El N-Isobutil-2(E),6(Z),8(E)-decatrienamida (espilantol), fue la alcamida más abundante dentro del grupo de las 5 alcamidas encontradas. Además, esta fracción exhibió actividad antimicrobiana, frente Escherichia coli, Staphylococcus aureus, Staphylococcus epidermidis y Candida albicans.
Conclusiones: la fracción clorofórmica de A. ciliata muestra un gran potencial no solo desde el punto de vista químico, sino también desde el farmacológico. Aunque todos los microorganismos empleados fueron inhibidos por acción de las alcamidasseparadas. Fue C. albicans el microorganismo más susceptible a la acción antimicrobiana de la muestra, tuvo una concentración mínima inhibitoria de 312,5 µg/mL.
Palabras clave: Acmella ciliata, alcamidas, espilantol, actividad antimicrobiana, Candida albicans.
ABSTRACT
Introduction: Acmella ciliata (Kunth) Cass is a weed renowned as a famous folk remedy for toothache and throat. The chemical substances which are attributed their biological activity are aliphatic alkamides.
Objetivo: analyze the chemical composition and biological activity of a fraction rich in alkamides from the apolar extract of Acmella ciliata (Kunth) Cass flowers
Methods: the qualitative analysis of metabolites was carried out using two-Dimensional gas chromatography coupled to time-of-flight mass spectrometry (CGxCG/TOFMS).The biological activity was evaluated by the minimum inhibitory concentration assay (MIC) using the resazurin microplate method.
Results: the chloroformic fraction of the etheric extract from A. ciliata flowers presents a variety of nitrogen containing compounds including predominantly aliphatic alkamides. N-Isobutyl-2 (E), 6 (Z), 8 (E)-decatrienamide (spilanthol) was the most abundant amide within the group of 5 alkamides found. Regarding its biological activity, the chloroformic fraction exhibited antimicrobial activity against Escherichia coli, Staphylococcus aureus , Staphylococcus epidermidis and Candida albicans.
Conclusions: chloroform fraction of A. ciliata shows great potential because of its chemical and pharmacological properties. Although all tested bacterias and fungi were inhibited by the activity of alkamides separated, C. Albicans was the most susceptible microorganism to the antimicrobial activity of the fraction, demonstrating a MIC of 312.5µg/mL.
Keywords: Acmella ciliata, alkamides, spilanthol, antimicrobial activity, Candida albicans
INTRODUCCIÓN
Acmella ciliata (HBK) Cassini, es una arvense conocida por ser un famoso remedio popular para el dolor de muelas y garganta, así como para las infecciones de las encías. Se sabe que la masticación de sus hojas y flores, tienden a adormecer la boca y de aliviar temporal, el dolor dental y oral. Los compuestos bioactivos a los que se le atribuyen estos efectos son las alcamidas alifáticas, que han demostrado su eficacia como compuestos medicinales, saborizantes e incluso en control biológico, por lo que son un grupo de metabolitos de gran interés actual.1 También, se ha reportado su acción insecticida y antibacteriana, aun así, no hay muchas investigaciones que determinen el potencial farmacológico de esta especie.
Las alcamidas o alquilamidas, son considerados compuestos bioactivos, esto significa que una pequeña cantidad de estos compuestos presenta una respuesta notable en las células receptoras. Alcamidas como el espilantol y la N-isobutil-deca-2E, 6Z, 8E-trienamida, entre otras; han sido aisladas y reportadas por diferentes autores en especies del género Acmella, como Acmella oppostofolia y Acmella oleraceae.2 La tesis doctoral “Acmella ciliata (HBK) Cassini. Phytochemische und enzymatische Untersuchungen, galenische Präformulierungen” desarrollada por Keipert en el 2009, presenta una elucidación completa y exacta, elucidación de los metabolitos encontrados en diferentes preparaciones galénicas, y extractos obtenidos por métodos convencionales y ultrasonido de A. ciliata. Evalúa de igual manera, la actividad de los extractos sobre diferentes enzimas que intervienen en el proceso inflamatorio.3
Previas investigaciones desarrolladas en los grupos de investigación Gymol y Diseño de Nuevos Productos (DNP) de la Universidad del Quindío, comprobaron el potencial de diferentes extractos crudos y aceites esenciales, obtenidos de las Flores y hojas de A. cilliata.4 Metabolitos polares como los flavonoides, taninos, quinonas oxidadas, azucares, lactonas y cumarinas estuvieron presentes en la fracción etanólica de las flores. En su fracción etérea se encontraron esteroles o metil esteroles, carotenos y alcamidas alifáticas. Gran parte de estos extractivos presentaron una potente acción sobre bacterias Gram positivas. Sin embargo el extracto apolar de las flores fue un potente inhibidor del crecimiento en S. aureus y C. albicans.5 Ya que en estudios anteriores se comprobó el potencial farmacológico del extracto apolar de las flores A. cilliata (HBK).
En esta investigación se busca analizar la composición química y actividad biológica de una fracción específica que fuera derivado de este extracto madre.
MÉTODOS
Recolección del material vegetal
Las flores y hojas de Acmella ciliata (HBK) Cass fueron recolectadas a las 6:00 a.m. en el municipio de Armenia, a una altitud de 1,483 metros sobre el nivel del mar y una temperatura entre los 20-24 ºC.
Clasificación taxonómica y secado del material vegetal
Se llevaron tres muestras de la especie vegetal al herbario de la universidad del Quindío, para su verificación taxonómica. La especie estudiada fue ingresada con el número de herbario 32750. Los órganos florales fueron secados en una estufa con circulación de aire a 35 ºC durante 24 h.
Obtención de la fracción clorofórmica
El extracto apolar de las flores de A. ciliata fue obtenido por extracción continua soxhlet, se usó 630 g de flores, previo, secadas y tamizadas. El extracto hexánico primario resultante fue fraccionado mediante el método de cromatografía en columna (CC). Para ello, se tomaron 13,585 g del extracto primario concentrado y fueron mezclados con sílica gel para cromatografía en capa delgada (CCD). La fase estacionaria utilizada fue gel de silice 60 (0,063-0,200) y como fase móvil se emplearon diferentes disolventes, siguió, sucesivo, serie eluotrópica: hexano, hexano: cloroformo (40:60), cloroformo, acetona y metanol. Las fracciones clorofórmicas obtenidas fueron reunidas para formar una sola fracción (denominada fracción AC7), la cual fue secada y conservada para su posterior análisis cromatográfico y biológico.
Cromatografía de gases en dos dimensiones acoplado a un espectrómetro de masas con analizador de tiempo de vuelo (CGxCG/TOFMS)
Preparación de las muestras
1,5 mg de la fracción AC7 fue diluida en una cantidad apropiada de acetato de etilo (Sigma-Aldrich, Cromasolv Plus, grado HPLC, 99,9 %), para obtener una concentración de 1 mg/mL.
Método analítico
Fue utilizado un sistema GCxGC/TOFMS LECO Pegasus 4D con muestreador multipropósito Gerstel y una entrada de temperatura programable CIS4. Se inyectó 1 µL de la fracción a una velocidad de 50 µL/min para un tiempo de corrido de 64 min. La temperatura inicial del vaporizador fue de -20 ºC con un tiempo de equilibrio de 1 minuto. Como programa de temperatura del vaporizador, se utilizó una rampa de temperatura de 10 ºC/s hasta alcanzar una temperatura de 250 ºC, esta fue sostenida por 10 min. El equipo Agilent 7890 de Cromatografia bidimensional, estuvo equipado con un modulador térmico LECO dual-jet entre la columna primaria y la secundaria. Precolumna: Restek Siltek Deactivated Guard Column (1,65 m × 0,25 mm I.D.). Columna primaria: SGE Analytical Science BPX-5, no polar, 5 % fenil polisilfenileno-siloxano (30 m × 0,25 mm I.D. × 0,25 µm espesor de película). La temperatura inicial de la columna primaria fue 35 ºC (sostenida 2 min) y fue llevada a 320 ºC (isotérmica 5 min) con una rampa de 5 ºC/s. Columna secundaria: SGE Analytical Science BPX-50, moderadamente polar, 50 % fenil polisilfenileno-siloxano (1,37 m × 0,1 mm I.D. × 0,1 µm espesor de película). La columna secundaria fue operada 10 °C sobre la columna primaria. Además, fue utilizado helio como fase móvil, (99,9995 %) con un flujo constante durante el análisis de 1 mL/min.
El tiempo de modulación fue el siguiente:
- Periodo de modulación: 4 s.
- Tiempo de pulso caliente: 1 s.
- Tiempo de enfriamiento entre etapas: 1 s.
- Temperatura del modulador en desplazamiento: 30 ºC sobre la temperatura en columna primaria.
El equipo de detección fue un espectrómetro de masas con tiempo de vuelo (TOFMS) LECO Pegasus IV (adquisición de retardo 600, masas monitoreadas m/z 35-600, tasa de adquisición de 100 espectros/s, voltaje 1500 V, energía de ionización-70 V, temperatura de ionización 250 °C). La relación S/N utilizada en el análisis fue de 1000.
Concentración mínima inhibitoria (CMI)
Preparación y análisis de la solución concentrada de las fracciones
Se preparó una solución stock del extracto con una concentración 10 veces mayor (50 mg/mL) a la primera concentración a usar en el experimento (5 mg/mL). Para disolver el soluto de la solución stock, se usó dimetil sulfóxido (DMSO) como solvente.
Microdilución en placa
Se diluyeron 10 µl de la solución stock, con 90 µl la solución de trabajo del microorganismo, a una concentración 3 a 6 x10 5 unidades formadoras de colonia (UFC). Con el fin de determinar la CMI, se realizó una dilución seriada de la solución stock, hasta llegar a una concentración de 156, 25 µg/mL. Las placas de 96 pozos, que contenían las diluciones fueron incubadas a 37 °C entre 18 a 24 h. Una vez el tiempo de incubación finalizado, se adicionó a cada pozo 11 µl de solución de resazurina a 440 micromolar (µM) como indicador metabólico. Las placas fueron de nuevo, incubadas por 2 h a 37 °C, y transcurrido el tiempo fue evaluado la matiz de coloración. Todo cambio de color púrpura a rosado, o incoloro, se registró como negativo. La CMI se toma como la concentración más baja que produce disminución de la viabilidad de los microorganismos
RESULTADOS
Análisis cualitativo por CGxCG/TOFMS
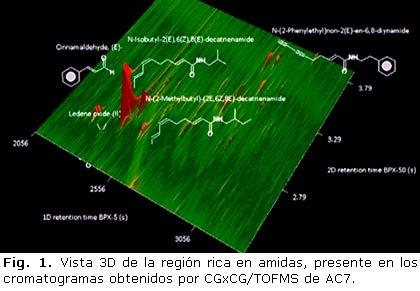
El perfil cromatográfico de la fracción AC7 a una S/N de 1000 presentó una amplia variedad de compuestos. Pese a su complejidad, este perfil cromatográfico llamó la atención debido a la presencia de amidas, específico, alcamidas alifáticas, en su composición. Las alcamidas presentes en mayor proporción, son presentadas en la tabla 1. Sin duda alguna, la alcamida alifática N-Isobutil-2(E), 6(Z), 8(E)-decatrienamida, conocida como espilantol, es la más abundante, presentó un pico con un área de 141’248.976. De igual forma, la imagen tridimensional del cromatograma obtenido en la región rica en amidas (Fig. 1), deja en evidencia la presencia de las alcamidas N-Isobutil-2(E), 6(Z), 8(E)-decatrienamida y N-(2-Feniletil) non-2 (E)-en-6,8-diinonamida como compuestos mayoritarios.
La estructura química alcamidas, determinadas por CGxCG/TOF-MS, esto según la comparación con la base de datos de espectros NIST, son presentadas en la figura 2.
Concentración mínima inhibitoria
Se buscó determinar la mínima concentración a la que la fracción AC7, rica en amidas, inhibe el crecimiento de los siguientes microorganismos: Escherichia coli (aislado clínico), Staphylococcus aureus (aislado clínico), Staphylococcus epidermidis (aislado clínico) y Candida albicans (aislado clínico). El esquema y las concentraciones utilizadas para este ensayo es el mostrado en la tabla 2.
En el ensayo fueron realizadas diluciones seriadas por triplicado, a partir de la solución AC7 de 5 mg/mL (5000 µg/mL). Además, se utilizaron controles positivos (antibiótico antimicótico-penicilina 10000 µg/mL, estreptomicina 10000 µg/mL y amfoterecina 25 µg/mL) y controles negativos (dimetilsulfóxido (DMSO) al 10 %). El resultado del experimento es el presentado en la figura 3.
La bacteria Gram negativa E. coli fue la que mostró tener una CMI mayor (2500 µg/mL), sugirió, una mayor resistencia de este microorganismo a la acción de los compuestos biológicos activos de AC7. Por el contrario, las bacterias Gram positivas S. aureus y S. epidermidis, fueron un poco más susceptibles, presentaron una CMI de 1250 µg/mL. Paralelo, el ensayo que más llamó la atención fue la microtitulación, realizada con C. Albicans, ya que este microorganismo fue inhibido por la acción de la fracción AC7, tuvo una CMI de 312,5 µg/mL.
DISCUSIÓN
El género Acmella es considerado de gran importancia con respecto a la síntesis de alcamidas alifáticas, las cuales están constituidas por la unión de un ácido graso y una amina proveniente de algún aminoácido.1 Al igual que en esta investigación, los autores Martin y Becker identificaron al espilantol o N-Isobutil-2(E), 6(Z), 8(E)-decatrienamida como la principal alcamida alifática de la especie A. ciliata. Además, fueron reportadas 3 de las alcamidas encontradas en AC7, todas ellas identificadas por contener una cadena saturada, proveniente del ácido decatrienoico. Estas son: N-Isobutil-2(E), 6(Z), 8(E)-decatrienamida (espilantol), N-(2-Metillbutil)-(2E, 6Z, 8E)-decatrienamida y N-(2-Feniletil) (2E, 6Z, 8E)-decatrienamida.6 Un año más tarde, en la publicación “Amides and other constituents from Acmella ciliata” se reporta al igual que en este estudio diferentes amidas como la N-(2-Feniletil)-cis-2,3-epoxynona-6,8-diinoamida y N-(2-Feniletil)non-2(E)-en-6,8-diinonamida.7 Estas amidas son muy fácil de identificarlas, por tener en su estructura el sistema Di-ino, el cual es relacionado con las alcamidas encontradas solo en la familia Asteraceae.8 La composición estructural de la mayoría de amidas halladas, encajan en la descripción dada por Ríos en el 2012, para las alcamidas del género Acmella. Según el autor estos metabolitos consisten de una amina N-isobutil, N-2-metilbutil o N-feniletil y residuos de ácidos grasos de 8 a 12 carbonos.9
En general, los organismos gram-negativos como E. coli son menos susceptibles a la acción de antibacterianos, ya que poseen una membrana exterior que rodea la pared celular y que restringe la difusión de compuestos hidrofóbicos, a través, de su cubierta de lipopolisacáridos.10 Las alcamidas identificadas en la fracción AC7, han sido caracterizadas como antimicrobianos por otros autores,Molina en 1999 evaluó la actividad antimicrobiana de afinina y capsaicina (alcamidas) frente a E. coli, Pseudomonas solanacearum, Bacillus subtilis ySaccharomyces cerevisiae.2 Para E. coli y S. cerevisiae encontró inhibición del crecimiento a concentraciones menores de 25 μg/mL. Otras especies del género Acmella, también cuenta con actividad antimicrobiana,Acmella oleracea conocida como Spilantes acmella, presentó inhibición frente a S. epidermidis, la CMI fue de 125 μg/mL.11
Rani y Murty en 2006 “Antifungal potential of flower head extract of Spilanthes acmella” concluyeron que los extractos etéreos de las flores de S. acmella, poseen una marcada actividad tóxica frente hongos patógenos (Aspergillus niger, Aspergillus paraciticus, Fusarium oxysporium y Fusarium monilifarmis). Se relaciona esta actividad biológica con la presencia de alcamidascomo el espilantol. Al parecer C. albicans (Fig. 3) también, es muy susceptible a estemetabolito apolar que fue determinado, peculiar, en la fracción de AC7.12 Según Boneen, la región insaturada 2E, 6Z, 8Z presente en las alcamidas como el espilantol, juegan un papel muy importante en el efecto antifúngico.8 Esta afirmación, fue respaldada por un estudio que comprobó cómo los análogos saturados del espilantol: pelitorina y fagaramida no presentaban acción inhibitoria.13
El análisis cualitativo llevado a cabo para la fracción AC7 por CGxCG TOF-MS, dejó en evidencia el alto contenido de amidas, específico, alcamidas alifáticas, en su composición. El compuesto N-Isobutil-2(E), 6(Z), 8(E)-decatrienamida, conocido como espilantol, es el metabolito secundario que se encuentra en mayor abundancia. Todas las alcamidas encontradas en esta investigación consisten de aminas N -isobutil, N-2-metilbutil o N-feniletil y residuos de ácidos grasos de 8 a 12 carbonos. La fracción AC7 tiene un gran potencial no solo desde el punto de vista químico, sino también desde el farmacológico. Esta fracción presentó actividad antimicrobiana frente E. coli, S. aureus, S. epidermidis y C. albicans en el ensayo de CMI por el método de microdilución en placa con resazurin. Aunque todas las bacterias y hongos utilizados en el ensayo fueron inhibidos por AC7, fue C. albicans el microorganismo más susceptible a la acción antimicrobiana de la muestra, tiene una CMI de 312,5 µg/mL.
Agradecimientos
A Colciencias y A la universidad del Quindío, por financiar esta investigación en el marco del proyecto JOVENES INVESTIGADORES E INNOVADORES. Al proyecto CZ.2.16/3.1.00/24014 del Fondo Europeo de Desarrollo Regional y al Dr. Jan Razek por realizar los ensayos cromatográficos y su asesoría en el análisis realizados. Al estudiante de doctorado Germán Téllez, por su asesoría en la ejecución de los ensayos de actividad biológica. A los grupos de investigación de inmunología molecular y búsqueda de principios bioactivos.
Apoyo financiero
Los recursos financieros para la realización del presente trabajo fueron otorgados por la Universidad del Quindío, en el marco del proyecto JOVENES INVESTIGADORES E INNOVADORES de COLCIENCIAS y el proyecto CZ.2.16/3.1.00/24014 del Fondo Europeo de Desarrollo Regional.
REFERENCIAS BIBLIOGRÁFICAS
1. Molina J, García A. Alcamidas en plantas: distribución e importancia. Avance y Perspectiva. 2001;20(1):377-87.
2. Molina J, García A, Ramírez E. Antimicrobial properties of alkamides present in flavouring plants traditionally used in Mesoamerica: affinin and capsaicin. J Ethnopharmacol. 1999;64(3):241-8.
2. Nakatani N, Nagashima M. Pungent Alkamides from Spilanthes acmella L. var. oleraceae Clarke. Biosci Biotechnol Biochem. 1992;56(5):759-62.
3. Keipert R. Acmella ciliata (HBK) Cassini. Phytochemische und enzymatische untersuchungen, galenische Präformulierungen. Trabajo de tesis para optar por el título por el título de doctor en ciencias. Universidad Libre de Berlín; 2009.
4. Rincón C, Castaño JC, Ríos E. Actividad biológica de los aceites esenciales de Acmella ciliata (Kunth) Cass. Rev Cubana Plant Med. 2012;17(2):160-71.
5. Rincón C. Estudio fitoquímico preliminar de las flores y hojas de Acmella ciliata (HBK) cass y evaluación de la actividad biológica de los extractos y del aceite esencial. Trabajo de tesis para optar por el título de químico. Universidad Del Quindío; 2010.
6. Martin R, Becker H. Spilanthol-related amides from Acmella ciliata. Phytochemistry. 1984,23(8):1781-3.
7. Martin R, Becker H. Amides and other constituents from Acmella ciliata. Phytochemistry. 1985;24(10):2295-300.
8. Boonen J, Bronselaer A, Nielandt J, Veryser L, De Tre G, De Spiegeleer B, et al. Alkamid database: Chemistry, occurrence and functionality of plant N-alkylamides. J Ethnopharmacol. 2012;142(3):563–90.
9. Ríos MY. Natural Alkamides: Pharmacology, Chemistry and Distribution. 2012 [citado 8 Mar 2013]. Disponible en: http://www.intechopen.com/books/drug-discovery-research-in-pharmacognosy/natural-alkamides-pharmacology-chemistry-and-distribution
10. Burt S. Essential oils: their antibacterial properties and potential applications in foods: a review. Int J Food Microbiol. 2004;94(3):223–53.
11. Prachayasittikul S, Suphapong S, Worachartcheewan A, Lawung R, Ruchirawat S, Prachayasittikul V, et al. Bioactive Metabolites from Spilanthes acmella Murr. Molecules. 2009;14(2):850-67.
12. Rani SA, Murty SU. Antifungal potential of flower head extract of Spilanthes acmella. Afr J Biomed Res. 2006;9(1):67-9.
13. Jang KH, Chang YH, Kim D-D, Oh K-B, Oh U, Shin J, et-al. New polyunsaturated fatty acid amides isolated from the seeds of Zanthoxylum piperitum. Arch Pharm Res. 2008;31(5):569-72.
Recibido: 15 de agosto de 2014.
Aprobado: 27 de julio de 2015.
Carlos Andrés Rincón Mejía . Grupo de Inmunología Molecular. Universidad del Quindío. Armenia, Colombia.
Correos electrónico: crinconm@fh-koeln.de, carlosandres0415@gmail.com