Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.21 n.1 Ciudad de la Habana ene.-abr. 2010
ARTÍCULO ORIGINAL
Criterios de referencia para los indicadores de secreción de insulina y de los parámetros lipídicos en una población mixta hospitalaria
Reference criteria for insulin secretion indicators and of the lipid parameters in a hospital mixed population
Celeste Arranz CalzadoI; Roberto M. González SuárezII; Aimeé Álvarez ÁlvarezI; Bertha Rodríguez PendásI; Arturo Reyes DuránIII
IMáster en Ciencias Bioquímicas. Investigador Auxiliar. Instituto Nacional de Endocrinología (INEN). Ciudad de La Habana, Cuba.
IIDoctor en Ciencias Médicas. Investigador Titular. INEN. Ciudad de La Habana, Cuba.
IIILicenciado en Bioquímica. INEN. Ciudad de La Habana, Cuba.
RESUMEN
INTRODUCCIÓN: la utilidad clínica de numerosos indicadores para el diagnóstico de la sensibilidad y la resistencia a la insulina es estudiada y aplicada frecuentemente con los mismos criterios de interpretación diagnóstica que fueron propuestos por sus autores. Las diferencias entre las características particulares de las distintas poblaciones y de la metodología empleada para la determinación de la glicemia y la insulinemia sobre el valor del punto de corte usado para el diagnóstico, requiere el uso de criterios diagnósticos representativos de esa población. Es difícil establecer criterios particulares porque la complejidad y el costo de la metodología directa convencional que usa poblaciones de referencia, es inaccesible en general a los laboratorios individuales. Existe una alternativa más simple, el método indirecto de estimación de rangos de referencia, basado en segregar poblaciones mixtas hospitalarias en sus componentes gausseanos, que pudiera ser el más adecuado para obtener criterios diagnósticos no sesgados.
OBJETIVOS: calcular los límites de referencia de los principales indicadores para el diagnóstico de la resistencia a la insulina y la validez de los resultados obtenidos con este método.
MÉTODOS: se estudiaron los parámetros estadísticos y los valores de referencia de 8 indicadores de secreción de la insulina, 3 indicadores de resistencia y 5 indicadores de sensibilidad a la insulina, derivados de la relación entre la glicemia y la insulinemia en ayunas, a partir de 1 000 muestras sucesivas de la población mixta hospitalaria que se atiende en el Instituto Nacional de Endocrinología. Se aplicó esta metodología a otros parámetros que también tienen una distribución asimétrica en la población, como la insulina y los lípidos séricos (colesterol y triglicéridos) y que cuentan con valores de referencia de aceptación universal, usados como control interno para evaluar si el método empleado brinda resultados no sesgados. Se aplicó el programa de la FAO, Fish Stock Assessment Tools (FISAT), para separar los valores de toda la población en sus componentes gausseanos y estimar los parámetros estadísticos del componente constituido por la población sana. Se compararon los resultados obtenidos por esta metodología con los valores de corte en uso en la institución.
RESULTADOS: la metodología empleada permitió determinar los parámetros estadísticos del componente "normal" de la población mixta estudiada y proporcionó rangos de referencia para la glicemia (3,22-6,10 mmol/L), insulinemia (32-68 pmol/L), colesterol (2,2-5,28 mmol/L) y triglicéridos (0,65-1,97 mmol/L), similares a los aceptados generalmente, lo que se interpretó como un criterio de validez del método. Los resultados obtenidos en los indicadores de sensibilidad o resistencia a la insulina brindaron en general una sensibilidad diagnóstica mayor, con una menor especificidad.
CONCLUSIONES: se concluyó que el uso de muestras mixtas hospitalarias y de la metodología descrita permite obtener, de una manera simple y confiable, rangos de referencia representativos de las condiciones locales.
Palabras clave: muestra mixta, componentes gausseanos, programa FISAT, indicadores, resistencia y sensibilidad a la insulina.
ABSTRACT
INTRODUCTION: the clinic usefulness of many indicators for the diagnosis of insulin-sensitivity and resistance is studied and frequently applied using the same criteria of diagnostic interpretation proposed by authors. The differences among the particular features of the different populations and the methodology used for determination of glycemia and the insulinemia over the cut point used for diagnosis require the use of diagnostic criteria representative of that population. It is difficult to establish particular criteria because of the complexity and the cost of the conventional direct methodology using reference populations is inaccessible in general to individual laboratories. There is a simpler alternative, the estimation indirect method of reference ranks, based on segregation of hospital mixed populations in its gaussean components that could be more appropriate to obtain non-biased diagnostic criteria.
OBJECTIVE: to estimate the reference limits of main indicators for insulin-resistance and the validity of results obtained using this method.
METHODS: authors studied the statistic parameters and reference values of 8 indicators of insulin secretion, 3 indicators of resistance and 5 indicators of insulin-sensitivity, derived from relation between fasting glycemia and insulinemia from 1 000 consecutive samples of hospital mixed population seen in National Institute of Endocrinology. We applied this methodology to other parameters with an asymmetric distribution in population; by example, insulin and serum lipids (cholesterol and triglycerides) having reference values of universal acceptation used as an internal control to assess if the method applied offers non-biased results. We applied the FAO program called Fish Stock Assessment Tools (FISAT) to separate the value of population in its Gaussean components and to estimate the statistic parameters of component created by health population. We compared the results obtained using this methodology with cut value used in by this institution.
RESULTS: the methodology used allowed us to determine the statistic parameters or "normal" component of study mixed population and provides reference ranks for glycemia (3,22-6,10 mmol/L), insulinemia (32-68 pmol/L), cholesterol (2,2-5,28 mmol/L) and triglycerides (0,65-1,97 mmol/L) similar to those generally accepted considered as a criterion of method validity. Results obtained in the insulin sensitivity and resistance indicators gave us a greater diagnostic sensitivity with a lower specificity.
CONCLUSIONS: we concluded that the use of hospital mixed samples and of methodology described allows obtaining in a reliable and simple way reference ranks representative of the local conditions.
Key words: mixed sample, gaussean components, FISAT program, indicators, insulin resistance and sensitivity.
INTRODUCCIÓN
La importancia y alta prevalencia del síndrome de resistencia a la Insulina (SRI) ha planteado la necesidad de emplear métodos simples y analíticamente válidos para la detección en gran escala de sujetos con este síndrome y que se encuentran en riesgo de padecer entidades clínicas tan importantes y de gran prevalencia como la diabetes mellitus, la hipertensión arterial, la cardiopatía isquémica, entre otras.1 Los actuales métodos de referencia para la detección de los trastornos de la sensibilidad a la insulina y de la resistencia a la insulina, por su complejidad y costo, solo son empleados como instrumentos de investigación clínica experimental y no como medios diagnósticos para la asistencia y la investigación clínica y epidemiológica. Hoy día se explora la utilidad diagnóstica de numerosos indicadores alternativos de la resistencia a la insulina, pero en general se usan los mismos criterios de interpretación diagnóstica que fueron propuestos por sus autores, sin tener en cuenta las diferencias entre las características particulares de las distintas poblaciones y de la metodología empleada para la determinación de la glicemia y la insulinemia.2-4 Esto plantea la necesidad de contar con criterios de interpretación ajustados a las características de las poblaciones en las que se aplican los métodos diagnósticos y las particularidades analíticas de los métodos de uso local.
La calidad y la utilidad de los valores de referencia calculados en una población particular dependen, en gran medida, de la metodología empleada para seleccionar la población de referencia y para determinar los valores de los analitos en cada muestra.5 Para calcular los límites del rango de referencia por el método directo convencional con el uso de poblaciones supuestamente sanas, representativas de la población total, los requisitos de estratificación y aleatoriedad obligan a examinar un gran número de sujetos, establecer los parámetros que aseguran su pertenencia a esa población e incorporar un gran número de muestras con criterios de selección muy estrictos.6 En la actualidad existen diversas normas metodológicas sobre este particular, emitidas por asociaciones profesionales o gubernamentales, así como por agencias internacionales,7,8 lo cual ilustra de modo claro lo difícil y costoso que resulta la obtención de valores de referencia metodológicamente válidos. Esta compleja y costosa metodología solo ha podido ser abordada en los países desarrollados en programas multicéntricos con un alto nivel de financiamiento y los resultados representan sin más las condiciones de las poblaciones de origen. No obstante, estos valores han sido oficializados por las agencias internacionales y han sido adoptados por los productores de medios diagnósticos, con lo que han adquirido vigencia internacional, a pesar de que de modo estricto solo son aplicables a las poblaciones en las que fueron realizadas. Ante esta situación se han buscado soluciones simples y más accesibles para lograr una aproximación válida a este problema, como es el uso de métodos indirectos aplicados a muestras mixtas que incluyan personas sanas y enfermas para el cálculo de valores de referencia.9 Estos métodos se basan en el hecho de que los resultados de una determinación analítica en un laboratorio asistencial en su mayoría se encuentran dentro de límites normales, por lo que el total de resultados que se obtiene en un laboratorio clínico particular incluye un grupo mayoritario con valores normales y uno o varios grupos con valores patológicos. Los valores de referencia para ese laboratorio pueden extraerse de esa población mixta, con el empleo de un método estadístico adecuado que permita calcular los parámetros de la distribución de los valores del grupo normal.
Este problema se abordó inicialmente con procedimientos gráficos,9 que trataban de reconstruir el componente mayoritario a partir del histograma de la población total. Más adelante se propuso la solución numérica de Bhattacharya,10 que todavía se mantiene vigente y permite descomponer una población mixta en sus componentes gausseanos y estimar el número de sujetos, la media y la desviación estándar de cada subpoblación. Esta metodología ha sido empleada mucho para este fin11-14 y hoy día se puede encontrar como parte de programas de computación empleados en bioquímica clínica y para usos industriales, desarrollados originalmente para otros usos, como el programa FISAT,15 distribuido por la FAO para caracterizar las distintas camadas de peces a partir de los datos de las capturas realizadas en una región. Este método indirecto para extraer la población de referencia tendría la ventaja adicional de ser representativa de la población que recibe los servicios en el laboratorio que lo realiza y de los métodos analíticos empleados.
En un estudio reciente concluido por el doctor Roberto González y otros (Comunicación personal), en el cual realizó una estimación de rangos de referencia para las determinaciones bioquímicas con una distribución no gausseana en la población general, encontró que este método indirecto puede ser el más adecuado para obtener criterios diagnósticos no sesgados, en los parámetros de bioquímica clínica con una distribución asimétrica, porque la asimetría de la distribución de los valores de algunos parámetros de bioquímica clínica en las poblaciones de referencia se deben a la contaminación con individuos con trastornos subclínicos no detectados en el proceso de selección, de ahí que cualquier población de referencia obtenida en la población general puede ser concebida como una población mixta, en la medida en que en el proceso de su selección no se detecten los individuos con alteraciones metabólicas en sus períodos iniciales.
En este estudio se pretende calcular criterios no sesgados para la interpretación diagnóstica de los valores de los principales indicadores de la sensibilidad a la insulina y de la resistencia a la insulina calculados con muestras en ayunas a partir de los valores del componente normal de una población mixta hospitalaria, para contar con criterios provisionales para su extensión en nuestra institución. Estos valores serán comparados con los criterios establecidos previamente por nuestro grupo con los métodos convencionales en poblaciones de referencia,16 y con criterios derivados de estudios del valor predictivo de la progresión hacia la diabetes en estudios evolutivos de grupos de riesgo. También se compararán los valores obtenidos con este método de las determinaciones de glicemia, insulina y del colesterol y triglicéridos en ayunas, parámetros que cuentan con criterios diagnósticos aceptados universalmente, como control interno de la validez del procedimiento empleado.
Los objetivos de este trabajo son:
1. Establecer criterios de interpretación diagnóstica para las determinaciones de indicadores de la secreción a la insulina en ayunas y de los lípidos séricos (colesterol, triglicéridos), a partir de los resultados de una muestra hospitalaria mixta.
2. Determinar si la metodología propuesta para establecer criterios de interpretación diagnóstica, a partir de los resultados de una muestra mixta hospitalaria por medio de la segregación de sus resultados en sus componentes gausseanos, brinda resultados coherentes con los obtenidos en la metodología convencional.
MÉTODOS
Base de datos
Se recopiló la información de 1 000 muestras sucesivas en las cuales se determinó alguno de estos parámetros bioquímicos entre 2003 y 2006, disponible actualmente en los registros de los laboratorios de Diabetes y de Bioquímica Clínica del INEN. Se obtuvieron los resultados de las determinaciones en ayunas de colesterol, triglicéridos, glicemia, insulinemia, realizados con los métodos en uso en el INEN.17-19 En las muestras con resultados de glicemia e insulinemia se calcularon de acuerdo con la fórmula descrita en el trabajo original referido los indicadores siguientes:
— Indicadores de resistencia a la insulina (los valores superiores indican menor sensibilidad a la insulina):
• Índice de resistencia a la insulina del modelo HOMA.20
• [(RI HOMA)= (I0 x G0)/22,5].
• Relación insulina /glucosa en ayunas21 (I0/G0).
• Índice FIRI (fasting insulin sensitivity index).22
• (FIRI)= [(I0 x G0)/25].
— Indicadores de sensibilidad a la insulina (los valores superiores indican mayor sensibilidad a la insulina):
• Índice de Belfiore para muestras en ayunas23
• (BEL0)= [2/[(I0/I0n xG0/G0n) -1]].
• Índice ISI (insulin sensitivity index) en ayunas.24
• (ISI0)= [10 000/(I0 x G0)].
• Índice de Raynaud25 (RAY)= [40/I0].
• Índice de Bennett4 (BEN)= 1/(log I0 x log G0).
• Índice QUICKI (quantitative insulin sensitivity check index).26
• (QUICKI)= [1/[log I0 + log G0].
Procesamiento de los datos
Se aplicó el método de segregación de la población en sus componentes gausseanos y se estableció el rango comprendido entre la media ± 2 desviaciones estándar con los valores estimados con el programa FISAT.15 Los rangos resultantes se compararon con los calculados previamente en la institución.
RESULTADOS
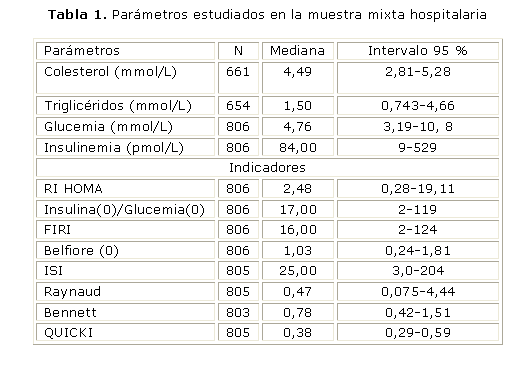
En la tabla 1 se muestra un resumen de los datos iniciales empleados al recopilar todos los resultados de la muestra mixta hospitalaria con que se trabajó en el período comprendido entre 2003 y 2006. La muestra para el colesterol y los triglicéridos fue un poco más de 600 y se calculó la mediana y el intervalo de confianza para 95 %. En el caso de la insulina y las glucemias, la N fue mayor que 800, con la cual se calcularon los índices tanto de insulinorresistencia como de sensibilidad; también se calcularon la mediana y el intervalo de confianza en cada uno de ellos.
En la tabla 2 se muestran las características de los 2 primeros componentes obtenidos con el análisis de Bhattacharya. En todos los casos se identificaron al menos 2 poblaciones, pero en algunos se encontraron 3 y hasta 4 componentes, que no se presentan porque no tienen relevancia para el análisis posterior. Se interpretó que el primer componente representa la población normal en los parámetros bioquímicos iniciales y en los 3 primeros indicadores que son los de resistencia a la insulina y el segundo componente se corresponde con la población normal en los 5 indicadores de sensibilidad a la insulina. El programa también proporciona un indicador de separación (IS= diferencia de las medias/diferencia las desviaciones estándar) que es un estimado de la distancia entre 2 componentes sucesivos y que se asocia a la calidad del proceso de identificación de las poblaciones. Se estima que los índices de separación menores que 2 pueden tener mayor error en la identificación entre las 2 poblaciones y por encima de este valor hay una mayor confiabilidad en el resultado de estas.
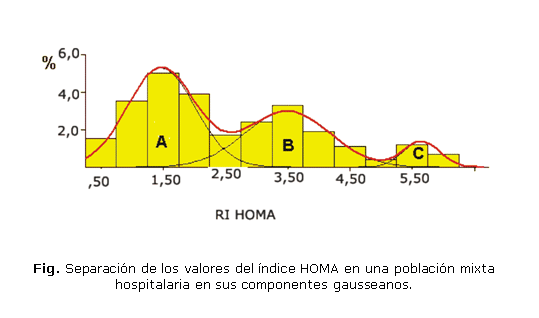
Un ejemplo representativo de este método se ilustra en la figura. Se observan 3 componentes; el componente A mayoritario para el índice de resistencia HOMA, que coincide con la población normal, el componente B y el componente C, para poblaciones patológicas o con mayor riesgo de agrupar individuos con trastornos subclínicos. O sea, que el primer componente es capaz de identificar aquella población con menor riesgo y con índice HOMA menor, por tanto muestra una mayor sensibilidad del método para identificar población realmente sana.
En la tabla 3 se muestran los rangos de referencia calculados a partir de la población identificada por el programa FISAT, en comparación con los rangos o criterio diagnóstico aceptados en la actualidad. Existe una alta correspondencia entre el punto de corte de estos parámetros, salvo en la insulina en el que aparentemente se eliminaron los valores de la parte de la población con hiperinsulinismo, como los obesos, al seleccionar una población simétrica como fuente de los parámetros de referencia. Esto hace que los valores altos de insulina de los individuos con trastornos que ocasionen a una insulinemia elevada quedarían en la llamada "cola" de esta distribución, por lo que son segregados y fuera del rango de normalidad.
En la tabla 4 se presentan la comparación de los puntos de corte calculados para los distintos indicadores de sensibilidad y resistencia a la insulina calculados utilizando la población mixta con los de uso general, reportados por la literatura. Como era de esperar los valores de los indicadores de resistencia son menores, especialmente los del índice RI HOMA. En 6 de los 8 indicadores estudiados, los nuevos valores tuvieron una mayor sensibilidad y una disminución de la especificidad en el pronóstico de la progresión hacia la diabetes a corto plazo en una población de alto riesgo. Ocurrió lo contrario con los indicadores de Raynaud y en QUICKI, para lo cual no tenemos una explicación, pero se conoce que todos los índices no miden lo mismo ni se comportan; por ello se trata de calcular varios para ver la tendencia que sigue la mayoría. En el presente caso 75 % de los índices ofreció una mayor sensibilidad como indicador de riesgo.
DISCUSIÓN
La resistencia a la insulina es un criterio patogénico vigente y en expansión pero su incorporación en gran escala a la clínica está limitada por la ausencia de métodos analíticos simples y de aceptación general para determinar la sensibilidad a la insulina.1,27
El método de separación de la población mixta en sus componentes gausseanos asume que, los parámetros que se estudian siguen una distribución normal, pero en este estudio, cuando ese método se aplicó al cálculo de los criterios de referencia para las determinaciones de colesterol y triglicéridos, parámetros que se conoce siguen una distribución asimétrica en la población, se encontraron puntos de corte casi idénticos a los aceptados universalmente para este fin. El programa FISAT advierte que cuando la separación entre los componentes gausseanos es menor que 2, la eficiencia del método no es la mejor,15 en el presente análisis y una comunicación personal del doctor Roberto González sobre un estudio que ha concluido recientemente, también encontró un mayor margen de error en la estimación del punto de corte con el uso de poblaciones virtuales híbridas, con un componente patológico en los casos con una menor separación entre los componentes. No obstante, en este estudio los parámetros con indicador de separación menor que 2, colesterol y triglicéridos, tuvieron resultados aceptables que reprodujeron los criterios diagnósticos aceptados generalmente.
Es conocido que la insulina, y en consecuencia los indicadores derivados de este parámetro, siguen una distribución asimétrica ajustable a una distribución lognormal.16,28,29 Este hecho puede explicar que en general los resultados del presente trabajo brindan valores distintos a los reportados por los autores y en poblaciones supuestamente sanas estudiadas antes por nuestro grupo, porque excluye del análisis los valores superiores localizados en la "cola" que caracteriza las distribuciones asimétricas.16,28,29 No obstante este análisis se justifica si se tiene en cuenta que la resistencia a la insulina y toda la constelación de trastornos metabólicos que la acompañan son durante gran parte de su evolución, trastornos subclínicos que pueden estar presentes en las poblaciones "supuestamente sanas", que en general se emplean para establecer valores de referencia. En un estudio de nuestro grupo en una población en la que se estudiaron de modo exhaustivo y se excluyeron los trastornos clínicos y metabólicos asociados con el síndrome metabólico, menos de 10 % de los sujetos tenían valores del índice RI HOMA superiores a 2,6.30 Es posible que los criterios de referencia estimados con este método, además de sus evidentes ventajas prácticas, brinden una metodología no sesgada que permita identificar y utilizar los sujetos que en verdad están libres de trastornos subclínicos y con ellos establecer valores de referencia de alta sensibilidad, que permitan la detección de los trastornos metabólicos subclínicos en sus etapas más precoces.31,32
Se concluye que con el método indirecto de estimación de rangos de referencia, basados en segregar poblaciones mixtas hospitalarias en sus componentes gausseanos, fue posible obtener de una manera simple y confiable rangos representativos de las condiciones locales, tanto para indicadores de secreción de insulina como para la glucemia y los parámetros lipídicos, comparables con los obtenidos por la metodología convencional y reportados por la OMS. Se recomienda que la aplicación de estos resultados en la práctica clínica, asistencial y en la investigación, deben ser confirmados y validados en estudios clínicos prospectivos.
REFERENCIAS BIBLIOGRÁFICAS
1. Zimmet P, Alberti G. The metabolic syndrome: progress towards one definition for an epidemic of our time Nature clinical practice. Endocrinol Metabolism. 2008;4:239.
2. Abdul-ghani M, Matsuda M, Balas B, Defronzo RA. Muscle and liver insulin resistance indexes derived from the oral glucose tolerance tes. Diabetes Care. 2007;30:89-94.
3. Hanson RL, Pratley RE, Bogardus C, Narayan KM, Roumain JM, Imperatore G, et al. Evaluation of simple indices of insulin sensitivity and insulin secretion for use in epidemiologic studies. Am J Epidemiol. 2000;151:190-98.
4. Trout K, Tkacs CH. Methods of measuring insulin sensitivity. Biol Res Nurs. 2007;8:305.
5. Solberg HE. Establishment and use of reference values. In: Burtis CA, Ashwood T, editors. Textbook of Clinical Chemistry, 3th ed. Chap 14. London: WB Saunders Company; 1999.
6. Henny J, Petitclerc C, Fuentes-Arderiu X, Petersen PH, Queralto JM, Schiele F, et al. Need for revisiting the concept of reference values. Clin Chem Lab Med. 2000;38:589-95.
7. International Federation of Clinical Chemistry. Approved recommendation on the theory of reference values. Part 5. Statistical treatment of collected reference values. Determination of reference limits. J Clin Chem Clin Biochem. 1987;25:645-56.
8. Guerci AA. Métodos de análisis clínicos y su interpretación. 4ta ed. Argentina: Ed. Ateneo; 2000.
9. Thielmann K. Rangos normales y patológicos. En: Manual de Metodología de Bioquímica Clínica. Cap. 8. La Habana: Editorial Instituto Cubano del Libro; 1972.
10. Bhattacharya A. A simple method of resolution of a distribution into Gaussian components. Biometrics. 1967;23:115-35.
11. Oosterhuis WP, Modderman TA, Pronk C. Reference values: Bhattacharya or the method proposed by the IFCC? Ann Clin Biochem. 1990;27:59-65.
12. Ferre-Masferrer M, Fuentes-Arderiu X, Puchal-Ane R. Indirect reference limits estimated from patients results by three mathematical procedures. Clin Chim Acta. 1999;279:97-105.
13. Grossi E, Colombo R, Cavuto S, Franzini C. The REALAB project: a new method for the formulation of reference intervals based on current data. Clin Chem. 2005;51:1232-40.
14. Ilcol YO, Aslan D. Use of total patient data for indirect estimation of reference intervals for 40 clinical chemical analytes in Turkey. Clin Chem Lab Med. 2006;44:867-76.
15. Gayanilo FC, Sparre P, Pauly D. FISAT II: FAO-ICLARM Stock Assessment Tool. Roma: Food and Agriculture Organization of the United Nations; 2002.
16. González R, Arranz C. Evaluación de la secreción de insulina y la sensibilidad a la insulina por medio de la prueba de tolerancia a la glucosa por vía oral. Estudio en sujetos con tolerancia a la glucosa normal. Rev Cubana Endocrinol. 2000;11:23-30.
17. Schettler G, Nüssel E. Cholesterol CHOP-PAP. Arb Med Loz Med Präv Med. 1975;10:25.
18. Barham D and Trinder P. Glucosa GOD-PAP. Analyst. 1972;97:142-5.
19. Arranz C, González R. Utilización de un método para la separación de la hormona libre y unida en el radioinmunoensayo de insulina. Rev Cubana Invest Biomed. 1988;7:150-6.
20. Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetología. 1985;28:412-19.
21. Guerrero-Romero F, Rodríguez-Moran M. Glucose intolerance is predicted by the high fasting insulin-to-glucose ratio. Diabete Metab. 2001;27:117-21.
22. Duncan MH, Singh BM, Wise PH, Carter G, Alaghband-Zadeh J. A simple measure of insulin resistance. Lancet.1995;346:120-1.
23. Belfiore F, Iannello S, Volpicelli G. Insulin sensitivity indices calculated from basal and OGTT-induced insulin, glucose, and FFA levels. Mol Genet Metab. 1998;63:134-41.
24. Gutt M, Davis CL, Spitzer SB, Llabre MM, Kumar M, Czarnecki EM, et al. Validation of the insulin sensitivity index (ISI0,120): comparison with other measures. Diabetes Res Clin Pract. 2000;47:177-84.
25. Raynaud E, Perez-Martin A, Brun JF, Benhaddad AA, Mercier J. Revised concept for the estimation of insulin sensitivity from a single sample.Diabetes Care. 1999;22:1003-4.
26. Katz A, Nambi SS, Mather K, Baron AD, Follmann DA, Sullivan G, et al. Quantitative insulin sensitivity check index: a simple, accurate method for assessing insulin sensitivity in humans. J Clin Endocrinol Metab. 2000;85:2402-10.
27. Boyko EJ, Jensen CC. Do we know what homeostasis model assessment measures if not, does it matter? Diabetes Care. 2007;30:2725-7.
28. Perich P, González R, Valdés E, Arranz C. Desarrollo de diabetes mellitus en pacientes con tolerancia a la glucosa alterada. Seguimiento de 18 años. Rev Cubana Endocrinol. 2002;13:101-9.
29. González R, Perich P, Arranz C. Heterogeneidad de los trastornos metabólicos de las etapas iniciales de la diabetes mellitus 2. Rev Cubana Endocrinol [serie en Internet]. 2009 Abr [citado 26 Ago 2009];20(1): Disponible en:
http://scielo.sld.cu/scielo.php?pid=S1561-29532009000100003&script=sci_arttext
30. Arranz C, Álvarez A, Perich P, González R. Relación de la sensibilidad a la insulina determinada con diferentes índices con el síndrome metabólico en hombres con glicemia en ayunas normal. Rev. Asociación Latinoam Diabetes. 2007;15:120.
31. Twigg SM, Kamp MC, Davis TM, Neylon EK, Flack JR. Prediabetes: a position statement from the Australian Diabetes Society and Australian Diabetes Educators Association. MJA. 2007;186:461-5.
32. Absetz P, Oldenburg B, Hankonen N, Valve R, Heinonen H, Nissinen A, et al. Type 2 diabetes prevention in the real world: Three-year results of the GOAL Lifestyle Implementation Trial. Diabetes Care. 2009;32:1418-20.
Recibido: 24 de noviembre de 2009.
Aprobado: 15 de enero de 2010.
MSc. Celeste Arranz. Instituto Nacional de Endocrinología. Calle 17 No. 510 esq. D, Vedado, municipio Plaza, Ciudad de La Habana, Cuba. Correo electrónico: celeste@infomed.sld.cu; celeste@inend.sld.cu