Introducción
El embarazo es un periodo de la vida en el que se producen cambios importantes en la fisiología tiroidea. Hasta alrededor de las 20 semanas de gestación, el tiroides fetal no produce cantidades suficientes de T4, por lo tanto, durante la primera mitad del embarazo, el desarrollo del feto depende del aporte de hormonas tiroideas de la madre.1
En la embarazada se producen varios cambios fisiológicos que provocan ajustes en el eje tiroideo. En primer lugar, la producción de gonadotropina coriónica humana (en inglés, hCG), hormona que tiene homología estructural con la TSH y una acción agonista en su receptor.2 Al final del primer trimestre se produce el pico de hCG, que provoca un aumento en la producción de hormonas tiroideas e incluye la elevación transitoria, sobre todo, de T4 y la subsecuente disminución de los valores de TSH.2,3 Al disminuir la hCG con el avance del embarazo, los niveles de tirotropina tienden a elevarse nuevamente, pero no llegan a alcanzar el valor de las mujeres no embarazadas.3,4
En la gestación se evidencia, además, un incremento en la producción de la globulina transportadora de tiroxina (del inglés, TBG) debido al efecto de los estrógenos, lo que provoca que las concentraciones de esta proteína alcancen de dos a tres veces los valores pre-gestacionales entre las semanas 16-20.5 El aumento en la TBG induce una elevación de los niveles de hormonas tiroideas totales de alrededor de 1,5 veces hacia la semana 16 del embarazo.6
A todos estos cambios se suma el aumento en los requerimientos de yodo en la madre durante esta etapa de la vida, por el mayor aclaramiento renal de este mineral, el aporte al feto y la mayor actividad de la desyodasa placentaria.3,6
Un tiroides sano se adapta a las modificaciones mencionadas mediante cambios en la captación de yodo, el metabolismo de las hormonas tiroideas y en la regulación del eje hipotálamo-hipófisis-tiroides.3 Esto conduce a que los parámetros de función tiroidea en las embarazadas sean diferentes a los de la población general.1
Existen varios factores que influyen en los parámetros de función tiroidea entre distintas poblaciones de gestantes. Dentro de ellos se encuentran la edad gestacional, el embarazo único o múltiple, el color de la piel, el hábito de fumar, el índice de masa corporal, el estado nutricional del yodo, la presencia de anticuerpos antitiroideos, el momento de la toma de muestra de sangre, los métodos empleados en las determinaciones hormonales y los valores de referencia.6,7 Los factores de riesgo para la disfunción tiroidea en la gestación incluyen además, la edad materna, los antecedentes familiares de enfermedad tiroidea, la multiparidad y la presencia de bocio, entre otros.6
La edad gestacional puede influir en los niveles de TSH, sobre todo durante el primer trimestre, por las modificaciones fisiológicas en las concentraciones de hCG y hormonas tiroideas, explicadas anteriormente.7
En las mujeres con embarazos múltiples, los niveles séricos de hCG son mayores y los de tirotropina más bajos.7Dashe y otros8 compararon las concentraciones de TSH durante el primer trimestre en 132 mujeres con embarazo gemelar y resultaron inferiores a las de las 13,599 embarazadas con feto único, utilizadas como controles.
La localización geográfica y el color de la piel también pueden influir sobre los parámetros de función tiroidea.9,10 Se ha descrito que la TSH en las mujeres de piel negra puede ser menor que en las de piel blanca. Esto fue reportado por Walker y otros9 en un estudio norteamericano que encontró niveles inferiores de TSH en las mujeres afroamericanas.
En cuanto al hábito de fumar, se han publicado trabajos que muestran diversos efectos sobre la función tiroidea en las embarazadas; tanto el aumento en las concentraciones de TSH, como su disminución.11,12,13 Otros autores plantean que los efectos del tabaco sobre las concentraciones de TSH durante el embarazo son limitados.13
En algunos estudios también se ha reportado una asociación entre el IMC y los niveles de TSH.14,15 En este sentido, Laurberg y otros16) advirtieron que el percentil 97,5 para la tirotropina fue mayor en mujeres obesas, que en no obesas.
El estado nutricional del yodo es otro factor relevante para la tirotropina, al ser este mineral, el sustrato para la síntesis de hormonas tiroideas. La deficiencia de yodo, principalmente en su forma severa, se asocia a un aumento de la TSH.3,17,18
Los marcadores de autoinmunidad, fundamentalmente los AcTPO, se consideran el factor de riesgo más importante para la disfunción de la glándula tiroidea durante el embarazo en los países desarrollados.19 Existen evidencias sobre la presencia de mayores niveles de TSH en las mujeres con títulos elevados de anticuerpos contra la TPO y la tiroglobulina (Tg).20
Por su parte, el momento de la toma de muestra de sangre también resulta importante, pues la TSH mantiene su ritmo circadiano durante el embarazo, con niveles bajos en la tarde y un pico entre las 10 pm y las 2 am.21 En cuanto a los métodos para realizar las determinaciones hormonales, los valores de tirotropina varían discretamente, sin que esto tenga significación clínica.22
El estudio de los factores asociados con la tirotropina en el embarazo permite una mejor interpretación de los parámetros de la función tiroidea y sería útil para identificar las mujeres con posibilidades de desarrollar una disfunción tiroidea en este período de la vida. Por ello se realizó el presente trabajo, con el objetivo de identificar los factores clínicos y bioquímicos asociados a la tirotropina en embarazadas aparentemente sanas.
Métodos
Se realizó un estudio observacional, descriptivo y transversal, con 247 mujeres embarazadas aparentemente sanas de los policlínicos Vedado, Moncada y 19 de abril del municipio Plaza de la Revolución, en el periodo comprendido desde septiembre de 2015 hasta enero de 2019. Se excluyeron las mujeres con embarazo gemelar.
Previo consentimiento informado por escrito, se entrevistaron las embarazadas y recogieron las variables siguientes: edad, edad gestacional, paridad, color de la piel, hábito de fumar, antecedentes familiares de enfermedad tiroidea, consumo de suplementos yodados y peso en la captación del embarazo (obtenido del carnet de embarazada). Se realizó el examen físico de la gestante para identificar la presencia de bocio y se midió la talla para calcular el índice de masa corporal inicial. Se tomó además, una muestra de orina para yoduria y de sangre para determinar TSH, T3 y T4 totales y libres, AcTPO, AcTg y hCG.
Técnicas y procedimientos
La talla se midió en un tallímetro vertical apto para el uso, con la embarazada en posición erecta (sin calzado), vista al frente, los miembros superiores a ambos lados del cuerpo, las palmas y dedos de las manos rectos y extendidos hacia abajo, mirando hacia el frente, con el peso distribuido equitativamente en ambos pies.23 La presencia de bocio se consideró cuando al examen físico, la gestante presentaba un tiroides palpable o visible con el cuello en posición normal.24
Métodos de laboratorio
Las determinaciones hormonales y de anticuerpos se realizaron mediante los kits diagnósticos proporcionados por Centro Nacional de Isótopos y producidos por la compañía húngara IZOTOP. Las concentraciones séricas de TSH y Tg se determinaron por inmunoradiometría (IRMA) y las determinaciones de T4 y T3 totales y libres, AcTPO y AcTg se realizaron mediante radioinmunoanálisis. La hCG se determinó mediante inmunoensayo para electro-quimioluminiscencia (Elecsys; Roche Diagnostics International, Rotkreuz, Suiza).
La sensibilidad funcional fue la siguiente: 0,07 mUI/L para la TSH, 7 nmol/L para la T4 total, 0,7 pmol/L para la T4 libre, 0,37 nmol/L para la T3 total, 0,58 pmol/L para la T3 libre, 0,6 mUI/L para la hCG, 10 UI/mL para los AcTPO y 13 UI/mL para los AcTg. Los rangos de referencia de los fabricantes fueron: 0,3-4,00 mUI/L para la TSH, 55-170 nmol/L para la T4 total, 10-22 pmol/L para la T4 libre, 1,25-,03 nmol/L para la T3 total, 1,9-5,7 pmol/L para la T3 libre y ≤1mUI/mL para la hCG. Los AcTPO se consideraron positivos con niveles mayores que 25 UI/mL y los AcTg con niveles superiores a 100 UI/mL.
Para la determinación espectrofotométrica de yodo en orina, se utilizó el método cinético en microplaca.25
Análisis estadístico
Se determinaron distribuciones de frecuencias de las variables cualitativas, y media y desviación estándar, o mediana y rango de las cuantitativas según correspondió. Se compararon los valores promedio de la tirotropina según trimestre del embarazo y color de la piel, utilizando un análisis de varianza de una vía (ONEWAY).
Se utilizó la prueba Chi cuadrado para comparar las medias de TSH según paridad (categorizada en nulípara y multípara), presencia (o no) de hábito de fumar, antecedentes familiares de enfermedad tiroidea, consumo de suplementos yodados y de bocio. Se determinó la asociación de los valores de tirotropina con las variables cuantitativas: edad materna, edad gestacional, IMC inicial, hormonas tiroideas, anticuerpos antitiroideos, yoduria y hCG, mediante el coeficiente de correlación de Pearson. En todos los análisis se consideró el valor de 0,05 como nivel de significación estadística.
Consideraciones éticas
Las embarazadas participaron de manera voluntaria previo consentimiento por escrito. Los resultados se utilizaron solo con fines científicos y se mantuvo la confidencialidad de los datos. Este proyecto obtuvo la aprobación del Comité de Ética de las Investigación del Instituto de Endocrinología.
Resultados
La media de edad fue de 28,41 ± 4,81 años y el promedio del índice de masa corporal al inicio del embarazo fue de 24,54 ± 4,67 kg/m2. Al analizar el resto de las características clínicas se observa que predominaron las mujeres de piel blanca (57,89 %), nulíparas (59,92 %), sin antecedentes patológicos familiares de enfermedad tiroidea (72,87 %) ni hábito de fumar (92,71 %), que no consumían suplementos vitamínicos yodados (87,85 %) y que al examen físico no presentaban bocio (68,42 %) (tabla 1).
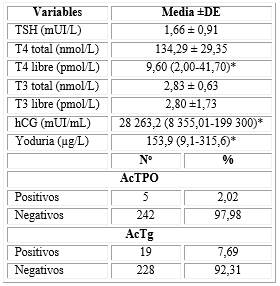
La tabla 2 presenta las características bioquímicas de las participantes, se aprecia la media ±DE o mediana (rango) de los parámetros de función tiroidea, hCG y yoduria.
La edad mostró una correlación negativa débil con la TSH (r = -0,17; p = 0,008), y la edad gestacional tuvo una correlación positiva débil (r = 0,25; p = 0,000). Dentro de las variables cualitativas presentaban una media superior de tirotropina las mujeres nulíparas con relación a las multíparas (1,80 ± 0,90 mUI/L vs 1,45 ± 0,89 mUI/L; p = 0,003); las que tenían antecedentes negativos de enfermedad tiroidea en su familia (1,81 ± 0,89 mUI/L vs 1,56 ± 0,9 mUI/L; p = 0,04) y las que tomaban suplementos vitamínicos que contenían yodo (1,96 ± 0,72 mUI/L vs 1,62 ± 0,93 mUI/L; p = 0,03) (tabla 3).
Tabla 3 Factores clínicos asociados con la TSH en las mujeres embarazadas. Plaza de la Revolución, 2015-2019

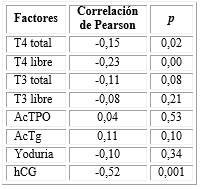
Presentaron una correlación negativa con la tirotropina, la T4 total (r = -0,15; p = 0,02; correlación débil) y libre (r = -0,23; p = 0,00; correlación débil) y la hCG (r = -0,52; p = 0,001; correlación moderada) (tabla 4).
Discusión
La TSH presentó asociación con varios factores clínicos y bioquímicos. La edad materna mostró una correlación negativa con esta hormona. Esto contrasta con lo que describe la mayoría de las publicaciones sobre el tema, pues la edad mayor de 30 años se considera un factor de riesgo para el hipotiroidismo.6Potlukova y otros26 al analizar los subgrupos de factores de riesgo para el hipotiroidismo durante el embarazo, observaron que la incorporación de mujeres de 30 años o más aumentó la proporción de casos identificados de 55,3 % a 85,6 %. Ehrenkranz y otros27 hallaron en su estudio que los niveles de TSH se incrementaban con la edad. El resultado encontrado en las mujeres de Plaza de la Revolución podría estar relacionado con que a medida que la edad es mayor, la autoinmunidad tiroidea es más frecuente,28 y en este caso podrían haber predominado los anticuerpos estimulantes del tiroides. Fu y otros29 no observaron diferencias estadísticamente significativas para las concentraciones de TSH y T4 libre entre los diferentes grupos de edades de las gestantes de su estudio. De Oliveira y otros30 tampoco hallaron relación entre la tirotropina y la edad materna (p = 0,221).
Varios autores reportan la relación directa entre la edad gestacional y los niveles de TSH, que concuerdan con lo hallado en las embarazadas del presente trabajo.16,31 El mecanismo que justifica estos cambios con el avance de la gestación está relacionado fundamentalmente con los niveles de hCG, que aumentan al final del primer trimestre, como se explicó anteriormente.2
Existen muchos estudios que demuestran que el IMC también es un determinante de la función tiroidea durante el embarazo, y que tiene una correlación positiva con la TSH.15-17,32,33 Sin embargo, en las gestantes de Plaza de la Revolución no se demostró esta asociación, posiblemente porque la media de IMC de las gestantes se encuentra en el rango del peso normal.
El descenso en los rangos de referencia para la TSH durante la gestación se observa esencialmente en todas las poblaciones, pero el alcance de esta reducción varía significativamente entre los diferentes grupos raciales y étnicos.6,19Korevaar y otros.34 mostraron estas diferencias en los intervalos de referencia de la TSH entre varios grupos étnicos en una cohorte de embarazadas de origen europeo. Diferentes estudios han encontrado concentraciones inferiores de TSH en las mujeres de piel negra que en las de piel blanca.9,10 En el presente trabajo la relación entre los niveles de tirotropina y el color de la piel no resultó estadísticamente significativa, pero las mujeres de piel negra fueron las que presentaron la media más baja.
La TSH resultó superior en las mujeres multíparas con respecto a las nulíparas, posiblemente porque las gestaciones sucesivas pueden agotar las reservas maternas de yodo.35 En la literatura también se plantea que la mayor paridad puede reducir la respuesta de la glándula tiroides a la estimulación por la hCG, con lo cual no se produciría adecuadamente el aumento en las hormonas tiroideas que lleva a la disminución de la TSH.36
Entre las gestantes estudiadas, las que tenían antecedentes familiares positivos de enfermedad tiroidea presentaron una media menor de TSH lo que contrasta con lo descrito en la literatura, pues la historia familiar de estas afecciones se encuentra dentro de los factores considerados de riesgo para la aparición de una enfermedad tiroidea durante el embarazo, fundamentalmente, el hipotiroidismo.6) En las mujeres de Plaza de la Revolución, los antecedentes familiares de hiperfunción tiroidea podrían ser más frecuentes que los de hipotiroidismo, lo que contribuiría a una media inferior de TSH en las que tienen esta historia familiar.
En cuanto al hábito de fumar, algunos autores como describen su relación con una disminución en las concentraciones séricas de TSH.11,12) Sin embargo, el estudio de Pearce y otros13 reporta una mediana de TSH mayor en las mujeres fumadoras que en las no fumadoras. En la presente investigación no se demostró asociación entre la tirotropina y el hábito de fumar, probablemente por el pequeño número de gestantes fumadoras.
El uso de suplementos yodados en las embarazadas del municipio Plaza de la Revolución se asoció con una media superior de TSH, lo cual contrasta con un estudio llevado a cabo en mujeres austríacas, que demostró una relación entre el consumo de estas preparaciones multivitamínicas y el hipertiroidismo latente o manifiesto, que los autores interpretaron como un hipertiroidismo inducido por yodo. Después de suspender la ingesta de estas preparaciones, la función tiroidea volvió a la normalidad.37
El resultado de las gestantes del municipio Plaza de la Revolución es inesperado, pues un estudio realizado en la misma población reveló que 43,6 % de estas mujeres tenían una ingesta insuficiente de yodo y en ninguna la ingesta fue excesiva.38) Podríamos esperar entonces que la suplementación mejore el estado nutricional del yodo, y que los niveles de tirotropina sean inferiores en las mujeres que consumen este tipo de preparaciones. Sin embargo, publicaciones recientes sugieren que la suplementación con yodo puede dar como resultado un "efecto aturdidor" temporal de la glándula, a través del efecto Wolff-Chaikoff, con una disminución transitoria en la síntesis de hormonas tiroideas.18,39) Según algunos autores, estos resultados indican que la deficiencia leve a moderada debe prevenirse de manera óptima en el período preconcepcional, y que iniciar el uso de suplementos durante el embarazo puede ser demasiado tarde y tener efectos adversos sobre la función tiroidea.18
Aunque la presencia de bocio coloca a la mujer en la categoría de alto riesgo para desarrollar una disfunción tiroidea durante el embarazo, la media de TSH de las gestantes que tenían este hallazgo al examen físico no mostró diferencias significativas, comparadas con las que no lo presentaban.6
En cuanto a los factores bioquímicos analizados, se evidenció una correlación negativa entre la tirotropina y la T4, tanto para la total como para la libre, lo que se corresponde con la regulación fisiológica del eje tiroideo. Los niveles suficientes de tiroxina, se produce una inhibición de la síntesis de TSH por las células tirotropas.40
La autoinmunidad tiroidea se considera el principal factor de riesgo para el hipotiroidismo materno. En una investigación realizada en los Estados Unidos de América se compararon los niveles de TSH de 1 211 mujeres con anticuerpos positivos y 8 351 con anticuerpos negativos, y estos resultaron significativamente superiores en el primer grupo (1,64 vs 1,00 mUI/L).20 Sin embargo, en el presente estudio no hubo correlación de la TSH con los anticuerpos antitiroideos, lo que probablemente responda al pequeño número de casos con anticuerpos elevados.
La hCG también presentó una correlación negativa con la TSH, tal como lo plantea la literatura. La subunidad alfa de la gonadotropina coriónica tiene una estructura similar a la de la tirotropina, lo que permite su acción agonista en el receptor de los tirocitos, aumentando la producción de hormonas tiroideas e inhibiendo la síntesis de TSH.2
La descripción de los factores que se asocian a los niveles de TSH en nuestro medio, podría ser útil para una mejor interpretación de las variaciones de esta hormona en la embarazada, y para identificar con mayor precisión a las mujeres que pueden desarrollar una disfunción tiroidea en esta etapa de la vida.
Limitaciones
En el presente trabajo se analizaron los factores clínicos y bioquímicos asociados con la tirotropina en un grupo de mujeres gestantes, sin estratificarlas por trimestre del embarazo. Esto representa una limitación del estudio, pues algunas variables podrían estar más o menos asociadas con la TSH en los distintos momentos de la gestación, por los cambios descritos en la fisiología tiroidea.
Las concentraciones de tirotropina durante el embarazo muestran una relación inversa con la edad materna, la paridad, los antecedentes familiares de enfermedad tiroidea, la T4 total y libre, y la gonadotropina coriónica, mientras que la edad gestacional y el consumo de suplementos con yodo revelan una relación directa con la TSH.