Introducción
Desde la ocurrencia de los atroces experimentos con humanos en el contexto de la Segunda Guerra Mundial, en los que estuvieron involucrados médicos y científicos, la humanidad comprendió la necesidad de regular éticamente la investigación científica.1) Este fue el origen del Código de Núremberg sobre los principios éticos en las investigaciones biomédicas promulgado en 1947, destacándose, entre otras cuestiones, que el consentimiento voluntario del sujeto es absolutamente esencial, que se debe evitar todo sufrimiento o daño innecesario y que la persona tiene la libertad de salir del experimento en cualquier momento.1
Sin embargo, en las décadas de 1950 y 1960 la mayoría de las investigaciones biomédicas se hacían sin cumplir los principios éticos enunciados en el Código de Núremberg. En 1964 La Asociación Médica Mundial en la Declaración de Helsinki reafirma los principios del Código de Núremberg y establece dos categorías de investigaciones: aquéllas cuyo objetivo es esencialmente diagnóstico o terapéutico y aquéllas cuyo objetivo esencial es puramente científico, sin utilidad clínica directa para el sujeto de la investigación.1
La declaración de Helsinki y sus sucesivas modificaciones en diferentes escenarios hasta el presente, son el pilar sobre el cual deben regirse las investigaciones en el ser humano.2
En 1966, los Institutos Nacionales de Salud de Estados Unidos instituyeron las normas sobre investigaciones clínicas en humanos y en 1972 el Congreso de ese país promulgó el Acta Nacional de Investigación, que estableció la Comisión Nacional de Protección a Sujetos Humanos en la Investigación Biomédica y de la Conducta.3 En 1978, esta Comisión emitió su famoso informe conocido como Informe Belmont, que especifica los principios éticos que deben seguir todas las investigaciones en humanos: respeto por las personas, beneficencia y justicia.4
Además de establecer estos principios, el Informe Belmont estableció la obligación de las instituciones que patrocinan investigaciones a hacer una revisión ética independiente de cada investigación, requisito previo a la obtención de fondos estatales para ella. Se establecieron así por primera vez los comités institucionales de ética de la investigación.5
Al comienzo de la década de los 90, comenzó la preocupación por la ética de las investigaciones epidemiológicas en poblaciones humanas, y posteriormente por la problemática de las investigaciones colaborativas internacionales, especialmente aquellas desarrolladas o financiadas por países desarrollados en países del tercer mundo.6
El Consejo de Organizaciones Internacionales de Ciencias Médicas (CIOMS), organismo afiliado a la Organización Mundial de la Salud reunió a expertos de varias regiones del mundo y en 1993 promulgó las Normas Internacionales para las Investigaciones Biomédicas en Sujetos Humanos7 Este documento analiza exhaustivamente todos los aspectos éticos en investigaciones internacionales.
Desde el año 2014, según la resolución número 40 del Ministerio de Salud Pública, son los Comités de Ética de la Investigación (CEI) los encargados del proceso de revisión y evaluación de la validez ética de los proyectos científico-técnicos en todas las instituciones de salud cubanas donde se realicen investigaciones con seres humanos.8
El camino recorrido por la ciencia sobre ética de la investigación científica ha sido explorado con versatilidad de criterios por diferentes autores y en las diferentes ramas de la salud. A pesar de la existencia de normas éticas para la investigación biomédica, periódicamente se han reportado circunstancias en que estos lineamientos no son del todo respetados, en especial, por el desconocimiento de los profesionales en dichos temas.9,10,11
Teniendo en cuenta que las Jornadas científicas son los escenarios idóneos para la exposición y el intercambio científico técnico de las investigaciones en las instituciones docentes de salud del nivel secundario, se decide realizar el presente estudio con el objetivo de evaluar la observancia de los principios éticos en las investigaciones presentadas en las Jornadas Científicas del hospital Joaquín Albarrán de La Habana, Cuba, desde el año 2015 al 2018.
Material y Métodos
Se realizó un estudio descriptivo de corte transversal evaluándose todas las investigaciones que se presentaron en las Jornadas Científicas del hospital Joaquín Albarrán Domínguez, desde el año 2015 al 2018, a las que se les aplicó como instrumento de evaluación, una valoración de los aspectos éticos que debería cumplir y plasmarse en una investigación científica.
El universo estuvo conformado con los 268 trabajos presentados en los años declarados.
Para la identificación de las variables de estudio se realizó una revisión bibliográfica sobre los Códigos éticos que regulan la investigación en seres humanos, entre los que destacan:1,2,3
a. El Código de Núremberg.
b. La Declaración de Helsinki de la Asociación Médica Mundial.
c. Los Principios Internacionales de Ética de la Investigación Biomédica del Consejo de Organizaciones Internacionales de Ciencias Médicas.
d. Manual de organización y procedimiento del CEI del hospital Joaquín Albarrán.
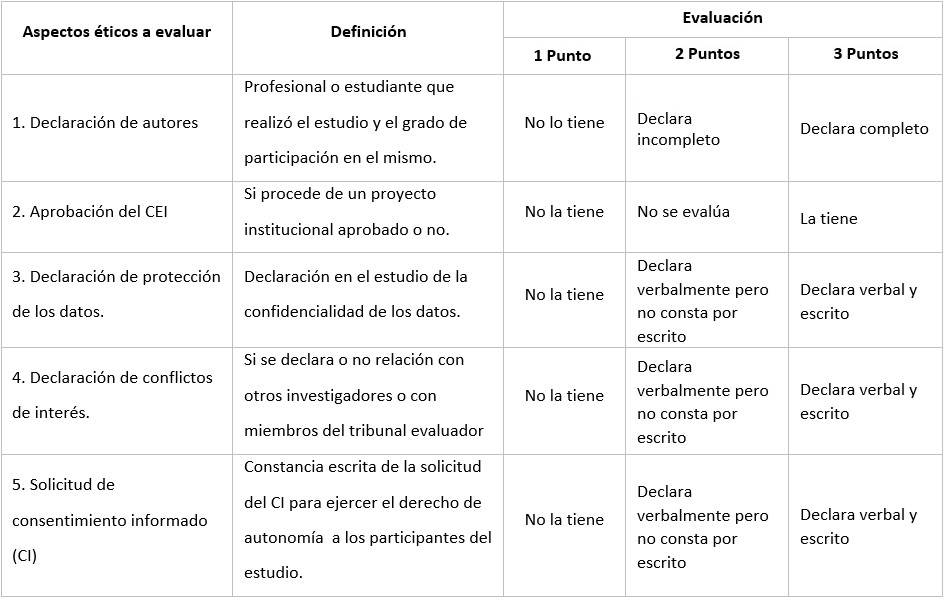
Se tuvo en cuenta que el investigador solicitara el consentimiento voluntario y consciente del individuo (en especial la anuencia de usar los datos de la Historia Clínica para investigaciones), preferiblemente por escrito y por un profesional sin conflictos de intereses, que la integridad de la información emanada de la investigación debería ser protegida adecuadamente, el grado de responsabilidad y participación de cada autor en el estudio y si la investigación había sido aprobada oportunamente por el CEI de la institución.
El instrumento para la evaluación constó de 5 aspectos que fueron validados por el criterio de 8 expertos en el tema, los cuales fueron: (Tabla 1).
Evaluación general de las investigaciones
Los estudios calificados entre 5 y 8 puntos fueron considerados de mal porque la mayoría de los aspectos evaluados estaban incompletos o no los tenían, los calificados entre 9 y 12 puntos de regular porque cumplían algunos aspectos completos y como buenos los que obtuvieron 13 puntos o más, porque plasmaron más del 90 por ciento de los requisitos necesarios de la ética para una investigación.
También se tuvo en cuenta el año de la Jornada Científica en que se expuso el trabajo científico y el departamento que presentó la investigación, considerándose como de perfil clínico las especialidades de medicina interna, medicina intensiva, geriatría, cardiología, dermatología, laboratorio clínico, anatomía patológica y rehabilitación y como de línea quirúrgica los que pertenecían a cirugía general, otorrinolaringología, urología, proctología y angiología entre otras especialidades.
Se confeccionó una planilla para el vaciamiento de los datos, y con la información recogida se aplicaron técnicas de estadística descriptiva, porcentajes y frecuencias. Se realizó la prueba de Chi cuadrado para evaluar las frecuencias de los cumplimientos. Se consideró estadísticamente significativo un valor de p inferior a 0,05.
Aspectos éticos
Los autores declaran su compromiso de confidencialidad y protección de la información recogida durante la investigación, la que solo se utilizará para los fines de la presente investigación. También se solicitó la autorización a la dirección del centro y al CEI para la ejecución de la misma. El estudio es parte de un proyecto de investigación formalmente inscrito en el CEI de la Universidad de Ciencias Médicas de La Habana y tiene la aprobación del Ministerio de Ciencia, tecnología y medio ambiente (CITMA) de Cuba.
Resultados
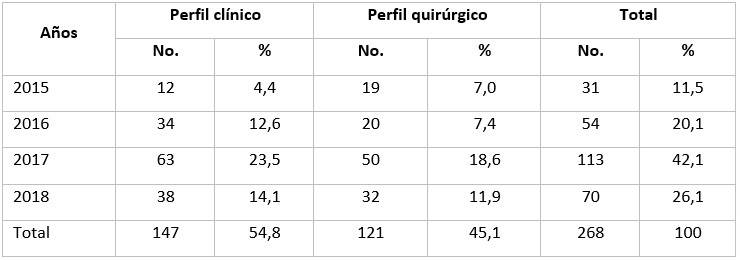
En las 4 jornadas científicas revisadas, se presentaron un total de 268 trabajos, con discreto predominio en la participación del perfil clínico (54,8 %). Hubo un aumento importante de estudios presentados en el año 2017, lo que está relacionado con la participación en ese año de investigaciones realizadas por estudiantes y profesores del departamento de tecnología de la salud (licenciaturas en Rehabilitación en Salud y Laboratorio Clínico entre otros). (Tabla 2).
Tabla 2 Distribución según años y perfil de las especialidades
Nota: los porcentajes fueron calculados sobre la base del total de trabajos presentados.
Predominaron los aspectos éticos evaluados con 1 punto, y entre ellos la declaración de conflicto de intereses en el que 230 investigaciones no lo presentaban (85,8 %), sin embargo más de la mitad de las investigaciones (148 para el 55,2 %) tenían descrita la declaración de protección de la información. (Tabla 3).
Tabla 3 Distribución de la puntuación de los aspectos éticos

*p=0,000
Nota: los porcentajes fueron calculados sobre la base del total de trabajos presentados.
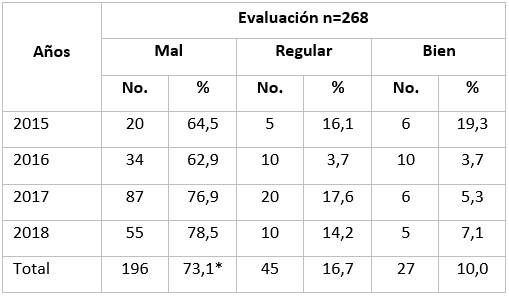
Cuando se evaluaron los trabajos en general, el 73,1 % (196 investigaciones) fueron calificados de M (mal), principalmente en el año 2018 (78,5 %), seguidos del año 2017 (76,9 %).
Un pequeño porcentaje de los estudios fueron calificados de bien (B), y solo en el año 2015 alcanzó el 19,3 % del total, destacándose que en el resto de los años, menos del 8 por ciento obtuvo esta calificación. (Tabla 4)
Discusión
El desarrollo de la investigación científica resulta un requisito indispensable para el perfeccionamiento el sistema de Educación Médica y la competencia de los profesionales; la Jornada Científica es uno de los eventos de base más importantes para el debate de los resultados de las investigaciones que se desarrollan en una institución de salud, y es el marco ideal para el aprendizaje de los procesos investigativos en los estudiantes (asesorados por los profesores e investigadores del centro), estimula la exploración científica y la creatividad y brinda la experiencia necesaria para la redacción así como la defensa de los trabajos presentados, sentando la base para futuras investigaciones durante la vida profesional.12
En el presente estudio se pudo comprobar que las investigaciones que se ejecutan anualmente en la institución son insuficientes, teniendo en cuenta que el número de estudiantes en cada año sobrepasa los 300.
Con respecto a los parámetros éticos evaluados, hubo muy baja calificación en todas las investigaciones. Debe señalarse que aunque los estudios que se presentaron eran fundamentalmente de perfil epidemiológico y de tipo descriptivo, todas las investigaciones deberían reflejar, al menos, los 4 primeros aspectos evaluados.
También podría pensarse que en este tipo de investigaciones (de perfil epidemiológico) puede obviarse reflejar la anuencia del sujeto al no poder obtenerse su permiso al momento de la investigación (CI); sin embargo, para revisar las Historias Clínicas con fines investigativos, se deberá contar también con la autorización del paciente o sujeto investigado, hecho que no se plasma habitualmente en las historias clínicas cuando se confecciona inicialmente, lo que también se convierte en una deficiencia común cuando se obtiene el CI y, por tanto, para la ejecución de futuras investigaciones.
Hace 31 años, una revisión publicada en New England Journal of Medicine señaló que de cien trabajos clínicos consecutivos, doce tenían reparos éticos, y que de cincuenta estudios clínicos, sólo dos solicitaron el Consentimiento Informado correspondiente. Algunos reparos éticos eran graves, como por ejemplo omitir terapia antibiótica de reconocida eficacia en sujetos con fiebre tifoidea, empleados como controles para otro estudio.13
En Cuba la información objetiva sobre el tema de esta investigación es escasa, fundamentalmente en estudios epidemiológicos; en sentido general los aspectos evaluados en esta investigación fueron calificados de mal, y es relevante la ausencia de la declaración de conflictos de intereses y el grado de participación de los autores en los trabajos científicos.
Cuando se valoró la observancia de la ética en cada estudio, solo el 10 % (27 trabajos) fue calificado de bien (tabla 4), lo que constituyó una deficiencia marcada en la confección y presentación de las investigaciones.
Toda investigación se sostiene en una idea elemental, la honestidad. La deshonestidad de un investigador, revisor de manuscritos o editor, escandaliza en cualquier campo, pero esto es aún más grotesco en la investigación médica.14 Dicho requisito es obvio desde la planificación inicial hasta la publicación final. Esto significa, entre otras cosas, recoger meticulosamente los datos, llevar registros impecables del trabajo realizado, interpretar los resultados con realismo, sin forzar la demostración de hipótesis preconcebidas y, finalmente, su publicación en una revista científica reconocida.
Los coautores del trabajo deben también dominar el tema e interpretar los resultados. Por eso es importante que en los estudios quede plasmado el porcentaje de participación de cada autor en la investigación, como sería su contribución en la concepción y el diseño del estudio, la adquisición de los datos y el análisis e interpretación de los mismos, así como su intervención en la redacción y revisión crítica, el aporte intelectual y su aprobación a la versión final.6
Es posible que estos requerimientos se desconozcan y que se piensa que solo deben tenerse en cuenta en el momento de la publicación del estudio, causa por la que no se incluyeron en la presentación y defensa de las investigaciones.
Hay dos elementos negativos que suelen presentarse en la declaración de participación de los autores: los investigadores “honorarios” y la exclusión de los denominados “autores fantasmas”. Los “honorarios” suelen ser personas incluidas en la nómina porque son autoridades respetadas del sitio de trabajo y sus nombres podrían dar más peso o credibilidad a lo que se describe o afirma en la investigación (aunque no hayan participado en el estudio), o bien pertenecen a una unidad o departamento cuyos miembros pretenden injustamente figurar como autores en todas las investigaciones generadas en los mismos.5,6,15
Los “fantasmas” son personas que realmente participaron en el estudio, pero que se estimó prudente excluirlas de la nómina porque tienen conflictos de intereses tan obvios que podrían afectar la credibilidad del contenido y la intención del estudio (ejemplo: funcionarios de la organización que financió el estudio o que se beneficiará con la publicación de sus resultados). Los autores coinciden que la frecuencia de estos errores es elevada, pero se encuentra en un sub-registro por su difícil comprobación.5,6,15
Otro aspecto importante y que tiene un elevado porcentaje de calificaciones de M es la obtención del CI, en la práctica, respetar el principio de autonomía es imprescindible para la ejecución de investigaciones con humanos (ensayos clínicos) o informaciones sobre su persona, pues el paciente está en el total derecho de que sus datos sean usados o no con fines investigativos (ensayos clínicos o estudios epidemiológicos); igualmente, supone el respeto por la intimidad del sujeto durante todo el estudio y el guardar secreto sobre su nombre al publicar los resultados obtenidos.16
Una norma ética elemental es respetar el anonimato de las personas, eliminando cualquier palabra o símbolo que permita identificarlas. Las fotografías son elementos que exigen un cuidado especial: desde hace más de una década se ha establecido que el rostro de las personas solo puede reproducirse en casos con interés clínico específico y con la autorización escrita y firmada por la persona o su representante legal, los que deben tener la oportunidad de conocer el documento en que aparecerá la fotografía, antes de que sea publicado. Obviamente, es inaceptable limitarse a cubrir los ojos de la persona fotografiada.17
Más de la mitad de los trabajos no tienen la aprobación del CEI, esto puede significar que no están adheridos a proyectos de investigaciones, por tanto, legalmente no están registrados en la institución.
Dentro de las normas de la investigación médica, cuyo cumplimiento debe ser exigido en todas las investigaciones, están las centradas en la “Declaración de Helsinki” sobre el respeto a los derechos humanos. El primer filtro para verificar su cumplimiento recae en los mismos autores y en las autoridades que aprueban iniciar el estudio, seguido por un segundo filtro, que es el CEI que lo autoriza.2,3
Los autores insisten en la importancia de la evaluación y aprobación por el CEI de las instituciones para el inicio y ejecución de cualquier tipo de investigación. Cuando se valora y aprueba la competencia científica de una futura investigación por un grupo de expertos ajenos al investigador, no hay dudas de que el proceso que se llevará a cabo es serio y está encaminado a obtener los mejores resultados cumpliendo las normas éticas establecidas.18,19
Las deficiencias señaladas se deben al desconocimiento en temas de ética de la investigación por los profesionales de la salud, lo que coincide con un estudio publicado en Santiago de Cuba donde se comprobaron insuficiencias en los conocimientos básicos sobre la ética de la investigación, lo que pudiera tener consecuencias contraproducentes en el desarrollo de estudios científicos.20
Otra investigación en La Habana resalta, entre sus conclusiones, el amplio desconocimiento de la ética de la investigación con sujetos humanos, lo que confirma la necesidad de instruir a los profesionales en la observancia de la ética médica.21
La formación de los estudiantes desde el pregrado en los principios éticos de la investigación, es la base de un profesional íntegro, preparado para realizar investigaciones científicas con la calidad requerida, sin la violación de los principios éticos mundialmente establecidos.22
Por tanto, es necesario trazar estrategias encaminadas a capacitar a los profesionales de la salud y en especial al profesorado, teniendo en cuenta que la investigación científica y la ética constituye uno de los principios en los que se respalda la formación integral de los estudiantes de las ciencias médicas.17,21
Limitaciones del estudio
Para la realización del estudio solo se tuvo en cuenta los trabajos presentados en Jornadas Científicas a nivel de base, sin embargo, la Universidad de Ciencias médicas de la Habana a la cual pertenece el hospital, propició eventos interuniversitarios, municipales, provinciales y nacionales, cuyos datos no fueron incluidos en la presente investigación.