INTRODUCCIÓN
Más de 17 millones de estadounidenses tienen algún tipo de problema cardíaco. De ellos, la mayoría, 11 millones, padece una arteriopatía coronaria, cinco millones tienen una cardiopatía valvular y un millón tienen una cardiopatía congénita1. La enfermedad coronaria es la causa de muerte más frecuente entre los adultos de ese país y consumen más recursos sanitarios que cualquier otra enfermedad1.
Aproximadamente un tercio de los pacientes que son tratados por algún tipo de cirugía, tienen una enfermedad coronaria o riesgo de padecerla. De los 72 millones de procedimientos quirúrgicos realizados, aproximadamente 0,7 millones son cardíacos primarios2.
En Cuba, las enfermedades cardiovasculares constituyen la primera causa de muerte y de ellas, la cardiopatía isquémica representa el 75%. Esta enfermedad la padece casi el 20% de la población mayor de 60 años3.
La isquemia del miocardio suele ser secundaria a la obstrucción de las arterias coronarias por placas ateromatosas, las cuales son consecuencia del depósito anormal de lípidos en la íntima vascular, favorecida por múltiples factores de riesgo. El fenómeno conduce a disfunción endotelial y, en general, de toda la pared arterial, cuyo corolario es un estado clínico de bajo flujo coronario, agudo o crónico4.
Los mecanismos por medio de los cuales el fenómeno de isquemia/reperfusión lesiona el corazón, son complejos y existe un intenso debate acerca de la contribución de los componentes individuales de este proceso. Algunos autores como Balakumar y Sharma5, afirman que el proceso de reperfusión es dos veces más dañino para el miocardio que la lesión isquémica en sí2,5,6. Si se daña el corazón por isquemia/reperfusión, su función también se verá afectada y, por ende, la correcta función de órganos de vital importancia como hígado y riñones, dependientes totalmente de un gasto cardíaco adecuado.
El fenómeno de «daño posreperfusión» en la cardiopatía isquémica, como contrapartida al beneficio de los procedimientos de revascularización generalizados en los últimos años, ha alcanzado un máximo interés al identificarse estrategias que pueden contrarrestarlo. Hace más de 30 años se describió el precondicionamiento isquémico en animales, al demostrar que breves períodos de isquemia, inducidos experimentalmente sobre el miocardio, limitan el tamaño del infarto resultante tras una posterior oclusión coronaria7.
En 1986, Murry et al7, realizaron la primera investigación sobre precondicionamiento isquémico en modelos de experimentación animal (perros) y observaron que la producción de cuatro ciclos de cinco minutos de isquemia, seguida de reperfusión, durante otros cinco minutos, por oclusión y repermeabilización de la arteria circunfleja, inmediatamente antes de un episodio sostenido de isquemia miocárdica de mayor duración que producía un infarto agudo de miocardio experimental (40 minutos de oclusión de la mencionada arteria), paradójicamente, disminuía en un 25% el tamaño del infarto con respecto a sujetos no tratados con el protocolo de precondicionamiento isquémico2,7.
En la década de los años 90, Przyklenk et al8 publicaron -por primera vez en la historia del condicionamiento isquémico-, que la isquemia inducida en otra zona del corazón o en otro tejido alejado de este órgano, podía igualmente condicionar la respuesta del miocardio, frente a un insulto isquémico posterior. Se desarrolla así, el concepto de condicionamiento isquémico a distancia (CIAD) o remoto. El primero se realizó en el año 1993 por dicho autor8, quien explica cómo un protocolo de precondicionamiento isquémico aplicado mediante ciclos de oclusión y reperfusión de la arteria circunfleja en perros, pudo reducir el tamaño del infarto subsiguiente a la oclusión de otra arteria coronaria, la descendente anterior; de manera que el efecto protector del condicionamiento puede ejercerse fuera del territorio miocárdico que posteriormente va a sufrir un infarto. Luego, surgen trabajos, incluso ensayos clínicos controlados8,9, en los que el efecto protector del precondicionamiento isquémico se ejerce desde fuera del propio corazón, como los tejidos muscular esquelético de las extremidades superiores o inferiores.
De forma general, el CIAD en sus dos formas fundamentales pre y poscondicionamiento es un procedimiento fácil de realizar, inocuo, sin reacciones adversas o complicaciones demostradas, y puede ser aplicado para la protección ante la isquemia en varios órganos de nuestro cuerpo10; entre ellos, el más estudiado, por la importancia que tiene, es el corazón, pero también se han estudiado otros, donde igualmente el CIAD resulta efectivo: cerebro, riñones, sistema gastrointestinal (hígado, intestino delgado y grueso, páncreas, músculo esquelético) y pulmones10; este último, mucho menos afectado que el resto por el sistema de doble irrigación arterial que presenta, lo cual lo hace menos susceptible a presentar episodios de isquemia.
El objetivo de esta investigación fue identificar el efecto del CIAD con fines de protección renal y hepática, relacionado al comportamiento de los niveles de creatinina y transaminasas glutámico-purúvica y glutámico-oxalacética en el postoperatorio de la revascularización miocárdica quirúrgica (CABG, por sus siglas en inglés).
MÉTODO
Se realizó un estudio cuasiexperimental, explicativo, con 247 pacientes (grupo estudio) propuestos para cirugía cardíaca de CABG, que se compararon con igual número de pacientes ya operados (grupo control). Los pacientes del segundo grupo (control histórico) se analizaron de forma retrospectiva, y los del grupo estudio, donde se aplicó el CIAD, se evaluaron de forma prospectiva; en ambos casos de acuerdo al orden de llegada a la Unidad Quirúrgica del Cardiocentro Ernesto Che Guevara de Villa Clara, Cuba.
Criterios de inclusión
Pacientes que acudieron para CABG electiva en un período de un año y (los del grupo estudio) expresaron su acuerdo de participar en la investigación al firmar el consentimiento informado. Los pacientes del grupo control ya estaban operados, en ellos no se aplicó el CIAD y solo se utilizaron los datos de la historia clínica, sin emplear sus datos personales; además, se contó con la aprobación del Comité de Ética de la Investigación del centro donde se realizó el estudio.
Criterios de exclusión
Se excluyeron los pacientes a los que además de la CABG, se les realizó procedimientos de ablación intraoperatorio de focos arrítmicos, implantación de válvulas o injertos aórticos u otros, presencia de una fístula arteriovenosa o linfedema del brazo derecho en el caso del grupo estudio, cirugía cardíaca previa endovascular o convencional, cirugía de urgencia o emergencia, insuficiencia renal y disfunción neurológica previa.
Criterios de salida
Pacientes que fallecieron durante el período transtoperatorio y en la primera semana del postoperatorio.
Variables principales
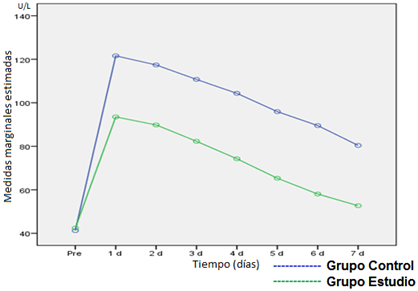
Enzimas hepáticas: Se evaluaron los valores séricos (en unidades/litro [U/L]) de las transaminasas glutámico-pirúvica (valor normal 7-41 U/L) y glutámico-oxalacética (valor normal 12-38 U/L).
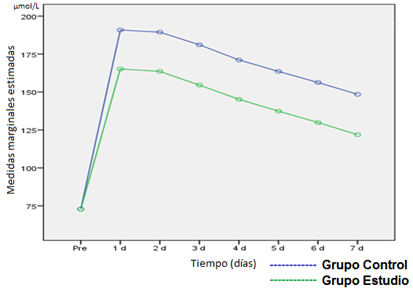
Creatinina: Expresada en micromoles por litro (µmol/L), se consideró un valor normal hasta 132,6 µmol/L.
Las determinaciones séricas de estas variables se obtuvieron en ayunas, antes (en chequeo preoperatorio) y después de la cirugía (primeros siete días del posquirúrgico), y se procesaron en el laboratorio clínico del hospital donde se realizó la investigación.
Otras: Se evaluaron otras variables pero no fueron objetivo primario de este artículo. Entre ellas se encuentran: edad, sexo, número de vasos coronarios con lesiones angiográficamente significativas, número de vasos coronarios revascularizados y duración de la circulación extracorpórea (CEC).
Protocolo anestésico y del CIAD
La inducción anestésica se realizó con la administración endovenosa, en dosis única, de lidocaína 2% 1 mg/kg de peso corporal, fentanilo 5 μg/kg, propofol 2 mg/kg y bromuro de vecuronio 0,1 mg/kg; luego se colocó el tubo orotraqueal. La ventilación pulmonar mecánica se efectúo con un ventilador Fabius GS, el volumen corriente inicial se calculó a 7 ml/kg, con frecuencia respiratoria de 12 a 16 ciclos por minuto y una FiO2 de 50%; luego se colocó un catéter venoso profundo en la vena yugular interna derecha (vía intermedia) para monitorizar la presión venosa central y dos centímetros debajo se colocó un introductor calibre 8F para insertar un catéter en la arteria pulmonar (Swan-Ganz), con el que se midió el índice cardíaco y la resistencia vascular sistémica. El mantenimiento de la anestesia se realizó con isofluorano entre 1 y 1,5 de concentración alveolar mínima.
Después de estabilizado el paciente, posterior a la instrumentación anestésica, se procedió a colocar, en el grupo estudio, un torniquete en el brazo derecho (pre-CIAD), que se insufló hasta alcanzar una presión de 200 mmHg y se mantuvo durante cinco minutos; luego se desinsufló para permitir la reperfusión de la extremidad por cinco minutos, posteriormente se repitió este ciclo dos veces más.
Una vez pinzada la arteria coronaria para su revascularización (evento isquémico mayor), se repitió el procedimiento de insuflar/desinsuflar el torniquete (pre-CIAD) y posteriormente, al momento del cierre, se realizó por tercera y última vez igual procedimiento (post-CIAD). Después de concluida la cirugía, se trasladó el paciente a la unidad de cuidados intensivos quirúrgicos (UCIQ), donde fue atendido según el protocolo establecido por el servicio de cirugía cardiovascular.
Procesamiento de la información
La información obtenida fue agrupada en una base de datos en Microsoft Excel 2010 y procesada con el programa estadístico SPSS versión 20. Las variables cualitativas fueron resumidas mediante números absolutos y porcentajes, las cuantitativas con la media y su desviación estándar. Para la comparación de los grupos estudiados se empleó la prueba Chi cuadrado ((2) para las variables cualitativas, y la prueba t de Student para las cuantitativas.
RESULTADOS
Se conformaron dos grupos de 247 pacientes cada uno (muestra representativa de la población estudiada), y no se encontraron diferencias significativas (p>0,05) respecto al conjunto de variables que representan el estado inicial de los pacientes: edad, sexo, fracción de eyección del ventrículo izquierdo, antecedentes patológicos familiares de cardiopatía isquémica, presencia de diabetes mellitus, hipertensión arterial, dislipidemia o enfermedad pulmonar obstructiva crónica, duración de la CEC, arteriopatía extracardíaca o periféricas, número de vasos con lesiones angiográficas significativas, número de vasos revascularizados, clase funcional según la NYHA, infarto miocárdico reciente/antiguo, angina inestable, hábito de fumar y tratamiento, lo que garantizó la homogeneidad de los grupos y permitió realizar las comparaciones entre ellos.
Con relación a la creatinina (Figura 1) se apreció que previo a la cirugía no se encontraron diferencias significativas entre los grupos (p>0,05); sin embargo, cuando se analizaron cada uno de los primeros siete días del postoperatorio, en los pacientes del grupo estudio, sí se encuentran diferencias significativas (p<0,001), con cifras más elevadas que en el grupo control.
Similares resultados se obtuvieron al analizar las transaminasas glutámico-purúvica (Figura 2) y glutámico-oxalacética (Figura 3), pues no hubo diferencia estadística antes de la cirugía (p>0,05) y se demostraron diferencias muy significativas en la primera semana del postoperatorio (p<0,001) a favor del grupo donde se utilizó el CIAD.
DISCUSIÓN
Aunque hoy se asume que la reperfusión es esencial para salvar el miocardio isquémico frente a la necrosis, paradójicamente la propia reperfusión puede producir o incrementar el daño miocárdico2,5. Tal es así, que en las últimas décadas se ha intensificado la necesidad de mejorar la protección miocárdica ante la isquemia, con el objetivo de minimizar los daños producidos por el fenómeno de isquemia/reperfusión. No menos importante resulta la protección renal y hepática, dependientes totalmente de la adecuada función cardíaca, pues en este tipo de cirugía -CABG con utilización de CEC- se pueden afectar las presiones de perfusión de estos órganos y provocar daño isquémico. Por otra parte, un gasto cardíaco inadecuado por isquemia miocárdica posterior a la CABG trae como resultado una afectación de las funciones hepática y renal por disminución de la función miocárdica (bajo gasto cardíaco), sin que estos órganos estén directamente afectados.
Los parámetros estudiados, como la creatinina y las transaminasas glutámico-pirúvica y glutámico-oxalacética disminuyeron significativamente en el grupo donde se aplicó el CIAD, lo cual sugiere que el procedimiento también pudiera proteger a otros sistemas orgánicos de vital importancia, y no solo el corazón, como son: riñones11-14, hígado10,11,15, cerebro11,20,21, y pulmones21, entre los más importantes e imprescindibles en la pronta recuperación del paciente, y que son muy afectados por el síndrome de respuesta inflamatoria sistémica, que se desencadena durante la CEC, estrategia utilizada en la mayoría de las intervenciones quirúrgicas cardiovasculares. Sin embargo, otros autores16-19 plantean que el CIAD no protege al sistema renal. No obstante, en un artículo muy interesante publicado por Zimmerman y otros nefrólogos estadounidenses22, donde se estudiaron 118 pacientes, divididos en dos grupos, durante el postoperatorio de una cirugía cardíaca, se encontró que del total de la muestra, previa estratificación de riesgo y sin diferencias significativas prequirúrgicas (p=0,43), 12 pacientes del grupo estudio y 28 del control tuvieron disfunción renal aguda, con diferencias estadísticas muy significativas (p=0,004); lo que demostró la efectividad del CIAD en la prevención del daño renal agudo, sobre todo, posterior a uno de los principales factores de riesgo para esta complicación en la cirugía cardíaca, el uso de la CEC.
CONCLUSIONES
El condicionamiento isquémico a distancia es un procedimiento útil para la protección renal y hepática durante la revascularización miocárdica quirúrgica, demostrado por una disminución significativa de los valores séricos de creatinina y transaminasas glutámico-purúvica y glutámico-oxalacética.