INTRODUCCIÓN
La identificación de sustancias prohibidas, o sus principales metabolitos, en muestras de orina de un atleta se puede considerar un delito de dopaje. Por lo tanto, el objetivo de un laboratorio acreditado por la Agencia Mundial Antidopaje (AMA) es proporcionar datos que confirmen de manera inequívoca la presencia de este tipo de compuestos en la orina. Esta organización establece los elementos necesarios para garantizar una óptima armonización y buenas prácticas en las organizaciones nacionales e internacionales. Los principales elementos son de obligatorio cumplimiento, entre ellos: el Código Mundial Antidopaje, el Estándar Internacional de Laboratorios y Documentos Técnicos relacionados con la actividad analítica. El incumplimiento de los requisitos descritos en estos elementos conlleva a la pérdida de la acreditación de un laboratorio de control del dopaje. [Hilderbrand et al (2003); Botrè et al (2012) y (AMA 2016)].
La exigencia de la AMA, reflejada en su Estándar Internacional para Laboratorios (AMA, 2016) y los documentos técnicos pertinentes (AMA-MRPL, 2018), referente a la disminución de los niveles de detección es cada vez mayor. Esto obliga a los laboratorios al incremento constante de la sensibilidad de sus ensayos, ya sea mediante el incremento en el recobrado en la técnica de extracción, o mediante la introducción de equipos de medición de mayor sensibilidad.
Las técnicas de espectrometría de masas (EM) que aumentan la selectividad, son particularmente importantes cuando se analizan determinados compuestos en matrices complejas, por ejemplo, la orina. En este caso es típico que los iones comunes al ruido químico o biológico como al analito estén presentes en la ventana cromatográfica de interés. Por lo tanto, es esencial que la técnica de EM empleada sea capaz de discernir la señal del analito del ruido de fondo. Las técnicas utilizadas para aumentar la selectividad y la sensibilidad incluyen, pero no se limitan, a la EM acoplada a cromatografía gaseosa (CG) de alta resolución y la EM en tándem acoplada a CG, según plantean Gambelunghe et al (2002) y Grob y Barry (2004).
La detección de esteroides anabólicos androgénicos en la orina implica grandes retos entre los que se puede citar la coexistencia con otros compuestos excretados de forma endógena que pueden interferir en su adecuada detección. En el campo de la analítica del dopaje fue fundamental la introducción del perfil de esteroides en CG-EM ya que sin duda podría formar parte del posterior "pasaporte biológico” que actualmente se propone para todos los atletas. Esto ha sido descrito y defendido por Marques et al (2006), Krone et al (2010), Saugy et al (2014), AMA (2016) y Alladio et al (2016).
En el Laboratorio Antidoping de La Habana, desde su inauguración en el año 2001, la EM de simple cuadrupolo acoplada a cromatografía de gases (CG- Q) es la técnica empleada para la detección de esteroides y/o sus metabolitos principales en la orina. En el 2001 la AMA no exigía un límite en la detección de las sustancias prohibidas. No obstante, siguiendo la experiencia de otros laboratorios pioneros y basado en estudios publicados, la concentración mínima que deberían observar los laboratorios, para los esteroides y/o metabolitos era de 10 ng/mL y de 2 ng/mL solo para 4 de ellos. Actualmente, los niveles de sensibilidad exigidos para este grupo de compuestos se encuentran entre 2 y 5 ng/mL en la orina. Sin embargo, el Estándar Internacional de Laboratorios de la AMA (AMA-MRPL, 2018) establece que el límite de detección validado para cada esteroide debe ser, al menos, el 50 % del valor mínimo de rendimiento requerido (conocido como MRPL por sus siglas en inglés).
El objetivo del presente trabajo fue la implementación de un método analítico para la detección de esteroides y/o sus metabolitos en orina, así como el clenbuterol y el ciclofenil metabolito, mediante la técnica de espectrometría de masas de triple cuadruplo acoplado a cromatografía de gases (CG-QqQ). Mediante la evaluación de muestras provenientes de un estudio de excreción en orina se verificó la superioridad del método CG-QqQ sobre el establecido (CG-Q).
METODOLOGÍA
Reactivos
Enzima β-glucuronidasa tipo K12 de Escherichia coli (ROCHE, Alemania); tert-butilmetileter pureza 99 %, (MERCK, Alemania); n-pentano, pureza 99 %, (MERCK, Alemania); 2-mercaptoetanol pureza 99 %, (SIGMA-ALDRICH, Alemania); N-Methyl-N-(trimethylsilyl)-trifluoroacetamide (MSTFA) para síntesis (SIGMA-ALDRICH, Alemania); Ioduro de amonio pureza 99 %, grado analítico (SIGMA-ALDRICH, Alemania); Hidrógenofosfato de Sodio y Dihidrógenofosfato de sodio dihidratado ambos pureza 99 %, grado reactivo (MERCK, Alemania).
Muestras Control
Las muestras de control se prepararon por adición de las disoluciones metanólicas del material de referencia de concentración conocida en matriz orina blanco, previamente verificada. En un matraz aforado de 50 mL se adicionó un volumen de las disoluciones del material de referencia para alcanzar una concentración de 10 ng/mL. A partir de esta disolución, se realizaron diluciones consecutivas para alcanzar las concentraciones de 5ng/mL; 2,5 ng/mL y 1,25 ng/mL, excepto para la 19-norandrosterona, 6β-OH-turinabol y clenbuterol.
Esteroides Anabólicos Androgénicos: 19-norandrosterona, 19-noretiocolanolona, Epimetendiol, metabolito de la Dromostanolona (2(-metil-5(-androstan-3(-ol-17-ona), metabolito de la Fluoximesterona (9(-fluoro-18-nor-17,17-dimetilandrosta-4,13-dien-11(-ol-3-ona), metabolito de la Metenolona (1-metilen-5(-androstan-3(-ol-17-ona), metabolitos de la Metiltestosterona (17(-metil-5(-androstane-3(,17(-diol y 17(-metil-5(-androstane-3(,17(-diol), 1-Testosterona, Metil-1-testosterona, Etisterona, metabolito del Clostebol (4-cloroandrost-4-en-3(-ol-17-ona), Metilstembolona, metabolito del Danazol (17(-etinil-2(-hidroximetil-4-androsten-17(-ol-3-ona), metabolito de la Noretandrolona (17(-etil-5(-estrane-3(,17(-diol), metabolito de la Mesterolona (1(-metil-5(-androstan-3(-ol-17-ona), metabolito de la Boldenona (5(-androst-1-en-17(-ol-3-one), 4-hidroxi-testosterona, Epitrembolona, 6β-hidroxi-turinabol, 6β-hidroxi-metandienona.
β2-agonista: Clenbuterol
Antiestrogénico: 4-hidroxi-ciclofenil (metabolito del Ciclofenil)
Validación
Para la validación se tomó en consideración lo establecido en el Estándar Internacional de Laboratorios de la Agencia Mundial Antidopaje y la NC ISO/IEC 17025: 2006, en relación a los parámetros a validar para los metabolitos sin umbral, es decir, para aquellos metabolitos que no necesitan ser necesariamente cuantificados sino identificados. [ (AMA 2016) y NC ISO (2006)]
Ensayo de Especificidad: se emplearon muestras de orina provenientes de 10 individuos de ambos sexos con el objetivo de buscar variabilidad metabólica y fisiológica. Se verificaron las interferencias al tiempo de retención de los analitos de interés.
Ensayo de arrastre: se evaluó la presencia de los metabolitos de interés en una muestra blanco analizada inmediatamente después del análisis instrumental de una muestra conteniendo los analitos del estudio en una concentración de 1μg/mL.
Límite de detección: se evaluó la relación señal: ruido para cada analito en las diluciones 1: 4 (2,5 ng/mL) y 1: 6 (1,25 ng/mL).
Ensayo de precisión intra-día (repetibilidad): se analizaron en paralelo diez réplicas en dos concentraciones (CI: concentración inferior y CS: concentración superior) y se calculó el coeficiente de variación (CV) de las respuestas obtenidas, expresada como la relación de áreas entre el analito y el patrón interno (PI) Metiltestosterona.
Ensayo de rendimiento de extracción: se analizaron en paralelo cuatro réplicas de muestras de CS extraídas siguiendo el procedimiento y cuatro réplicas donde la matriz fue extraída previamente a la adición del material de referencia, para alcanzar la misma concentración (100 % de extracción). El recobrado se calculó como:
R = [(RACS) / (RAmpe)]*100
Donde: RACS es la relación de áreas entre analito y PI en el control superior; RAmpe es la relación de áreas entre el analito y el PI en la muestra con matriz previamente extraída.
Ensayo de robustez: se analizaron en paralelo cuatro réplicas de muestras de CS extraídas siguiendo el procedimiento. Se emplearon 5 mL de n-pentano en lugar de tert-butilmetileter en el paso de la extracción líquido-líquido. A estas muestras se les calculó el R a partir de los controles considerados como el 100 % de extracción en el ensayo de recobrado. Se aplicó una prueba de Student (( = 0,05).
Estudio controlado de excreción urinaria de Metiltestosterona
Se administró una dosis única de 10 mg Metiltestosterona por vía oral a un voluntario sano (sexo masculino, 38 años, 180 cm de altura y 80 kg peso corporal) el cual declaró no haber consumido ningún medicamento en los 7 días anteriores al estudio. Las muestras de orina se colectaron durante 170 horas y se mantuvieron en una temperatura de -20ºC hasta el momento del análisis.
El estudio cumplió con los requisitos de la Declaración de Helsinki para la investigación en humanos.
Preparación de las muestras para su análisis instrumental
Las muestras fueron preparadas según se describe en Martínez-Brito et al (2014) Brevemente, a 2 mL de la muestra de orina se adicionaron 25 μL de PI. Luego de realizar una hidrólisis enzimática con enzima β-glucuronidasa, se realizó una extracción líquido-líquido con tert-butilmetileter a pH básico. Los derivados trimetilsilil fueron evaluados por la técnica de CG-QqQ. Las muestras provenientes del estudio de excreción fueron simultáneamente evaluadas por la técnica de CG-EM.
Instrumentos
CG-QqQ: Cromatógrafo de gases Agilent 7890A acoplado a Espectrómetro de Masas triple cuadruplo (GC-QqQ, en tándem) de Agilent Technologies (modelo 7000B, 2015, EEUU).
Condiciones cromatográficas: Columna Capilar HP-Ultra1 (Agilent J&W GC, EEUU), metilsiloxane, longitud 19 m x 0,2 mm de diámetro interno y 0,11 μm de grosor de fase estacionaria, flujo constante 0,8 mL/min, volumen de inyección 2 μL, con un tiempo de análisis total de 20,12 min. El espectrómetro de masas (Agilent Technologies modelo 7000B, 2015, EEUU) fue operado en el modo monitoreo de reacciones múltiples (MRM), con una energía de ionización 70 eV, con un flujo de gas de enfriamiento (He), para disminuir el ruido químico.
CG-Q: Cromatógrafo de Gases HP 6890 acoplado a Espectrómetro de Masas cuadrupolar HP 5973 con Inyector Automático serie 7683, con software Agilent Enhanced Chemstation G1701CA versión C.00.00, (EUA). Se usó la misma columna cromatográfica. Flujo constante 0,9 mL/min, volumen de inyección 2 μL, con un tiempo de análisis total de 23,2 min. El espectrómetro de masas fue operado en el modo monitoreo selectivo de iones (SIM).
RESULTADOS Y DISCUSIÓN
El acoplamiento de técnicas cromatográficas con la EM incrementa la cantidad de información analítica obtenida, pero el uso de varios detectores, analizadores de masas en configuración tándem aumenta considerablemente la sensibilidad y la especificidad en el análisis de matrices complejas. Esto permite eliminar los fenómenos de falsos positivos y falsos negativos en un procedimiento analítico.
El monitoreo de reacción múltiple (MRM, Multiple Reaction Monitoring), según describe Garrido et al (2008), es uno de los métodos de adquisición de datos más interesantes del CG-QqQ y que lo hace único, pues permite, explorando y usando correctamente sus ventajas, convertirlo en un detector de masas altamente selectivo y sensible. En el primer analizador MS1 (Q1) se filtran iones precursores seleccionados (operación en modo SIM), mientras que en el segundo analizador MS2 (Q3) se filtran solo iones-producto de la transición o reacción de disociación del precursor. El registro de dos transiciones independientes, junto con el tiempo de retención permite confirmar inequívocamente la presencia de un analito-target en una mezcla compleja. El uso del triple cuadruplo operado en modo MRM, es de particular importancia para el análisis de compuestos presentes a nivel traza en matrices complejas, por ejemplo, análisis de residuos de pesticidas en alimentos, vegetales o muestras biológicas.
La Tabla 1 muestra las transiciones seleccionadas para cada analito, así como su energía de colisión y el tiempo de retención (TR) bajo las condiciones instrumentales para la detección de 23 compuestos.
Resultados del proceso de validación cualitativa
El primer parámetro que debe evaluarse durante un proceso de validación es el arrastre. En el supuesto caso de que el instrumento no sea capaz de recuperarse ante el análisis de una muestra concentrada, conllevando a la contaminación del siguiente resultado, se necesita la inyección de blancos intermedios entre muestras con el objetivo de obtener resultados independientes.
Luego del análisis de muestras a una concentración de 100 µg/mL no se observaron señales interferentes en las muestras blanco al tiempo de retención (TR) de los analitos ni del PI. Solamente la 19-noretiocolanolona mostró una interferencia de 0,2 % lo cual fue significativamente menor al criterio de aceptación del 10 %.
En el ensayo de la especificidad se observó que ninguno de los blancos de individuos diferentes mostró interferencias superiores al criterio de aceptación fijado. En la totalidad de los casos solamente se encontró una transición y nunca las dos seleccionadas para cada analito evidenciando la selectividad del método y como consecuencia evitando los falsos positivos en el procedimiento de pesquizaje.
Los resultados para el ensayo de precisión intra-día (repetibilidad) fue expresado en términos de dispersión característica de los resultados (Tabla 2). Para la CI, los valores de CV % se mantuvieron entre 0,9 y 16,9 %. El valor mayor se observó para el metabolito del Danazol, del cual se conoce su pobre patrón de fragmentación debido a su estructura y paso de formación de derivados. El comportamiento de la variación en la CS fue adecuado observándose entre 1,6 y 13,9 %.
El límite de detección (LD) se estimó a partir del valor de la relación señal: ruido obtenida en la concentración correspondiente a la dilución de los controles 1: 6 (n=10) que se corresponde con el 25 % del valor mínimo de detección exigido por la AMA según se describe en su documento técnico AMA-MRPL (2018). Como muestra la Tabla 2, los LDs obtenidos fueron extremadamente bajos y esto se debe a la alta selectividad de la técnica empleada, dando así cumplimiento de forma óptima a las exigencias de la organización.
El ensayo para la detección de esteroides en la orina abarca, además, la detección de sustancias de otros grupos farmacológicos como son estimulantes, β-bloqueadores o β-agonistas, por ese motivo se realiza la extracción líquido-líquido con el disolvente tert-butilmetileter. El objetivo de evaluar el ensayo de robustez sustituyendo este disolvente por n-pentano fue debido a su baja polaridad, lo cual permite disminuir las interferencias propias de la matriz, aumentar la sensibilidad y con ello aumentar la capacidad de detección. Al no comportarse de igual manera que el tert-butilmetileter no debería ser usado en el ensayo de pesquizaje, por tanto, se evaluó con el objetivo de ser usado posteriormente en ensayos de confirmación donde se requiere una mayor limpieza de la matriz.
El recobrado se mantuvo mayor al 50 % excepto para el 6β-hidroxi-turinabol (39 %). En este caso para las transiciones m/z 227 > 163 y m/z 315 > 227, la relación señal: ruido fue de 25 y 8 respectivamente en la concentración de 1,25 ng/mL (n = 10), por lo que su LD se estima inferior a 1 ng/mL.
La 19-norandrosterona, 19-noretiocolanolona, epimetendiol y los metabolitos de metiltestosterona 5α- y boldenona no mostraron diferencias significativas en la extracción con tert-butilmetileter y n-pentano (Test de Student, α = 0,05). Mientras que el metabolito del ciclofenil, 6β-hidroxi-metandienona y el 6β-hidroxi-turinabol mostraron cero recobrado cuando se extrajeron con n-pentano.
Estudio de excreción en orina de Metiltestosterona
La metiltestosterona se absorbe rápidamente en el tracto gastrointestinal. Los principales mecanismos metabólicos por los que atraviesa son las reducciones del grupo cetónico en C3 y el doble enlace entre los carbonos C4 y C5. Cada uno de estos metabolitos se obtiene en dependencia de la enzima que catalice la reacción, ya sea 5α-reductasa o 5β-reductasa. Los metabolitos son excretados en la orina gracias a la Fase II del metabolismo, conjugándose con el ácido glucurónido, según describe Martínez-Brito (2014).
Metabolito 1 (5α-), 17α-metil-5α-androstan-3,17-diol
La excreción urinaria del metabolito 5α- de la metiltestosterona, en el tiempo, se muestra en la Figura 1. A partir de las 51 horas no se observaron señales analíticas cuando se monitorea la transición m/z 318>187. Sin embargo, el monitoreo de la transición m/z 450>365 mostró una adecuada relación señal: ruido hasta las 73,5 horas (relación señal: ruido igual a 11 y 10 en los dos penúltimos puntos). La concentración máxima estimada para este metabolito fue de 47 ng/mL a las 11 horas de la administración y a las 22 horas se observó un ligero incremento que reflejó el efecto del primer paso.
Metabolito 2 (5β-), 17α-metil-5β-androstan-3,17-diol
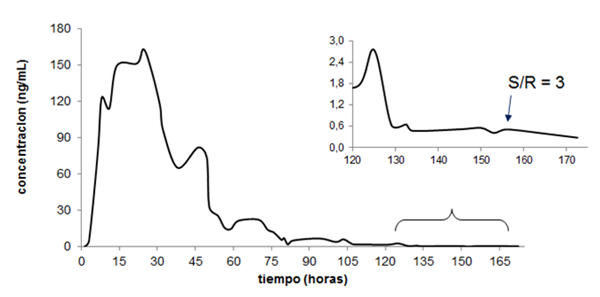
El metabolito 5β- de la metiltestosterona es, por excelencia, el marcador del consumo de metiltestosterona, se mantiene presente en el organismo por mucho más tiempo que su análogo 5α-. La Figura 2 muestra la excreción del metabolito 5β-. Aún a las 153 horas pudo ser detectado este analito con una relación señal: ruido igual a 3 y una concentración de 0,7 ng/mL. En las muestras colectadas posterior a las 153 y hasta las 173 horas que duró el estudio, pudo ser detectada una señal suficientemente clara como para ser llevado a cabo un proceso de confirmación. La concentración máxima estimada para este metabolito fue de 163 ng/mL a las 24,5 horas de la administración y a las 46 horas se observó todavía una concentración estimada en 81 ng/mL que al igual que el metabolito 5α-, reflejó el efecto del primer paso.
Comparación entre las técnicas instrumentales CG-Q y CG-QqQ
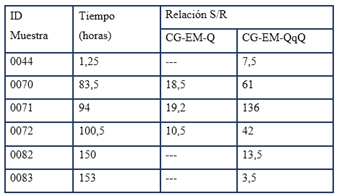
Las muestras provenientes del estudio de excreción fueron analizadas simultáneamente en ambos instrumentos con el objetivo de corroborar el nivel de detectabilidad alcanzado. Al comparar la relación señal: ruido para el metabolito 5β- por ambas técnicas, fue evidente la superioridad analítica del nuevo método usando la técnica CG-QqQ (Tabla 3).
La muestra 0044 corresponde a la primera muestra colectada después de la administración de la metiltestosterona. Mientras que el análisis por CG-QqQ ya mostraba señales analíticas con una buena relación señal: ruido, en el CG-Q no se detectaron señales analíticas. En las muestras 0070, 0071 y 0072 el CG-Q mostró señales con buena relación señal: ruido, pero mucho más bajas que las observadas en la técnica triple cuadruplo. Cuando en las muestras 0082 y 0083 se fue observando la disminución de la señal analítica en el cuadruplo triple, ya el simple cuadruplo había dejado de mostrar señales de positividad.
Tabla 1 Compuestos incluidos en el estudio de implementación de la técnica CG-EM-QqQ en el Laboratorio Antidoping.
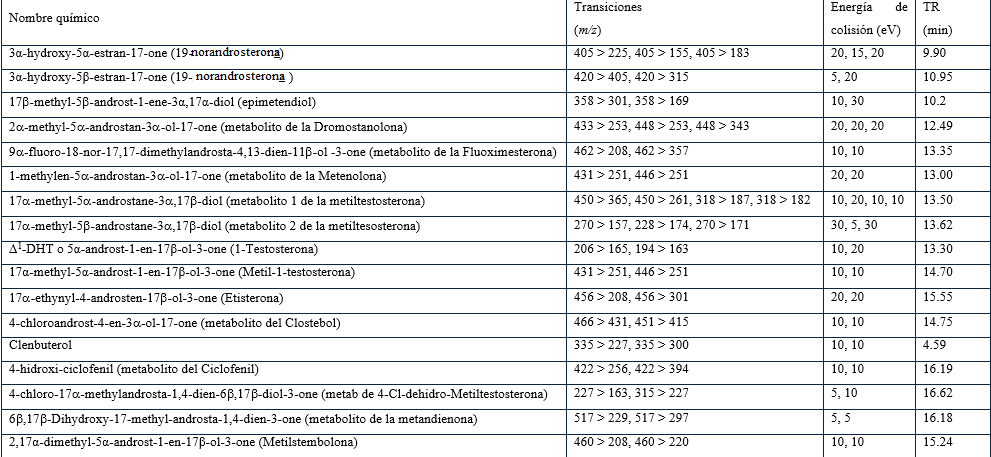
Tabla 2 Resumen de los resultados del proceso de validación.
Leyenda:
met.: metabolito; CV: coeficiente de variación para evaluación precisión intra-dia o repetibilidad; LD: límite de detección; RE: rendimiento de extracción; ROB: Robustez; MRPL: valor mínimo de detección exigido por la Agencia Mundial Antidopaje (por sus siglas en inglés); CS: control superior; CI: control inferior.
Tabla 3 Comparación entre las técnicas CG-EM-Q y CG-EM-QqQ en la evaluación de la relación señal: ruido para el metabolito 5β de la metiltestosterona.
Leyenda:
CG-EM-Q: cromatografía de gases acoplado a espectrometría de masas de cuádruplo simple; CG-EM-QqQ: cromatografía de gases acoplado a espectrometría de masas de triple cuádruplo; S/R: relación señal: ruido.
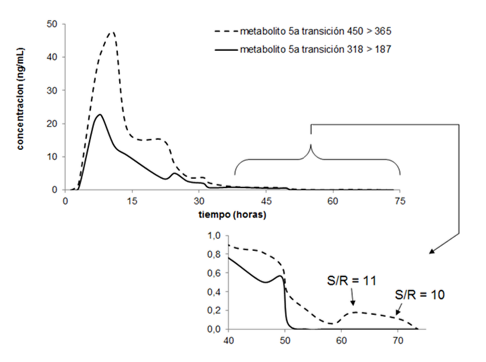
Fig. 1 Excreción urinaria del metabolito 5α- de la metiltestosterona medido por la técnica cromatografía de gases acoplado a espectrometría de masas de triple cuádruplo (CG-EM-QqQ).
CONCLUSIONES
Los ensayos ejecutados durante el proceso de validación demostraron que la introducción del espectrómetro de masas triple cuadruplo fue preciso, sensible y el instrumento demostró su recuperación luego del análisis de muestras concentradas. Los niveles de detección mínimos que exige la Agencia Mundial Antidopaje para las sustancias descritas fueron alcanzados satisfactoriamente, elevando la capacidad analítica del ensayo. Se demostró que los procesos de confirmación de ocho de los analitos evaluados pueden ser llevados a cabo con n-pentano en el paso de la extracción líquido-líquido, incrementando con ello el rendimiento de extracción y la sensibilidad. La aplicación del ensayo a muestras de orina provenientes de un estudio de excreción de metiltestosterona permitió corroborar la superioridad de la técnica implementada con respecto al uso del espectrómetro de simple cuádruplo, permitiendo la detección de este esteroide después de 153 horas de administrada una dosis única.