INTRODUCCION
En la actualidad, la malaria representa una menor carga global a la que existía en el año 2010 y muchos países con una carga baja de esta enfermedad están avanzando rápidamente para eliminarla, pero esta parasitosis continúa siendo un importante desafío para la salud pública (Organización Mundial de la Salud, OMS, 2019). El incremento en su severidad como resultado de la disminución de la transmisión (Varo et al, 2018; Njuguna et al, 2019), la eficacia limitada de las vacunas (Hviid et al, 2018) y la amenaza para el control por la emergencia de la resistencia al fármaco de primera línea contra Plasmodium falciparum (Giannangelo et al, 2019), representan factores que motivan la búsqueda de alternativas terapéuticas y nuevas dianas.
La malaria severa se caracteriza por la presencia de anemia, malaria cerebral, afectaciones a la placenta, fallo renal agudo y dificultad respiratoria y/o daño pulmonar agudo (Pereira et al, 2018). La oclusión de los vasos sanguíneos por los parásitos secuestrados que producen una disminución de la perfusión tisular, el aumento de la permeabilidad vascular de barreras como la hematoencefálica y la respuesta pro-inflamatoria y pro-trombótica del hospedero frente a la concentración alta de parásitos, están asociados a la fisiopatología de la malaria (Glennon et al, 2018). La mayoría de las investigaciones confluyen a que los daños al endotelio vascular están relacionados con los fallos de órganos en la malaria severa, de forma similar a la sepsis (Hemmer et al, 2011).
El estrés oxidativo está presente en la malaria severa, en particular en la malaria cerebral y en la dificultad respiratoria se considera que este contribuye a la disfunción inflamatoria vascular (Linares et al, 2013). Se reconocen al menos cuatro fuentes de especies reactivas del oxígeno (ERO): 1, el proceso inflamatorio iniciado en el hospedero en respuesta a la infección; 2, la catálisis de metales de transición y reacciones de Fenton debidas a que durante la digestión de la hemoglobina, el parásito libera cantidades significativas de hierro (Fe2+) no asociado y a que se produce hemólisis relacionada con la anemia; 3, la ocurrencia de los eventos de isquemia-reperfusión resultantes de los procesos de citoadherencia y de anemia estimulados por la infección y 4, la producción de ERO directamente por el parásito (Percario et al, 2012; Immenschuch et al, 2017; Barber et al, 2018).
El ozono es un agente oxidante fuerte que ha sido reconocido como una sustancia con alto poder germicida contra bacterias, hongos, virus y protozoos (Smith et al, 2017). Lell et al (2001) descubrieron que el ozono a 80 µg/mL produjo una inhibición significativa del crecimiento in vitro de P. falciparum, independientemente de si el contacto con el ozono se produjo sobre los eritrocitos hospedadores antes o después de la infección con parásitos, sin diferencias en relación a la madurez de los estados asexuales, pero aumentó el efecto si el ozono se aplicó en ambas fases.
Adicionalmente, la mezcla ozono/oxígeno ha mostrado efectos contradictorios sobre el sistema inmune, por una parte, puede estimular la defensa del hospedero contra los microorganismos, principalmente mediante reacciones como oxidante, similares a la producción de ERO por los neutrófilos durante la inmunidad adaptativa y por el aumento de la liberación de citoquinas pro-inflamatorias. Por la otra, existen estudios que reportan la reducción del estrés oxidativo y la regulación de la respuesta inflamatoria sistémica (Martin- Barrasa et al, 2015). Esto se relaciona con una mayor supervivencia a las infecciones bacterianas en modelos experimentales (Zamora et al, 2010; Guanche et al, 2010; Yamanel et al, 2011). Sin embargo, se describen también efectos indiferentes o agravantes del pre- tratamiento y de esquemas terapéuticos con ozono sobre la respuesta inflamatoria sistémica y el estado clínico en modelos de sepsis (Torossian et al, 2004; Zamora et al, 2007; Martin- Barrasa et al, 2015, Orhan et al, 2017).
La respuesta activadora de los sistemas de defensa antioxidante frente al ozono medicinal en diversas patologías (Menéndez-Cepero et al, 2008, León-Fernández, 2014) se relaciona con mecanismos de traducción de señales para la activación o represión de la transcripción de genes específicos (ej. Nrf2, del inglés, nuclear factor erythroid 2‐related factor 2) que tienen una vinculación estrecha con los mecanismos moduladores del estrés oxidativo y con la inflamación (Tu et al, 2019) y que pueden ser investigados como dianas en la malaria severa (Glennon et al, 2018).
Sin embargo, la actividad del ozono sobre la parasitemia in vivo y el curso de la infección malárica experimental no han sido analizadas previamente. Esta evaluación puede realizarse en diferentes modelos murinos, entre estos, la selección del modelo de infección de los ratones BALB/c con Plasmodium berghei ANKA aporta datos sobre el aumento progresivo y fatal de la parasitemia, hasta alcanzar valores >60% y anemia en un periodo de 15 días (Claser et al, 2017). Con fundamento en las potencialidades del ozono como germicida y antioxidante, en interrelación con la respuesta a la infección, el objetivo de este trabajo fue evaluar el efecto de la administración de varias dosis de ozono medicinal antes o en paralelo con la infección de ratones BALB/c con P. berghei ANKA.
METODOLOGÍA
Se realizó un estudio experimental, en los laboratorios de Parasitología, Investigaciones Farmacológicas y Bioterio del Instituto "Pedro Kourí".
Animales de experimentación
Se emplearon ratones hembras BALB/c de 6 a 8 semanas de edad y peso entre 17 y 20 g, suministrados por el Centro de Producción de Animales de Laboratorio (CENPALAB). Estos animales se adaptaron a su nuevo ambiente por más de 3 días antes de comenzar los experimentos. Los ratones se colocaron al azar en jaulas en grupos de 5-10 animales y se mantuvieron con acceso libre al agua y los alimentos, periodos de 12 h de luz y 12 h de oscuridad, temperatura de 25°C y humedad relativa del 70%. Los procedimientos experimentales fueron realizados con mínimo sufrimiento animal y reducción del número según Centro Estatal para el Control de los Medicamentos, Equipos y Dispositivos Médicos (CECMED, 2013).
Parásito y curso de la infección
La cepa de P. berghei ANKA (procedente del Laboratorio de Microbiología, Parasitología e Higiene de la Universidad de Amberes, Bélgica) se propagó por pases sucesivos de eritrocitos
parasitados en ratones BALB/c. En cada experimento, una suspensión de glóbulos que
contenía 0,5 x 106 parásitos en 0,1mL se inoculó mediante inyección intraperitoneal en cada ratón (Elias et al, 2012). La parasitemia se determinó al día 4 (d4), 7 (d7) y 10 (d10) post- infección (p.i.), mediante la extracción de 2 µL de sangre de la cola, preparación de extensiones finas, fijación con metanol y tinción con Giemsa. El conteo de eritrocitos parasitados se realizó según Schlichtherle et al (2000). El peso se determinó en una balanza técnica (SCALTEC, Alemania). Para la curva de supervivencia se registraron diariamente las muertes espontáneas en un periodo de observación de 20 días, ya que esta línea de ratón es menos susceptible a muertes tempranas entre los días 7 y 10 producidas por daños neurológicos.
Determinación de biomarcadores redox al d4 p.i
Se utilizaron grupos de 5 ratones sanos y 5 ratones infectados con P. berghei ANKA que al d4
p.i. se extrajo sangre del seno retro-orbital con anestesia inhalada para la obtención de sueros, a los que se les determinaron los parámetros bioquímicos siguientes: malonildialdehído (MDA), productos avanzados de la oxidación de proteínas (PAOP), organoperóxidos (HPO), potencial de peroxidación (PP), glutatión reducido (GSH), actividad enzimática de la catalasa (CAT) y de la superóxido dismutasa (SOD).
Para determinar la concentración de MDA, el ensayo se basó en la formación de un cromóforo producto de la reacción de una molécula de malonildialdehído y dos moléculas de N-metil-2-fenil-indol. El cromóforo es estable y absorbe a longitud de onda de 586 nm (Erdelmeier et al, 1998).
El método para cuantificar la concentración de HPO se fundamentó en la oxidación del ión ferroso a férrico por peróxidos orgánicos y el H2O2 en condiciones ácidas, determinando la absorbancia a longitud de onda de 560nm (McLemore et al, 1998).
La concentración de PAOP se determinó a partir del seguimiento de la transformación de los iones yodo a yodo diatómico, siguiendo el cambio de densidad óptica a longitud de onda de 340nm. Se utilizó como patrón cloramina T y los resultados se expresaron como μM de cloramina (Witko-Sarsat et al, 1999).
La actividad enzimática de SOD se determinó empleando el método de McCord y Fridovich (1969). En este se utiliza la descomposición catalítica de la xantina por la enzima xantina oxidasa, como fuente de aniones superóxido. Se midió la disminución de la reducción del citocromo C a través de espectrofotometría a una longitud de onda de 546 nm y el resultado se expresó en U/mg de proteína.
La actividad enzimática de CAT se determinó a partir del método de Clairbone (1986) que se basa en la descomposición de H2O2 en agua y oxígeno a través de la CAT, medido por espectrofotometría a longitud de onda de 240nm, se expresaron en U/g de proteína.
Para determinar la concentración de GSH se utilizó la preparación deslipidada de las muestras de suero en la que el GSH reaccionó con el 5,5´- ditiobis (2 ácido nitrobenzoico) para rendir un cromóforo que absorbe a longitud de onda de 412nm (Tietze, 1974).
El PP se determinó después de incubar muestras de suero con una solución de sulfato de cobre II (2mM, concentración final) a 37ºC por 24 h. Para estimar el PP se sustrajo, del valor de concentración de MDA determinado a las 24 horas, el obtenido al tiempo cero (Ozdemirler et al, 1986).
Las proteínas totales se determinaron por el método de Bradford et al (1976).
Administración de ozono
La mezcla O2/O3 se administró intraperitonealmente a razón de 1 mL por animal a partir de
cada lote en jeringuillas desechables de 20 mL, de polipropileno, émbolo siliconado y cerradas con acople de aguja No. 27 de material similar (SHANCHUAN, China). Cada lote de mezcla se generó con un equipo (Ozonobaric, SEDECAL, España) a partir de oxígeno grado medicinal y correspondió a las diferentes concentraciones de ozono que se produjeron por el propio instrumento que tiene incorporado un espectrofotómetro UV para calcular la concentración de ozono a partir de su absorbancia a 254 nm y contiene además un controlador del volumen y la velocidad de flujo del gas. Mediante el equipo se obtuvieron tres concentraciones de ozono: 5, 20 y 40 mg/L, por las cuales se obtuvieron dosis de 0,3 (D1); 1,5 (D2) y 2,5 (D3) mg/kg de peso corporal. Cada concentración preparada se utilizó inmediatamente. Para los controles negativos (sin ozono), se administró oxígeno medicinal.
Grupos experimentales
I.- Se emplearon cuatro grupos de 10 ratones cada uno, tres recibieron cuatro administraciones intraperitoneales (1 mL- ip.) diarias de dosis de 0,3 (D1); 1,5 (D2) y 2,5 (D3) mg/kg de ozono (grupos pre) y un grupo sirvió como control negativo, al término del esquema se chequearon los pesos y la supervivencia. Luego de un intervalo de reposo de dos días, los cuatro grupos se infectaron con P. berghei según descripción previa en el acápite 2.2 y se registró el curso de la infección en cuanto a parasitemia, peso y supervivencia.
II.- Se constituyó un esquema de tratamiento posterior a la infección formado por una serie (post1) de dos grupos de 5 ratones, uno recibió ozono (1 mL-ip.) cuatro veces, 1 vez por día, a D1 y un grupo control; y por otra serie (post2) de dos grupos de 5 ratones, uno recibió ozono a D3 (ip.) con la misma frecuencia descrita y un grupo control. En ambos casos, la inoculación de eritrocitos infectados (descripción previa) en el día inicial (d0) transcurrió 4 horas antes de la administración de ozono y ésta se continuó en los tres días siguientes de modo similar al ensayo de supresión de Peters et al (1975). También se siguió el curso de la infección en cuanto a parasitemia, peso y supervivencia.
III.- Se utilizaron dos grupos de 5 ratones cada uno: 1) se administró artemisinina (Sigma, E. U.) a 25 mg/kg, disuelta en dimetilsulfóxido (DMSO) al 10% en salina fisiológica estéril 0,9% (0,1 mL); 2) recibieron un volumen igual del vehículo; todos por la vía ip. y 3) no se administró sustancia. En el día 0 se infectaron los grupos 1-2, que después se les administraron las sustancias correspondientes en el mismo esquema descrito en II. Se determinó parasitemia y peso.
Análisis estadístico
El análisis estadístico se realizó mediante pruebas no paramétricas. Los resultados de la parasitemia y el peso se expresaron como medianas y rangos, comparados mediante la prueba U de Mann-Whitney o mediante la prueba de Kruskall-Wallis seguida de comparaciones múltiples de Dunn. Se utilizaron curvas de Kaplan-Meier para evaluar el perfil de supervivencia de los animales en cada grupo experimental y se compararon por las pruebas de Mantel/Cox y Gehan-Breslow-Wilcoxon. Las concentraciones séricas de biomarcadores redox se compararon mediante la prueba t de Student. Se empleó el programa estadístico GraphPad Prism (versión 5.0 para Windows, GraphPad software Inc, E.U). Un valor de p < 0,05 se consideró como estadísticamente significativo.
RESULTADOS
La infección de ratones BALB/c con P. berghei ANKA presentó al d4 valores de parasitemia con mediana 3,31 % (2,96% - 3,83%). En esta etapa temprana de la infección, se observaron diferencias estadísticamente significativas (p<0,05) en las concentraciones séricas de indicadores del balance redox, al comparar el grupo de infectados con controles sanos
(Tabla). Los valores de los indicadores de daño oxidativo y también de los que señalan un aumento de la capacidad antioxidante se incrementaron, mientras los valores de GSH disminuyeron. Estas variaciones indicaron la participación de procesos redox tempranamente, cuando cursa el d4 de la infección con P. berghei, coincidente con la etapa de administración y análisis del suministro del ozono.
Se determinaron los cambios de peso corporal para evaluar la potencialidad de producir toxicidad al administrar D1, D2 y D3 de ozono gaseoso, cuatro veces repetidas, 1 vez por día, por la vía i.p., En la figura 1A podemos constatar que no se produjeron diferencias estadísticamente significativas (p>0,05) entre las medianas y rangos del peso corporal de los ratones cuando se encontraban sin administrarles ozono y a continuación a d0 de la infección. Posteriormente, al seguir el avance de la infección en tratados con ozono y controles negativos, se produjo una disminución significativa del peso corporal en controles negativos al d7 (p< 0,05) y d10 (p<0,05); mientras se detectó decrecimiento significativo del peso corporal al d10 con el pre-tratamiento con las dosis D1 (p<0,01) y D2 (p<0,05) de ozono. (Fig. 1A).
En relación con la parasitemia, se observó una tendencia a variaciones entre los que recibieron pre-tratamiento con ozono y controles negativos, pero solamente constituyó una reducción estadísticamente significativa (p<0,05) con la dosis D3 (Fig. 1B). La parasitemia se incrementó en los controles negativos al d7 con mediana 20,9% (15,4% - 30,0%), pero no mostró diferencias (p>0,05) con los tratados con ozono. Sin embargo, la comparación de las curvas de supervivencia de los 4 grupos estudiados mostró que las curvas obtenidas con las tres dosis de ozono (con medianas de 16 d (D1), 16 d (D2) y 14 d (D3)) se desplazaron respecto al control (mediana de 10,5 d), aunque no alcanzaron significación estadística (p>0,05) (Fig. 1C).
El tratamiento p.i con ozono a D1 y D3 tampoco reflejó toxicidad, estimada por la ausencia de cambios significativos (p>0,05) en el peso corporal entre d0 y d4 de cada grupo estudiado. Sin embargo, se observó un aumento estadísticamente significativo de la parasitemia al d4 en los grupos tratados con D1 (p<0,01) y D3 (p<0,05) en comparación con los controles negativos (Fig. 2). Con este esquema, el aumento inicial de la parasitemia no determinó cambios posteriores en el curso de la infección ya que las diferencias en la parasitemia no se mantuvieron a d7 y d10, mientras las medianas del peso y las curvas de supervivencia de los grupos tratados y sus respectivos controles fueron similares.
Por otra parte, se alcanzó una reducción total estadísticamente significativa (p<0,05) de la parasitemia con el fármaco de referencia artemisinina a 25 mg/kg. Esta dosis no provocó cambios en el peso de los animales, estimados hasta d4. Es un resultado contrario a la aplicación de ozono en el esquema de supresión de Peters et al (1975) en el experimento anterior, lo cual confirma la importancia de la abundancia relativa in vivo de ozónidos y otros derivados de la interacción del ozono con fluidos biológicos, para obtener actividad antiparasitaria.
DISCUSIÓN
La terapia con ozono provee la intervención en mecanismos que permiten restablecer el balance de los estados redox alterados que se producen con diferente impacto en diversas situaciones patológicas (Smith et al, 2017) y en dependencia de la influencia del estrés
oxidativo en la patología es posible obtener éxito terapéutico. Las experiencias publicadas sobre el ozono describen una reducción de los marcadores de oxidación de lípidos y proteínas, el restablecimiento de los niveles de glutatión reducido y la normalización o estimulación de la actividad de enzimas antioxidantes (León-Fernández, 2014; Smith et al, 2017).
En este trabajo se observaron diferencias estadísticamente significativas (p<0,05) en las concentraciones séricas de biomarcadores redox. Se mostró un aumento de los indicadores de daño oxidativo a lípidos y proteínas, al comparar el grupo de infectados con controles sanos, en el d4, etapa temprana de la infección. Este resultado puede estar relacionado con la producción sostenida de ERO producto de la activación del sistema inmune del hospedero ante la infección parasitaria y a que el parásito degrada la hemoglobina liberando hierro, el cual constituye un catalizador de las reacciones de oxidación. En correspondencia, el aumento de la actividad de las enzimas SOD y CAT está relacionado con el aumento de sus sustratos. Este incremento en el daño oxidativo por la infección sugiere que se produce simultáneamente un consumo de los antioxidantes secundarios como el GSH (Bilgin et al, 2012).
En un estudio anterior con la misma especie y cepa, se detectó un aumento de la cantidad de dienos conjugados, así como lipoproteínas de baja densidad oxidadas en plasma de ratones BALB/c infectados (Elias et al, 2012). En el modelo de infección de ratones suizos con P. berghei NK65, la concentración de MDA en suero, hígado y encéfalo de animales infectados también aumentó significativamente, mientras las actividades de CAT y SOD se redujeron (Ibrahim et al, 2012). En la medida que la infección avanzó hacia los días 7 y 12 p.i., Elias et al (2012) detectaron altos niveles de Fe hemático libre en la circulación, generadores de estrés oxidativo a partir de la producción de radicales hidroxilos. En paralelo, este modelo de malaria murina mostró como daños significativos a órganos, el aumento progresivo de la permeabilidad vascular renal con aumento de la creatinina y urea sanguínea que comenzó en el d4 (Elias et al, 2012). En este punto también determinaron que la actividad de la hemoxigenasa-1 renal estuvo deficiente, así como descendieron los niveles de bilirrubina indirecta y TGF-beta (del inglés- Tumor Growth Factor- beta) en plasma. No determinaron la actividad enzimática de CAT, SOD, tampoco la concentración de GSH (Elias et al, 2012). Más adelante en el curso de la infección, otras investigaciones describen la aparición de anemia (Claser et al, 2017) y de daños gastrointestinales consistentes en dilatación gástrica severa, acumulación de gases y adelgazamiento y fragilidad mesentéricos que llevan a las pérdidas de peso significativas y en su conjunto finalmente contribuyen a la mortalidad (Shimada et al, 2019).
Estudios realizados en modelos de choque séptico donde el ozono se aplicó en forma de pre- condicionamiento oxidativo o de forma terapéutica, han mostrado que actúan por diferentes mecanismos de acción. Cuando el ozono es aplicado preventivamente, su acción es sobre un organismo sano, por tanto, es capaz de preparar a este (tanto desde el punto de vista inmunológico como bioquímico) para enfrentar la sepsis que se va a inducir posteriormente (Zamora et al, 2007). Así los resultados del experimento I podrían estar relacionados con una actividad sobre los procesos inflamatorios relativamente moderados debidos a la liberación masiva de parásitos y componentes internos del glóbulo rojo durante la ruptura del esquizonte (Deroost et al, 2016) y que se reflejan en los daños a órganos descritos para este modelo de malaria murina. Esta actividad podría haber favorecido el retardo del decrecimiento del peso corporal y la mortalidad en los grupos pre-tratados con ozono.
Los antioxidantes más frecuentemente investigados en la malaria son las vitaminas C y E, N- acetilcisteína, folato y desferroxamina. Estos ensayos en general contribuyeron a conocer que los antioxidantes que actúan estrictamente como secuestradores de radicales libres pueden disminuir el daño celular y las patologías inducidas por la infección con Plasmodium, pero desafortunadamente tienden a aumentar la supervivencia de los parásitos maduros en el hospedero (Isah y Ibrahim, 2014, Delhaye et al, 2018). Recientemente, se obtuvo que la administración de oxígeno hiperbárico disminuyó la activación endotelial en la malaria cerebral experimental en el modelo de ratones C57BL/6 infectados con P. berghei ANKA, conjuntamente, la acumulación vascular de parásitos y leucocitos se redujo, de este modo mejoró el flujo sanguíneo microcirculatorio cerebral y la hipoxia (Bastos et al, 2018).
La infección de los ratones BALB/c con P. berghei ANKA se ha caracterizado como una respuesta antiparasitaria ineficiente debida a una insuficiente activación inmune y/o una regulación negativa excesiva que favorece la replicación del parásito y resulta en hiperparasitemia (Deroost et al, 2016). En el caso de los resultados del pre-tratamiento con ozono, se requerirá profundizar en la caracterización, pues al disminuir inicialmente la parasitemia, nos sugiere una etapa de activación inmune seguida de otra anti-inflamatoria o una respuesta pro-inflamatoria modulada (Otta et al, 2018).
Por el contrario, en la administración de ozono p.i. se observó un aumento de la parasitemia al d4, lo cual no se relaciona con los efectos antiparasitarios in vitro reportados por Lell et al (2001). En un esquema p.i. con vitamina E, por vía i.p. durante 14 días, se detectaron los parásitos desde el día 3 p.i. y se mantuvieron niveles similares de parasitemia entre no tratados y tratados hasta el día 11 p.i. cuando el tratamiento con la vitamina disminuyó la parasitemia hasta el final del experimento (Ibrahim et al, 2012). En la exposición a 100% oxígeno hiperbárico desde d0 hasta d10, los autores mostraron una reducción diaria significativa de la parasitemia a partir del d4 en relación a los no expuestos, que no detiene el incremento de la parasitemia en el curso de la infección en el modelo de malaria murina causada por P. berghei NK65, pero sí el curso de enfermedad neurológica en el modelo de malaria cerebral con P. berghei ANKA (Blanco et al, 2008). Los efectos del ozono por vía i.p. sobre los modelos de sepsis en esquemas terapéuticos no son los mejores, se argumenta que es difícil lograr una modulación previa en un tiempo breve para lograr una respuesta adecuada, que se requeriría evaluar otras dosis y vías de administración (Zamora et al, 2007), con el cuidado de que el ozono medicinal a dosis relativamente altas en un organismo con señales de estrés oxidativo puede dañar las enzimas antioxidantes (Borrego et al, 2004).
Aunque el ozono puede provocar efectos germicida y antioxidante ya que tras su disolución en fluidos biológicos reacciona con los ácidos grasos poli-insaturados y agua para formar peróxido de hidrógeno y una mezcla de productos de la ozonización tales como lipoperoxilos, hidroperóxidos, MDA, isoprostanos, ozónidos, alquenos y 4-hidroxinonenal (Smith et al, 2017), el análisis de los experimentos II y III (de tratamiento p.i.) nos sugiere que no se produjo suficiente concentración de ozónidos a partir de la administración i.p. de ozono gaseoso, a pesar de utilizarse dosis altas para conseguir actividad antiparasitaria.
Los resultados de este trabajo motivan a profundizar en investigaciones del efecto del ozono en esquemas de pre-tratamiento, pero aún más sobre el más correcto régimen de combinación de este antioxidante y un fármaco antimalárico como opción terapéutica, en la que no deberá faltar un análisis de la conexión con los elementos de la respuesta antioxidante, de la respuesta inmune y de los posibles beneficios sobre los daños a órganos ocasionados por la malaria severa.
Tabla 1 Concentraciones séricas de indicadores redox en ratones BALB/c infectados con P. berghei ANKA al día 4 p.i.
| Indices Redox | Sanos o controles (M ± DE) | |
|---|---|---|
| Daño Oxidativo | ||
| MDA (μmol/g Hb) | 1,68 ± 0,23 | 3,02± 0,27 * |
| HPO (M) | 2,09 ± 0,44 | 3,82 ± 0,5 * |
| PAOP (M Cloramina T) | 13,31 ± 0,75 | 18,13 ± 0,89 * |
| Capacidad antioxidante | ||
| GSH (M/g Hb) | 11,58 ± 0,66 | 7,03 ± 0,77 * |
| CAT (U/mg min) | 249,00 ± 28,46 | 368,71 ± 12,57 * |
| SOD (U/mg min) | 23,41 ± 1,64 | 25,17 ± 1,50 * |
| PP (M) | 3,92 ± 0,69 | 5,80 ± 0,27 * |
*: Representa diferencias significativas (p< 0,05) con respecto al grupo sano. M: media
DE: desviación estándar

Fig 1.A Análisis de las medianas y rangos mínimos y máximos del peso corporal de ratones BALB/c en grupo control y tres subgrupos que recibieron el esquema de tratamiento previo con ozono gaseoso formado por cuatro administraciones ip. diarias a dosis de 0,3 (D1); 1,5 (D2) y 2,5 (D3) mg/kg (grupos pre); luego fueron infectados con 0,5 x 106 eritrocitos parasitados con P. berghei ANKA en 0,1mL y el peso se registró inicialmente y a d0, d4, d7 y d10 p.i. Diferencias significativas dentro de un mismo grupo comparado con el inicio de la infección se indican con *p< 0,05 y **p< 0,01, obtenidas por la prueba de Kruskall Wallis y comparaciones múltiples de Dunn. B. Parasitemia al d4 pi (valores de medianas y rangos mínimos y máximos) de ratones BALB/c en grupo control y grupos que recibieron el esquema de tratamiento previo con D1, D2 y D3 de ozono. *Indica diferencias significativas a p< 0,05 según la prueba U de Mann Whitney. C. Perfil de supervivencia de ratones BALB/c del grupo control y grupos que recibieron el esquema de tratamiento previo con D1, D2 y D3 de ozono.
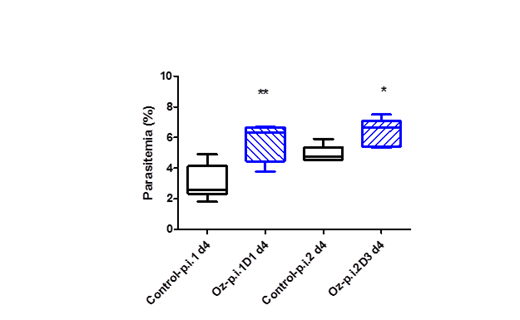
Fig. 2 Parasitemia en el d4 p.i. (Valores de medianas y rangos mínimo y máximo) de ratones BALB/c todos infectados con P. berghei ANKA a d0. En la serie p.i.1 se compararon dos grupos de 5 ratones, uno recibió la D1 de ozono (ip.) cuatro veces, 1 vez por día (d0-d3) y otro grupo fue control. En la serie p.i.2 de dos grupos de 5 ratones, uno recibió la D3 (ip.) de ozono con la misma frecuencia y otro fue ontrol. *Indica diferencias significativas a p< 0,05 y ** a p< 0,01 dentro de cada serie; según la prueba U de Mann Whitney.
CONCLUSIONES
Se concluye que solamente el ozono antes de la infección manifestó efecto contra esta, Los resultados de este trabajo motivan a profundizar en investigaciones del efecto del ozono en esquemas de pre-tratamiento, pero aún más sobre el más correcto régimen de combinación de este antioxidante y un fármaco antimalárico como opción terapéutica, en la que no deberá faltar un análisis de la conexión con los elementos de la respuesta antioxidante, de la respuesta inmune y de los posibles beneficios sobre los daños a órganos ocasionados por la malaria severa.














