Introducción
Los niveles séricos elevados de lipoproteína de baja densidad- colesterol (LDL-C) y colesterol total (CT) son los principales factores de riesgo de enfermedad coronaria (Ference, Graham, Tokgozoglu & Catapano, 2018; Lusis, A., 2012; Wu, Gao, Zheng, Ma & Xie, 2018), y ha sido demostrado que la reducción del LDL-C reduce el riesgo coronario (Downs et al., 1998; Expert Panel of Detection, Evaluation and Treatment of High Blood Cholesterol in Adults, 2001; Heart Protection Study Collaborative Group, 2002; Shepherd et al., 2002; Tonkin et al., 1998). Por lo tanto, la reducción de LDL-C es un objetivo principal en el control de los lípidos en sangre para la prevención coronaria (Expert Panel of Detection, Evaluation and Treatment of High Blood Cholesterol in Adults, 2001; Grundy et al., 2004; Teramoto et al., 2007).
Además de la reducción del LDL-C, es importante controlar otras variables lipídicas, de modo que los cambios beneficiosos del perfil lipídico incluyan aumentos de colesterol unido a lipoproteínas de alta densidad (HDL-C) y reducción de triglicéridos (TG) (Expert Panel of Detection, Evaluation and Treatment of High Blood Cholesterol in Adults, 2001; Hata et al., 2002; Piepoli et al., 2016).
Los cambios terapéuticos en el estilo de vida, que incluyen la adherencia a una dieta estándar para reducir el colesterol, se recomiendan como la opción de primera elección para tratar la dislipidemia. La dieta sola, sin embargo, con frecuencia no es suficiente para alcanzar los valores sanguíneos adecuados de LDL-C, principalmente en pacientes de alto riesgo que requieren niveles de esta variable más restrictivos. En estos casos, debe indicarse el uso de fármacos hipolipemiantes (Expert Panel of Detection, Evaluation and Treatment of High Blood Cholesterol in Adults, 2001).
Por otra parte, el estrés oxidativo ha sido asociado a la patogénesis de muchas enfermedades humanas por lo que se ha ampliado el uso de antioxidantes, particularmente como tratamiento para accidentes cerebrovasculares y enfermedades neurodegenerativas. Los antioxidantes también son ampliamente utilizados como ingredientes en suplementos dietéticos para prevenir enfermedades enfermedades cardiovasculares (Leopold, J., 2015).
En muchos de estos casos, no está claro si los oxidantes desencadenan la enfermedad, o si se producen como consecuencia de esta y provocan los síntomas de la enfermedad (Valko et al., 2007). Un ejemplo de ello es el papel del estrés oxidativo en las enfermedades cardiovasculares. Aquí, la oxidación de la lipoproteína de baja densidad (LDL) parece accionar el proceso de aterogénesis, que da lugar a la aterosclerosis, y finalmente a la enfermedad cardiovascular (Aviram, M., 2000; Van Gaal, Mertens & De Block, 2006).
La existencia de plantas con un elevado potencial terapéutico constituye una alternativa farmacológica de marcado interés en el tratamiento de estas enfermedades.
Sacha inchi (Plukenetia volubilis L.) es una planta semileñosa y perenne de la familia Euphorbiaceae con gran expansión económica en América Central y del Sur, así como en algunos países del sudeste asiático, como China, Tailandia y Vietnam. Esta especie ha sido cultivada por los indígenas de la Amazonia peruana durante siglos. Sus semillas, utilizadas como alimento para los nativos de la selva amazónica, son una buena fuente de aceite (35-60%), proteína (25-30%), aminoácidos, ácido oleico, minerales y vitamina E (tocoferoles y tocotrienoles) (Chirinos et al., 2013; Gutiérrez, Rosada & Jiménez, 2011; Hamaker et al., 1992). Los aceites de esta planta contienen ácidos grasos, específicamente con muy alto contenido (47-51%) del ácido omega-3 α-linolénico (ALA) (Bondioli & Della Bella, 2006; Maurer, Hatta-Sakoda, Pascual-Chagman & Rodriguez-Saona, 2012), el cual ha demostrado reducir el riesgo de enfermedades cardiovasculares (Harris, W., 2005; Harrison & Abhyankar, 2005 y Lavie, Milani, Mehra & Ventura, 2009), favorecer el balance de citoquinas anti-inflamatorias vs. las proinflamatorias (Pischon et al, 2003; Zhao et al, 2007), así como ejercer efectos neuroprotectores, hipotriglicerolémicos y anti-hipertensivos (Barceló & Murphy, 2009; Crupi, Marino & Cuzzocrea, 2013; Simopoulos, A., 2011).
Los otros ácidos mayoritarios en el aceite de Sacha Inchi son el ALA, del tipo omega-6 (33-36%) y el ácido oleico, del tipo omega-9 (9-10%) (Chirinos et al., 2013; Follegatti, Piantino, Grimaldi & Cabral, 2009; Gutiérrez et al., 2011; Maurer et al, 2012), para una proporción de ácidos ω-6/ω-3 que se considera dentro del intervalo ideal para mantener la homeostasis, el desarrollo normal y la salud mental (Simopoulos, A., 2011). Entre los efectos demostrados de este aceite se encuentran la protección cardiovascular, favorecer el desarrollo cognitivo (Nokdhes & Sittiprapaporn, 2017), y ejercer efectos hipocolesterolemizante (Córdova et al, 2006; Garmendia, Pando & Ronceros, 2011; Gonzales & Gonzales, 2014), antioxidante (Chirinos et al., 2013) y anticancerígeno (Wang, Zhu & Kakuda, 2018).
El aceite de Sacha inchi (ASI) tiene un gran valor nutricional, debido a su alto contenido de ácidos grasos poliinsaturados (PUFA) y vitamina E. Los ácidos ALA (C18: 3, ω-3) y linoleico (AL, C18: 2, ω-6), principales ácidos grasos presentes en ASI, son esenciales para el crecimiento y desarrollo normal de los seres humanos. Las dos familias de ácidos grasos omega-6 (AL) y omega-3 (ALA) son fisiológica y metabólicamente distintos y no pueden ser sintetizados en el cuerpo humano y deben ser obtenidos de la dieta.
Una vez que el ALA llega al organismo, la enzima delta-6 desaturasa inicia su conversión en ácido eicosapentaenoico y finalmente en ácido docosahexaenoico (Burdge 2006; Burdge & Wootton 2002; Monteiro, Askarian, Nakamura, Moghadasian & Ma, 2013). En consonancia con lo anterior, la administración del aceite de Sacha Inchi a voluntarios sanos, a diferencia de lo que ocurrió al administrar aceite de girasol (con bajo contenido de ALA), provocó un aumento en las concentraciones plasmáticas de los ácidos omega-3 ALA y docosahexaenoico (Gonzales, Gonzales & Villegas, 2013). Todo lo anterior sustenta que se recomiende el consumo de aceites con altos contenidos de ácidos omega-3, de origen animal o vegetal, como una alternativa eficaz para la prevención y protección contra las enfermedades cardiovasculares y como neuroprotectores, entre otros efectos beneficiosos (Crupi et al, 2013; Maurer et al, 2012; S.I.P.O., 2012).
En estudios previos realizados en Perú se evaluó la toxicidad subcrónica (60 días) en ratas y la dosis letal 50 (DL 50) en ratones de los aceites crudos de sacha inchi, demostrando por un lado que no es tóxico en ratas luego de administrarse durante 60 días y que presenta una DL50 superior a los 37 g/kg y, por el otro se observó una disminución, a los 60 días de consumo, de colesterol total y triglicéridos, mientras que el marcador HDL se incrementó durante el estudio; lo que podría vislumbrar un potencial efecto en la prevención de eventos cardiovasculares (Arilmi et al., 2010).
Dado el gran interés que ha cobrado el uso del ASI para las industrias alimenticias y farmacéuticas a nivel mundial, en nuestro país se ha desarrollado en los últimos años el cultivo de la planta y la obtención de su aceite, lo que propicia que se pueda contar por primera vez en el país con un aceite rico en ALA. Sin embargo, hasta el presente no se han realizado estudios toxicológicos preclínicos que evalúen la toxicidad del ASI de origen cubano.
Los estudios agudos realizados en especies roedoras son imprescindibles en la primera etapa de la investigación de una nueva sustancia con potencialidades para convertirse en medicamento. El método alternativo a la toxicología aguda, método de las clases (OECD, 2002), se encuentra validado para ser empleado en cualquier especie comúnmente usada en estudios toxicológicos agudos, no obstante, los roedores constituyen las especies de elección. Este método permite clasificar la toxicidad aguda de la sustancia evaluada al tiempo que se emplea un reducido número de animales. Por tanto, el objetivo del presente trabajo fue evaluar la toxicidad oral por dosis únicas del aceite de Sacha inchi en ratas utilizando el método de las Clases.
Materiales y Métodos
Animales:
Se emplearon ratas Sprague Dawley, suministradas por el Centro de Producción de Animales de Laboratorio (CENPALAB, Cuba), adultos jóvenes de 6-8 semanas, de ambos sexos, cuyo peso corporal oscilaba entre 200-250 g al inicio del estudio.
Se utilizó esta especie roedora por ser la más empleada en los estudios agudos, por otra parte, de esta línea se tienen amplios conocimientos en nuestro laboratorio.
Los animales se adaptaron durante siete días a las condiciones del laboratorio: temperatura 20-25 ºC, humedad entre 50-70 % y ciclos de luz- oscuridad de 12 horas. El alimento que se les administró durante toda la experiencia fue pienso estándar para esta especie preparado en el CENPALAB. El acceso al agua y al alimento fue ad libitum.
Toda la manipulación de los animales se realizó de acuerdo con los principios éticos para el uso de los animales de Laboratorio recomendados en los lineamientos internacionales y en la República de Cuba, plasmados en los Procedimientos Normalizados de Trabajo establecidos en el Centro de Productos Naturales. El protocolo de aprobación por el Comité de ética para el trabajo con animales de experimentación fue el 022/2017.
Sustancia de ensayo:
El aceite de Sacha inchi es un extracto lipídico obtenido de la semilla de Plukenetia volubilis L. (Sacha inchi), planta nativa de la Amazonía, conocida también como maní del monte, sacha inchik y maní de inca, que contiene un alto contenido de ácidos grasos esenciales (omega 3 y 6), ácido oleico y vitamina E (tocoferoles y tocotrienoles). Fue suministrado por la Entidad de Ciencia Tecnología e Innovación (ECTI) “Sierra Maestra”. La sustancia es un líquido aceitoso transparente que fue almacenado en frasco ámbar de cristal y mantenido en lugares frescos y protegidos de la luz. Se utilizó el lote 17006.
El aceite de sacha inchi se administró tal cual y se preparó una disolución de NaCl (0,9 %) para administrar al grupo control.
Se realizó una administración única mediante intubación gástrica, en ayunas, en el horario de la mañana. Se empleó la vía oral por ser la que coincide con la utilizada en la terapéutica. Además, esta vía es la recomendable en el caso de productos a administrar por vía oral en que no se conozcan todos los aspectos de su farmacocinética.
Grupos experimentales
Teniendo en cuenta evaluaciones toxicológicas que se han realizado a este aceite en los cuales se han utilizado determinados niveles de dosis sin que se haya manifestado ningún cuadro clínico indicativo de daño inducido por la sustancia, y las características propias de este método experimental se inició el estudio por la mayor dosis recomendada para este ensayo (ensayo límite). Este método parte del concepto de un uso escalonado de dosis a partir de una dosis de partida, que en este caso fue de 2000 mg/kg en machos y en hembras (OECD, 2002).
Se distribuyeron los animales en dos grupos experimentales/sexo de tres animales cada uno. Un grupo recibió el aceite de sacha inchi (2000 mg/kg) y el otro, volúmenes equivalentes del vehículo: disolución de NaCl (0,9 %).
Variables analizadas
Al realizar la administración de la sustancia de ensayo se observaron los animales cada una hora las primeras cuatro horas, luego cada cuatro horas hasta las 12 horas de la administración (primer día). A partir de las 24 h de la administración las observaciones se realizaron dos veces al día hasta completar los 14 días.
Se registró la mortalidad y la presencia de los siguientes signos clínicos: alopecia, ataxia, nivel de actividad general, catalepsia, aspecto general, convulsiones, aspecto de la cola, apnea, aspecto de los ojos, disnea, aspecto de los genitales, edema en las patas, aspecto de las heces, epistaxis, aspecto de la orina, piloerección, características de la marcha, lesiones en la piel, nódulos o abscesos, reflejos, ptosis palpebral, taquipnea, lagrimeo, salivación, sangrado ocular, temblores.
El peso corporal se controló al inicio, a los siete días y al final de la experiencia. Los animales fueron pesados en una balanza CP3202P (Sartorius, Alemania).
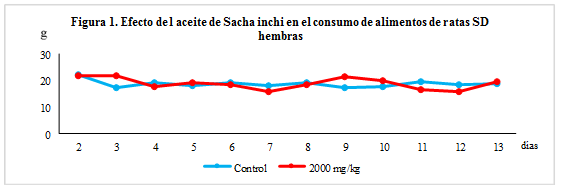
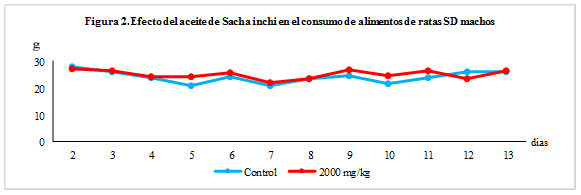
El consumo de alimentos se controló durante toda la experiencia. Fue calculado diariamente por diferencia de pesada entre alimento suministrado y alimento remanente.
Necropsia y examen histopatológico
Luego de 14 días de administración, se realizó la necropsia de todos los animales, para lo que fueron anestesiados con tiopental sódico (30 mg/kg) y desangrados hasta morir. Se realizó el análisis macroscópico de órganos y cavidades y se examinó el contenido de las cavidades abdominal, torácica y craneana.
Análisis estadístico
El análisis del peso corporal y el consumo de alimento se realizó de manera independiente para cada sexo mediante análisis de varianza (ANOVA). El nivel de significación establecido fue de p< 0,05. Todos los análisis se realizaron empleando el Statsoft for windows. StatSoft, Inc. (2003). STATISTICA (data analysis software system), versión 6.
Resultados y Discusión
La administración de dosis orales únicas (2000 mg/kg) del aceite de Sacha inchi a ratas SD no produjo muertes durante el transcurso de la experiencia, ni se manifestaron signos clínicos indicativos de toxicidad en ninguno de los animales.
En el peso corporal no se encontraron diferencias significativas en ninguno de los intervalos estudiados entre animales tratados y controles (Tabla 1).
Tabla 1 Efectos de dosis orales únicas del aceite de Sacha inchi sobre el peso corporal (g) (X ± DE) de ratas SD.

X media; DE desviación estándar
En cuanto al consumo de alimento tampoco mostró diferencias significativas en ninguno de los grupos estudiados (Figuras 1 y 2). Estos resultados permiten definir que el aceite de Sacha inchi debe tener una toxicidad aguda superior a los 2000 mg/kg en ratas SD y, por tanto, según la metodología empleada su toxicidad es no clasificable.
`
El estudio macroscópico reveló que ningún animal presentaba lesiones en las cavidades y órganos examinados al momento de la necropsia, por lo cual no existieron diferencias entre animales tratados y controles. Los resultados anteriores, unidos a la no ocurrencia de muertes durante el estudio determinó que no se tomaran muestras para estudio histopatológico, tal como fue establecido en el protocolo.
La administración de dosis orales únicas (2000 mg/kg) de aceite de Sacha inchi a ratas SD no produjo muertes ni signos de toxicidad, por lo cual este aceite puede clasificarse como una sustancia no tóxica. Este estudio siguió el método de Toxicidad Aguda de las Clases (ATC, siglas en inglés), que persigue brindar una aproximación sobre la toxicidad de la sustancia a investigar a partir de la administración única de un solo nivel de dosis previamente definido. Se consideró la naturaleza de la sustancia a evaluar y se realizó el ensayo con la dosis límite propuesta (2000 mg/kg) (OECD, 2002). Este tipo de estudio, desarrollado preferiblemente en roedores, centra su atención en la detección de signos clínicos indicativos de toxicidad, ausentes en los animales tratados de ambos sexos, e incluye la realización de necropsia de los sobrevivientes a los 14 días de administrar la sustancia (OECD, 2002), la cual no reveló lesiones macroscópicas en los animales evaluados.
Conclusiones
El aceite de Sacha inchi presenta una toxicidad intrínseca baja, mostrando una toxicidad por dosis orales únicas superior a los 2000 mg/kg de peso corporal, dosis a la que no se evidencian signos indicativos de toxicidad en ninguno de los sexos, por lo que su toxicidad se puede declarar como no clasificable según el método ATC.