INTRODUCCIÓN
De acuerdo con el Instituto Nacional de Alergia y Enfermedades Infecciosas y la Academia Europea de Alergia e Inmunología Clínica, la alergia alimentaria (AA) se define como una “reacción adversa hacia determinados alimentos, que surge de una respuesta inmune específica, ya sea mediada por inmunoglobulina E (IgE), por células o por ambos”. La Organización Mundial de Alergia ha declarado que 2.5 % de la población en general padece algún tipo de AA, aunque los valores pueden variar de 1 a 10 % dependiendo de diferentes factores. La población infantil es la que resulta más afectada, con una prevalencia de 6 a 8 % (Reyes-Pavón et al., 2020).
Dentro del grupo de las alergias alimentarias, la mediada por IgE tiene una mayor repercusión desde el punto de vista clínico, ya que puede desembocar en la aparición de reacciones graves (De la Cruz et al., 2018). La IgG4 alergeno específica actúa como un anticuerpo bloqueador al competir con la IgE alergeno específica en la unión de alergenos e inhibir la formación del complejo IgE-alergeno y es ampliamente considerado como un marcador de tolerancia a enfermedades alérgicas. El término respuesta Th2 modificada se ha utilizado para reflejar títulos altos de IgG4 alergeno específica que se presentan durante los estados de tolerancia (McGowan et al., 2019).
Los alergenos alimentarios son proteínas o glucoproteínas de aproximadamente 5 a 100 kDa de peso molecular (PM) con capacidad de unirse específicamente a la IgE de pacientes alérgicos. Los principales alergenos alimentarios agrupados en el denominado grupo de los “grandes 8” son: leche, huevo, maní, frutas secas, pescados, mariscos, soya, trigo y sus derivados. No obstante, la prevalencia de la AA a estos alimentos es variable en distintos países del mundo (Reyes-Pavón et al., 2020).
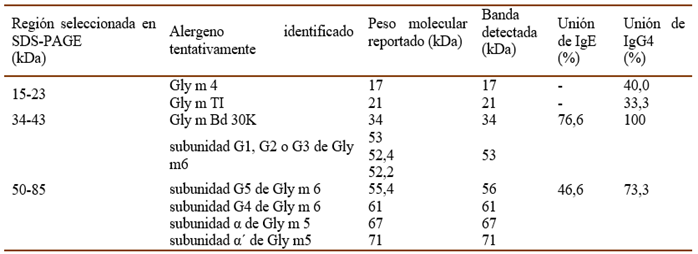
La soya (Glycine max) es una leguminosa comestible perteneciente a la familia Fabaceae. Los productos derivados de ella son ampliamente utilizados en la alimentación animal y humana, la industria farmacéutica y en diferentes manufacturas textiles. Por esta razón es considerada la leguminosa más importante del mundo (San Miguel et al., 2017). Alrededor de 28 proteínas de soya son reconocidas por IgE de pacientes alérgicos, sin embargo, sólo unas pocas han sido reconocidas como alergenos. Entre ellas se encuentran: Gly m Bd 30K (~34 kDa), Gly m 4 (~17 kDa), Gly m TI (~21 kDa), Gly m 5, conformada por tres subunidades: α (~67 kDa), α’ (~71 kDa) y β (~50 kDa) y Gly m 6, conformada por 5 subunidades: G1 (~53 kDa), G2 (~52,4 kDa), G3 (~52,2 kDa), G4 (~61,2 kDa) y G5 (~55,4 kDa) (allergen.org; allergome.org; Berneder et al., 2013; Mateo, 2014; Natarajan et al., 2018; Murakami et al., 2018; Pi et al., 2021).
Los extractos alergénicos son preparados que se emplean para el diagnóstico y la inmunoterapia específica de los individuos alérgicos. Se obtienen mediante la extracción de los componentes alergénicamente activos presentes en la materia prima (Molina-Sáenz et al., 2017). Su obtención hace posible el diagnóstico específico de la sensibilización alérgica mediante pruebas cutáneas. La utilización de preparados estandarizados permite una mayor precisión en el diagnóstico de enfermedades mediadas por IgE. Específicamente la composición de proteínas de los extractos alergénicos es un requisito de calidad muy importante. Para su producción es necesario contar con métodos para el control de la calidad validados permitiendo demostrar que los resultados obtenidos son confiables y reproducibles. Esto contribuye a asegurar la calidad del producto, así como la eficiencia productiva.
Tiene vital importancia la caracterización de los extractos según el perfil alergénico, pues este puede variar en dependencia de la región geográfica (Larsen y Dreborg, 2020). La técnica de electroforesis en geles de poliacridamida en presencia de dodecil sulfato de sodio (SDS-PAGE, siglas en inglés) es un método rápido, reproducible y de bajo costo. Es ampliamente utilizada para cuantificar, comparar y caracterizar proteínas. Además, en su forma semipreparativa, constituye la técnica de entrada para la realización de Western Blotting, de manera que las proteínas se separan según su PM bajo la acción de un campo eléctrico y luego se transfieren a una membrana para estudios inmunológicos (Kendrick et al., 2019).
Según la GUIA No. 41-2013 “Validación de Métodos Analíticos” del CECMED, la validación de los métodos analíticos desempeña un papel determinante pues de ellos depende la comprobación confiable y reproducible de los índices de calidad de las materias primas y productos, lo cual contribuye notablemente al aseguramiento de la calidad, seguridad y eficiencia de los mismos. Por todo lo planteado el objetivo de este trabajo fue validar el método de SDS-PAGE para un extracto alergénico de soya.
MATERIALES Y MÉTODOS
Descripción de las muestras
Para la obtención del extracto alergénico se partió de semillas de soya suministradas por la Unidad Empresarial de Base de Semillas de San Antonio de los Baños, Artemisa. Se pesaron 200 g de semillas en balanza técnica (Sartorius, EUA). Luego se molieron en molino (IKA WERK, Alemania) y se trataron con éter dietílico a una proporción de 1:20 en un equipo Soxhlet (Alemania), para separar los lípidos. Para la extracción se le adicionó 2 L de tampón fosfato salino pH 7,4 (sPBS, siglas del inglés); NaCl 0,145 mol/L; Na2HPO4 0,0085 mol/L; KH2PO4 0,0044 mol/L. Seguidamente se extrajeron los componentes solubles, para ello se agitó la mezcla con la ayuda de un agitador de hélice (IKA WERK, Alemania) a una temperatura entre 4-8oC durante 6 h. Luego se centrifugó a 1792 g durante 60 minutos, seguido de una filtración por membrana de 0,8 μm en cápsulas SARTOBRAN (EUA), a una presión de 2 Bar en un sistema Sartorius (EUA). Se realizó un proceso de diafiltración-concentración utilizando un sistema Amicon CH2 (EUA) de 2 L de capacidad, con tres cartuchos de fibra hueca H10P10, y un diámetro de 10 kDa. Primero, se concentró hasta un volumen de 1 L, luego se diafiltró con 5 L de sPBS y finalmente se concentró hasta 0,5 L. Este volumen se esterilizó por filtración con membranas de 0,2 μm en cápsulas SARTOBRAN, (EUA) en un sistema Sartorius (EUA) en Gabinete de Seguridad Biológico clase A, acorde a las Buenas Prácticas de Manufactura, para la obtención del Ingrediente Farmacéutico Activo (IFA). A continuación, en condiciones asépticas utilizando Gabinete de Seguridad Biológica clase A, se prepararon diluciones del IFA en sPBS, a una concentración final de proteínas de y 2 mg/mL. Luego se procedió al llenado aséptico de una mitad del IFA obtenido, en bulbos 2R (1mL/bulbo), para su posterior liofilización y su empleo como material de Referencia Interna (RI) para pruebas in vitro. A la otra mitad del IFA se le adicionó 50% de glicerol (v/v), previamente esterilizado en autoclave GETINGE (Alemania) a 120oC por 30 minutos, para obtener una concentración final de proteínas de 1 mg/mL. Los extractos se conservaron hasta su uso; las variantes liofilizadas se almacenaron a -20oC y los glicerinados, entre 4 y 8oC.
Método analítico. SDS-PAGE
El sistema consta de una cámara de electroforesis acoplada a una fuente de corriente alterna. La técnica se realizó teniendo en cuenta que para la preparación de las muestras al extracto liofilizado se le realizó una dilución 1/8 y al glicerinado una dilución 1/4 en H2O destilada. A partir de estas diluciones se tomaron 20 µL, se le adicionó igual cantidad de tampón reductor, se calentaron 5 minutos y se aplicaron posteriormente 10 µL. Se utilizó un Patrón de Bajo Peso Molecular de 14-97 kDa (Pharmacia). La corrida del gel se realizó bajo las condiciones: 25 mA de corriente y voltaje abierto. Una vez terminada la corrida, se tiñó 1 hora en la zaranda a temperatura ambiente y destiñó cambiando la solución de destinción 2 ó 3 veces para lograr una completa visualización de las bandas. Se realizó el análisis densitométrico mediante el sistema ImageMaster v4.0 (Amersham Pharmacia) y se determinaron el PM de las bandas detectadas y el área bajo la curva expresada en porcentaje del total (A%) de las bandas contenidas en los rangos seleccionados.
Western Blotting IgE /IgG4
Para definir las bandas principales a identificar en el extracto de soya, se realizó la técnica de SDS-PAGE como se describe anteriormente hasta concluir la corrida del gel, seguida de inmunotransferencia para evaluar la reactividad sérica de anticuerpos IgE e IgG4 a las proteínas del extracto. Se utilizaron los sueros de 30 pacientes (5 niños y 25 adultos, seleccionados por su sintomatología alérgica y prueba de punción cutánea positiva al extracto alergénico). El método analítico de inmunotransferencia se realizó de acuerdo con lo descrito por Mateo et al. en el año 2017.
Para la identificación de proteínas de unión a IgE e IgG4, se realizó la transferencia electroforética de los geles a membranas de nitrocelulosa de 0,45 μm, durante 2 h en el equipo de transferencia semiseco (Pharmacia). Luego se bloquearon los sitios inespecíficos con solución de bloqueo (leche descremada al 5%, PBS-Tween 20 al 0,1%), durante 1h a 37°C. Este paso se realizó con agitación en zaranda, condición que se mantuvo hasta el final del ensayo. Después las membranas fueron incubadas con los sueros de los pacientes (1 mL de suero diluido 1:2 en BSA al 0,5% PBS-Tween 20 al 0,1%), durante 12 horas a 4°C. Luego se aplicó el conjugado anti-Fc IgE humana-Peroxidasa (Sigma, Alemania), dilución 1:2000 en BSA al 0,5% PBS-Tween 20 al 0,1%, para la determinación de IgE; o anti-Fc4 IgG4 humana-biotina (Sigma, Alemania), dilución 1:5000 en BSA 0,5% PBS-Tween20 al 0,1%, para la detección de IgG4. Posteriormente, para el caso de la determinación de IgG4, la membrana se incubó durante 30 min a 37°C, con 1 mL del conjugado Estreptavidina-Peroxidasa (Sigma, Alemania), dilución 1:10000 en BSA 0,5% PBS-Tween20 al 0,1%. Entre cada etapa de incubación se realizaron tres pasos de lavado de 10 minutos cada uno, con solución de lavado (PBS-Tween 20 al 0,1%). Para el revelado, las membranas se incubaron durante 10 min a 20°C y protegidas de la luz, con sustrato cromogénico Diaminobencidina (DAB), catalizador de cobalto y urea (Sigma-Aldrich®, Merck KGaA, Alemania), tabletas reconstituidas en agua destilada, a razón de (1 tableta de DAB + 1 tableta de urea) en 5 mL de agua destilada. La reacción se detuvo con agua destilada (tres lavados) durante 10 min a 20°C y luego se secaron sobre papel de filtro. Para el procesamiento se utilizó el equipo SHARP JX-300 (Reino Unido) y se realizó un análisis densitómetro con ayuda del programa Imagen Master 1D versión 3.0 (Amersham-Pharmacia, Reino Unido).
Método de Validación
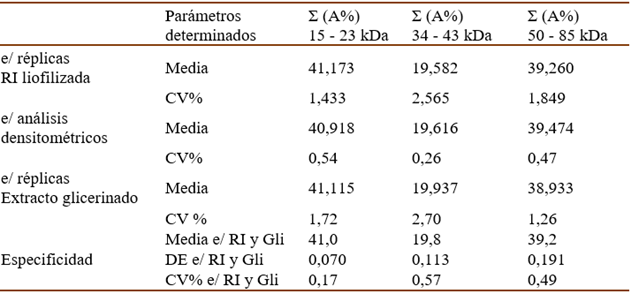
El método de validación fue diseñado de acuerdo con lo expresado en la GUIA No. 41-2013 “Validación de Métodos Analíticos” del CECMED. Está compuesto por los ensayos de precisión (repetibilidad y precisión intermedia), exactitud, especificidad y límite de detección. Las muestras empleadas fueron la RI liofilizada de Soya, lote: H101 y el extracto alergénico glicerinado de Soya, lote: HH10101, obtenidas según se describe en el acápite 2.1.
Para evaluar la repetibilidad de la técnica, fue realizado por un mismo analista un ensayo (como se describe en el acápite 2.2) para cada muestra aplicando 6 réplicas en cada caso. El análisis densitométrico del gel correspondiente a la RI se realizó por triplicado. Se determinaron, mediante una hoja de cálculo de Excel, la media de la suma de los valores de PM y de A%, de las bandas contenidas en los rangos seleccionados y la desviación estándar (DE) y coeficiente de variación (CV%) de la suma de los valores de A%. Se tuvieron como criterios de aceptación: que el CV% de A% entre réplicas de un mismo ensayo y entre diferentes análisis densitométricos fueran menor que el 5%, para cada suma.
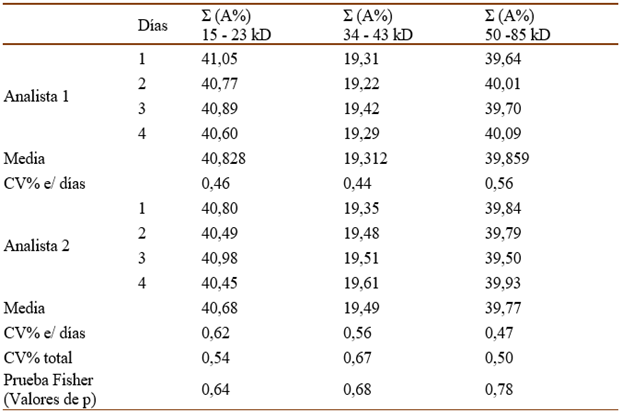
El ensayo de precisión intermedia fue realizado por dos analistas en cuatro días diferentes para las muestras de producto final glicerinado por triplicado. Se determinaron la media, DE y CV% de la suma de los valores de A% de las bandas contenidas en los rangos seleccionados, para cada analista por separado y el total. Se tuvieron como criterios de aceptación que CV% entre diferentes días por un analista y el CV% total para cada rango sea menor que el 5% y además que no existieran diferencias significativas entre CV% de los analistas según la prueba de Fisher (p>0,05).
La exactitud se evaluó comparando los resultados del PM de bandas principales de la RI obtenidos en el ensayo de repetibilidad con los valores de PM registrados en la literatura (17, 21, 34, 53, 55.4, 61, 67 y 71 kDa). Para ello se utilizó una prueba t de Student y se tuvieron como criterios de aceptación la no existencia de diferencias significativas entre los valores comparados (p>0,05). Para determinar la especificidad se evaluó la posible interferencia del glicerol, excipiente del producto terminado, comparando con la referencia liofilizada. Se tomaron los resultados obtenidos en el estudio de repetibilidad. Criterio de aceptación: CV < 5% para los porcentajes de las bandas principales obtenidos entre los extractos alergénicos glicerinados y liofilizados.
El límite de detección fue determinado por un solo analista en un ensayo. Se utilizaron como muestras la RI liofilizada de soya preparada a diferentes concentraciones (0.125, 0.25, 0.5, 1, 2, 3, 4, 5 µg/ml), siendo 1 µg/ml la concentración del extracto liofilizado en el resto de los ensayos de la validación.
RESULTADOS
Inmunorreactividad de anticuerpos IgG4 e IgE a las proteínas del extracto de soya
La inmunorreactividad a las proteínas del extracto de semillas de soya se estudió en el suero de 30 pacientes (5 niños, 25 adultos). En la Fig. I se muestran los resultados de este ensayo empleando la técnica de Western Blotting. Como se puede observar la banda cercana a los 34 kDa fue la más representada, siendo reconocida por la IgE de 23 sueros de pacientes (4 niños y 19 adultos) para un 76,6% de reconocimiento. Además, fue reconocida por la IgG4 de todos los sueros analizados.
Por otra parte, fueron reconocidas por la IgE las bandas entre 50-85 kDa en los sueros de 14 pacientes (4 niños y 10 adultos) para un 46,6% de reconocimiento. Además, por los Ac IgG4 de 22 sueros (17 y los 5 niños), para un 73,3% de reconocimiento. Se encontraron también dos bandas cercanas a 17 kDa y a 21 kDa, reconocidas la IgG4 de 40 y 33,3%, respectivamente, de los pacientes estudiados. Sin embargo, estas bandas no fueron reconocidas por la IgE de los pacientes incluidos en el estudio.
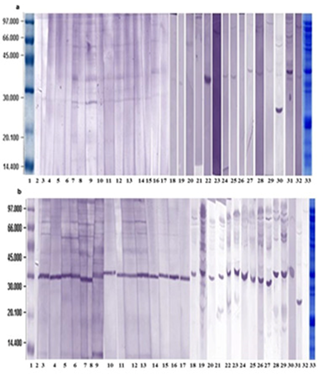
Fig. 1 Western Blotting de extracto de semillas de soya: a: perfil de unión a IgE, b: perfil de unión a IgG4. Carriles 1: Patrón de bajo peso molecular de 14-97 kDa (Pharmacia, Reino Unido); 2: Albúmina de suero bovino (BSA) al 0,5% como control negativo; de 3-17 y 18-32: Proteínas del extracto incubadas con los sueros de los pacientes del estudio; 3, 18, 20 y 23: niños alérgicos; 4 al 17, 19, 21 y 22, 25 al 32: adultos alérgicos; 33: proteínas del extracto de semillas de soya separadas por SDS-PAGE.
Desempeño del método analítico
En la tabla I se muestran los resultados de los ensayos de Repetibilidad y Especificidad. Como se puede observar los valores del CV% determinados en todos los casos fueron menores que 5%, por lo que quedó demostrada la precisión intraensayo del método y su especificidad para las muestras analizadas.
En el caso de la precisión intermedia, como se observa en la tabla II, los CV% calculados en cada caso fueron menores que el 5% y se demostró a través de la prueba de Fisher la no existencia de diferencias significativas entre los CV% de los analistas, pues los valores de p fueron mayores que 0,05. De esta forma se cumplieron los criterios de aceptación del ensayo y quedó demostrada la precisión interensayo de la técnica de SDS-PAGE para las muestras analizadas.
La exactitud del método fue demostrada, pues, como se observa en la figura II, no hubo diferencias significativas (t Student, p>0.05) entre los pesos moleculares determinados por la técnica de SDS-PAGE con las condiciones establecidas y los valores de referencia reportados en la literatura.
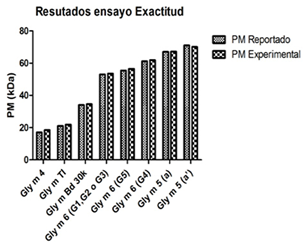
Fig. 2 Resultados de la evaluación de la exactitud del método de SDS-PAGE. No se observan diferencias significativas (t Student, p>0.05) entre el peso molecular determinado experimentalmente para las bandas alergénicas principales del extracto de Soya y el peso molecular reportado en la literatura.
Como se observa en la figura 3, el límite de detección (LD) de la técnica resultó ser la concentración de 0.5 µg/ml, siendo reconocida como la menor concentración del extracto aplicada en que se detectan todas las bandas principales presentes en la muestra.
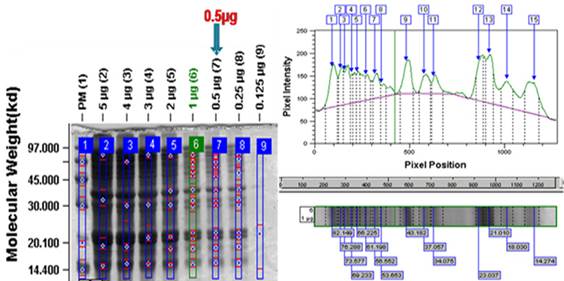
Fig. 3 Análisis densitométrico del SDS-PAGE de extracto de semillas de soya: carril 1. PPM de 14-97 kDa (Pharmacia, Reino Unido). Carriles 1: Patrón de bajo peso molecular; 2-9: RI liofilizada de soya a las concentraciones 0.125, 0.25, 0.5, 1, 2, 3, 4, 5 µg/ml respectivamente. En verde en el carril 6 la concentración empleada en el resto de los ensayos (1 µg/ml). La flecha en carril 7 marca la concentración de 0.5 µg/ml, que corresponde al LD.
DISCUSIÓN
Inmunorreactividad de anticuerpos IgG4 e IgE a las proteínas del extracto de soya
La soya está compuesta aproximadamente por 38-40% de proteínas con funciones diversas. Se ha informado que alrededor de 28 de estas proteínas son alergénicas. Entre ellas se destacan: Gly m Bd 30K (34 kDa), Gly m 4 (~17 kDa), Gly m TI (~21 kDa), Gly m 5, conformada por tres subunidades: α (67 kDa), α’ (71 kDa) y β (50 kDa) y Gly m 6, conformada por 5 subunidades: G1 (53 kDa), G2 (52,4 kDa), G3 (52,2 kDa), G4 (61,2 kDa) y G5 (~55,4 kDa) (allergen.org; allergome.org; Berneder et al., 2013; Mateo, 2014; Natarajan et al., 2018; Murakami et al., 2018; Pi et al., 2021).
No obstante, los datos publicados sobre los alergenos de la soya siguen siendo controversiales y se reconoce que no han sido identificados todos los componentes claves para predecir la reactividad clínica IgE alergeno específica a este alimento (Pi et al., 2021).
La banda detectada en este trabajo a 34 kDa fue identificada tentativamente como Gly m Bd 30K (también conocida como P34), cisteíno proteasa análoga a la papaína. Aunque P34 es relativamente, un constituyente menor de la semilla (menos del 1% de la proteína total), es considerada un alergeno mayor o inmunodominante, habíendose identificado como causa de reacciones alérgicas en pacientes sensibles a la soya. En varios estudios se ha demostrado que más del 65% de los pacientes sensibles a la soya muestran unión de IgE solo a esta proteína, lo cual coincide con los resultados obtenidos en este estudio (76,6% de reconocimiento) (Figueroa-García et al., 2012; Jeong et al., 2013; San Miguel et al., 2017). El contenido de P34 suele ser alto en varios productos de la soya, por ejemplo, en la harina de soya (32 mg/g), aislado de proteína de soya (29 mg/g) y leche de soya (23 mg/g), lo cual es consistente con el patrón del consumo de productos de soya en Cuba, sobre todo para el yogur de soya (Mateo, 2014).
En este trabajo, también fueron reconocidas por la IgE del suero de pacientes bandas entre 50-85 kDa (46,6 %), pero con menor intensidad que la banda de 34 kDa. Este conjunto de bandas apretadas podrían corresponder a subunidades de Gly m 5 (b-conglicinina) y Gly m 6 (glicinina), dos proteínas de almacenamiento que componen la mayor parte del contenido proteico de la soya, las cuales son reconocidas como los alergenos más importantes y clínicamente relevantes de las soya en países desarrollados (Murakami et al., 2018).
Por otra parte, la banda detectada por la IgG4 alrededor de los 17 kDa pudiera corresponder con Gly m 4, proteína de transferencia de lípidos análoga a Bet v 1, conocido panalergeno respiratorio. Ha sido reportado que la sensibilización a Gly m 4, en ausencia de sensibilización a Gly m 5 y Gly m 6, está relacionada con síntomas graves y generalizados en la mayoría de los pacientes (Berneder et al. 2013).
En este estudio también se detectó por la IgG4 una banda cerca de los 21 kDa que pudiera corresponder con Gly m TI, inhibidor de la α-amilasa/tripsina, reportado como alergeno de la soya. Sin embargo, ambas proteínas no fueron reconocidas por la IgE de los pacientes alérgicos evaluados. Por lo tanto, para confirmar la relevacia de la alergenicidad de estas proteínas en la población cubana sería recomendable estudiar un mayor número de pacientes. Su reconocimiento por IgG4 y no por IgE pudiera sugerir que se ha logrado una tolerancia hacia ellas, tal vez por ser muy comunes en la dieta habitual en nuestro país. La selección de las bandas útiles para la técnica de SDS-PAGE como ensayo de control de calidad, debe tener en cuenta su relevancia clínica, así como los criterios de desempeño en el ensayo, particularmente la posibilidad de resolver claramente las bandas e identificarlas apropiadamente por su peso molecular.
Teniendo en cuenta las bandas principales identificadas como alergénicas (IgE) y antigénicas (IgG4), fueron seleccionadas para la validación del método (ensayos de exactitud y límite de detección), las bandas cercanas a los 17; 21; 34; 53; 56; 61 67 y 71 kDa. Para los ensayos de repetibilidad, precisión intermedia y especificidad se utilizaron los rangos de PM 15 - 23, 34 - 43 y 50 - 85 kDa, los cuales contienen a las bandas principales como se observa en la Tabla IV
Desempeño del método analítico
Según la GUIA No. 41-2013 “Validación de Métodos Analíticos” del CECMED, la validación de los métodos analíticos desempeña un papel determinante pues de ellos depende la comprobación confiable y reproducible de los índices de calidad de las materias primas y productos, lo cual contribuye notablemente al aseguramiento de la calidad, seguridad y eficiencia de los mismos.
La precisión es una medida de cuan cerca están los resultados unos de otros o, mejor dicho, es el grado de concordancia de los valores de una serie repetida de ensayos analíticos, efectuados sobre una muestra homogénea. Es la distribución de los valores analíticos alrededor de su media y se expresa como el coeficiente de variación (CV%). Este parámetro se determina a tres niveles, siempre que proceda: intraensayo (repetibilidad), interensayo (precisión intermedia) e interlaboratorios (reproducibilidad) (GUIA No. 41-2013 del CECMED; Kurbanoglu et al., 2018). En este estudio se demostraron los dos primeros niveles con resultados satisfactorios.
La repetibilidad se lleva a cabo sobre la base de un número suficiente de determinaciones de una mezcla homogénea del producto, en las mismas condiciones, muestra, analista, laboratorio, equipos y reactivos; generalmente en un corto intervalo de tiempo, por lo cual evalúa la variabilidad intrínseca del proceso. Por otro lado, la precisión intermedia es la medida de la precisión dentro de un laboratorio cuando se emplea una muestra homogénea y se analiza en condiciones diferentes, es decir analista diferente y día diferente (GUIA No. 41-2013 del CECMED). El estudio de precisión de la técnica de SDS-PAGE para extractos de soya mostró una buena repetibilidad y reproducibilidad de los resultados, obteniéndose CV menores que 5%. Estos resultados cumplen no solo con los criterios de aceptación de la guía nacional del CECMED (GUIA No. 41-2013), sino también con lo expresado en la guía internacional para la Validación de Métodos Analíticos ICH Q2 (R1).
Es importante también que el método analítico mantenga una imprecisión mucho menor que el rango de tolerancia establecido para los productos. Específicamente para la composición de proteínas de los productos alergénicos no se establecen rangos explícitos en los documentos regulatorios internacionales, quedando este aspecto a decisión de los fabricantes. No obstante, en la Monografía para Productos Alergénicos de la Farmacopea Europea (2010:1063), se establecen como rango para el ensayo de contenido de proteínas totales 80-120% y para el de componentes alergénicos individuales 50-150%. La precisión del SDS PAGE en este trabajo con las bandas seleccionadas (5%) resultan mucho menor que ambos intervalos, lo cual sostiene la idoneidad de este ensayo para el control de calidad.
La Exactitud es la proximidad entre los resultados de la prueba obtenidos mediante ese procedimiento y el valor verdadero. Para que la evaluación de la exactitud se considere satisfactoria, no existirán diferencias significativas entre los valores obtenidos experimentalmente y los valores asignados. (GUIA No. 41-2013 del CECMED). En este estudio se demostró la robustez del método de SDS-PAGE pues no hubo diferencias significativas entre los PM de las bandas principales determinadas experimentalmente con respecto los registrados en la literatura para cada uno de los componentes alergénicos.
La Especificidad es la habilidad de evaluar inequívocamente el analito en presencia de componentes que se puede esperar que estén presentes (GUIA No. 41-2013 del CECMED) y que pueden causar interferencias. En el campo de la tecnología farmacéutica, el glicerol es un disolvente de extraordinario valor, capaz de formar disoluciones concentradas y permanentes, imposibles de obtener con otros vehículos. El mismo se ha utiliza ampliamente como excipiente para los extractos alergénicos para prick test y para la vía sublingual por sus cualidades como preservo y estabilizante (Kyoung Yong Jeong, 2013). En este estudio el glicerol no ofreció interferencias en la determinación de las bandas en el extracto glicerinado con respecto a la RI liofilizada.
Numerosos términos han sido utilizados para definir el límite de detección (LD) por lo que este concepto ha sido uno de los más controversiales en química analítica. En general, se toma como LD la cantidad más baja de analito que puede detectarse, pero no necesariamente cuantificarse, como una concentración o cantidad exacta en las condiciones experimentales indicadas. El LD puede obtenerse de tres formas diferentes: a) inspección visual, es el mínimo nivel donde el analito es detectado; b) método de relación señal-ruido, basado en el en ruido basal del instrumento y c) desviación estándar de la respuesta basada en la pendiente de la curva de calibración (GUIA No. 41-2013 del CECMED; Kurbanoglu et al., 2018). En este estudio, teniendo en cuenta la forma de inspección visual y las características de la técnica que se está validando, se definió el LD como la menor concentración del extracto aplicada en que se detectan todas las bandas principales presentes en la muestra: 17 kDa (Gly m 4), 21 kDa (Gly m TI), 34 kDa (P34), 53 kDa (Gly m6), 56 kDa (Gly m 6), 61 kDa (Gly m 5), 67 kDa (Gly m 5) y 71 kDa (Gly m5). La banda de 56 kDa desapareció a la concentración de 0,25 µg, por lo que no fue seleccionada como LD de acuerdo con los criterios de aceptación establecidos. Por tanto, el LD de la técnica fue 0.5 µg, ya que a dicha concentración se detectan todas las bandas principales presentes en la muestra. De ese modo, este LD hace posible aplicar la técnica no solo para un producto liofilizado (como la RI) sino también en el producto terminado glicerinado y en productos intermedios durante el proceso de fabricación.
En el presente trabajo se empleó una Referencia Interna del Extracto Alergénico de Soya en forma liofilizada. La Guía Europea para la producción y control de la calidad de productos alergénicos establecen la definición, importancia y caracterización de la Referencia Interna (RI) (Bonertz et al.,2018). Teniendo en consideración la complejidad de la producción de extractos alergénicos (EAs), resulta difícil lograr la estandarización de los mismos, ya que el producto generalmente es una mezcla de componentes con características alergénicas. Por tal motivo se hace necesario que cada productor establezca una RI para cada uno de sus EAs, siempre y cuando no se disponga de una Referencia Internacional reconocida. La RI será un lote típico completamente caracterizado, el cual servirá de base para la demostración de la consistencia lote a lote, del proceso de producción. La validación de la técnica de SDS-PAGE empleando la RI aporta mayor valor a la caracterización de la RI y contribuye a robustecer el sistema de control de la calidad de este producto.
CONCLUSIONES
El estudio demostró que la técnica de SDS-PAGE para la determinación de la composición de proteínas de extractos alergénicos de soya (seleccionando 8 bandas principales con actividad de unión de IgE e IgG4 en pacientes alérgicos cubano) cumple con los parámetros de precisión y exactitud. Asimismo, el método evidenció su especificidad en cuanto a la no interferencia del Glicerol, empleado como excipiente. El límite de detección para la RI liofilizada de soya fue de 0.5 µg/ml. De esta forma el método queda validado, cumpliendo con los requisitos nacionales e internacionales y demostrando su idoneidad para ser empleado para el control de calidad de este producto.