Introducción
La enfermedad de Alzheimer (EA) es un trastorno neurodegenerativo que se desarrolla, principalmente, en las personas mayores. Se caracteriza histopatológicamente por la presencia en el cerebro de placas seniles (PS) o β-amiloides (βA). La acumulación anómala de estas trae consigo la pérdida específica de neuronas, y afecta a las sinapsis entre ellas. No existe actualmente una cura para la EA, la cual tiene un gran impacto emocional, social y económico, tanto en los pacientes, como en sus familias. Por ello, la búsqueda de métodos de diagnóstico de esta enfermedad resulta de gran interés.1,2
Entre las técnicas de neuroimagen exploradas para la detección in vivo de βA, la Resonancia Magnética de Imágenes (RMI) presenta ventajas sobre otras que utilizan radiaciones ionizantes y son menos accesibles. La baja sensibilidad de la RMI a las estructuras βA hace necesario el uso de agentes de contraste (ACs) que permitan diferenciar mejor los tejidos sanos, de los patológicos.3 Las investigaciones actuales se centran en la búsqueda de ACs capaces de atravesar la barrera hematoencefálica (BHE) y que, a su vez, porten en su estructura moléculas afines al βA, lo que garantizaría un diagnóstico preciso de la EA. Los ACs descritos para este uso no son seguros, debido a problemas relacionados con su estabilidad química y su capacidad de atravesar la BHE.4
Las sales de gadolinio(III) —Gd(III)— generan un aumento de la relajación longitudinal (T1) de los protones del agua en los tejidos, provocando un incremento en la intensidad de la señal en RMI. El uso clínico de estas sales, consideradas como ACs positivos (o ACs T1), no está permitido debido a su toxicidad. Sin embargo, se ha experimentado con éxito el uso de iones Gd(III) en forma de complejos o de nanopartículas (NPs) del óxido metálico. En particular, las NPs son ventajosas porque pueden ser funcionalizadas con recubrimientos tales que permitan el acceso a zonas específicas del cuerpo y, al mismo tiempo, transporten compuestos con alta afinidad por las dianas terapéuticas deseadas.4
Diferentes derivados monosustituidos de la naftalina, denominados Amylovis®, y obtenidos en el Centro de Neurociencias de Cuba (CNEURO), son considerados candidatos potenciales para el estudio de la EA. Estudios previos 5-9 han evaluado el efecto de los Amylovis® sobre la cinética de agregación de la proteína BSA y del péptido hIAPP1-37 in vitro, mediante diversos ensayos.
Recientemente, se realizaron simulaciones de dinámica molecular in silico para identificar el tipo de interacción y la estabilidad del complejo formado entre estos derivados con el péptido βA1-42, así como con una estructura fibrilar del mismo, que predijeron que Amylovis® puede inhibir los procesos de oligomerización y fibrilación. Además, los ensayos in vitro e in vivo que evalúan la actividad anti-βA1-42 de estos compuestos tuvieron resultados prometedores.
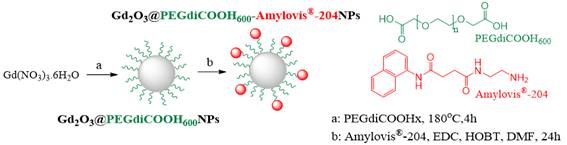
En la actualidad, el CNEURO y el Laboratorio de Bioinorgánica (LBI) trabajan en conjunto en el diseño de ACs basados NPs de óxidos metálicos para la detección precoz de la EA a través de la RMI.10-12 De forma general, estos ACs se conforman por un núcleo magnético de hierro(II, III) o gadolinio(III) recubierto con polímeros funcionalizados, como el polietilenglicol dicarboxilado (PEGdiCOOH), al cual se conjuga, mediante la reacción de esterificación tipo Steglich, el N1-(2-aminoetil)-N4-(1-naftil)succinimida (Amylovis®-204).
El objetivo del presente trabajo es caracterizar los conjugados de Gd2O3NPs con Amylovis®-204 y evaluar su relaxitividad longitudinal. El producto final puede generar un novedoso AC para el estudio molecular y el diagnóstico in vivo de la EA por RMI, y ayudar a la implementación de terapias tempranas para mitigar la enfermedad.
Materiales y métodos
Reactivos y disolventes
Los reactivos y disolventes utilizados fueron puros para síntesis de las firmas Merck, Panreac y Sigma-Aldrich. El agua utilizada en todos los experimentos fue destilada.
Instrumentos y caracterizaciones
Los espectros infrarrojos con transformada de Fourier (FT-IR) se registraron en un equipo ATI Mattson Genesis Series FTIR. El tamaño (d) y el diámetro hidrodinámico (dh) de las Gd2O3NPs fueron determinados mediante Microscopía Electrónica de Transmisión (TEM) —JEM-1010, JEOL—, y Dispersión Dinámica de la Luz (DLS) —Zetasizer AT, Malvern Panalytical—, respectivamente. La cantidad de materia orgánica en la superficie de las Gd2O3NPs se determinó mediante Análisis Termogravimétrico (TGA) —Thermogravimetric Analyzer SF®, Mettler Toledo, USA—. La determinación del contenido de Gd(III) y la relaxitividad longitudinal (r1) de las Gd2O3NPs se determinaron con un equipo de resonancia magnética SIEMENS Magnetom Allegra 3T.
Para realizar la determinación por RMI de la c(Gd) se digieren las muestras (rel. H2O2:HNO3 1:2, v/v) y se enrasan a volumen final de 1,5 mL con agua destilada. Las imágenes de RMI se obtuvieron con una secuencia de pulso Recuperación de Inversión Eco de Espín (IR-SE). Los tiempos de repetición (TR) empleados fueron 8 500 y 10 000 ms; el tiempo de eco (TE) 13 ms y los tiempos de inversión (TI) estuvieron entre 23 ms y 6 800 ms. Se emplea el ToolBox de MATLAB “KRelax” (desarrollado en CNEURO y registrado en el CENDA, en donde se procesan las imágenes obtenidas que permiten calcular los valores de intensidad y desviación estándar de la región de interés (ROI) seleccionada. A partir de la curva de relajación longitudinal (Intensidad vs. TI) obtenida, se aplica el algoritmo de Levenberg-Marquardt, y se deducen los valores de T1 para cada ROI. Asimismo, a partir de la curva de velocidad de relajación longitudinal (R1= 1/T1, R1 vs. c(Gd)) obtenida, se interpolan en ella los valores de R1 de las muestras analizadas para determinar la c(Gd). La curva de calibración de Gd(III) confeccionada abarcó un intervalo de concentración entre 0 y 2 mmol/L del elemento.
Síntesis de las Gd2O3@PEGdiCOOH600NPs
En un balón de 25 mL equipado con un condensador a reflujo, 955 mg (2,12 mmol) de Gd(NO3)3·6H2O, se disuelven en 24 g (40 mmol) de PEGdiCOOH600Da, a 100 ºC. Luego, la temperatura de la mezcla de reacción se eleva a 140 ºC por 1 h, y posteriormente a 180 ºC, por 4 h más. Concluido este tiempo, el crudo de reacción se dializa en agua por 2 días (rel. v/v 1:1000), se ultrafiltra (membrana PES, 30 kDa) y se centrifuga (5 000 rpm, 15 min). La dispersión acuosa se conserva a 5 ºC.
Conjugación del Amylovis®-204 a las Gd2O3@PEGdiCOOH600NPs (Gd2O3@PEGdiCOOH600-Amylovis®-204NPs)
A 10 mL de una dispersión acuosa de Gd2O3@PEGdiCOOH600NPs se adicionan 5 mL de DMF, y se elimina el agua mediante rotoevaporación. A esta disolución se adicionan, de forma consecutiva, N1-(2-aminoetil)-N4-(1-naftil)succinimida (Amylovis®-204, 22 mg, 77 μmol), HOBT (25 mg; 0,19 mmol) y EDC (25 mg; 0,13 mmol), previamente disueltos en DMF (850, 500, 1 000 μL, respectivamente). La mezcla se agita durante 24 h. Luego se dializa, ultrafiltra y centrifuga en condiciones similares a las descritas anteriormente. La dispersión acuosa se conserva a 5 ºC.
Resultados y discusión
Tomando en cuenta experiencias previas, 12 la síntesis de nanopartículas de óxido de gadolinio(III) (Gd2O3NPs) funcionalizadas con grupos carboxilos (figura 1, etapa a) se realizó por el método del poliol, que consiste en la descomposición térmica de una sal de Gd(III) en presencia de un disolvente de alto punto de ebullición, que también actúa como recubrimiento.13 En este caso se empleó un derivado dicarboxílico de polietilenglicol de 600 Da comercial (PEGdiCOOH600Da). La presencia de grupos carboxilos permite, por tanto, la conjugación de N1-(2-aminoetil)-N4-(1-naftil)succinimida (Amylovis®-204) a través de una reacción de esterificación tipo Steglich (figura 1, etapa b).
Caracterización mediante FT-IR
Los espectros FT-IR de las Gd2O3NPs recubiertas con PEGdiCOOH600Da y conjugadas al Amylovis®-204 se muestran en la figura 2. Para las Gd2O3@PEGdiCOOH600NPs, la presencia en el espectro FT-IR (figura 2A) de una banda poco intensa en los 583 cm-1 se atribuyó a 𝜈Gd-O, evidenciando la formación del núcleo de óxido metálico. Según los informes de Ahrén y col., 14 la poca intensidad de la banda se corresponde con Gd2O3NPs con tamaños inferiores a los 10 nm. Asimismo, las bandas en 3 447 cm-1 (𝜈OH), 2 910-2 875 cm-1 (𝜈Csp3-H), 1 456 cm-1 (δCH2) y 1 100 cm-1 (𝜈as COC) se corresponden al polímero tipo PEG que recubre el núcleo de las NPs. La banda en 1 744 cm-1 (𝜈C=O) indica la presencia de grupos carboxilos libres.
En la figura 2A, las otras dos señales en el intervalo 1 450-1 650 cm-1 corresponden a las bandas 𝜈as COO - (1 633 cm-1) y 𝜈s COO - (1 470 cm-1). Se conoce que los modos de coordinación del grupo carboxilato (COO-) se definen por la separación (Δ) de estas bandas.14-15 Esta diferencia en las Gd2O3@PEGdiCOOH600NPs es de 163 cm-1. Sobre la base de este valor, el modo de unión de los grupos carboxilato del recubrimiento al núcleo debe ser tipo puente.
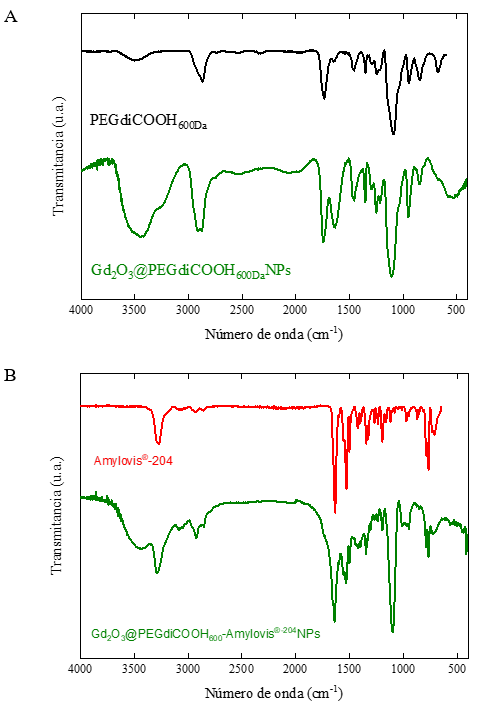
Fig. 2 Espectros FT-IR del PEGdiCOOH600Da y las Gd2O3@PEGdiCOOH600NPs (A) y del Amylovis®-204 y las Gd2O3@PEGdiCOOH600Amylovis®-204NPs (B)
En el caso del espectro FT-IR de las Gd2O3@PEGdiCOOH600-Amylovis®-204NPs (figura 2B), las señales del derivado de PEG empleado, también se observan. La señal del grupo carbonilo se desplaza a menores valores de número de onda, de 1 744 cm-1 (𝜈C=O, ácido carboxílico) a 1 640 cm-1 (𝜈C=O, amida), producto de la conjugación del derivado de naftilo. Las bandas en 3 287 cm-1 (𝜈NH), 3 084 cm-1 y 3 049 cm-1 (𝜈Csp2-H), 1 400cm-1 (𝜈C-N), 790 cm-1 (δNH) y 770 cm-1 (γCH) se corresponden con el derivado de Amylovis® empleado.9 El desplazamiento de la señal 𝜈NH, en comparación con el Amylovis®-204 (3 270 cm-1), es consecuente con la formación de un enlace amida.16 Una vez conjugado el Amylovis®-204 al recubrimiento de las Gd2O3@PEGdiCOOH600NPs, la estabilidad del sistema coloidal disminuyó, manifestándose en la paulatina precipitación de las NPs. Este proceso ocurre de forma más rápida que en sus análogas sin conjugar, lo cual es indeseado para su aplicación final.
Caracterización mediante DLS y TEM
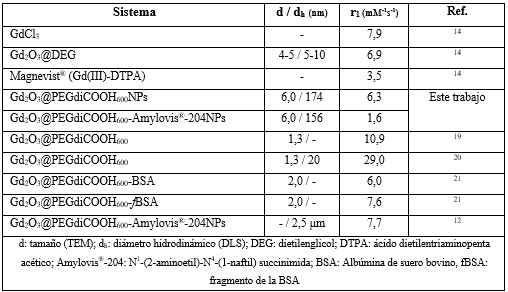
La determinación del diámetro hidrodinámico (dh) de las Gd2O3@PEGdiCOOH600NPs se realizó a través del registro de los perfiles de DLS (figura 3A, línea verde oscura). Las NPs pegiladas presentaron un dh de 174 nm, valor inferior a los 200 nm que se describen en la literatura como el dh idóneo, para que las NPs atraviesen la BHE. El perfil de DLS de las Gd2O3@PEGdiCOOH600-Amylovis®-204NPs (figura 3B, línea verde clara) muestra que su d h es de 156 nm, valor menor al de las NPs pegiladas. Esta disminución se asocia a la naturaleza hidrofóbica del derivado de Amylovis® conjugado, lo que limita la cantidad de moléculas de agua que interactúan con la NP. Según experiencias previas descritas en la literatura, 12 estas NPs presentaron d h de alrededor de 2,5 µm. Las diferencias de los resultados que se obtienen con aquellas descritas en este trabajo se asociaron, fundamentalmente, a la modificación de la metodología de síntesis y el método de purificación de las Gd2O3NPs.
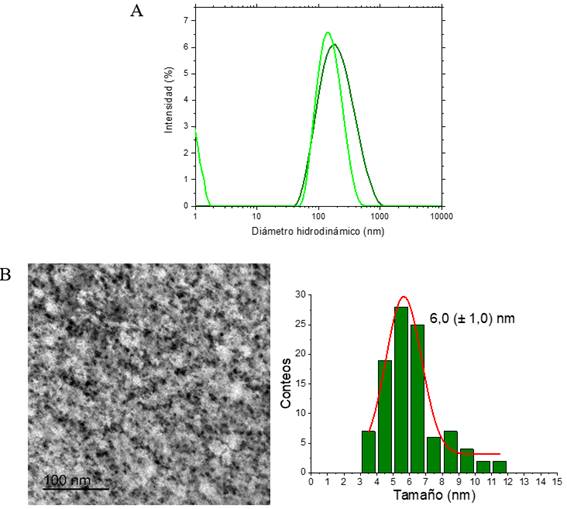
Fig. 3 Perfiles de DLS de las Gd2O3@PEGdiCOOH600NPs (línea verde oscuro) y Gd2O3@PEGdiCOOH600-Amylovis®-204Ps (línea verde clara) (A). Imagen TEM y distribución de tamaño de las Gd2O3@PEGdiCOOH600NPs (B)
Por Microscopia Electrónica de Transmisión (TEM), y con el programa ImageJ 1.52a, se determinó el tamaño (d) del núcleo de las Gd2O3@PEGdiCOOH600NPs (figura 3B), siendo este de 6,0 (± 1,0) nm. El valor de d para las Gd2O3NPs pegiladas se corresponde con lo esperado por el análisis del espectro FT-IR de las NPs (menos de 10 nm, baja intensidad de la banda 𝜈Gd-O). Los valores de d suelen ser menores que los d h , la diferencia entre ambos se asocia a la posible agregación de las NPs (ver imagen TEM, figura 3B) producto de las interacciones existentes entre las cadenas de PEGdiCOOH que las recubren, y a las interacciones de estas con el disolvente (agua). Estas interacciones pueden ser fundamentalmente del tipo hidrofílicas, producto de las características de los monómeros que conforman la cadena de PEG y la polaridad de sus grupos terminales.
Caracterización mediante TGA
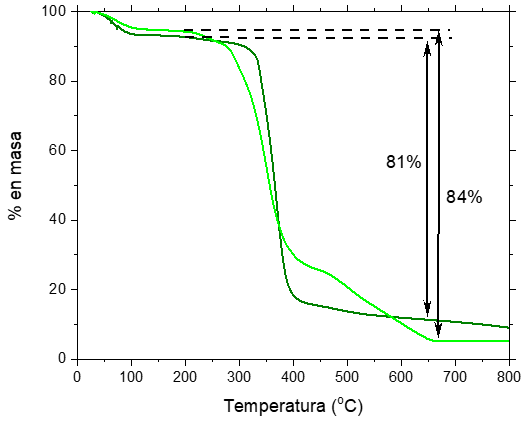
En la figura 4 se observan las curvas correspondientes al Análisis Termogravimétrico (TGA) de las NPs pegiladas y conjugadas con Amylovis®-204. Las curvas del TGA se caracterizaron por la existencia de una primera etapa, donde se produce una pérdida de masa del 7 %, y 5 % para las Gd2O3@PEGdiCOOH600NPs y Gd2O3@PEGdiCOOH600-Amylovis®-204NPs, respectivamente, lo que corresponde a la eliminación de la humedad de la muestra. El menor grado de hidratación de la segunda muestra se corresponde con la hipótesis empleada para explicar su menor d h , ya que estas interaccionan en menor medida con las moléculas de agua debido al carácter hidrofóbico del recubrimiento. A continuación, para las NPs funcionalizadas con el PEGdiCOOH600Da, se produce una pérdida de un 81 % de la masa entre los 200 y 600 oC, debido a procesos de desorción y descomposición del recubrimiento orgánico. En el caso de las NPs recubiertas con Amylovis®-204, la pérdida de masa en este intervalo de temperatura, se corresponde con un 84 %. En ambos gráficos de TGA se aprecia, que luego de los 650 oC no existen variaciones significativas de pérdida de masa, lo que se corresponde con el núcleo de las Gd2O3NPs.
La existencia de una gran cantidad de recubrimiento en la superficie de las Gd2O3NPs es evidente en ambos casos. La cantidad de materia orgánica pudiera ser la causa de la alta agregación que se observa en las imágenes TEM y la marcada diferencia entre los valores de d h y d. Estos resultados evidencian la necesidad de optimizar los procesos de síntesis (relación PEGdiCOOH/Amylovis®-204) y purificación (tiempo de centrifugado, volumen de diálisis) de las Gd2O3@PEGdiCOOH600-Amylovis®-204NPs.
Determinación de la relaxitividad longitudinal (r1)
La caracterización magnética de los sistemas nanométricos descritos, resulta clave para validar su aplicabilidad como AC para RMI. Las relaxitividades longitudinal y transversal (r1 y r2, respectivamente) y su relación (r2/r1), constituyen parámetros importantes para la selección del AC adecuado. Los AC T1 empleados en RMI deben poseer una relación r2/r1 cercana a la unidad, buscándose siempre el más alto valor de r1. Este valor está modulado por la mayor o menor interacción de las moléculas de agua con los iones paramagnéticos Gd(III). Es por ello, que los recubrimientos de estos compuestos deben ser seleccionados de forma adecuada, pues por un lado tienen la función de minimizar la toxicidad del ion; y por otro, no deben afectar el mecanismo de propagación del efecto paramagnético.17-18
En este trabajo, los resultados de las mediciones de relaxitividad (tabla 1) confirman las propiedades magnéticas de las Gd2O3NPs sintetizadas. Las Gd2O3@PEGdiCOOH600NPs mostraron valores de r1 similares a los descritos en la literatura y superiores al del Magnevist®, complejo de Gd(III) de mayor empleo como AC en la práctica clínica actual. Esto corrobora que las NPs obtenidas fueron capaces de modificar la velocidad de relajación de los protones de las moléculas de agua, medio en el que se realizaron los estudios.
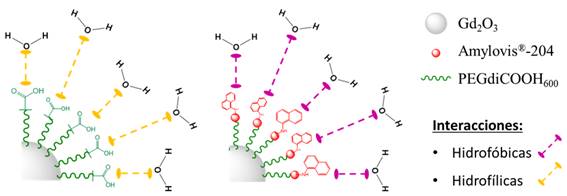
Al comparar los valores de r1 de las Gd2O3NPs pegiladas con los de las Gd2O3@PEGdiCOOH600-Amylovis®-204NPs, se observa una disminución de dichos valores. Esto se asocia a la presencia de Amylovis®-204, cuya naturaleza hidrofóbica dificulta la migración de las moléculas de agua, desde el seno de la disolución a la superficie del núcleo de las Gd2O3NPs (figura 5). En el espectro FT-IR de las Gd2O3@PEGdiCOOH600-Amylovis®-204NPs (figura 2B) no aparece la señal de vibración 𝜈C=O del grupo carboxilo(-COOH). Esto indica, que el grado de conjugación fue total; por tanto, es de esperar que en las Gd2O3@PEGdiCOOH600-Amylovis®-204NPs no existan grupos -COOH disponibles. Esta cobertura hidrofóbica en las NPs (figura 5) afecta el valor de r1, el cual disminuye casi cuatro veces respecto a las NPs pegiladas. Una posible solución a esto sería controlar la cantidad de Amylovis®-204 conjugado a las Gd2O3NPs.
Es conocido, que las NPs con elevados dh, o la poca estabilidad coloidal (procesos de agregación), generan elevados valores de relaxitividad transversal (r2). Esto puede propiciar que la relación r2/r1 sea superior a la unidad, aspecto no favorable para el desarrollo de ACs T1 basado en Gd(III). En este trabajo, debido a la poca estabilidad coloidal de las Gd2O3@PEGdiCOOH600NPs y las Gd2O3@PEGdiCOOH600-Amylovis®-204NPs, no fue posible determinar, de forma confiable, los valores de r2 para los sistemas obtenidos. Sin embargo, los resultados de r1 son alentadores para el fin planteado. La optimización de la síntesis y purificación de las Gd2O3NPs podría permitir la determinación de los valores de r2, para evaluar así las potencialidades de las Gd2O3@PEGdiCOOH600-Amylovis®-204NPs como ACs T1 para la detección in vivo, por RMI, de las PS características de la EA.
Conclusiones
El método del poliol propuesto para la obtención de Gd2O3NPs funcionalizadas con PEGdiCOOH600 y su posterior conjugación con el derivado de Amylovis®-204, permite obtener un conjugado Gd2O3@PEGdiCOOH600-Amylovis®-204NPs con d h inferior a 200 nm. La cantidad de PEGdiCOOH y Amylovis®-204 en la superficie de las Gd2O3NPs, puede resultar un parámetro clave para lograr sistemas de mayor estabilidad coloidal. Los valores de relaxitividad longitudinal (r1) de las Gd2O3NPs fueron comparables a los valores r1 de los ACs nanoestructurados descritos en la literatura, y superiores a los presentados por los complejos de Gd(III) de uso clínico. Este resultado valida su potencial uso como AC para la técnica de RMI.